Кардиомиопатии заболевания миокарда: ее виды. Правожелудочковая аритмогенная кардиомиопатия: попытки разобраться с определением. Ее генетические основы. Классификации и варианты.
В.И. Целуйко, д.м.н., профессор,
К.Л. Крейндель, Харьковская медицинская академия последипломного образования
Кардиомиопатии заболевания миокарда неизвестной этиологии. Выделяют 4 вида кардиомиопатий: дилатационная, гипертрофическая, рестриктивная и правожелудочковая аритмогенная. Если гипертрофическая и дилатационная кардиомиопатии относительно известны кардиологам, то диагноз правожелудочковая аритмогенная кардиомиопатия (ПКМП) встречается крайне редко и не всегда правильно трактуется. Иногда ПКМП диагностируется у больных с дилатацией полости правого желудочка (ПЖ) после предшествующих длительных нарушений ритма. Это принципиально неправильно, так как нарушается причинно-следственная связь: при ПКМП первичным является перерождение миокарда с замещением его жировой и соединительной тканью. Гетерогенность миокарда правого желудочка (наличие мышечной, жировой, соединительной ткани) с различными электрофизиологическими характеристиками является основанием для развития в последующем правожелудочковых аритмий.
Согласно определению McKenna, «правожелудочковая аритмогенная кардиомиопатия заболевание, характеризующееся прогрессивным замещением миокарда правого желудочка соединительной или жировой тканью, с редким вовлечением в процесс миокарда левого желудочка, как правило, не поражает межжелудочковую перегородку». Термин «аритмогенная дисплазия правого желудочка» предложен G. Fontaine в 1977 г., поэтому это заболевание часто называют болезнью Фонтейна. В 1982 г. Marcus предложил термин «аритмогенная правожелудочковая кардиомиопатия, или аритмогенная болезнь правого желудочка». Многие авторы рассматривают ПКМП как миокардиальный феномен, однако, по мнению Fontaine, ПКМП является проявлением дисплазии. D. Corrado и соавт. считают, что в 76% случаев ПКМП в процесс вовлекается и левый желудочек (ЛЖ). А по данным C. McRae и соавт., ЛЖ поражается в 50% случаев ПКМП, что сопровождается наличием выраженной дилатационной кардиомиопатии.
ПКМП относительно редкое заболевание и по данным Perry встречается с частотой 1:5000. Выделены отдельные регионы, где ее распространенность выше, например Греция (о. Наксос) и Италия (Венеция). Ранняя диагностика ПКМП позволяет предупредить возникновение летальных аритмий и внезапную сердечную смерть. Трагичность заболевания заключается в его бессимптомном начале и неясной причине возникновения.
Несмотря на то что ПКМП описана более 30 лет назад, в отечественной литературе практически нет посвященных ей работ. В значительной степени это связано с относительно редкой встречаемостью ПКМП, отсутствием специфической клинической картины, необходимостью использования дорогостоящих, не всегда доступных методов инструментального обследования, а также с недостаточной настороженностью и знаниями врачей об этом заболевании. Судить о распространенности ПКМП в Украине достаточно сложно, так как заболевание практически не диагностируется.
Известно, что заболевание чаще манифестирует в молодом (до 40 лет) возрасте, преимущественно у мужчин (соотношение 4:1). Иногда первым проявлением заболевания является внезапная смерть. Наряду с гипертрофической кардиомиопатией, ПКМП рассматривается как основная причина внезапной смерти у молодых спортсменов 22%.
Генетические основы ПКМП
Этиология правожелудочковой аритмогенной дисплазии в настоящее время изучена недостаточно. Чаще всего заболевание носит идиопатический или наследственный характер. Показано, что с генетической точки зрения когорта больных достаточно гетерогенна, выявлены как аутосомно-доминантные, так и рецессивные типы наследования. Кроме того, идентифицировано 6 генов и 9 независимых локусов, ответственных за развитие правожелудочковой дисплазии/кардиомиопатии. Мутантные гены, ассоциированные с правожелудочковой кардиомиопатией, выявлены в 14 [q23-24] и 17, 12, 18 [q21] хромосомах. Они включают промежуточные филаменты, десмоплакин, плакофиллин, плакоглобин, ядро факторы защиты миокарда от воздействия механического стресса на клеточном уровне. Помимо этого, десмосомы входят в структуру вставочного сердечного диска и участвуют во внутриклеточных сигнальных сетях, которые сейчас прицельно изучаются in vitro. Проявлением данных мутаций является нарушение функции сократительных белков и их взаимодействия.
Кроме того, выделяют и другие варианты ПКМП:
- Врожденная аномалия развития миокарда ПЖ с клиническим проявлением внезапной смертью.
- Следствие дисплазии, обусловленной метаболическими нарушениями, поражающими ПЖ и вызывающими прогрессирующее замещение миоцитов.
- Воспалительного генеза: дисплазия как результат миокардита, когда инфекция не оставляет следов первичного воспаления. По данным F. Calabreseи соавт., в случаях ПКМП часто обнаруживали миокардит, в связи с чем рассматривают этиологический агент заболевания в виде группы кардиотропных вирусов. Е. Нурмухаметова считает самой частой причиной миокардита поражение вирусом Коксаки группы В. При этом возможно вовлечение как проводящей системы сердца, так и непосредственно миокарда. Но Fontaineпридерживается другой точки зрения: пациенты с ПКМП склонны к возникновению инфекционных миокардитов, то есть изменена интерпретация причинно-следственной связи. По мнению Peters, острый/хронический миокардит приводит к вовлечению в процесс левые отделы сердца, что является прогностически неблагоприятным признаком. Ввиду противоречивых данных роль инфекционного миокардита при ПКМП требует дальнейшего изучения.
- По мнению Turrim, Corrado, ПКМП является следствием дистрофии миокарда с уменьшением массы миокарда, его дисфункцией, электрической нестабильностью и сердечной недостаточностью.
- Morgera и соавт. отметили ассоциации блокады левой ножки пучка Гиса с аритмиями и идиопатическими желудочковыми тахиаритмиями.
- По мнению Folino, существует корреляционная зависимость между снижением вагусного воздействия и степенью тяжести болезни.
Классификация ПКМП
Группа ученых во главе с G. Fontaine на протяжении 23 лет исследовала более 250 пациентов не только во Франции, но и за ее пределами, включая Японию, США, Австралию. На основании наблюдения ими была предложена классификация ПКМП.
Изолированная дисплазия ПЖ
- Чистая форма ПКМП: макроскопический образец содержит в себе дилатацию ПЖ с выпячиваниями в области «треугольника дисплазии» (фиброзная и жхзировая ткань окутывают ПЖ в виде пятен, распространяясь на область верхушки, воронки и трикуспидальную область в форме треугольника. Большая часть массы миокарда замещена жиром. Типичный гистологический образец дает возможность выявить замещение среднего и наружного слоя миокарда ПЖ (менее миокард ЛЖ) жировой тканью и фиброзным ограничением. Утолщенная медия дистальной части коронарных артерий объясняет появление у таких пациентов атипичной боли в области грудной клетки, которая относится к маркерам синдрома Х.
- Болезнь Наксоса уникальная аутосомнорецессивная форма ПКМП, часто представлена в виде злокачественных желудочковых аритмий. Статистически: 25 пациентов из 12 семей, пенетрантность 90%. У таких больных имеется характерный фенотип: ладонностопный кератоз по типу пемфигоида, шерстистые волосы. Клинические признаки, данные электрокардиографии (ЭКГ) и результаты биопсии сходны с таковыми при ПКМП.
- Венецианская кардиомиопатия представляет собой наибольший симптомокомплекс ПКМП. При этой форме ЛЖ вовлекается чаще, чем при предыдущей. Семейная пенетрантность составляет 50%. Зарегистрирован летальный исход в возрасте 7 лет.
- Болезнь Поккури, гистологически соответствующая ПКМП, описана в Юго-Восточной Азии, Японии. Некоронарная прекардиальная элевация сегмента ST в области ПЖ выявлена у подростков, у которых во время сна или отдыха был риск возникновения внезапной смерти. У некоторых пациентов выявлены типичные ЭКГ-признаки ПКМП.
- Изолированная тахикардия, исходящая из ПЖ: полученные при выполнении ядерного магнитнорезонансного исследования и ангиоконтрастировании данные подтверждают наличие ПКМП, локализованной в области воронки.
- Доброкачественные экстрасистолы.
Предполагают, что они исходят из области воронки. Гистологически определялось значительное распространение фиброзной ткани в области воронки, ассоциированное с воспалением. По мнению авторов, причины смерти таких больных миокардиты.
- Аномалия Уля редко встречаемая патология, приводящая к сердечной недостаточности в молодом возрасте и в течение нескольких дней/недель к смерти. Причина смерти таких пациентов перегрузка сердца, сердечная недостаточность и/или аритмии. В таких случаях миокард характеризуется полным отсутствием мышечных волокон, а эндокард и эпикард противопоставлены. Макроскопически при болезни Уля определяется «пергаментное» сердце. Болезнь Уля является результатом экстенсивной и завершенной апоптотической деструкции миокарда ПЖ, в отличие от ПКМП. На данный момент аномалия Уля и ПКМП рассматриваются как патогенетически сходные заболевания.
- Неаритмогенные формы ПКМП согласно новой классификации ВОЗ рассматриваются как форма ПКМП. В этом случае предполагается наличие аритмогенного субстрата в «спящем состоянии», который выявляется при специальных инвазивных/неинвазивных исследованиях.
Дисплазия с вовлечением ЛЖ
- Бивентрикулярная дисплазия характеризуется поражением обоих желудочков. Типичная гистологическая структура ЛЖ: замещение жировой тканью, фиброзным ограничением. Это состояние приводит к сердечной недостаточности в связи с чрезмерным уменьшением миокарда ЛЖ и может быть ошибочно диагностировано как идиопатическая дилатационная кардиомиопатия. Дифференциально-диагностическим критерием является наличие жировой инфильтрации миокарда.
- Дисплазия, осложненная миокардитом в таком случае вовлекаются оба желудочка, прогноз неблагоприятный. В большинстве случаев в структурной основе ПКМП миокардит генетически предопределен. При миокардите с вовлечением обоих желудочков возникает сердечная недостаточность, приводящая к смертельному исходу, уносящая жизни 1% пациентов в год.
Сложной является постановка диагноза в случаях неаритмогенных форм, осложненных миокардитом.
Диагностика
Диагноз ПКМП ставится на основании структурных, гистологических, ЭКГ, генетических факторов. Определить функциональные и структурные повреждения позволяют исследования: ЭхоКГ, ангиография, ядерномагнитный резонанс с томографией или радионуклидное исследование.
Диагностика правожелудочковой кардиомиопатии достаточно сложна, так как нет характерных специфических или клинических жалоб либо клинических проявлений. В начале течение заболевания может быть бессимптомным или со стертой симптоматикой. Основные жалобы связаны с нарушениями ритма, и их проявления зависят от тяжести аритмии. Единичные правожелудочковые экстрасистолы больные могут субъективно не ощущать, в то время как наличие желудочковой экстрасистолии высоких градаций или желудочковой тахикардии проявляется пресинкопальные и синкопальные состояния, общая слабость.
Большое значение в диагностике правожелудочковой кардиомиопатии имеет ЭКГ, изменения на которой относительно специфичны. При проведении ЭКГ часто отмечаются отрицательные зубцы Т в отведениях V1-V2, а при вовлечении ЛЖ также в V4. При этом продолжительность комплекса QRS в правых грудных отведениях превышает 110 мс при его неизмененной ширине в отведении V6. Большая продолжительность комплекса QRS в правых грудных отведениях по сравнению с левыми сохраняется и в случаях блокады правой ножки пучка Гиса. Такая более чем полная блокада обусловлена сопутствующей париетальной блокадой проводящей системы ПЖ.
Весьма характерны различные эктопические желудочковые аритмии, вплоть до стойкой желудочковой тахикардии, при которой желудочковые комплексы обычно имеют вид блокады левой ножки пучка Гиса, а электрическая ось сердца может быть отклонена как вправо, так и влево. Пароксизмальная желудочковая тахикардия в большинстве случаев возникает в ПЖ и легко индуцируется при электрофизиологическом исследовании. У таких больных зачастую выражена дисперсия интервала QT в различных отведениях, а на сигналусредненной ЭКГ обнаруживаются поздние желудочковые потенциалы. По данным Corrado, в 14% случаев внезапной смерти у молодых пациентов в Венеции на ЭКГ зафиксирована элевация сегмента ST, аутопсия подтвердила ПКМП.
При ЭхоКГ определяется дилатация ПЖ, сокращения которого в типичных случаях носят асинергичный характер. У небольшой части больных наблюдается диффузная гипокинезия ПЖ. Определяется снижение фракции выброса (ФВ) ПЖ до 28%. Левые отделы сердца чаще не изменены. При сопутствующем миокардите характерно вовлечение ЛЖ со снижением его ФВ. По мнению Y. Juilliere, ФВ обоих желудочков является предиктором выживаемости при развитии идиопатической дилатационной кардиомиопатии. Согласно данным D. Mehta, наиболее чувствительным методом диагностики является 2-режимное эхокардиографическое исследование.
Сопоставляя результаты ЭКГ в 12 отведениях, ЭхоКГ (увеличение полости ПЖ) и эндомиокардиальной биопсии, можно говорить о степени тяжести дисфункции ПЖ.
Контрастная селективная правожелудочковая вентрикулография является золотым стандартом с условием соответствующего обзора и при избежании появления преждевременных желудочковых экстрасистолий [32, 48]. При этом характерна дилатация ПЖ в сочетании с сегментарными нарушениями его сокращения, выпячиваниями контура в областях дисплазии и увеличением трабекулярности. Это отличает аритмогенную кардиомиопатию ПЖ от правожелудочковой дилатационной кардиомиопатии и «чистого» миокардита, при которых гипокинезия ПЖ, а также ЛЖ носят диффузный характер.
Радионуклидная ангиография определяет снижение ФВ ПЖ с нормальной или относительно сохраненной функцией ЛЖ. Такие факторы, как наличие QRSдисперсии, синкопальных эпизодов в анамнезе и подтвержденные радионуклидной ангиографией изменения ПЖ и/или ЛЖ, являются независимыми неинвазивными предикторами внезапной смерти.
Электронная микроскопия позволяет определить ремоделирование вставочных дисков кардиомиоцитов.
Магнитно-резонансная томография позволяет производить запись замещения миокарда фиброзножировой тканью, выявлять очаги диаметром от нескольких миллиметров, производить расчет содержания жировой ткани.
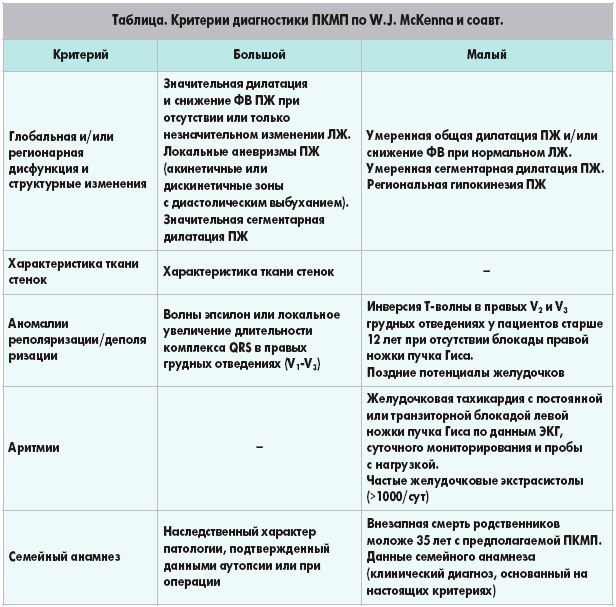
Стандартом диагностики является гистологическое подтверждение трансмурального фиброзно-жирового замещения миокарда ПЖ. Патологический процесс носит очаговый характер. Лишь в поздних стадиях слияние отдельных очагов может создавать впечатление диффузного поражения ПЖ. Тем не менее, биопсия не является чувствительным методом исследования изза сегментного (островкового) повреждения, а также в связи с тем, что забор материала производят из области межжелудочковой перегородки, тогда как при данной патологии жировое перерождение распространяется из эпикарда в эндокард. При осмотре макропрепарата сердца ПЖ дилатирован, истончен и покрыт жировой тканью. Часто определяются аневризмы книзу от трехстворчатого клапана и в области верхушки. В ряде случаев дисплазия распространяется на часть ЛЖ. W.J. McKenna предложил диагностические критерии аритмогенной дисплазии ПЖ, среди которых выделяют
большие и малые (табл.). О наличии ПКМП свидетельствует выявление 2 больших, либо 1 большого и 2 малых, либо 4 малых критериев.
Прогноз
Неинвазивными предикторами неблагоприятного прогноза при ПКМП являются преклонный возраст, синкопы, сердечная недостаточность, вовлечение в процесс ЛЖ и желудочковые аритмии. Дисперсия QRS >40 мс рассматривается как независимый предиктор синдрома внезапной сердечной смерти при ПКМП. Течение заболевания может быть осложнено развитием сердечной недостаточности. Сердечная недостаточность может быть как изолированной правожелудочковой, так и бивентрикулярной с развитием систолической недостаточности в течение 4-8 лет с момента возникновения полной блокады правой ножки пучка Гиса.
Лечение
При ПКМП применяют медикаментозное, неинвазивное и оперативное лечение.Медикаментозное лечение проводится только как симптоматическая терапия и предусматривает устранение и предотвращение жизнеугрожающих аритмий, реже проявлений застойной сердечной недостаточности. Лучшие результаты получены при использовании соталола (83%) в сравнении с верапамилом, эффективность которого составила 50%, амиодароном (25%) и бета-блокаторами (29%). В тяжелых случаях при хорошей переносимости с соблюдением мер предосторожности можно использовать комбинации препаратов, например амиодарона с бета-адреноблокаторами или амиодарона с флекаинидом или другими антиаритмическими средствами класса 1С. В первом случае учитывается положительное фармакодинамическое, а во втором фармакокинетическое взаимодействие комбинируемых лекарственных средств. Флекаинид можно сочетать также с бетаадреноблокаторами. При недостаточной эффективности, оцениваемой с использованием данных холтеровского мониторирования ЭКГ, подбор методов антиаритмической терапии целесообразно проводить с помощью электрофизиологического исследования.
Лечение застойной сердечной недостаточности проводят общепринятыми методами. Особенно эффективны карведилол и ингибиторы АПФ. При брадикардии, в том числе и индуцированной антиаритмической терапией, рекомендуется установка электрокардиостимулятора.
В случаях рефрактерности к терапии и при высоком риске развития синдрома внезапной сердечной смерти прибегают к неинвазивным методам лечения: имплантации дефибриллятора-кардиовертера или радиочастотной абляции. По данным Gatzoulis, на о. Наксос двум пациентам со злокачественными желудочковыми аритмиями имплантированы автоматические дефибрилляторы. По мнению S. Peter, абляция проводится только при ангиографическом подтверждении фокальной дисплазии. По данным Masedo, при липоматозной инфильтрации ПЖ>6 мм (согласно результатам магнитно-резонансного исследования) без локальной или распространенной дисфункции ПЖ следует осторожно проводить имплантацию кардиовертерадефибриллятора и использовать лекарственные препараты. Имплантация кардиовертера-дефибриллятора, как правило, переносится без осложнений и позволяет снизить смертность.
У больных с упорными потенциально фатальными желудочковыми аритмиями, особенно в сочетании с дисфункцией ЛЖ и застойной сердечной недостаточностью, эффективно хирургическое лечение вентрикулотомия, обеспечивающая прерывание циркуляции патологической волны возбуждения в ПЖ.
Среди методов оперативного вмешательства самым эффективным является трансплантация сердца. Однако, ввиду многих причин, она производится крайне редко, и данные по этому поводу в литературе встречаются нечасто.
Наряду с тем что в изучении ПКМП достигнуты определенные результаты, присутствие «белых пятен» в этиологии этого заболевания свидетельствует о необходимости проведения дальнейших исследований по данной теме.














Комментировать