Сравнительная характеристика нестероидных противоспалительных препаратов. Применение НПВП в клинической практике. Патология органов пищеварения, ассоциированная с приемом НПВП. Методы лабораторной и инструментальной диагностики патологии ЖКТ. Тактика ведения пациентов, получающих НПВП. Динамическое наблюдение за пациентами с различной степенью риска гастропатий.
М. А. Ливзан*, доктор медицинских наук, професор, М. Ф. Осипенко**, доктор медицинских наук, професор, Е. А. Лялюкова*,1 кандидат медицинских наук,* ГБОУ ВПО ОмГМА МЗ РФ, Омск,** ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
Благодаря широкому спектру показаний нестероидные противовоспалительные препараты (НПВП) стали популярным классом лекарственных средств и на сегодняшний день являются лидерами по продажам в аптечной сети.
По данным проведенного в Европе опроса НПВП назначают 82% врачей общей практики и 84% ревматологов. В России в 2007 г. было продано 105,8 млн упаковок НПВП [1]. Самостоятельное потребление НПВП пациентами в 7 раз превышает объем врачебных назначений [1]. С учетом масштаба применения НПВП, вопросы их эффективного использования и безопасности данной терапии чрезвычайно актуальны.
Сравнительная характеристика нестероидных противоспалительных препаратов
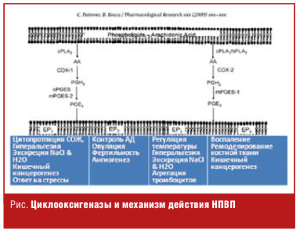
Класс НПВП представлен примерно 20 различными по химической структуре препаратами: производными салициловой, индоловой, гетероарил уксусной, энолиоковой и других кислот, имеющими общие фармакологические эффекты. Основной механизм фармакологического действия всех НПВП заключается в блокаде фермента циклооксигеназы (ЦОГ), регулирующего биотрансформацию арахидоновой кислоты в простагландины (ПГ), простациклин (ПГI2) и тромбоксан А2 (ТхА2). Ингибиция ЦОГ-2 рассматривается как один из важных механизмов противоспалительной и анальгетической активности данного класса препаратов (рис.).
Применение НПВП в клинической практике
В клинической практике НПВП применяются в ряде ситуаций [1–3].
1. Ургентное обезболивание и купирование лихорадки при:
- головных болях;
- почечной и билиарной коликах;
- дисменорее;
- лихорадочных состояниях, связанных с инфекционными и онкологическими заболеваниями.
2. Комплексное анестезиологическое пособие.
3. Купирование боли при заболеваниях опорно-двигательной системы.
Перспективно использования НПВП в практике онкологов. Эффективность НПВП в профилактике развития и рецидивов злокачественных новообразований желудочно-кишечного тракта (ЖКТ) хорошо обоснована теоретически и подтверждена данными эпидемиологических и когортных наблюдательных исследований. Длительное применение НПВП (сулиндак, целекоксиб) позволяет снизить темпы прогрессирования заболевания при семейном аденоматозном полипозе и уменьшить риск рецидивов спорадических аденоматозных полипов толстой кишки. НПВП являются эффективным средством для купирования хронической боли у онкологических больных. Имеются данные, свидетельствующие об эффективности НПВП в качестве дополнительного компонента традиционной химиотерапии.
Побочные эффекты применения НПВП
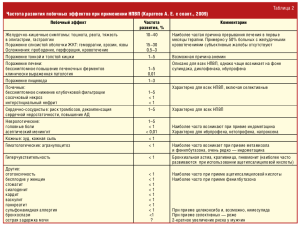
Терапевтические эффекты, обусловленные ингибированием различного типа ЦОГ (табл. 1), сопряжены с развитием ряда побочных эффектов.
Подавление активности ЦОГ-1 ассоциируется с высокой частотой поражения ЖКТ. Подавление ЦОГ-2-зависимого синтеза ПГ I2-клетками сосудистого эндотелия при отсутствии влияния на контролируемый ЦОГ-1 синтез ТхА2-тромбоцитами на фоне применения селективных НПВП обусловливает высокий риск развития тромбоэмболических осложнений. Помимо этого регистрируются и другие класс-специфические побочные эффекты (табл. 2).
Прием НПВП, в первую очередь неселективных в отношении ЦОГ-1, ассоциируется с широким спектром поражения органов пищеварения, от функциональных нарушений до тяжелой органической патологии, способной привести к летальному исходу. Прием селективных НПВП, напротив, сопряжен с высоким риском тромбоэмболических осложнений. Возможно поражение любого отдела ЖКТ — от полости рта до прямой кишки. Различные желудочно-кишечные симптомы (изжога, тошнота, рвота, тяжесть в эпигастрии, гастралгии) испытывают от 10% до 40% больных, при эзофагогастродуоденоскопии (ЭГДС) гастропатии (эрозии, язвы) регистрируется у 15–30% обследованных, тяжелые осложнения в виде прободений, перфораций, кровотечений — у 0,5–3%, поражение тонкой, толстой кишки, печени отмечается у 1–5% пациентов, принимающих НПВП.
Особенностью НПВП-ассоциированных язв являются следующие характеристики:
- острое повреждение слизистой;
- множественность изъязвлений;
- нетипичная локализация (локализация в желудке);
- «стертость» клинической картины;
- частые осложнения (кровотечения).
Риск желудочно-кишечных кровотечений становится максимальным при приеме большинства НПВП к 84-му дню лечения, а для индометацина — в течение первых 7 дней (T. Lee, 2007).
Негативное влияние на ЖКТ не ограничивается только верхними отделами. В последние годы все большее внимание уделяется проблеме лекарственного поражения тонкой кишки, прежде всего т. н. НПВП-энтеропатии. Эта патология характеризуется нарушением проницаемости кишечной стенки с экссудацией белка и диапедезом эритроцитов, приводящей к железодефицитной анемии и гипоальбуминемии, а также повреждению слизистой оболочки с развитием эрозий, язв и их осложнений — кровотечения и перфорации, появлением циркулярных стриктур и нарушением проходимости ЖКТ.
Бессимптомное повышение трансаминаз отмечается у 1–5% больных, регулярно принимающих НПВП, серьезные гепатотоксические реакции отмечаются в 1 случае на 10 000 больных, регулярно принимающих НПВП (U. Boelsterli и соавт., 2002; A. Walker, 1997). Патогенез этой патологии неизвестен. Определенную роль могут играть: поражение митохондрий гепатоцитов, как результат блокады ферментных систем цикла Кребса и разобщения окислительного фосфорилирования, блокада фосфодиэстеразы, нарушение экскреции желчи вследствие образования комплексов с желчными кислотами и энтерогепатической рециркуляции НПВП, иммуно-генетические нарушения и др. Поражение печени — редкая, но потенциально угрожающая жизни патология, связанная с приемом НПВП, имеющая характер метаболической или иммунологической идиосинкразии.
Методы лабораторной и инструментальной диагностики патологии ЖКТ
Основными методами диагностики поражения верхних отделов желудочно-кишечного тракта является ЭГДС, которую в группах риска необходимо провести в первый месяц от начала лечения. Вспомогательное значение может иметь исследование кала на скрытую кровь чувствительным методом. Проведение диагностических мероприятий для выявления патологии тонкой кишки показано больным, регулярно принимающим НПВП, в случае наличия у них клинических симптомов (диарея, метеоризм, абдоминальная боль), признаков кишечного кровотечения или железодефицитной анемии, гипоальбуминемии. Для диагностики поражения слизистой тонкой кишки используют эндоскопические методы, позволяющие визуализировать тощую и подвздошную кишку — энтероскопию, для диагностики стриктур — энтерографию с контрастным веществом, для диагностики воспаления — кал на кальпротектин. Обязательным является исследование кала на скрытую кровь высокочувствительными методами (иммунохимический метод или тест на трансферрин и гемоглобин в кале).
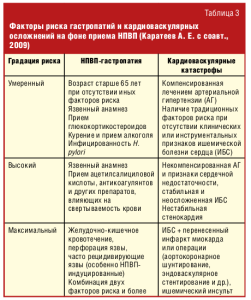
С целью диагностики гетатотоксических реакций необходим мониторинг биохимических показателей печени (табл. 3).
Тактика ведения пациентов, получающих НПВП
При ведении пациентов, получающих НПВП, необходимо:
- оценить факторы риска со стороны органов пищеварения и риск кардиоваскулярных осложнений у пациента до терапии (табл. 3);
- оценить наличие хронических заболеваний;
- кожные реакции на НПВП в анамнезе;
- при наличии у пациента тяжелых сопутствующих заболеваний назначение НПВП следует согласовать с врачами соответствующих специальностей;
- до лечения необходимы исследования: ЭГДС, общий анализ крови, определение уровней аланинаминтрансферазы (АЛТ), аспатратаминотрансферазы (АСТ), билирубина, креатинина крови;
- лечение следует начинать с наименее токсичных препаратов;
- использование минимально необходимой дозы;
- желательно избегать полипрагмазии;
- необходимо динамическое наблюдение за пациентами, получающими НПВП.
При наличии факторов риска необходимо проведение соответствующей профилактики. При риске ЖКТ-осложнений назначаются ингибиторы протонной помпы, при кардиоваскулярном риске — низкие дозы ацетилсалициловой кислоты.
Динамическое наблюдение за пациентами с различной степенью риска гастропатий [1]
1. Степень риска гастропатий отсутствует.
Если факторов риска нет, но длительность приема НПВП составляет более 4 недель, следует назначить селективные НПВП + ингибиторы протонной помпы (ИПП).
Контроль за нежелательными эффектами
Необходимые исследования: общий анализ крови (ОАК), определение уровней АЛТ, АСТ, креатинина; контроль артериального давления (АД) — перед лечением, через 3 недели от начала лечения, затем 1 раз в 3 месяца при непрерывном приеме в средних и высоких дозах; оценка субъективных жалоб (со стороны ЖКТ, отеки и т. д.) при каждом визите. При появлении признаков патологии ЖКТ необходимо провести эндоскопическое исследование (ЭГДС, колоноскопия, капсульная эндоскопия), кал на скрытую кровь чувствительным методом, кал на кальпротектин.
Лечебная тактика.
Возможно назначение неселективных НПВП: ацеклофенак, диклофенак, ибупрофен, кетопрофен (2-я линия: индометацин, пироксикам, напроксен) или могут быть назначены селективные НПВП.
В группах риска применение ИПП должно продолжаться на протяжении всего курса лечения НПВП или низкими дозами Аспирина.
2. Риск умеренный.
Имеется 1 фактор риска (пожилой возраст без дополнительных факторов риска (нет тяжелой сопутствующей патологии), или прием кортикостероидов, или курение и прием алкоголя, или инфицированность Н. рylori, или диспепсия в анамнезе).
Контроль за нежелательными эффектами.
Необходимые исследования: ОАК, определение уровней АЛТ, АСТ, креатинина; контроль АД — перед лечением, через 3 недели от начала лечения, затем 1 раз в 3 месяца при непрерывном приеме в средних и высоких дозах; оценка субъективных жалоб (со стороны ЖКТ, отеки и т. д.) при каждом визите, при появлении признаков патологии ЖКТ необходимо эндоскопическое исследование (ЭГДС, колоноскопия, капсульная эндоскопия), кал на скрытую кровь чувствительным методом, кал на кальпротектин; дополнительно ЭГДС через 1 месяц после начала приема НПВП, при появлении признаков НПВП-гастропатий определить наличие Н. рylori любым методом в соответствии со стандартами, общий анализ крови 1 раз в месяц.
Лечебная тактика.
Может назначаться любой селективный НПВП или неселективный НПВП + ИПП (следует стремиться к назначению НПВП в малых дозах, коротким курсом).
3. Риск высокий.
Имеется 1 фактор риска (язвенный анамнез, или прием Аспирина, или тяжелая сопутствующая патология).
Контроль за нежелательными эффектами.
Необходимые исследования: ОАК, определение уровней АЛТ, АСТ, креатинина; контроль АД — перед лечением, через 3 недели от начала лечения, затем 1 раз в 3 месяца при непрерывном приеме в средних и высоких дозах, оценка субъективных жалоб (со стороны ЖКТ, отеки и т. д.) при каждом визите, при появлении признаков патологии ЖКТ — эндоскопическое исследование (ЭГДС, колоноскопия, капсульная эндоскопия), кал на скрытую кровь чувствительным методом, кал на кальпротектин; дополнительно: ЭГДС через 1 месяц после начала приема НПВП, при появлении признаков НПВП-гастропатий определить наличие Н. рylori любым методом в соответствии со стандартами, общий анализ крови 1 раз в месяц.
Лечебная тактика.
Назначить по выбору: селективный НПВП + ИПП (стремиться к назначению в малых дозах, коротким курсом).
4. Риск очень высокий.
У пациента есть язвы, осложненные кровотечением или перфорацией в анамнезе, или часто рецидивирующие язвы, или комбинация двух факторов риска и более.
Контроль за нежелательными эффектами
Необходимые исследования: ОАК, определение уровней АЛТ, АСТ, креатинина; контроль АД — перед лечением, через 3 недели от начала лечения, затем 1 раз в 3 месяца при непрерывном приеме в средних и высоких дозах, оценка субъективных жалоб (со стороны ЖКТ, отеки и т. д.) при каждом визите. При появлении признаков патологии ЖКТ необходимо эндоскопическое исследование (ЭГДС, колоноскопия, капсульная эндоскопия), кал на скрытую кровь, кал на кальпротектин; дополнительно: ЭГДС через 1 месяц после начала приема НПВП, при появлении признаков НПВПгастропатий определить наличие Н. рylori любым методом в соответствии со стандартами, общий анализ крови 1 раз в месяц.
Лечебная тактика:
назначить селективный НПВП + ИПП. У лиц с язвенным анамнезом и лиц, получающих препараты, влияющие на свертываемость крови, использование селективных НПВП без ИПП не является эффективным методом профилактики гастропатий и осложнений. В группах риска применение ИПП должно продолжаться на протяжении всего курса лечения НПВП или низкими дозами Аспирина.
При сочетании ЖКТ-факторов риска и кардиоваскулярных осложнений следует назначить селективный НПВП + ацетилсалициловую кислоту + ИПП.
Тактика ведения пациентов с различным сердечно-сосудистым риском в настоящей статье не рассматривается.
При приеме нимесулида контроль показателей, отражающих состояние печени (АЛТ, АСТ, щелочной фосфатазы), необходимо осуществлять 1 раз в месяц.
Лечение язв, ассоциированных с приемом НПВП [1, 4]
Прекращение приема НПВП само по себе не приводит к рубцеванию язв, но может повышать эффективность про-тивоязвенной терапии.
Ингибиторы протонной помпы (40 мг в сутки омепразола ( Омез ®), или рабепразола, или 60 мг лансопразола) являются основным средством лечения гастродуоденальных язв и эрозий, превосходящими по лечебному действию Н2-гистаминоблокаторы и мизопростол (уровень доказательности рекомендаций А). Длительность курсовой терапии при локализации небольших язв в двенадцатиперстной кишке должна быть не менее 4–6 недель, а при больших размерах и локализации язв в желудке — 8–12 недель. Эффективность противоязвенной терапии может быть повышена комбинацией ИПП с препаратами висмута (уровень доказательности рекомендаций С).
С профилактической целью в группах риска используются ИПП (20 мг в сутки омепразола (Омез®) или рабепразола или 30 мг лансопразола) на протяжении всего приема любых НПВП, включая низкие дозы Аспирина.
Лечение НПВП-энтеропатий
Подходы к медикаментозному лечению НПВП-энтеропатии не разработаны. Применение ИПП не уменьшает риск развития НПВП-энтеропатии. Использование селективных НПВП снижает риск развития или рецидива патологии тонкой кишки. По сравнению с неселективными НПВП селективные НПВП существенно безопаснее в плане развития НПВП-энтеропатии. По некоторым данным, прием сульфасалазина и коллоидного субцитрата висмута способствовал уменьшению кровопотери при приеме НПВП. Одновременное назначение НПВП и сульфасалазина в дозе 2 г/сутки редуцировало увеличенную проницаемость кишечного эпителия, индуцированную приемом индометацина (J. Hayllar, 1994). Дополнительное назначение метронидазола в дозе 400 мг 2 раза в сутки 7 дней способствовало редукции изменений кишечной проницаемости, вызванной приемом индометацина (G. Davies, 1993).
Особенности применения нимесулида
Один из наиболее популярных в России селективных НПВП — нимесулид ( Найз ®). Эффективность нимесулида подтверждена длительным периодом (более 20 лет) клинического использования. Немаловажно, что генерики нимесу-лида в нашей стране по цене доступнее других представителей группы селективных НПВП.
Продемонстрировано преимущество нимесулида перед другими НПВП по быстроте действия и выраженности анальгетического эффекта. Благодаря своим биохимическим особенностям, нимесулид легко попадает в область воспаления (в частности, в пораженные суставы при артрите), накапливаясь в большей концентрации, чем в плазме крови. Через 30 мин после перорального приема концентрация препарата в крови достигает ~50% от пиковой и отмечается отчетливый обезболивающий эффект. Через 1–3 ч наступает пик концентрации препарата и, соответственно, развивается максимальное анальгетическое и противовоспалительное действие.
Молекула нимесулида в отличие от многих других представителей лекарственной группы НПВП имеет свойства основания. Это затрудняет ее проникновение в слизистую верхних отделов ЖКТ, тем самым уменьшая возможность контактного раздражения слизистой желудка и развития диспепсии. Нимесулид в целом лучше переносятся, чем неселективные НПВП. На сегодняшний день отсутствуют данные метаанализа о безопасности нимесулида, как и ряда других селективных НПВП, в отношении серьезных осложнений со стороны ЖКТ [5].
Все НПВП, включая селективные, способны вызывать эндоскопическое поражение ЖКТ, развитие тяжелых ЖКТ-осложнений.
При наличии факторов риска, к которым относится пожилой возраст, наличие соматической патологии и др. использование только селективных НПВП недостаточно профилактики гастропатий и ЖКТосложнений. Назначение ингибиторов протонной помпы требуется на весь период лечения НПВП.
В каждом случае выбор нимесулида, как препарата для длительного применения, должен сопровождаться тщательным анализом факторов риска и последующим активным контролем нежелательных эффектов.
Противопоказанием для назначения являются: наличие эрозивно-язвенных изменений слизистой оболочки желудка и двенадцатиперстной кишки, активное кровотечение, воспалительные заболевания кишечника, нарушения свертывания крови, печеночная почечная недостаточность, активное заболевание печени или сопутствующее применение любых потенциально гепатотоксичных средств.
У лиц с язвенным анамнезом и лиц, получающих препараты, влияющие на свертываемость крови, использование нимесулида необходимо на фоне сопутствующего приема ИПП. Применение нимесулида у больных с хроническими заболеваниями сердечно-сосудистой системы, как и других НПВП, возможно только на фоне их эффективной медикаментозной коррекции. В силу обсуждаемой проблемы гепатотоксических осложнений, нимесулид, как и все НПВП, не следует назначать больным с хроническими заболеваниями печени, сопровождающимися нарушением функции, или лицам, имеющим в анамнезе лекарственные гепатотоксические реакции.
Таким образом, во всех клинических ситуациях, даже если планируется кратковременное применение препаратов в низких дозах, выбор НПВП должен осуществляться индивидуально, исходя из фармакологических особенностей препарата, клинической ситуации и наличия факторов риска появления нежелательных эффектов. Врач должен осуществлять контроль за нежелательными эффектами. Пациенту также должна быть предоставлена необходимая информация о возможных нежелательных эффектах и методах самоконтроля в процессе лечения.
Литература
1. Каратеев А. Е., Яхно Н. Н., Лазебник Л. Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М.: ИМА-Пресс, 2009, 167 с.
2. Насонов Е. Л., Насонова В. А. Фармакотерапия боли: взгляд ревматолога // Consilium medicum.2000, 2 (12), 16–21.
3. Borenstein D. The role of the rheumatologist in managing pain therapy // Nat. Rev. Rheumatol. 2010, 6,227–231.
4. Ливзан М. А., Костенко М. Б. Язвенная болезнь: современные подходы к диагностике и терапии // Лечащий Врач. 2010, № 7. С. 20–24.
5. Каратеев А.Е. Целекоксиб, эторикоксиб, мелоксикам и нимесулид: достоинства и недостатки / А.Е.Каратеев // Ревматология. Травматология. Ортопедия, 2011. № 1.









Комментировать