Дегенеративные заболевания позвоночника. Спондилез. Частые спондилогенные причины дорсалгии.
Садоха К.А., Паторская И.А.
Белорусская медицинская академия последипломного образования, Медико-санитарная часть ОАО БелОМО им. С.И. Вавилова
Дегенеративные заболевания позвоночника –cамые распространенные из группы болезней костно-мышечной системы, частая причина боли в спине (БС). Боли в спине – вторая по частоте причина обращаемости за медицинской помощью после респираторных заболеваний. Распространенность вертеброгенных болезней в популяции, по данным различных авторов, составляет от 40 до 80%, со стойкой тенденцией к росту. В большинстве регионов до 14,7% работающего населения ежегодно оказываются временно нетрудоспособными по поводу данной патологии, что определяет актуальность проблемы и необходимость поиска способов ее решения.
В МКБ-10 все формы патологии по-звоночника обозначаются как дорсопатии (М40–М54) – группа заболеваний костно-мышечной системы и соединительной ткани, в клинике которых ведущий – болевой и /или функциональный синдром в области туловища и конечностей невисцеральной этиологии [1–3, 6, 8]. Согласно МКБ-10, дорсопатии подразделяются на следующие группы:
1) дорсопатии, вызванные деформацией позвоночника, дегенерациями межпозвоночных дисков без их протрузии, спондилолистезами;
2) спондилопатии;
3) дорсалгии.
Разработаны диагностические критерии дорсопатий [8]:
1) вертеброгенный болевой синдром;
2) чувствительные, двигательные нарушения в зоне иннервации пораженного корешка;
3) наличие относительно глубоких биомеханических расстройств компенсации двигательного акта;
4) данные электронейрофизиологического исследования, которые регистрируют нарушения проводимости по корешку, результаты игольчатой электромиографии, позволяющие установить денервационные изменения в мышцах пораженного миотома;
5) соответствующие данные компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) или рентгенологического исследования позвоночника.
Дорсалгия – болевой синдром в различных отделах спины и конечностей невисцеральной этиологии вследствие рефлекторных и/или компрессионных осложнений, дистрофических и функциональных изменений позвоночника, проксимальных суставов, а также миофасциального синдрома или фибромиалгии [2, 3]. Выделяют первичные и вторичные дорсалгии.
Вторичная дорсалгия может быть связана с врожденными аномалиями, травмами позвоночника, опухолевыми и инфекционными процессами, остео-порозом, заболеваниями внутренних органов. Существуют так называемые симптомы «опасности», обычно указывающие на вторичный (симптоматический) характер дорсалгии:
1) впервые возникшие и быстро нарастающие боли;
2) значительная интенсивность боли;
3) независимость интенсивности боли от положения тела и движений;
4) усиление боли ночью;
5) лихорадка и/или резкое похудение;
6) недавняя травма, возникновение болей в связи с травмой;
7) очаговые неврологические нарушения, которые выходят за рамки типичной радикулопатии;
8) признаки злокачественного новообразования, онкологическое заболевание в анамнезе;
9) общая слабость;
10) дебют острого болевого синдрома в возрасте моложе 20 или старше 55 лет [2].
Первичная дорсалгия – болевой синдром в спине, обусловленный дистрофическими и функциональными изменениями в тканях ПДС – позвоночно-двигательных сегментов (дугоотростчатых суставах позвонков, межпозвонковом диске – МПД, фасциях, мышцах, сухожилиях, связках) с возможным вовлечением смежных структур.
В связи с прямохождением позвоночник человека подвержен значительным статодинамическим нагрузкам, что приводит к относительно ранним дегенеративно-дистрофическим процессам. Снижение гидрофильности и недостаточное кровоснабжение хрящевой ткани МПД ведет к уменьшению объема и к изменению формы их пульпозных ядер, к снижению прочности фиброзных колец, особенно более слабого заднего их отдела. При этом происходит снижение высоты МПД и его протрузия, а затем и пролабирование элементов ткани диска за пределы краев прилежащих позвонков. Термином «протрузия диска» обозначается состояние, когда целостность наружных волокон фиброзного кольца сохранена, его выпячивание происходит под действием секвестров дегенерированного пульпозного ядра.
Патологическая протрузия межпозвоночного диска отличается от физиологической тем, что распространенное или локальное выпячивание фиброзного кольца приводит к сужению позвоночного канала и не уменьшается при движениях позвоночника [4]. Выпячивание диска считается значительно выраженным и клинически значимым, если оно превышает 25% переднезаднего диаметра позвоночного канала или сужает канал до критического уровня (10 мм). Собственно термин «выпадение или грыжа диска» применяется для обозначения случаев проникновения фрагментов или большей части пульпозного ядра через диффузный разрыв фиброзного кольца за его пределы или через поврежденную гиалиновую пластинку в тело позвонка [4, 6, 13]. Появление тех или иных симптомов грыж зависит от их расположения [4]. Грыжи нижнепоясничного отдела позвоночника чаще проявляются резкой болью в пояснице с распространением по ходу ущемленного нервного корешка. В тяжелых случаях межпозвонковые грыжи дисков нижнепоясничного отдела могут приводить к слабости мышц нижних конечностей, к нарушению деятельности мочевого пузыря и нижних отделов кишечника. Такие случаи – абсолютное и срочное показание к консультации нейрохирурга, к оперативному лечению [1, 6, 13].
Раздел «Спондилопатии» включает остеохондроз, спондилез, артроз и дегенерацию фасеточных (дугоотростчатых) суставов – спондилоартроз [1,4, 5, 6, 13]. Спондилез – следующий этап остеохондроза с образованием костных выступов, крючков – остеофитов. В результате диск оказывается ограничен по боковым сторонам остеофитами. В какой-то мере появление остеофитов –компенсаторная реакция организма при постепенном разрушении хряща межпозвонкового диска, – остеофиты ограничивают патологический процесс в фиброзном кольце.
Остеохондроз и спондилез не имеют отдельных самостоятельных симптомов. Это определенные этапы единого патологического процесса [1, 4, 6,13]. Для диагностики спондилеза лучше использовать рентгенографию и компьютерную томографию. При этом Г.А. Зедгенидзе, П.Л. Жарков выделяют три стадии деформирующего спондилеза:
1) костные клювовидные разрастания не выходят за плоскость площадки тела позвонка, располагаясь на уровне краевого канта (лимбуса); 2) костные разрастания огибают межпозвонковый диск; иногда идущие друг к другу остеофиты образуют неоартроз; 3) образование мощной костной скобы, соединяющей тела между собой и полностью блокирующей двигательный сегмент [5].
Деформирующий спондилез связан с травматизацией передней продольной связки выпячивающимся фиброзным кольцом, которое отрывает ее от места прикрепления к телу позвонка ниже лимбуса. В ответ на травму передняя продольная связка, играющая роль надкостницы, отвечает костеобразованием. Если деформирующий спондилез передней продольной связки позвоночника – саногенетический процесс, направленный на фиксацию позвоночного двигательного сегмента, то оссификация задней продольной связки позвоночника всегда отражает выраженную патологию диска с тенденцией пролабирования его кзади [4–6, 13].
Позвоночный столб вместе с периферическим отделом опорно-двигательного аппарата составляет единую биокинематическую систему, органически сочетающую в себе стабильность со значительной мобильностью. Сбалансированное функционирование позвоночника как центральной составляющей этой системы обеспечивается структурной и функциональной полноценностью следующих структур: 1) межпозвонковых дисков; 2) апофизарных, крестцово-подвздошных, тазобедренных, коленных и голеностопных суставов; 3) связочного аппарата; 4) мышц спины, живота и нижних конечностей [3, 4, 8, 13, 14]. Возникающее в результате нестабильности повреждение мягких тканей ПДС и сосудисто-нервных образований в корешковом и позвоночном каналах приводит к появлению рефлекторных, рефлекторнокомпрессионных, компрессионно-рефлекторных, корешковых и сосудистых синдромов.
Среди наиболее частых спондилогенных причин дорсалгии выделяют [9]:
1) дисковертебральный синдром (синдром «мигрирующего диска»), возникающий при раздражении нервных окончаний вследствие сегментарной нестабильности ПДС;
2) синдром межпозвонкового отверстия, когда болевые ощущения обусловлены протрузией пульпозного ядра, раздражением нервных окончаний фиброзного кольца и задней продольной связки, спинального ганглия;
3) дископаравертебральный синдром, связанный с появлением мышечных блокад позвоночных сегментов;
4) суставной синдром, который появляется при сближении суставных отростков и растяжении суставных капсул (синовиальная боль);
5) синдром межостистых отростков, обусловленный фиброзным перерождением капсульносвязочных структур позвоночника;
6) дискомедулярный синдром – компрессионно-ишемические поражения нервных корешков и структур спинного мозга.
Таким образом, совокупность дегенеративнодистрофических процессов в позвоночнике с клинической точки зрения можно представить как синдромы компрессионного поражения нервных корешков и рефлекторные [1–4, 6, 9, 13, 14]. Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы, прежде всего мышечно-тонические. Они диагностируются с учетом следующих критериев:
1) глубокая боль в пределах спазмированной мышцы («короткая» боль);
2) боль провоцируется движением с участием соответствующей мышцы;
3) симптомы натяжения вызывают локальную боль – псевдоположительные симптомы;
4) при пальпации мышца болезненна, напряжена, с локальными гипертонусами [2, 3, 9,13].
Компрессионные радикулопатии проявляются следующими клиническими признаками:
1) чаще стреляющие боли, иррадиирующие в верхнюю или нижнюю конечность до пальцев кисти или стопы («длинная» боль);
2) боль часто провоцируется движением в соответствующем отделе позвоночника, изменением позы, различна по характеру и выраженности;
3) симптомы натяжения вызывают «длинную»боль – истинноположительные симптомы;
4) боль сочетается с парестезиями, сопровождается симптомами раздражения, затем выпадения функций заинтересованного нервного корешка (гипестезия, слабость, гипотрофия мышц, снижение или выпадение рефлексов);
5) при пальпации выявляются напряжение и болезненность паравертебральных мышц;
6) дискорадулярный конфликт при МРТ-исследовании [3, 9, 13].
У 54% пациентов с дорсопатиями выявляются миофасциальные болевые синдромы:
1) боль, удаленная от спазмированной мышцы («отраженная» боль);
2) при пальпации мышца напряжена, резко болезненна, с локальными гипертонусами;
3) давление на триггерную точку провоцирует резкую болезненность в самой точке и на отдалении [1, 3, 13].
Несмотря на интенсивные исследования, все еще остается ряд нерешенных проблем, касающихся оптимального лечения дорсопатий. С целью воздействия на их основные клинические проявления во всем мире широко используются нестероидные противовоспалительные средства – НПВС, но их назначение часто сопровождается побочными эффектами. Одно из наиболее распространенных осложнений вследствие их назначения – эрозивно-язвенное поражение желудочно-кишечного тракта с развитием НПВС-гастропатий. Поэтому актуальная задача – поиск адекватных и безопасных методик лечения дорсопатий.
Долгое время проводился активный поиск оптимального препарата, который оказывал бы комплексное воздействие на многие звенья патогенеза спондилогенных дорсалгий. На протяжении последних лет для лечения многих заболеваний широко применяется созданный в Украине инъекционный препарат – L-лизина эсцинат – водорастворимая соль сапонина эсцина из плодов конского каштана и аминокислоты L-лизина – 0,1% раствор для иньекций; ампулы по 5 мл содержат 4,4 г эсцина [7].
Противовоспалительные свойства эсцина экспериментально подтверждены на разных моделях воспаления еще в 1970–90-х годах. Считают, что эсцин проявляет свою антиэкссудативную активность опосредованно, стимулируя выработку и высвобождение простагландиноподобного вещества (ПГ-2). Существует предположение, что противовоспалительное действие эсцина связано с его влиянием на кору надпочечников и способностью стимулировать секрецию глюкокортикоидов [7, 10–12]. Кроме того, эсцин, угнетая активность лизосомальных гидролаз, препятствует расщеплению мукополисахаридов в стенках капилляров и окружающей их соединительной ткани, уменьшая повышенную сосудисто-тканевую проницаемость. Эсцин также увеличивает содержание сухого остатка лимфы, нормализуя проницаемость «плазмолимфатического барьера», то есть комплекса гематоинтерстициальных и лимфоинтерстициальных взаимодействий, направленных на поддержание необходимого уровня метаболизма в тканях [11].
Мембранотропные свойства эсцина связаны с его способностью увеличивать текучесть липидного бислоя биологических мембран. Предполагают также, что эсцин реагирует с мембранными белками за счет взаимодействия между остатком глюкуроновой кислоты и остатками аминокислот лизина, аргинина. Венотонизирующее действие эсцина, возможно, обусловлено стимуляцией синтеза и высвобождения простагландина F2а в венозной стенке. Антиэкссудативные и капилляроукрепляющие свойства эсцина позволяют использовать его в качестве противоотечного средства.
Таким образом, препарат оказывает противоотечный, обезболивающий, противовоспалительный, мембранопротекторный эффекты, улучшает микроциркуляцию, снижает патологическую проницаемость сосудистой стенки за счет улучшения ее упруго-эластических свойств и венотонизирующего действия, восстанавливает эндотелиальную функцию, реологические показатели, снижает агрегационную активность тромбоцитов, применяется также с целью иммунокоррекции, так как модулирует Т-клеточное звено иммунной системы [7,10–12]. Фармакологическая многогранность L-лизина эсцината позволяет использовать его при спондилогенных дорсалгиях, учитывая патогенез этих заболеваний.
В дневном стационаре медсанчасти ОАО БелОМО им. С.И.Вавилова выполнено параллельное открытое клиническое исследование с целью оценки эффективности и безопасности L -лизина эсцината в комплексном лечении острых спондилогенных дорсалгий. Под наблюдением находилось 110 пациентов в возрасте от 26 до 58 лет (средний возраст – 42,0±2,2 года); 44 женщины и 66 мужчин. У 42 пациентов диагностирована люмбоишиалгия, у 36 – дискогенная радикулопатия с заинтересованностью первого крестцового корешка, у 32 – бирадикулярная дискогенная (L4-L5 и L5-S1) радикулопатия. Во всех случаях диагнозы соответствовали клинической классификации заболеваний периферической нервной системы (И.П.Антонов, 1985), адаптированной к Международной классификации болезней 10-го пересмотра (МКБ-10). Продолжительность заболевания –10,4±3,6 года. Длительность обострения до поступления в клинику колебалась от 1 до 5 недель и в среднем составляла 21,6 ±1,4 дня.
Распределение пациентов по группам проведено методом случайной выборки. В первой – основной группе (55 пациентов) на фоне общепринятого лечебного комплекса назначался L-лизина эсцинат (10 мл внутривенно капельно на 100 мл физиологического раствора – ежедневно №10). В контрольной группе (55 пациентов, сопоставимых с основной группой по возрасту, полу, клиническим формам и другим параметрам) применялась общепринятая схема лечения (НПВС, миорелаксанты, традиционная физиотерапия), но без L-лизина эсцината.
Дизайн исследования включал клинико-неврологическую оценку пациентов с традиционным обьективным осмотром, заполнением специально разработанной анкеты, определением степени выраженности боли по специальным шкалам до и после лечения, мануальное тестирование отдельных мышц с использованием дозированных нагрузочных проб, динамические общеклинические анализы, спондилографию с рентгенометрией позвоночника в двух проекциях, при необходимости – функциональную спондилографию, реовазографию нижних конечностей для определения состояния венозного оттока, электромиографию отдельных мышц, компьютерную, магнитно-резонансную томографию пояснично-крестцового отдела для подтверждения диагноза, исключения вторичного характера дорсалгии. Длительность наблюдения составила 14 дней.
Эффективность проводимого лечения оценивалась по следующим критериям:
1) интенсивность болевого синдрома по визуальной аналоговой шкале (ВАШ – 100 баллов);
2) обьем движений в позвоночнике;
3) мышечно-тонические проявления;
4) выраженность корешкового синдрома;
5) эмоциональная оценка пациентами своих болевых ощущений.
По шкалам вычисляли ранговый индекс боли (РИБ) как сумму прилагательных, характеризующих болевой синдром: С – сенсорные нарушения; Э – эмоцио-нальные расстройства; И – интенсивность боли; Р – разнообразие болевого синдрома и настоящее ощущение интенсивности боли (НИБ) от 0 до 5 баллов.
Степень выраженности мышечно-тонического синдрома (МТС) определяли, вычисляя индекс мышечного синдрома (ИМС):
I) выраженность спонтанных болей:
1 балл – в покое болей нет, появляются при нагрузке;
2 балла – боли незначительны в покое, усиливаются при движении;
3 балла – боли в покое, нарушается сон, вынужденная поза;
II) тонус мышц:
1 балл – палец легко погружается в мышцу;
2 балла – для погружения необходимо определенное усилие;
3 балла – мышца каменной плотности;
III) болезненность мышц:
1 балл – при пальпации пациент говорит о наличии боли;
2 балла – ответ на пальпацию мимической реакцией;
3 балла – ответ общей двигательной реакцией;
IV) продолжительность болезненности:
1 балл – болезненность прекращается сразу;
2 балла – продолжается до 1 мин;
3 балла – продолжается более 1 мин;
V) степень иррадиации болей при пальпации:
1 балл – болезненность локализуется в месте пальпации;
2 балла – боль распространяется на рядом расположенные ткани;
3 балла – боль распространяется на отдаленные области.
ИМС оценивают по сумме баллов названных признаков:
I степень (легкая) – ИМС до 5 баллов;
II (средняя, умеренная) – от 5 до 12 баллов; III (тяжелая, выраженная) – более 12 баллов[3].
Неврологический статус оценивался при поступлении, до начала лечения, через 5, 10 дней и при выписке из стационара. Результаты терапии по количественным оценочным шкалам обработаны статистически с вычислением t-критерия Стьюдента. Достоверными считали результаты при Р<0,05. Кроме клинической эффективности оценивались безопасность и переносимость препарата.
До начала исследований у всех наших пациентов в клинической картине преобладал вертеброгенный болевой синдром – различной интенсивности боли в пояснично-крестцовой области (у 76 – умеренной, у 34 – значительной), иррадиирующие в нижние конечности, с ограничением активных и пассивных движений в поясничном отделе позвоночника, напряжением околопозвоночных мышц и болезненностью их, остистых отростков, паравертебральных точек при пальпации на уровне L3-S1, положительными симптомами Ласега, Вассермана, Мацкевича. В случаях дискогенной радикулопатии клиническая картина дополнялась снижением или выпадением соответствующих рефлексов (L4 – коленного, S1 – ахиллового), мышечной слабостью и гипестезией в зоне иннервации пораженных нервных корешков.
Интенсивность боли все пациенты основной группы оценили как сильную и умеренную, по шкале ВАШ – соответственно 85,7±2 и 66,7±2 балла. Эти данные подтверждало НИБ – 4,4 ±0,1 и 2,7± 0,1, градуированное как сильная – умеренная боль. Эмоциональная и вегетативно-сосудистая окраска боли характеризовалась широким спектром разнообразных ощущений, в количественном отображении РИБ составил 10,8±0,4 балла. ИМС при обьективном осмотре определяли как выраженный (12,5± 0,2 балла; у 34 пациентов – 31%) и умеренный (7,6± 0,2 балла; у 76 чел. – 69%).
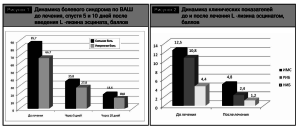
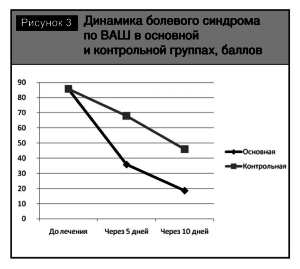
После проведенного лечения все 55 пациентов основной группы отметили улучшение своего состояния. Интенсивность боли по ВАШ через 5 дней терапии в 22 случаях (40%) снизилась до 35,8± 2 балла (р <0,01) и в 33 случаях (60%) – до 27,8±3 (p<0,01). Выраженность боли по ВАШ через 10 дней терапии у наших пациентов снизилась до 18,6±2 балла и 10,8±2 соответственно (р<0,01) (рис.1).
Мышечно-тонические проявления и их динамика соответствовали степени выраженности болевого синдрома. ИМС через 5 дней лечения составлял не более 4,8±0,2 балла (р<0,05); через 10 дней снизился до 2,0±0,2 (р<0,05). Положительной динамике болевого синдрома и ИМС сопутствовало значительное уменьшение болезненности паравертебральных точек в проекции сегментов L3–S1, восстановление полного обьема движений в позвоночнике у всех пациентов основной группы.
Снижение выраженности боли и ИМС сопровождалось исчезновением субьективных сенсорных ощущений, признаков вегетативной дисфункции, тревожности, депрессии, повышенной эмоциональной возбудимости, что проявлялось уменьшением РИБ и НИБ до 2,4±0,2 и 1,2±0,2 балла соответственно, р <0,05 (рис. 2).
Переносимость L-лизина эсцината у всех пациентов была хорошей за исключением одного случая, когда к концу курса лечения (10-й день) появилась кожная сыпь. Отсутствие побочных реакций в первые дни лечения вызывает серьезные сомнения в отношении препарата-виновника.
Оценка результатов лечения в основной группе, по мнению врача и пациентов, совпала во всех случаях. Значительное улучшение отметили 47 больных (80,5%), умеренное – 8 (19,5%). Таким образом, положительная динамика под влиянием L -лизина эсцината отмечалась у всех (100%) пациентов основной группы.
Клинические проявления у пациентов контрольной группы совпадали с аналогичными показателями в основной группе. После лечения состояние большинства больных контрольной группы также улучшилось. Интенсивность боли снизилась по ВАШ до 68±2 балла (р < 0, 05) через 5 дней и до 46±2 (р <0,05) – через 10 дней. Побочные эффекты в виде болей в эпигастральной области и диспепсических проявлений отметили 12 пациентов (21,8%) контрольной группы. При проведении фиброгастродуоденоскопии у всех этих больных выявлена гастропатия, у 3 (5,5%) – эрозивная, что позволяет трактовать эти нарушения как НПВС-гастропатию.
Сопоставление результатов лечения в основной и контрольной группах показало, что под влиянием терапии наблюдается регресс болевого, мышечно-тонического синдромов, вегетативно-сосудистой дисфункции и эмоционального ощущения боли, но их положительная динамика более значима и отчетлива у пациентов основной группы (рис. 3).
Таким образом, L-лизина эсцинат оказывает благоприятное комплексное воздействие на основные патогенетические звенья и клинические проявления спондилогенных дорсалгий, обладает противовоспалительным, обезболивающим, противоотечным, венотонизирующим (значительно улучшился венозный отток по данным реовазографии) эффектами, хорошо переносится больными. Следует отметить, что у пациентов с острой спондилогенной дорсалгией оптимальный курс лечения L-лизина эсцинатом для достижения стойкого желаемого клинического эффекта составляет 10 дней, что существенно сокращает сроки лечения.
L -лизина эсцинат в комплексном консервативном лечении острых спондилогенных дорсалгий эффективен в подавляющем большинстве случаев, сокращает сроки лечения, время нетрудоспособности, экономические затраты, что позволяет рекомендовать его к более широкому применению в амбулаторной и стационарной практике.
Значительный удельный вес спондилогенных дорсалгий в структуре неврологических заболеваний, экономические затраты, связанные с оплатой лечения и потерей трудоспособности, недостаточная информированность врачей по этой проблеме определяют ее актуальность. Необходим учет общих и частных закономерностей заболеваний позвоночника, ведущих синдромов поражения для разработки эффективных методов терапии. В этом плане необходимы оптимальные медикаментозные средства, которые оказывают комплексное действие на разные звенья патогенеза спондилогенных дорсалгий, так как у этих пациентов формируются сложные патологические реакции, определяющие клиническую картину заболевания. Желанием частично восполнить пробелы в проблеме диагностики, адекватной терапии первичных дорсалгий и является эта работа, основанная на собственном практическом опыте, анализе литературных данных отечественных и зарубежных авторов [1–6, 8, 9, 13, 14].
ЛИТЕРАТУРА
1. Бадалян, О.Л. Применение Вольтарена «Эмульгеля» в лечении дорсопатий / О.Л.Бадалян, С.Г.Бурд, А.А. Савенков и др. //РМЖ. – 2007. – №10 (15). – С. 860–862.
2. Бова, А.А. Современные подходы к проблеме боли в нижней части спины / А.А. Бова // Мед. новости. – 2008. – №1. – С. 36–40.
3. Крыжановский, В.Л. Боль в спине: диагностика, лечение и реабилитация / В.Л. Крыжановский: пособие для врачей. – Мн.: ДД,2004. – 28 с.
4. Кузнецов, В.Ф. Справочник по вертеброневрологии: клиника, диагностика / В.Ф. Кузнецов. – Мн.: Беларусь, 2000. – 351 с.
5. Методики рентгенологического и радиологического исследования позвоночника и крупных суставов / Г.А.Зедгенидзе, П.Л.Жарков.– Ташкент: Медицина УзССР, 1979. – 207 с.
6. Никифоров, А.С. Остеохондроз и спондилоартроз позвоночника как проявления единого дегенеративного процесса. Современные подходы к лечению / А.С. Никифоров, О.И. Мендель // РМЖ. – 2006. – №23 (14). – С.1708–1713.
7. ОАО «Киевмедпрепарат». Корпорация «Артериум». – Сб. информ. м-лов по лек. препаратам промоционной группы. – Киев, 2005. –32 с.
8. Путилина, М.В. Особенности диагностики и лечения дорсопатий в неврологической практике / М.В. Путилина // Сопsilium medicum. – 2006. – № 8 (8). – С. 44–48.
9. Соловьева, Э.Ю. Дорсопатия: совместное применение декскетопрофена и нимесулида в стадии обострения / Э.Ю. Соловьева, А.Н. Карнеев, А.И. Федин // Соnsilium medicum. –2007. – № 2(9). – С. 42–46.
10. Спасиченко, П.В. Отчет о клиническом испытании препарата «Раствор L-лизина эсцината 0,1% для иньекций» (2-я фаза клинических испытаний). – Киев,1997. – 25 с.
11. Усенко, Л.В. Применение L-лизина эсцината при купировании локальных отеков в церебральной и спинальной нейрохирургии и реаниматологии / Л.В. Усенко, В.И. Слива, А.А. Криштафор и др. // Новости медицины и фармации. – 2002. – №7–8. – С. 3.
12. Черний, В.И. и др. Применение препарата L-лизина эсцинат в нейрохирургии, неврологии, травматологии и ортопедии. – Киев,2004. –33 с.
13. Ширшов А.В. Поясничный остеохондроз: диагностика, клиника и лечение /А.В. Ширшов, М.А. Пирадов // РМЖ. – 2004. – №4 (12). – С.212– 215.
14. Devereaux M.W. Low back pain // Prim. Care Clin. Office Pract. – 2004. – Vol. 31. – P. 33–51.
Медицинские новости. – 2010. – №11
Источник: www.mednovosti.by



Комментировать