Индивидуальный мониторинг с помощью микрочипов может привести к революционному прорыву в диагностике и лечении
Диагностика в медицинском понимании предполагает набор правил, методов, решений, которые в конечном счете позволяют прийти к заключению о наличии или вероятности наличия того или иного заболевания.
Функциональная диагностика является специфическим и достаточно хорошо очерченным разделом медицинской диагностики. Оценивая перспективы и развитие функциональной диагностики за последние годы, хотелось бы отметить, что существуют как скептики, так и оптимисты. Скептики говорят, что поскольку основой функциональной диагностики является клиническая физиология, то есть анализ регуляторных процессов, протекающих в организме человека и указывающих на наличие заболевания, а сама клиническая физиология за последние годы не претерпела серьезных изменений, то и функциональная диагностика проходит в настоящее время фазу стабилизации без ожидания революционных прорывов.
Оптимисты рассуждают совершенно противоположно. Они говорят, что накопление технологических инноваций и данных, полученных за последнее время, приводит к качественным и количественным изменениям, которые открывают новые горизонты в данной области.
Не вызывает сомнений, что с развитием современных технологий мы получаем возможность выявлять все более ранние изменения регуляции, связанные с заболеванием. Но я хотел бы обратить внимание не на количественные, а на качественные тренды в функциональной диагностике. Традиционно предметом изучения были процессы в организме, протекающие либо в состоянии относительного покоя, либо при искусственно создаваемой «существенной» нагрузке, то есть фактически это была «провокационная» функциональная диагностика. Первой удачной попыткой перейти к «наблюдательной» функциональной диагностике можно признать создание в 60-х годах XX века аппаратуры для непрерывного контроля ЭКГ (Н. Холтер) и артериального давления (А. Нинман) в условиях «реальной жизнедеятельности».
Прошло 50 лет недоверия, скепсиса, пессимизма, признания и совершенствования, и эти методы стали незаменимы при выявлении и лечении нарушений ритма и проводимости сердца и артериальной гипертонии. Теперь мы понимаем, что та гипертония, которая традиционно выявлялась на приеме у врача, — это только 40–60% от «айсберга» действительной гипертонии. Часть из нее оказалась ложной гипертонией — «гипертонией белого халата». А очень тревожная ночная гипертония, а также гипертония, которая проявляется только на рабочем месте, стала доступна для выявления и коррекции только при использовании современных приборов, которые автоматически измеряют давление каждые 15–30 минут.
Более того, уже есть аппаратура в виде браслетов для ежесекундного контроля АД в условиях «реальных эмоциональных и физических» стрессов. В 2014 году в США впервые разрешена для клинического использования вживляемая в легочную артерию система для непрерывного измерения и передачи в центр наблюдения данных о давлении в малом круге кровообращения в «домашних условиях». Данный технологический прорыв привел к осязаемым результатам при наблюдении и лечении больных с низкой производительностью сердца. Большие усилия в создании имплантируемых устройств, позволяющих мониторировать все более широкий спектр показателей сердечно-сосудистой системы, отмечены со стороны фирм, производящих имплантируемые кардиостимуляторы.
Практически можно констатировать, что «джин вырвался из бутылки» и мы стоим на пороге создания «наблюдательной функциональной диагностики» на основе вживляемых микрочипов. Оптимисты мечтают о безопасных микрочипах, которые будут «с предупреждением» вживляться человеку и работать в течение длительного времени, собирая необходимую информацию, которая будет выявлять самые ранние неблагоприятные функциональные изменения. То есть функциональная диагностика будет направлена на выявление и коррекцию состояний, предшествующих заболеванию. Это направление — индивидуальный мониторинг с помощью микрочипов — может привести к революционному прорыву в диагностике и лечении.

Принятие решений в диагностике остается за человеком, но помощь, оказываемая техникой, становится значимой
В последнее время наблюдается не только появление новых методов диагностики, но и, что удивительно, возрождение методов, которые еще недавно казались устаревшими. Причем эти подходы приобретают совершенно иную роль в диагностике, нежели это было ранее.
В качестве одного из примеров можно упомянуть внедрение новых методов микроскопического анализа. Снижение роли и востребованности этих методов определялось небольшой точностью микроскопических методов, но в большей степени дороговизной. Анализ мазка крови стоит дорого, автоматический анализатор проводит анализ и быстрее, и дешевле. Внедрение систем автоматизированной пробоподготовки, автоматического фотографирования препаратов, развитие систем поддержки принятия решений и многое другое сделало микроскопические методы и более точными, и более дешевыми. Уже сейчас в некоторых клиниках установлены роботизированные системы, которые позволяют автоматически производить фотографирование большого числа препаратов. Роль диагноста сводится к анализу полученных изображений. На очереди системы распознавания изображений. Понятно, что принятие решения остается за человеком, но помощь, оказываемая техникой, становится значимой.
Плюс новые методы микроскопии понемногу из исследовательских лабораторий перебираются в клинику. Это не только новые приборы, но и новые экспериментальные подходы. Речь идет прежде всего о системах, связанных с использованием флуоресцентных белков, которые давно используются в исследовательских целях или в системах скрининга. Последнее довольно быстро перерастает в диагностические приложения.
Другой интересный пример — развитие методов проточной цитофлуориметрии. В этом методе анализируется наличие определенных белков на поверхности клеток, что очень важно, например, для дифференциальной диагностики лейкозов и лимфом. Опухолевые клетки отличаются довольно специфическим набором белков на своей поверхности, выявив которые, можно поставить диагноз. Проблема в том, что выявить надо довольно много маркеров. Ранее одновременно можно было выявить два, редко более маркеров. Если опухолевых клеток много, то проблемы нет. Но если опухолевых клеток мало, то распознать их среди многочисленных нормальных почти невозможно. Сейчас внедряются подходы, когда одновременно выявляются восемь маркеров. Часть из них используется для того, чтобы выявить опухолевую популяцию, а часть — для характеристики свойств опухолевых клеток.

Анализ результатов омиксных обследований позволяет на деле осуществить принцип персонализированной медицины
За прошедшие два десятилетия радикальному обновлению подверглись методы количественного и качественного анализа молекулярных основ жизни. От обнаружения отдельных разновидностей молекул и в фундаментальной, и в прикладной биомедицинской науке бесповоротно перешли к детектированию целых классов молекул в их полной или почти полной совокупности.
Такие совокупные методы получили наименование омиксных, от обобщения названий разделов науки, кончающихся на суффикс «-омика». Например, геномика изучает ансамбли генов, то есть геномы. Транскриптомика — ансамбли матричных РНК, то есть транскриптомы. Протеомика — ансамбли белков, то есть протеомы. Метаболомика — ансамбли реакций обмена веществ, то есть метаболомы, и так далее.
Использование множества омиксных технологий сделало возможной давнюю мечту медицины древности, вдохнуло новую жизнь в клиническую парадигму, сформулированную еще Галеном и Авиценной: «Лечи больного, а не болезнь».
Анализ результатов различных омиксных обследований позволяет наконец-то на деле осуществить вышеупомянутый принцип персонализированной медицины и назначать конкретному пациенту именно тот метод лечения, который более всего подойдет ему.
Тем не менее анализировать «сырые» результаты каждого из омиксных исследований для целей персонализированной медицины весьма затруднительно из-за больших объемов плохо структурированной информации, которую представляют собой эти «сырые» данные.
На помощь в обработке «сырых» данных приходят мощные математико-статистические методы, которыми располагает биоинформатика. Одним из магистральных путей глубокого обобщения и анализа омиксных данных является переход от описания в терминах отдельных молекул (белков, РНК, ДНК и так далее) к более общим характеристикам, описывающим сигнальные пути, то есть сложной совокупности взаимодействующих генов и их продуктов (белков), которая определяет метаболическую и митотическую судьбу клетки.
Поскольку такую совокупность сигнальных путей называют сигналомом, то подход, исследующий изменения в этих путях, можно назвать сигналомикой. Благодаря закону больших чисел (так как сигнальные пути содержат сотни генов и генных продуктов) на сигналомном уровне удается преодолеть значительную часть стохастического шума, который сильно затрудняет анализ системных изменений на геномном/транскриптомном/протеомном уровне. Коррелированность результатов различных геномных/транскриптомных/протеомных исследований на сигналомном уровне, как правило, тоже выше, чем на геномном/транскриптомном/протеомном.
Именно на сигналомном уровне удается найти эффективные маркеры-предсказатели индивидуальной эффективности многих лекарственных препаратов, в частности противоопухолевых, а также решить более масштабную, чем персонализированная медицина, задачу — «перепрофилирование препаратов» (drug repurposing), то есть поиск тех болезней, при которых могут быть эффективны различные лекарства, ранее созданные для лечения других заболеваний. Такое перепрофилирование становится возможным благодаря накоплению в открытом доступе результатов миллионов геномных/транскриптомных/протеомных/метаболомных и так далее исследований при различных патологических состояниях.

Провести генетический анализ, просеквенировать геном и понять, какая у вас будет болезнь, — эта наивная мечта, к сожалению, не реализовалась
Очень тяжело сказать в общем для всех заболеваний сразу, какие именно нужны методы диагностики. В первую очередь стоит отделять генетические заболевания от негенетических. Если говорить об аутоиммунных заболеваниях, то в них нужно обращать внимание на антитела. Какие-то болезни требуют методов визуализации, таких как магнитно-резонансная томография или позитронно-эмиссионная томография. Если говорить о нейропсихиатрических заболеваниях, то в них только в редких случаях имеется определенная генетическая основа, которая хорошо изучена и где помогает генетическая диагностика.
Провести генетический анализ, просеквенировать геном и понять, какая у вас будет болезнь, — эта наивная мечта, к сожалению, не реализовалась. Выяснилось, что мы все имеем достаточно большое количество нуклеотидных полиморфизмов, и, когда вы, допустим, получаете анализ всего генома, у вас будет очень много генетических изменений, и будет непонятно, как вы сможете точно связать именно эту мутацию именно в этом гене именно с этим заболеванием и этим симптомом. Так что в большинстве случаев остается традиционная описательная диагностика, когда пациент приходит к врачу и описывает свои проблемы, так как, к сожалению, никаких четких маркеров, например, для шизофрении не существует, и психиатрам приходится исследовать симптомы.
В случае каких-то других заболеваний можно более четко увидеть то, что называется биомаркером, когда вы что-то измеряете и можете точно понять: если у человека, допустим, в крови обнаружено какое-то вещество, значит, у него есть такое-то заболевание. Лучшим примером является фенилкетонурия, которая определяется по концентрации фенилаланина в крови. Врачи мечтают найти подобные биомаркеры для многих других заболеваний, но для широко распространенных заболеваний такие биомаркеры редки. А для большинства заболеваний психиатрического плана, как бы печально это ни звучало, подобных маркеров практически нет, поэтому пациент до сих пор идет к врачу и жалуется на свои симптомы, а врач осматривает его и видит проявление классических симптомов, или, как теперь модно говорить, эндофенотипов, и по ним ставит диагноз.
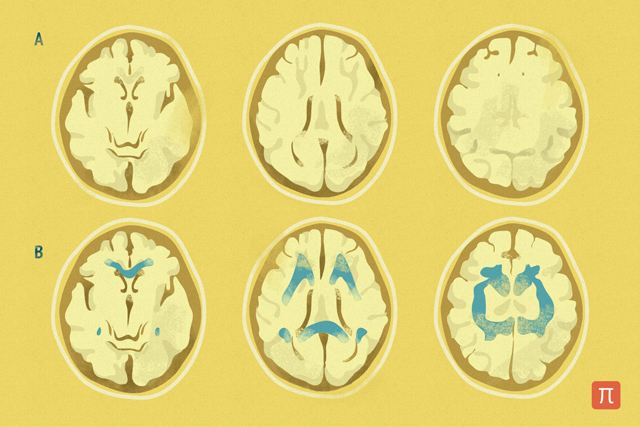
При нейродегенеративных заболеваниях методы нейровизуализации бывают информативны: например, при паркинсонизме на поздних стадиях с помощью позитронно-эмиссионной томографии можно зафиксировать потерю дофаминовых нейронов, но на ранних этапах это невозможно, а ведь самое важное — это диагностировать у человека проблемы до полного развития заболевания! То, о чем я говорю, относится в первую очередь к нейродегенеративным и психиатрическим заболеваниям, которыми я занимаюсь. У кардиологов, онкологов и иммунологов, к примеру, есть очень успешные методы диагностики. К сожалению, с заболеваниями нейропсихиатрического плана ситуация совершенно другая, потому что, когда можно что-то детектировать, часто уже бывает слишком поздно. Это очень большая проблема: как диагностировать заболевание на начальной стадии, когда еще можно остановить нейродегенеративный процесс?

Методы ранней диагностики болезней мозга разработать гораздо сложнее по сравнению с другими заболеваниями, потому что никто толком не знает, как работает мозг
Если говорить, например, о лечении рака, то наиболее эффективным средством борьбы с ним является хирургия. Поэтому чем раньше диагностируется опухоль, тем быстрее рак можно вылечить.
На данный момент эффективным методом нахождения опухолей является компьютерная томография. Если физики смогут разработать более эффективные томографы — с более высоким разрешением и способностью детектирования опухолевых клеток, — то это будет самым перспективным методом обнаружения опухоли на ранней стадии.
Конечно, разработка методов ранней диагностики зачастую приводит к новым методам терапии болезни. Но если ранняя диагностика диабета или сердечно-сосудистых заболеваний действительно позволяет разработать профилактику этих заболеваний, то с мозгом все сложнее. Гораздо сложнее разработать методы лечения для болезней мозга, потому что никто толком не знает, как работает мозг.
Возьмем часто встречающиеся болезни Альцгеймера и Паркинсона. Они считаются болезнями пожилых людей, но на самом деле ими заболевают в возрасте от 20 до 40 лет. Сейчас они диагностируются только тогда, когда разрушения мозга достигли такой степени, что проявляются симптомы.
Допустим, вам 25 лет. Представьте, что существует метод диагностики, который позволяет вам со 100-процентной вероятностью сказать, что если вы доживете, скажем, до 70 лет, то у вас разовьется Альцгеймер. Но в чем смысл таких методов диагностики, если лечения от этой болезни все равно пока нет?
В целом есть два перспективных направления: улучшение приборов, основанных на физических принципах, — те же томографы, а также улучшение методов химической диагностики на основании присутствия в крови биологических молекул — маркеров ранних стадий заболевания.

Ссылка на оригинал: http://postnauka.ru/talks/46485











Комментировать