Вопрос первичной медицинской профилактики и коррекции нозогенных факторов риска основных неинфекционных заболеваний, коррекции факторов риска в сфере эндоэкологии и гомеостаза. Основные патогенетические механизмы и коррекция некоторых факторов риска основных неинфекционных заболеваний с позиции профилактической медицины.
Авторы: Агапитов А.Е., *Костин А.К., **Агапитов Э.А., ***Говорина Е.Н., ГБОУ ДПО ИГМАПО; * ГАУ ДПО ИИПКРО; ** ОГБУЗ ГДКБ № 6; *** ОГБУЗ ГДКБ № 8
Среди широкого перечня задач современной профилактической медицины наиболее важными, но проблемными являются вопросы первичной медицинской профилактики и коррекции нозогенных факторов риска основных неинфекционных заболеваний, в том числе и коррекции факторов риска в сфере эндоэкологии и гомеостаза.
Более того, дальнейшее развитие профилактической медицины существенно зависит от объёма, а главное — результатов внедрения технологий интегративной медицины и внедрённых технологий первичной медицинской профилактики в разрезе задач коррекции факторов риска основных неинфекционных заболеваний (далее – ОНЗ). При этом появляются возможности реальной профилактики заболеваний желудочно-кишечного тракта, сердечно-сосудистой системы, онкологической патологии, иммунопатий, разнообразных атопических состояний, диабета и др.
Патогенетические механизмы и коррекция некоторых факторов риска основных неинфекционных заболеваний с позиции профилактической медицины (сокращённый вариант)
Прежде всего, следует отметить, что такие распространённые нозогенные факторы риска (далее – ФР), как уже указанные иммунопатии (иммунодефициты, слабость иммунного ответа, аутоиммунные конфликты), дефициты нутриентов (первичные ангиопатии, снижение уровня общего обмена, «скрытая цинга», «качественный голод», остеопороз и др.), дисбиозы и энтеропатии (токсическая нагрузка, вторичные иммунопатии, полиорганная недостаточность) — важнейшие патогенетические факторы. Они имеют сложно комбинированную и сочетанную нозогенную направленность прямого и тотального влияния практически на все нозогенные процессы в организме.
Комбинированность и сочетанность факторов риска ОНЗ является их специфической характеристикой и серьёзной проблемой для медицины, когда специалисты дезориентированы в вопросах правильной оценки влияния и значимости ФР в конкретных доклинических или клинических случаях и не редко просто не знают, что делать. В процессе углубления указанных дисфункций данная нозогенность указанных факторов риска выглядит в виде углубления дизадаптации и формирования стойкого нарушения гомеостаза органов и систем организма.
Более того, стандарты медицинской помощи часто только усугубляют положение врача, снижая его возможности по коррекции факторов риска заболеваний. И действительно: коррекция ФР ОНЗ не предусмотрена стандартами и, что самое главное — доминирующими нозологическими принципами современной медицины.
Говоря о комбинированности и сочетанности факторов риска заболеваний, авторы полагают, что неспроста первичные признаки снижения иммунитета и адаптивности схожи между собой и, например, с клиническими признаками дефицитов нутриентов. К основным из них относятся: иммунопатии; быстрая утомляемость, трудность концентрации внимания и снижение воли; частые смены настроения (от тоски до злобы); не обусловленная известными причинами головная боль; судороги и боли в мышцах и суставах; загрудинные и абдоминальные боли без возможности постановки диагноза; расстройство стула; периодическая или хроническая бессонница; увеличение скорости старения организма; полиорганная недостаточность, высокая заболеваемость, болезненность, инвалидизация и смертность.
Но при кажущейся безысходности и глобальности нозогенного влияния ФР на состояние здоровья и заболеваемость населения данная проблема далека от фатальности.
Риски многих заболеваний клиницистам и специалистам в сфере профилактической медицины следует считать модифицируемыми.
Более того, коррекция ФР ОНЗ — является обязательным практическим разделом программ индивидуального и группового медико-профилактического консультирования населения в центрах здоровья, при диспансеризации и в повседневной работе узких специалистов, участковых врачей и врачей семейной и общей практики.
Модифицируемость факторов риска заболеваний – их такая же специфическая характеристика, как и нозогенность.
Но модифицируемыми факторы риска делает первичная медицинская профилактика, а нозогенными — её отсутствие.
Следует подчеркнуть, что в основе механизмов дисфункций и патогенеза большинства ОНЗ лежит комбинированное сочетание дисбиозов, болезни накопленных дефицитов нутриентов, высокий уровень токсической нагрузки организма. Они в числе первых отвечают за формирование ангиопатий (фиброзно-дистрофические процессы эндотелия сосудов), развитие метаболического синдрома и липидного дистресс — синдрома, нарушение гомеостаза, катализа и анаболизма.
Поэтому в перечень вызванных ими заболеваний входят: сосудистая патология и сосудистые летальные катастрофы, функциональная недостаточность поджелудочной железы, дислипидемии и вторичные ангиодистрофии, ишемизация органов (в том числе ишемизация как онкофактор), язвенная болезнь желудка, гепатопатии, церебральная и кардиальная недостаточность.
Рассмотрим некоторые патогенетические механизмы развития заболеваний с точки зрения профилактической медицины.
Различные мнения авторов в настоящее время не позволяют однозначно и без оговорок отнести те или иные дислипопротеинэмии к атерогенным рискам. Одни считают фактором атерогенеза повышенное содержание липопротеидов низкой плотности (ЛПНП), другие — высокий уровень триглицеридов. Третьи полагают, что причина кроется в снижении уровня липопротеидов высокой плотности (ЛПВП).
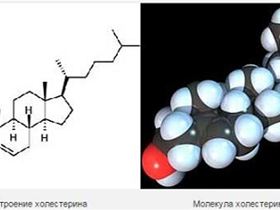
Но в настоящее время повышению уровня общего холестерина уже не отводят безоговорочно решающую роль в атерогенезе, как это было 20 лет назад. Гораздо большее значение имеют величины фракции ЛПВП.
Но и это в настоящее время не рассматривается как ключевой фактор. Их антиатерогенная роль в настоящее время объясняется уже не ортодоксально и механистически, а несколько иначе и с позиции интегративной медицины.
Полагают, что ЛПВП — наиболее важный эндотоксинсвязывающий элемент крови, который, согласно теории хронической эндотоксиновой агрессии (Яковлев М.Ю., 2003) является ведущим фактором защиты эндотелиального монослоя артерий от эндотоксиновой агрессии, от предстоящих первичных воспалительных и дистрофических процессов и последующего фиброза. Необходимо отметить, что именно зона дистрофии и хронического воспаления эндотелия является очагом высокой активности репаративных процессов, в отличие от соседних зон эндотелия.
Следовательно, клетки эндотелия, находящиеся в зоне хронического воспаления имеют повышенную потребность в липопротеидах в связи с ускоренным синтезом клеточных мембран вновь образующихся клеток.
Этим в настоящее время объясняется первичное повышение количества холестерина в зоне очаговых хронических воспалительно-дистрофических процессов эндотелия сосудов, а повышение холестерина рассматривается на первых этапах развития ангиопатий как индикатор хронического воспаления. Понятно, что указанные нами по сути – базовые нозогенные механизмы формирования будущих энтеропатий (и эндотелиальной дистрофии) современной клинической медициной попросту игнорируются.
Следует отметить, также что основой холестеринового гомеостаза является энтерогепатическая циркуляция холестерина (Петухов В.А., 2010).
Холестерин синтезируется гепатоцитами.
В составе желчных кислот (ЖК) он поступает в кишечник, где вместе с холестерином пищи подвергается обработке ферментами поджелудочной железы. ЛПНП осуществляют транспорт холестерина и триглицеридов в периферическую клетку, а ЛПВП переносят холестерин из клетки в печень для последующего катаболизма.
Но на фоне хронического или рецидивирующего дисбиоза (повышенное количество анаэробов, гемолитических палочек, стафилококков, грибов при снижении числа лактобацилл и бифидобактерий) липидный состав крови существенно меняется (Суворов А.Н., с соавтор., 2013). Патогенез ангиопатий, связанных с гиперхолестеринемией, далее выглядит так.
Изменение микроэкологии кишки приводит к нарушению циркуляции желчных кислот, повышается нагрузка экзогенным холестерином, что вызывает срыв компенсаторных возможностей регуляции метаболизма холестерина, увеличивается синтез эндогенного холестерина. Как следствие — далее нарушается трансформация холестерина в желчные кислоты и стероидные гормоны (тестостерон), замедляется трансформация холестерина и его производных в неабсорбируемые формы нейтральных стеринов и деструкции стеринов до конечных продуктов. Нарушается включение холестерина в мембраны клеток органов хозяина, усугубляются их дистрофии.
Кстати, стабильное снижение уровня тестостерона – один из первичных патогенетических факторов развития метаболического синдрома.
Микроорганизмы желудочно-кишечного тракта вмешиваются в холестериновый метаболизм, воздействуя на ферментные системы клеток хозяина, синтезирующие эндогенный холестерин. Дисбиоз (с повышенной способностью анаэробов формировать токсичные соли ЖК, нарушая гепатическую циркуляцию ЖК) способствует развитию патологических изменений в печени; повышаются концентрации холестерина, триглицеридов и других жиров, развивается стеатоз печени (Савельев В.С. с соавт.,2007).
Таким образом, микрофлора хозяина, синтезируя, трансформируя или разрушая экзогенные и эндогенные стерины, активно участвует в холестериновом метаболизме, и при нарушении этих процессов микробиота способствует развитию гиперхолестеринемии.
Вследствие дисбиоза в кишечном тракте на фоне стресса (психоэмоционального, воспалительного, лекарственного, химического и т.д.) увеличиваются всасывание и возврат в печень практически до 100 % выделенных в просвет тонкой кишки желчных кислот.
При этом в печени по принципу «обратной связи» уменьшается синтез желчных кислот, вследствие чего повышается содержание холестерина в плазме крови в связи с отсутствием необходимости восполнять ежедневные физиологические потери желчных кислот в нарушенном цикле энтерогепатической циркуляции.
Нарушение механизмов холестеринового гомеостаза и энтерогепатической циркуляции ЖК (вследствие хронического дисбиоза) является в дальнейшем патофизиологической основой формирования хронической дислипопротеидемии, липидного дистресс-синдрома и последующих разнообразных в морфологическом плане — ангиопатий.
В настоящее время вполне очевидно, что кишечная недостаточность и транслокации кишечных бактерий или эндотоксинов в портальную, воротную или системную циркуляцию кровеносного русла являются важным патогенетическим звеном развития полиорганной недостаточности.
Одним из наиболее «страдающих» органов – мишеней дисбиоза и эндотоксиновой агрессии — является печень, орган с целевой функцией детоксикации.
Рассмотрим в порядке построения логической цепи обменных процессов влияния нозогенных «событий» в печени на глубокие дисфункции в поджелудочной железе и кишечнике, связанные с дисбиозом.
Вследствие дисбиоза снижается защитно-барьерная функция эпителия кишечника и повышается токсическая нагрузка на многие органы и, в первую очередь, на печень, выполняющую дезинтоксикационные функции. Кроме снижения доли ЛПНП и формирования дислипидемии повышается (периодически – значительно) паренхиматозное давление в печени, что обуславливает дисфункцию поджелудочной железы. Это приводит к снижению продуцирования ею пищеварительных ферментов и снижает качество пищеварительного процесса и способствует усилению размножения анаэробов, грибковых культур, гемолитических палочек и стафилококков в кишечнике.
Таким образом, круг «от дисбиоза к дисбиозу» замкнулся.
Хорошо известно, что повышенная токсическая нагрузка на печень и ослабление её дезинтоксикационной функции обуславливает в частности — появление гепатогенной энцефалопатии, что проявляется в разных возрастных группах населения совершенно разными поведенческими признаками и эволюционирующими расстройствами функций ЦНС.
Наиболее характерными можно считать синдром снижения порога возбудимости ЦНС, появление синдрома гиперактивности у детей, снижение качества и «продуктивности» сна, ухудшение показателей когнитивности и обучаемости у детей и подростков (хотя с известной долей поведенческой трансформации данные признаки проявляются и у взрослых).
Следует отметить, что синдром снижения порога возбудимости ЦНС обуславливает склонность подростков и взрослых к хроническим интоксикациям, девиантному и асоциальному поведению. Но происходит это в комплексе с ещё одним аффективным проявлением дисбиоза – вторичным дефицитом нутриентов.
Дело в том, что дисбиотическая энтеропатия (в том числе — энтерит) резко снижает качество абсорбции жизненно важных нутриентов (синдром мальабсорбции нутриентов). Полагают, что от 30 % до 70 % дефицитов нутриентов в макроогранизме обусловлены снижением абсорбции.
Например, всасывание кальциферола (вит. Д) в тонком кишечнике резко нарушается при дефиците желчи и холестазе. Следовательно, остеопатические дисфункции становятся чаще клинической патологией при дисбиотической гепатопатии (Ребров В.Г., Громова О.А., 2008). Кроме того, восполнение дефицита Д3 восстанавливает функцию макрофагов и лимфоцитов.
Энтеропатии существенно ограничивают поступление железа и витамина С (тогда как эндогенная интоксикация требует их обязательного наличия в повышенном количестве). В условиях дефицита витамина С существенно ограничивается синтез коллагена и эластина, что прежде всего негативно влияет на состояние стенок сосудов (особенно капилляров), истончая их и создавая условия для очаговой дистрофии эндотелия. И если нарушении циркуляции желчных кислот, это так сказать «внутренний сосудистый фактор» эндотелиальной дистрофии, то дефицит витамина С – её «внешний фактор».
Такая особенность гемостаза витамина С указывает на отрицательную роль его дефицита в развитии ангиопатий, фиброзно-дистрофических изменений эндотелия, распространённого атеросклеротического процесса (лучше сказать всевозможных вариантов ангиопатий), повышении фиброзной ригидности стенок сосудов, формирование патогенеза гипертонической болезни. Безусловно, это ведёт к повышению риска сосудистых катастроф или ишемическим (явным и скрытым) болезненным состояниям.
Авторами данной статьи были указаны лишь некоторые обстоятельства реализации патогенетических механизмов рисков основных неинфекционных заболеваний в части формирования, например, сосудистой патологии и требующие серьёзных профилактических мероприятий и проведения детоксикации. Поэтому, определив на конкретных примерах содержание, сложную комбинированность и сочетанность факторов риска ОНЗ, можно определить и основные направления деятельности по коррекции ФР дисфункций и заболеваний как на доклинической стадии, так и при появлении нозологических признаков патологии.
Принципиально следует применять нижеследующие коррекционные и лечебные технологии.
Рацион питания должен быть достоверно обеспечен биотически необходимым количеством пребиотиков (пектины, инулины, крахмалы). Следует выделить в самостоятельный — вопрос обеспечения рациона питания необходимым количеством клетчатки. Для взрослого человека в зависимости от массы тела количество клетчатки в виде суточной нормы потребления (столько необходимо каждый день) должно составлять 60–80 г. После достаточного обеспечения рациона питания пребиотиками на постоянной основе, следует решать вопрос (по показаниям) о применении пробиотиков (живых бактериальных культур) в виде кисломолочных продуктов или лекарственных средств.
Одним из ключевых факторов коррекции ФР ОНЗ является обязательное биотическое восполнение рациона питания необходимым перечнем нутриентов, особенно тех, дефициты которых верифицированы у конкретного человека или в конкретной регионе (эндемические дефициты нутриентов). Доказано, что любая оптимизация пищевого рациона не может обеспечить полноценное поступление в организм большинства нутриентов. Поэтому требуется их употребление как дополнение к рациону питания. Перспективной технологией профилактики и лечения факторов риска ОНЗ и ангиопатий является энтеросорбционная терапия. Энтеросорбция, обеспечивая восстановление микроциркуляции и гомеостаза кишечного эпителия, способствует вторичному снижению токсической нагрузки и профилактики иммунопатий.







Комментировать