Обзор посвящен проблемам диагностики и лечения отечной формы рака молочной железы, которая отличается высокой злокачественностью, ранним и быстрым лимфогенным и гематогенным метастазированием, неудовлетворительными отдаленными результатами. Современные данные результатов исследований по выяснению биологических особенностей этой формы опухоли, клинического проявления и эффективности различных методов лечения.
Чхиквадзе Т.В., ФГУ «РНЦРР Росмедтехнологий», Онкологический клинический диспансер №1 Департамента здравоохранения г. Москвы.
Резюме
Обзор посвящен проблемам диагностики и лечения отечной формы рака молочной железы, которая отличается высокой злокачественностью, ранним и быстрым лимфогенным и гематогенным метастазированием, неудовлетворительными отдаленными результатами. Приведены современные данные результатов исследований по выяснению биологических особенностей этой формы опухоли, клинического проявления и эффективности различных методов лечения.
Классификация и история вопроса.
Отёчный рак молочной железы (ОРМЖ), относится к диффузным формам опухоли и встречается у 1- 5% больных раком молочной железы (РМЖ) (221, 110, 79, 112, 225, 255, 153). По данным различных авторов ОРМЖ является одной из наиболее злокачественных форм опухоли, имеет неблагоприятный прогноз — общая 5-летняя выживаемость в среднем не превышает 12-50% (254, 155, 172, 130, 110, 127, 220).
Различают первичную отёчную форму (синонимы — истинно отёчный, маститоподобный, инфламаторный или воспалительный рак, раковый мастит, панцирный рожистоподобный рак, кожный лимфатический канцероматоз, инфильтра- тивно-отёчный рак и т.д.) и вторичную отечную форму рака молочной железы. По международной классификации злокачественных опухолей TNM (6е издание, 2002г) первичный ОРМЖ обозначается как T4d, и вторичный — как T4b. Термин «воспалительная форма РМЖ — inflammatory breast cancer (IBC)» чаще применяется в англоязычной литературе и относится к первичному отечному РМЖ. Вторичная форма ОРМЖ встречается чаще — у 25% пациенток, и в отличие от первичной формы, представляет собой местно распространенный узловой рак молочной железы, осложненный лимфогенным метастазированием, блоком оттока лимфы и присоединившимся отеком молочной железы (21, 117).
Первое описание ОРМЖ было сделано Charles Bell в Англии в 1807 году. Он указал на крайне неблагоприятный прогноз при появлении диффузных изменений молочной железы, багровой окраски кожи над опухолью и болезненности молочной железы, рекомендовал не откладывать надолго выполнение операции (91). Однако на протяжении многих последующих лет эта форма рака молочной железы не рассматривалась как отдельная форма опухоли и рассматривалась в группе больных с местно распространенным раком молочной железы. Тактика лечения по отношения ОРМЖ в различные периоды менялась в зависимости от развития и совершенствования тех или иных методов лечения — хирургического, лучевого или лекарственного.
В начале 20 века, в 1909 году, A. Leitch указал на необходимость наличия 2 главных диагностических признаков ОРМЖ: диффузной отёчности молочной железы в виде гипертрофии и «лимонной корки», сочетание которых он считал патогномоничным симптомом «острого рака» (167). Термин «острый рак» он ввел для обозначения быстро растущих и диссеминирующих опухолей молочной железы, которые имеют фульминантное течение, и могут приводить к быстрому фатальному исходу, особенно у молодых пациенток. Он указывал на необходимость вовремя распознавать и максимально быстро и широко оперировать, описал макро- и микроскопическую картину данной формы рака молочной железы, изучил причину появления «лимонной корки» — наличие изменений в дерме, связанных с блоком лимфатических сосудов и возникновением лимфостаза.
В настоящее время связи с ростом заболеваемости раком молочной железы в целом и с ростом заболеваемости ОРМЖ в частности изучение особенностей клинического течения и разработка оптимальных методов лечения ОРМЖ является одной из актуальных проблем клинической онкологии. Национальный института рака США в 1998г представил, а в 2005г дополнил анализ данных 3636 пациентов ОРМЖ с 1988г по 2000г. Было отмечено удвоение частоты заболеваемости ОРМЖ к 1992 году по сравнению с 1975г с 0,3 до 0,7, а к 1997-99гг — до 2,5 на 100 тыс. женского населения. Общая заболеваемость ОРМЖ среди белого населения по данным анализа составила 2,2, а среди пациенток негроидной расы — 3,1 на 100 тыс. женского населения (153, 110, 170). Большинство (58%) больных были моложе 50 лет и среди них преобладали пациентки негроидной расы (225, 255). В нашей стране в статистических отчетах ОРМЖ не выделяется как отдельная форма РМЖ.
Клинические проявления и течение заболевания.
ОРМЖ характеризуется быстрым клиническим течением, уже в начале заболевания проявляется увеличением объема и отечностью молочной железы, гиперемией кожи и наличием «лимонной корки», местным повышением температуры, диффузным уплотнением ткани железы. При первичном ОРМЖ нет четко отграниченного, определяемого пальпаторно и на маммограмме опухолевого узла. При вторичной форме, наряду с вышеуказанными симптомами, в железе определяется опухолевый узел. После появления отека молочной железы течение болезни, в том числе и характер метастазирования, становится таким же агрессивным, как и при первичном ОРМЖ.
В клинике Gustave-Roussy была разработана и в дальнейшем имела клиническое применение система стадирования отёка под названием «Poussee Evolutive» (PEV), основанная на симптомах воспаления и опухолевой инвазии молочной железы (213):
PEV 0 — опухоль без увеличения в объеме молочной железы или признаков воспаления;
PEV 1 — с заметным увеличением объема за последние 2 месяца, но без признаков отёка;
PEV 2 — с воспалением и отеком меньшим, чем 50% поверхности молочной железы;
PEV 3 — с воспалением и отеком большим, чем 50% поверхности молочной железы.
Следует отметить, что на момент установления диагноза около 1/3 пациентов ОРМЖ имеют опухоль с отечно-воспалительными симптомами вовлечения всей молочной железы — PEV3, тогда как 2/3 — локализованное (менее 50%) поражение молочной железы — PEV2. Вовлечение всей молочной железы (PEV3) является плохим прогностическим фактором (169).
Для ОРМЖ характерно и раннее метаста- зирование в регионарные лимфатические узлы, которое может отмечаться у 95%, при этом поражение надключичных лимфатических узлов (N3) в среднем отмечается у 30-40% больных (75, 86, 121, 138, 255, 251).
Морфологическая характеристика.
Для больных ОРМЖ не характерно наличие какой-либо определенной гистологической формы опухоли. Опухоль молочной железы может быть представлена инфильтрирующим протоковым, дольковым, медуллярным, слизистым или другой гистологической формой рака. Однако большая часть больных ОРМЖ имеют высокую степень злокачественности опухоли (по Nottingham классификации (137,144)) в отличие от других форм РМЖ (159, 132, 255).
Многие исследователи при ОРМЖ в опухоли отмечают преобладание пролиферирующих лимфатических эндотелиальных клеток, в отличие от узловых форм РМЖ, особенно на периферии опухоли. При ОРМЖ средняя площадь, занимаемая лимфатическими сосудами опухоли, также больше, что указывает на склонность к более высокому гематогенному и лимфогенному метаста- зированию (244, 245).
Особое значение при изучении отёчного рака молочной железы придается поражению лимфатических сосудов кожи. В 1938 году W.Taylor и А.МеКгег описали опухолевую инвазию лимфатических сосудов кожи, как гистологическое доказательство «воспалительной карциномы» (229). Опухолевая инфильтрация лимфатических сосудов кожи при гистологическом исследовании выявляется примерно у 60-70% больных ОРМЖ (135, 106, 97, 92). Инвазия кровеносных сосудов также характерна для первичной формы ОРМЖ, отмечается у 74% больных, чаще чем при узловой форме — у 36% (р<0,01) (92). Следует отметить, что инвазия дермы вне лимфатических сосудов не так часто встречается при первичной форме ОРМЖ. Это отличает истинную форму от местно распространенной, вторичной отёчной формы рака молочной железы (161).
В литературе описаны различные механизмы, которые могут оказывать влияние на возникновение воспалительных признаков при раке молочной железы. Ряд авторов считает причиной развития отёка — высокий темп роста опухоли (время удвоения опухоли), ведущий к нарушению транскапиллярного обмена продуктами метаболизма опухолевых клеток и биологически активными веществами (33, 34, 227).
Однако большинство авторов в настоящее время связывают появление отёка кожи и молочной железы с бурной инвазией и эмболией раковыми клетками лимфатических сосудов, блоком оттока лимфы из ткани молочной железы (106, 102, 189, 204, 207, 217, 222, 168, 253).
Молекулярно-биологические особенности ОРМЖ.
В последнее время в литературе возрастающее внимание уделяется биологическим и молекулярным характеристикам опухоли, в том числе рака молочной железы. Изучение молекулярных особенностей ОРМЖ могут оказать помощь как в диагностике этой формы РМЖ, так и в разработке новых противоопухолевых препаратов и схем лечения.
При ОРМЖ чаще выявляется высокая фракция клеток S-фазы (SPF), высокий уровень PCNA (ядерный антиген пролиферирующей клетки), анеуплоидность, отсутствие экспрессии рецепторов эстрогена и/или прогестерона (РЭ/РП отрицательный статус), высокая степень злокачественности опухоли и гиперэкспрессия и мутация р53 белка (159, 199, 182, 85).
В других исследованиях было показано, что ОРМЖ является высоко лимфогенной и ангио- генной опухолью. McCarthy и коллеги (2002г) выявили значительное увеличение внутриопухоле- вой микрососудистой плотности при ОРМЖ (182). Colpaert с соавторами (2004г) в исследованиях ангиогенеза выявил корреляцию между маркером гипоксии карбоновой ангидразой IX и пролиферацией эндотелиальных клеток при ОРМЖ (124). В многочисленных работах при ОРМЖ выявлены гиперэкспрессии различных факторов роста:
УЕСБ-А (сосудистый эндотелиальный фактор роста, участвующий в ангиогенезе), УЕСБ-О и УЕСБ- й (сосудистый эндотелиальный фактор роста, участвующий в лимфангиогенезе), ЬБСБ (фактор роста фибробластов), Р1И, Кй^ Т1Е-1, Т1Е-2, И-6 и И-8 в сравнении с другими, узловыми формами РМЖ (124, 218, 243, 248, 161).
В современной литературе встречаются также сведения об экспрессии и других генов при ОРМЖ: М1В1 (К1 67) (199, 99, 96, 112, 85), о-Ме1, Р13К (146), Л111, ЕСР1, йи8Р1 ОХО1.2, ОО12/М1Р1А, ОО15/РАЫТЕ8 (92, 95), ОХОР4 (104), РИоО-гуанозинтрифосфотазы (АРНО/РИоО СТРаэе) и потеря экспрессии WNT-1 индуцированного секретирующего протеина 3 (LIBО/WI8P3) (162, 246, 247).
Несмотря на небольшие различия (205, 182), у больных ОРМЖ при исследованиях ИГХ- методом отмечается гиперэкспрессия белков НЕР2-пеи, ЕСБР и р53 (161, 85, 237, 113, 104, 214). Амплификация НЕР2-пеи и р53 генов впоследствии была подтверждена двумя группами авторов с помощью тюгоагтауэ-технологии анализа ДНК этих генов (112, 242).
Таким образом, проведенные исследования показали, что ОРМЖ чаще является высоко злокачественной опухолью, отрицательной по рецепторному статусу, быстро пролиферирующей и гиперэкспрессирующей НЕР2-пеи, ЕСБР и р53.
В настоящее время главная цель ученых идентифицировать специфические генные изменения, связанные с фенотипом и агрессивностью ОРМЖ, для развития в будущем более эффективного генетически обоснованного и направленного лечения.
Диагностика.
Диагностика ОРМЖ основывается как на характерной клинической картине, так и на данных лучевых и специальных методов исследования.
Лучевые методы диагностики.
При маммографии у больных первичной формой ОРМЖ отмечается увеличение объема молочной железы, диффузным утолщением кожи, повышением общей плотности ткани молочной железы, перестройка структурного рисунка железы с образованием расплывчатых неопределенной формы теней, гиперваскуляризации, а при вторичной форма на фоне вышеперечисленных изменений определяется затемнение неопределенной, реже округлой формы, без четких границ (98, 64, 51). Собственно опухоль, в отличие от других форм рака молочной железы, определяется менее чем в половине наблюдений. При ОРМЖ, по данным различных авторов, утолщение кожи до 30мм (в норме 0,5-2,5мм) на маммограммах в среднем встречается в 92-93,5% наблюдений, диффузное увеличение плотности молочной железы — 8193,5%, стромальная перестройка и утолщение трабекул — 62-85%, втяжение соска — 38-56,5%, гиперваскуляризация — 32,5%. Микрокальцинаты, характерные для рака молочной железы, найдены у 23-47%. У 58-83% больных отмечено увеличение лимфатических узлов подмышечной области. Опухолевая масса определялась на маммограммах в среднем в 15% наблюдений, пальпаторно — в 97% (165, 228).
При ультразвуковом исследовании (УЗИ) инфильтрация кожи у больных ОРМЖ распознается прерыванием связи между гиперэхоген- ной кожей и гипоэхогенным подкожным слоем, по утолщению кожи и куперовских связок. Опухолевый узел визуализируется как гипоэхогенное образование с гиперэхогенным ободком с неровными краями, превалированием ширины над длиной образования.
При доплеровском сканировании спектральные характеристики сосудов у больных с отечно-инфильтративной формой рака молочных желез отличались большим разнообразием — от практически нормальных характеристик сосудистой кривой до наличия картины шунтов и спектра патологических сосудов с признаками низкого сопротивления сосудистой стенки. Пространственная реконструкция патологического кровотока при данной форме рака молочной железы позволяет наглядно увидеть лакунообразные расширения, хаотичное расположение сосудистой сети, разный калибр выявленных сосудов (23). В паренхиме молочных желез выявляются гипоэхогенные линейные трубчатые структуры. Большинство из этих трубчатых структур представляют собой разнокалиберные сосудистые стволы с различными спектральными характеристиками. Только небольшая часть из видимых в В-режиме гипоэхогенных трубчатых включений, в основном горизонтально направленных и малого калибра, локализующихся в подкожной области, не показывала наличия скоростных потоков, вероятно, являясь лимфатическими сосудами. Отмечалось также увеличение количества кровеносных сосудов в метастатических лимфатических узлах (184, 116, 83).
Однако маммография и УЗИ имеют ограниченную ценность в диагностике ОРМЖ в связи с трудностью определения специфических изменений на фоне отечной и плотной опухоли.
Использование компьютерной томографии (КТ) в диагностике ОРМЖ позволяет выявить утолщение кожи пораженной молочной железы от 0,7 до 3,0см, диффузную инфильтрацию или опухолевые массы, микрокальцинаты и аденопатию в молочной железе, а также наличие регионарных и отдаленных метастазов (188).
При магнитно-резонансной томографии (МРТ) с внутривенным контрастным усилением и использованием стандартных катушек для молочных желез у больных первичной ОРМЖ выявляются изменения сосудистой сети пораженной молочной железы, более раннее и выраженное усиление по периферии очага или диффузное усиление без четких границ, утолщение кожи (134). F. Nakhlis с соавт. (2005г) указывают, что диффузное утолщение кожи и аномальные изменения сосудов выявляются до подтверждения клинического диагноза ОРМЖ (192).
Позитронно-эмиссионная томография
(ПЭТ) с фтордезоксиглюкозой (ФДГ) является чувствительным методом визуализации метастазов в лимфатических узлах, что в частности может помочь в оценке состояния парастернальных и средостенных лимфатических узлов, что особенно важно, когда опухоль располагается во внутренних и центральных квадрантах железы (40,151). Возможно применение ПЭТ уже после 2 курсов химиотерапии для ранней оценки эффективности лечения больных ОРМЖ и теоретической выживаемости, коррекции тактики лечения, особенно у пациентов с быстрым ростом опухоли (211).
Наиболее показательны данные, полученные Yang W.T. и соавт. в 2007 по оценке визуализации патологических изменений различными техническими средствами у 80 больных ОРМЖ. Средний возраст пациенток составил 51 год (от 2578 лет), у 75 (94%) выполнена маммография, у 76 больных (95%) — сонография, у 33 (41%) — МРТ, и у 24 (30%) — ПЭТ-КТ. Изменения в паренхиме молочных желез были выявлены: у 60 пациентов (80%) на маммограммах (узел и микрокальцина- ты), у 72 (95%) при сонографии (узел и нарушение архитектоники), у 23 (96%) при ПЭТ-КТ (гиперме- таболический участок) и у 33 (100%) при МРТ (усиление сигнала). Поражение регионарных подмышечных узлов выявлено у 71 больного (93%) при гистологическом или цитологическом исследовании, у 71 (93%) при сонографии, у 21 (88%) при ПЭТ-КТ, у 29 (88%) при МРТ, и у 34 (45%) на маммограммах. Отдаленные метастазы в кости, печень, и контралатеральные лимфатические узлы были выявлены у 9 пациентов (38%) при выполнении ПЭТ-КТ. Таким образом, наиболее точным в визуализации изменений в молочной железе при ОРМЖ является МРТ- исследование. Сонография может быть использована в диагностике изменений в регионарных лимфатических узлах. ПЭТ-КТ позволяет получить дополнительную информацию по наличию отдаленных метастазов и должно вы — полняться при уточнении стадии заболевания при ОРМЖ (256).
При трудностях в цитологическом подтверждении диагноза у больных ОРМЖ (например, при наличии микрокальцинатов) следует произвести биопсию с последующим гистологическим исследованием.
Биопсия молочной железы может проводиться под рентгенологическим или ультразвуковым контролем, а также возможно проведение биопсии кожи с целью выявления часто встречающейся при ОРМЖ опухолевой инвазии сосудов дермы. Некоторые авторы считают, что клиническая картина ОРМЖ бывает очень яркой и узнаваемой, и выполнение биопсии кожи является не обязательным для постановки диагноза (139.
При ОРМЖ применение тонкоигольной аспирации не считается целесообразным как при других опухолях молочной железы в связи с отсутствием наличия четко отграниченного опухолевого узла. В литературе описаны наблюдения выполнения пациентам множественных попыток тонкоигольной аспирации для получения диагностического материала и подтверждения клинически предполагающегося диагноза ОРМЖ. Аспираты содержали клетки, фрагменты фибрина и жировую ткань. Злокачественные клетки были представлены в плотно организованных кластерах и идентифицировались по огромному размеру, ядерной неоднородности и возросшему ядерноцитоплазматическому индексу. В отличие от аспирата, полученного при других формах рака молочной железы, одиночные клетки и клеточная разнородность не были характерны. Последующее гистологическое исследование у данных пациентов выявило наличие опухолевой эмболии лимфатических сосудов дермы. Авторы делают вывод, что в определенных условиях, диагноз ОРМЖ может быть поставлен и по тонкоигольной аспирации (133).
Таким образом, наиболее точным в визуализации изменений в молочной железе при ОРМЖ является МРТ. УЗИ может быть использовано в диагностике изменений в регионарных лимфатических узлах. ПЭТ-КТ позволяет получить дополнительную информацию о наличии отдаленных метастазов и может выполняться для уточнения стадии заболевания (256).
Лечение.
Лечение больных ОРМЖ является трудной задачей в связи с высокой злокачественностью опухоли, следствием которой являются как бурное местное развитие процесса, так и быстрая диссе- минация. Лечение больных отечной формой рака молочной железы на ранних этапах развития онкологии, когда применялось только хирургический и лучевой метод, считалось мало перспективным. 5-летняя выживаемость редко достигала 5%. В последствии с улучшением методов диагностики, лучевой терапии и, особенно, после совершенствования противоопухолевой лекарственной терапии удалось улучшить отдаленные результаты лечения больных ОРМЖ. Однако у некоторых врачей сохраняется пессимистический взгляд на перспективы лечения и прогноз у больных этой особой формой рака молочной железы. Иногда больным при наличии ОРМЖ отказывают в лечении (170). Разноречивы взгляды на необходимость проведения хирургического этапа в радикальном лечении местно распространенного ОРМЖ. Ряд авторов считает для этой категории больных необходимым проведение только консервативного лечения.
Многие авторы подчеркивают необходимость срочного начала лечения при наличии клинических и гистологических данных ОРМЖ (14, 45, 60, 121, 203, 236).
При лечении больных ОРМЖ применяются все те же методы, как и при узловых формах рака молочной железы: хирургический, лучевой и противоопухолевый лекарственный. Ценность каждого из этих методов неоднозначно определялась в различные периоды развития онкологии. Каждый из этих методов применялся как в монорежиме, так и в плане комбинированного и комплексного лечения.
Хирургическое, лучевое и комбинированное лечение.
Хирургический метод применялся одним из первых в лечении больных ОРМЖ. Как было ранее отмечено, первые попытки хирургического лечения были предприняты еще в XIX веке. С. Ве11 впервые указал на крайне неблагоприятный прогноз при появлении диффузных изменений молочной железы, багровой окраски кожи над опухолью, болезненности молочной железы и рекомендовал не откладывать надолго выполнение операции (91).
Ряд отечественных авторов указывает на положительные моменты операции: возможность удаления источника метастазирования, кровотечения и интоксикации (3, 29, 30, 18, 54, 66, 67).
Однако при ОРМЖ хирургическое лечение оказалось недостаточно эффективным. В начале 70-х годов С.й. Иаадепэеп указал на низкую эффективность только хирургического лечения (радикальной мастэктомии по Халстеду-Майер) — средняя продолжительность жизни составила 19 месяцев, а 5-летняя общая выживаемость 3% (152). У большинства больных (до 70%) возникал ранний рецидив болезни (87, 187, 217). В литературе описаны единичные сообщения о больных ОРМЖ, проживших после операции 5 лет без прогрессирования (186, 208, 143, 88). Поэтому большинство хирургов считали диагноз отёчного рака молочной железы противопоказанием к хирургическому лечению. В последующие годы радикальная лучевая терапия стала методом выбора у больных ОРМЖ, учитывая агрессивное течение болезни, обширное вовлечение лимфатических сосудов дермы и неудовлетворительные результаты хирургических операций.
Лучевая терапия позволяет избежать хирургической травмы, однако, как и операция остается фактором локального лечения и не влияет на отдаленное метастазирование. Для достижения определенного эффекта лучевого воздействия по данным многих авторов необходимо подведение к опухоли и регионарным зонам дозы не менее 60 — 70Гр (28, 88, 121, 253). Однако это не исключает развитие местных и регионарных рецидивов, которые достигают 46-88% (196, 213, 223, 234), а 5- летняя выживаемость оказалась такой же низкой, как и при хирургическом лечении (88).
L.Z. Nisce в 1979 году опубликовал результаты применения электронного пучка для субто- тального воздействия на кожу один раз в неделю в лечении 22 больных с рецидивом ОРМЖ. Облучение проводили верхней половины туловища по 4 Гр один раз в неделю в течение 6 последовательных недель с использованием электронов с энергией 3,5 МэВ на линейном ускорителе 6 МэВ . Полный клинический ответ отмечен у 17 (77%) пациентов и у 3 (14%) — частичный, общее число пациентов, ответивших на лечение — 81%. Ремиссия 6 и более месяцев отмечалась у 35% больных с полным ответом. Авторы считают данный метод необходимым в паллиативном лечении больных с быстро прогрессирующей болезнью (193).
A.M. Chu с соавторами (1980 год) применили лучевую терапию у 62 больных ОРМЖ , медиана выживаемости составили 18 месяцев. 5летняя актуариальная общая и безрецидивная выживаемость составили 14% и 6%, соответственно. Местный и регионарный рецидив отмечен у 43 больных (69%). У 12 пациентов (19%) отмечен только локальный рецидив в зоне облучения, у 31 (50%) местный рецидив + отдаленные метастазы, и у 14 (23%)- только отдаленные метастазы. Однако при подсчете суммарной очаговой дозы оказалось, что часто при облучении доза оказывалась на 20-35% ниже, чем необходимые 60 Гр. При наличии опухоли более 10 см и увеличении дозы в клинических пределах все же отмечались местные рецидивы, но безрецидивный интервал был дольше. Применение методики мультифракционирования с 1976 года при больших опухолях позволило уменьшить число местных рецидивов до 33% (у 2 пациентов из 6) (121).
J.L. Barker с соавторами также применил методику мульти- фракционирования в день у 11 больных ОРМЖ, что позволило уменьшить число местно-региональных рецидивов до 27% (89).
5-летняя выживаемость при использовании только лучевой терапии по данным разных авторов была такой же, как и при только хирургическом лечении, и не превышала 10%. (88, 135, 252, 253), а продолжительность жизни составила 11-33 месяца, (121, 209, 159).
Таким образом, применение лучевой терапии в монорежиме позволило несколько снизить частоту местных рецидивов, но, в целом, не привело к существенному улучшению отдаленных результатов лечения больных ОРМЖ по сравнению с только хирургическим лечением.
Лучевая терапия применялась в комбинированном лечении больных ОРМЖ в сочетании с хирургическим методом. J.M.Vaeth с соавт. (1982г) приводит данные результатов предоперационной мегавольтной лучевой терапии в дозе 45 Гр и последующей операции через 3-6 недель. У больных с регрессией опухоли отмечено уменьшение числа рецидивов по сравнению с больными с только лучевой терапией. Однако 5-летняя выживаемость после лучевой терапии составила 3,4 %, а после комбинированного лечения — 5,1%, различия не существенны (240, 241).
По данным различных авторов 5-летняя выживаемость после комбинированного лечения больных ОРМЖ не намного превысила 5% (217, 90, 52, 53).
C.A. Perez, на основании своих исследований отмечает, что комбинированное лечение больных ОРМЖ позволило улучшить местный контроль (201), но не привело к улучшению выживаемости по сравнению с монотерапией.
Применение комбинированного метода не позволило улучшить результаты лечения больных ОРМЖ, что указывает на системную природу болезни (149).
Химиотерапия и химиолучевое лечение.
Использование химиотерапии в лечение агрессивного отечного рака молочной железы позволяет влиять как на первичную опухоль, так и на субклинические очаги опухоли. В настоящее время используют комбинации химиопрепаратов с различным механизмом действия, что потенцирует противоопухолевый эффект и уменьшает риск развития лекарственной резистентности.
Впервые в 1969 году Cooper предложил схему CMFVP: комбинацию циклофосфамида, метотрексата, 5-фторурацила, винкристина и пред- низолона у больных ОРМЖ (125). Это позволило достичь ремиссии (полной и частичной) у 56,5% больных, а средняя продолжительность ремиссии составила 6,3 месяца (43).
Y. Takatsuka (1991 г) описал применение у 56-летней пациентки с обширным отеком пораженной молочной железы внутриартериальной химиотерапии с использованием высоких доз эпи- рубицина: 150 мг в сутки в 1, 4 и 7 день и ежедневного приема тамоксифена 40мг в сутки. После проведения 2 курсов отмечен полный клинический ответ: исчезновение отека и опухоли в молочной железе, что, возможно, было связано с эффективностью высоких доз эпирубицина (226).
Химиотерапия редко применяется в монорежиме. J. Rouesse с соавт. в 1986г. отметил улучшение выживаемости больных ОРМЖ при использовании химиолучевого лечения в сравнении с только лучевой терапией. В 1 группе (60 пациентов) проведена только лучевая терапия СОД 45Гр + буст 20-30Гр; во 2 группе (91 пациент) индукционная химиотерапия по схеме AVM (адриамицин, винкристин, метотрексат), лучевая терапия и поддерживающая химиотерапия по схеме VCF (винкристин, циклофосфамида и 5-фторурацил); в 3 группе (79 пациентов) индукционная химиотерапия по схеме AVCMF (адриамицин, винкристин, циклофосфамида, метотрексат и 5-фторурацил), лучевая терапия и поддерживающая химиотерапия также по схеме VCF. 4-летняя БРВ составила, соответственно: 15%, 32% и 54% (р<0,05);а ОВ — 42%, 53% и 74% (р<0,05 при сравнении с 3 группой) (209).
Thomas в 1995 году представил результаты химиолучевого лечения 125 пациентов с ОРМЖ T4d N0-2 M0. На первом этапе проведены 3 цикла химиотерапии с включением доксорубицина, винкристина, циклофосфамида, метотрексата и 5- фторурацила. Затем была проведена лучевая терапия в 3 этапа до СОД 65-75Гр на опухоль молочной железы. В перерыве между лучевой терапией проводили 5 курсов химиотерапии по схеме CAF. В результате химиолучевого лечения 82% пациентов имели полный клинический ответ. Кумулятивный 5-летний период без признаков местного и отдаленного метастазирования составил 27% и 53%, соответственно. 5-летняя ОВ и БРВ составила 50% и 38%, соответственно (230).
Интерес представляет статья Arthur D.W. с соавт. (1999г), посвященная лечению 38 больных ОРМЖ преимущественно химиолучевым методом. Пациентам проводили неоадъювантную химиотерапию, затем лучевую терапию мультифракционированием доз (по 1,5 Гр 2 раза в день с последующим бустом 18-21 Гр, СОД составила 63-66 Гр). Мастэктомия выполнена у 10 пациентов (26%) при стабилизации или прогрессировании болезни. Из 15 пациентов с полной ремиссией после химиотерапии, 87% пациентов были без признаков местного прогрессирования без выполнения мастэкто- мии. Общая 5-летняя выживаемость для группы с полной и отсутствием ремиссии составили 68% и 14%, соответственно. 5-летняя БРВ и ОВ для всей группы составили 11% и 33%. Авторы подчеркивают, что достижение полной ремиссии после химиотерапии играет важную роль в улучшении выживаемости больных ОРМЖ (80).
Высокодозная химиотерапия.
Интерес представляют исследования по применению высокодозной химиотерапии (ВДХТ). Исследования с применением более высоких доз химиопрепаратов показали более высокое число полученных ремиссий, но это не улучшило выживаемость больных ОРМЖ (118).
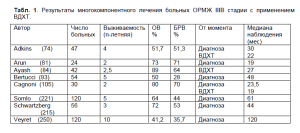
Последние годы проводятся исследования по применению высокодозной химиотерапии с поддержкой гемопоэтическими стволовыми клетками. Данные, полученные разными учеными можно увидеть в представленной ниже таблице 1.
F. Bertucci (2004г) не отметил статистически значимых различий в частоте полных патологических ответов в группах стандартной химиотерапии (20 пациентов) и ВДХТ (54 пациента): 17% и 27%, соответственно. Для всей группы 5-летняя ОВ и БРВ составляла 41% и 24%. Однако, при мультивариатном анализе независимым прогностическим фактором стало применение ВДХТ. 5летняя ОВ и БРВ для стандартной химиотерапии составили 18% и 15%, для ВдХт — 50% и 28%. (92, 93).
Т. Kim в 2006 году провел системный анализ результатов неоадъювантного лечения ОРМЖ, опубликованных в литературе. Всего было проведено 27 исследований с включением 1232 пациентов. Критерии включения и полученные результаты значимо отличались. Число объективных ответов, 3х- и 5-летняя ОВ различались от 14 до 100%, от 22% до 84% и от 32% до 75%, соответственно. Были проанализированы 4 группы нео- адъювантной химиотерапии: без применения ан- трациклинов, с низкими дозами, средними дозами антрациклинов и ВДХТ с поддержкой стволовыми клетками. Число полных гистологических ответов для этих 4-х групп составили: 4% (95% ДИ 1-18%), 14% (95% ДИ 8-22%), 11% (95% ДИ 7-17%) и 32% (95% ДИ 24-41%), соответственно. Отмечено увеличение числа гистологических ответов при интенсификации неоадъювантной химиотерапии, хотя этот анализ не является рандомизированным исследованием (160).
В большинстве наблюдений проведение высокодозной химиотерапии у больных ОРМЖ увеличило процент полного ответа на лечение, но существенно не повлияло на отдаленные результаты лечения.
Гормонотерапия.
В настоящее время наличие в тканях опухоли рецепторов стероидных гормонов служит критерием ее гормональной чувствительности и является показанием к назначению гормонотерапии. Отсутствие рецепторов сопровождается гор- монорезистентностью опухоли, за исключением 810%, когда опухоль все же оказывается гормоночувствительной (183). В большинстве исследований гормонотерапия проводится тамоксифеном.
При исследовании рецепторного статуса у больных ОРМЖ ряд авторов отметил отсутствие рецепторов эстрогенов и прогестерона (РЭ/РП) в опухолях у большей части больных ОРМЖ (15, 94, 164, 207, 222, 233, 251). По данным К.Ю. Зернова РЭ/РП отрицательный статус отмечен у большинства больных ОРМЖ — 67%, при местнораспространенном раке молочной железы — у 33%. (24). Другие, напротив отмечают наличие рецепторов у большинства больных ОРМЖ- 66% (199, 217).
По данным популяционного анализа 308 больных ОРМЖ проведенном в 2005 году M. Panades большую прогностическую значимость имеет наличие положительных рецепторов эстрогена в достижении 10-летней безрецидивной выживаемости (29,1% против 25,7% при РЭ-отрицательном статусе, р=0,02) (198). Однако в исследовании, проведенном в 2004 году J.A. Low, показано отсутствие влияния рецепторного и менопаузального статусов на общую выживаемость больных. Также не отмечено статистически значимого влияния положительных или отрицательных РЭ у больных как в пременопузе, так и в постменопаузальном периоде (173).
В настоящее время гормонотерапия в основном применяется в сочетании с другими методами лечения с использованием более современных препаратов, включая ингибиторы и инактиваторы ароматаз, аналоги гипоталамических гормонов.
Комплексное лечение.
Несмотря на значительные успехи в развитии химиотерапии анализ литературы, посвященный лечению ОРМЖ, свидетельствует о низкой возможности получения длительных ремиссий с помощью одного или двух методов лечения, требуется использовать многоступенчатый подход с применением всех новых современных методов лечения. Однако до последнего времени нет единого мнения о целесообразности применения всех 3 основных методов лечения рака молочной железы — хирургического, лучевого и лекарственного.
Ряд авторов указывают на нецелесообразность проведения лучевой терапии в лечении данных больных.
S. Noguchi с соавторами провели лечение 28 больных ОРМЖ с включением неоадъювантной внутриартериальной химиотерапии адриамици- ном, митомицином и 5-фторурацилом через грудную и подключичную артерии, с последующей расширенной радикальной мастэктомией и адъювантной химиотерапией. Число достигнутых клинических ответов после первичной химиотерапии составило 83%, полный гистологический ответ в виде некроза в 43% из них. Хирургический этап в среднем выполнялся через 7 недель после начала химиотерапии. Безрецидивная выживаемость 5- и 10-летняя составили 59% и 53%, что указывает на хороший локальный контроль после проведения химиотерапии. Применяемая методика сокращает сроки выполнения мастэктомии после неоадъ- ювантного лечения(195).
В 1997 году в США N.T.Ueno с соавторами опубликовали 20-летние результаты лечения больных ОРМЖ в клинике M.D. Anderson Cancer Center. Многокомпонентное лечение было проведено 178 пациентам с включением неоадъювант- ной химиотерапии антрациклинами, локальной лучевой терапии с последующим хирургическим лечением или без него, и адъювантной химиотерапии. Ответ на неоадъювантную химиотерапию отмечен у 71% больной, из них полный ответ — у 12%, что влияло на БРВ. У больных с полным ответом БРВ к 15 годам составила 44%, с частичным ответом — 31%, у резистентных -7%. К 15 годам 28% больных были без признаков болезни. Общая 5 и 10-летняя выживаемость составили 40% и 33%, при медиане наблюдения 37 месяцев (239).
Исследования других ученых также показали сходные результаты выживаемости, указывая на улучшение прогноза при данной форме рака молочной железы с введением неоадъювантной химиотерапии в комплексное лечение больных (141, 209).
Ряд ученых указывают на положительную роль мастэктомии в комплексном лечении больных ОРМЖ в достижении местного контроля и БРВ, особенно после проведения успешной неоадъ- ювантной химиотерапии. Fields в 1989 году провел анализ различных методов лечения 107 больных ОРМЖ с включением лучевой терапии. Были выделены 4 группы больных: только лучевая терапия (31 больной), сочетание с мастэктомией (16), с химиотерапией (23) и комплексное лечение с облучением, химиотерапией и мастэктомией (37). Медиана БРВ составила 12 мес., 5-летняя выживаемость — 12%. Проведение химиотерапии достоверно улучшало как ОВ, так и БРВ больных. Проведение хирургического этапа достоверно позволило усилить местный контроль, ОВ и БРВ. Медиана БРВ при комплексном лечении составила 34 месяца (5-летняя — 37%), а медиана ОВ- 47 месяцев (5-летняя — 48%) (141).
В 2005 году M.Panades приводит результаты лечения 308 больных ОРМЖ в зависимости от выполнения мастэктомии. Медиана наблюдения составила 6,5 лет, а медиана выживаемости без признаков болезни- 3,2 года. 10-летняя выживаемость без признаков регионарного рецидива составила для группы с мастэктомией после химиотерапии, мастэктомии до химиотерапии, и без мастэктомии: 62,8%, 58,6% и 34,4%, соответственно (р<0,05), соответствующая 10-летняя выживаемость без признаков болезни: 36,9%, 19,9% и 22,5% (р<0,05). При мультивариантном анализе выполнение мастэктомии было связано с улучшением выживаемости без признаков рецидива (р<0,05) (198).
В 2000г. R.H. De Boer с соавторами провел анализ результатов химиолучевого лечения 54 пациентов с первичной отечной формой рака молочной железы в зависимости от применения хирургического этапа лечения. При достижении положительного эффекта или стабилизации болезни после неоадъювантной химиотерапии пациенты подвергались только облучению (n = 35) или хирургическому лечению и облучению (n = 19). Пациенты только с лучевой терапией имели медиану ОВ и БРВ 35мес и 16мес, соответственно. Пациенты, получившие и хирургическое и лучевое лечение имели медиану ОВ и БРВ 35мес и 20мес, соответственно. Ни одно из отличий не было достоверным, что требует, по мнению автора, дальнейших проспективных рандомизированных исследований (131).
R.Y. Fleming (1997г) на основании пересмотра ретроспективных данных 178 больных ОРМЖ из M. D. Anderson Cancer Center (США) делает вывод, что добавление мастэктомии к хи- миолучевому лечению улучшает местный контроль у больных ОРМЖ, ОВ и БРВ у пациентов с полным или частичным клиническим ответом на неоадъювантную химиотерапию. У пациентов без адекватного ответа на химиотерапию улучшение ОВ и БРВ не отмечено. Прогностическими факторами местного прогрессирования являются ответ на неоадъювантную химиотерапию и объем резидуальной опухоли при исследовании операционного материала. Пациенты с комбинацией мастэкто- мии и лучевой терапии имели меньшую частоту местных рецидивов, чем проведение только лучевой терапии 16,3% и 35,7% (р=0,015) (145).
E.Harris (2003г) отметил улучшение результатов комплексного лечения пациентов ОРМЖ при наличии гистологического полного ответа. Медиана наблюдения составила 5,1 года. Общая 5- и 10-летняя выживаемость составила 56% и 35%, а БРВ — 49% и 34%, соответственно. При достижении полного морфологического ответа 5- и 10-летняя ОВ составила 65% и 46%, а БРВ- 59% и 50%, без полного ответа 5- и 10-летняя БРВ 45% и 27%, соответственно. Следует отметить, что в данное исследование не включались пациенты с отдаленными метастазами и прогрессированием на фоне неоадъювантной химиотерапии, что могло сказаться на полученных результатах (154).
Представляет интерес изучение выживаемости пациентов ОРМЖ при комплексном лечении с неоадъювантной химиотерапией с включением антрациклинов и с добавлением еженедельного введения паклитаксела. Комбинация антрацикли- нов и паклитаксела в сравнении только с применением антрациклинов в неоадъювантном лечении привела к увеличению числа полных морфологических ответов (pCR) при исследовании лимфатических узлов (45% против 16%, р=0,01). Отмечено улучшение выживаемости больных в группе с достигнутым полным морфологическим ответом по сравнению с группой с метастазами в регионарные лимфатические узлы: 5-летняя ОВ 82,5% против 37,1% (р=0,01), 5-летняя БРВ 78,6% против 25,4% (р=0,001) (156).
В исследовании проведенном M. Cristofanilli по изучению эффективности различных схем неоадъювантной химиотерапии на основе анализа 240 больных ОРМЖ выявлено статистическое значимое улучшение выживаемости больных при добавлении паклитаксела к химиотерапии антрациклинами (по схеме FAC) у пациентов с отрицательным статусом РЭ. Число ремиссий (полных и частичных) в группе химиотерапии FAC и с добавлением паклитаксела значимо не отличались 74% и 82%, соответственно. Медиана общей выживаемости при отрицательном статусе РЭ для первой и второй групп составила 32 месяца и 54 месяца при р=0,03, а БРВ — 18 и 27 месяцев при р=0,04 (126).
В настоящее время ведутся новые исследования по применению в неоадъювантном режиме химиотерапии с включением ежедневного приема лапатиниба (Tykerb- ингибитор тирозинкина- зы) и еженедельного введения паклитаксела у больных ОРМЖ с гиперэкспрессией ErbB2 и/или экспрессией ErbB1. Из проанализированных пациентов клиническая ремиссия в группе с гиперэкспрессией ErbB2 отмечена у 95% больных (20 из 21), в группе с гиперэкспрессией ErbB1- у 100% (2 из 2). Предварительные данные требует дальнейшего подтверждения в исследованиях (128).
Вместе с развитием комплексного лечения совершенствуется и хирургический этап лечения у больных ОРМЖ. Обширность поражение кожи и ткани молочной железы требует более широкого иссечения кожи и мягких тканей для проведения резекции в пределах здоровых тканей. Возникают технические трудности по закрытию дефектов при ушивании послеоперационной раны.
Д.Д. Пак с соавторами (2002 г.) предложили расширить объем удаляемых тканей и запатентовали вариант оперативного вмешательства, заключающийся в удалении молочной железы с грудными или без грудных мышц, подключично- подмышечно-подлопаточной клетчатки с лимфатическими узлами и прилежащей к железе кожи и подкожной клетчатки в следующих границах: сверху — второе межреберье, снизу — на 5 см ниже субмаммарной складки, медиально — противоположный край грудины, кнаружи — по задней подмышечной линии. Для закрытия образовавшегося дефекта с медиальных углов раны разрезы продлеваются вертикально вниз и, если позволяет анатомическое строение, несколько кнаружи. После отсепаровки формируется трапецивидный или П-образный кожно-подкожный лоскут, который подтягивается к верхнему краю раны и производится закрытие операционной раны. Разработанная методика хирургического этапа лечения: расширенная модифицированная радикальная маст- эктомия, включенная в схему комплексного лечения отечной формы рака молочной железы позволила снизить частоту местных рецидивов болезни до 6,6% и увеличить 3-х летнюю общую и безре- цидивную выживаемость пациенток до 76,6% и 60% соответственно. Авторы считают наиболее эффективным вариантом хирургического этапа расширенную модифицированную радикальную мастэктомию с удалением прилежащей кожи и подкожной жировой клетчатки, с сохранением обеих грудных мышц. Она является операцией выбора у больных ОРМЖ, так как при ее выполнении сводится к минимуму риск развития местного рецидива заболевания, улучшаются результаты выживаемости и качество жизни (46, 47, 48).
Однако, в литературе описаны и единичные результаты выполнения органосохраняющего лечения у больных ОРМЖ. В исследовании, проведенном в 18 госпиталях Японии, при анализе 133 результатов после органосохранного лечения РМЖ включавшего 9 наблюдений ОРМЖ, 64 — не отечной формы РМЖ, и 60 — РМЖ с отдаленными метастазами, были формально выделены виды прогрессирования: воспалительный, не воспалительный рецидивы и наличие только отдаленных метастазов. Значительным фактором риска развития воспалительного рецидива было наличие поражения регионарных лимфатических узлов, которые значительно чаще встречались в случаях лимфатической инвазии в отличие от группы с отдаленными метастазами. Время возникновения воспалительного рецидива было короче и составило 12 месяцев, несмотря на наличие или отсутствие лучевого этапа лечения. Воспалительный тип рецидива характеризовался местным широким распространением (наличием раковых эмболов в лимфатических сосудах дермы) и отдаленными метастазами (лимфатический канцероматоз), и дальнейшее хирургическое лечение было невозможным в большинстве случаев. Данный тип рецидива связан со значительно худшим прогнозом, чем при других типах рецидива. Эти результаты показывают, что рецидив соответствует так называемому оккультному случаю первичной формы ОРМЖ и важно предсказывать этот рецидив более точным морфологическим исследованием, в особенности у пациентов с метастазами в лимфатические узлы (194).
В связи с агрессивным течением ОРМЖ лишь небольшому числу женщин (п = 23) с данной формой выполнены реконструктивные операции после мастэктомии. Лечение включало мастэктомию у всех пациентов, химиотерапию у 22, и облучение грудной клетки у 14 пациентов. Немедленная реконструкция выполнена одномоментно с мастэктомией у 14 пациентов и отсрочено у 9. Виды реконструкции включали использование ТРАМ лоскута (п = 18), лоскута широчайшей мышцы спины (п = 2) и протезирование имплантатом молочной железы (п = 3). 7 женщинам дополнительно после реконструкции молочной железы была выполнена реконструкция соска. Медиана наблюдения 44 месяца, у 16 пациентов развился рецидив болезни, из них 6 были с местным рецидивом и 10 имели отдаленные мтс. 7 пациентов живы без признаков болезни, 4 — с признаками болезни и 12 умерли от прогрессирования рака молочной железы. Медиана БРВ после реконструкции составила 19 месяцев. Медиана ОВ -22 мес. Негативным прогностическим фактором явились положительные хирургические края при мастэктомии. Значительные эмоциональные и эстетические преимущества реконструкции молочной железы должны, по мнению авторов, быть доступны и для женщин с ОРМЖ. В свете улучшения прогноза ОРМЖ с использованием в настоящее время мультимодального лечения, реконструктивные операции, считают авторы, должны быть предложены как часть возможной терапии (120).
Таким образом, при лечении больных ОРМЖ недостаточно применения монотерапии или сочетания двух методов лечения. Наилучшие результаты получены при проведении комплексного лечения с включением неоадьювантной химиотерапии и при достижении положительного эффекта от этого лечения. До сих пор существуют разногласия по проведению локального лечения данных больных. Традиционно в связи с плохим прогнозом многие специалисты считают ОРМЖ не хирургическим заболеванием. Но с улучшением выживаемости после использования современных методик полихимиотерапии роль хирургического этапа лечения была пересмотрена. Результаты, полученные различными авторами, оказались противоречивыми: в некоторых исследованиях было показано преимущество включения в лечении хирургического этапа (141, 145, 198), при других — это преимущество не было отмечено (131).
Прогностические факторы.
Прогностические факторы при ОРМЖ до настоящего времени исследованы недостаточно, хотя на их изучение фокусируется все возрастающее внимание (34, 37, 95, 104, 138, 146, 163, 178,
185, 214, 216). По результатам исследования, проведенного B. Chevallier (1987г), менструальная функция, возраст, рецепторный статус, первичная или вторичная форма опухоли, тип химиотерапии и время появления симптомов ОРМЖ не влияли на продолжительность жизни (117).
S.Chang с соавторами (2000г) провели исследования по изучению влияния повышенного индекса массы тела на выживаемость больных ОРМЖ. Высокий индекс массы тела (более 26,6 кг/м2) был значимо связан с увеличенным риском развития ОРМЖ. В целом в пременопаузе пациенты имели значимо худшую выживаемость, чем женщины в постменопаузальном периоде. Преме- нопаузальные женщины с избыточным весом имели незначительно лучшую выживаемость, чем соответствующие женщины с меньшим весом. Постменопаузальные женщины с избыточным весом, имели значимо худшую выживаемость, чем соответствующие женщины с меньшим весом. Таким образом, эти данные показывают, что факторы, ассоциированные с избыточным весом, могут вносить вклад в ухудшении выживаемости среди постменопаузальных женщин (110, 111).
По наблюдениям почти всех специалистов поражение регионарных лимфатических узлов, как и при других местно распространенных формах рака молочной железы, сокращает общую и без- рецидивную выживаемость больных ОРМЖ (100, 103, 117, 197, 221).
При изучении продолжительности жизни при ОРМЖ в зависимости от наличия или отсутствия опухолевой инвазии в лимфатические сосуды кожи различными исследователями получены противоречивые результаты. Одни авторы не нашли существенных различий в продолжительности жизни в зависимости от наличия или отсутствия гистологических и клинических признаков ОРМЖ (251). Другие, F.V. Lucas и соавт.(1978г), G. Gruber и соавт.(2004г) — отмечают, что пациенты с клинической картиной и гистологическими данными отечной формы имели более быстрое наступление прогрессирования, чем пациенты только с гистологически подтвержденной инвазией сосудов («оккультная» форма). В то же время, они считают, что наличие одного из критериев: клинического или гистологического, оправдывает использование термина «воспалительный рак молочной железы» и указывают на плохой прогноз, несмотря на лечение (150, 174).
В начале 90-х годов было выявлено важное прогностическое значение степени отёчновоспалительных признаков у больных ОРМЖ на момент постановки диагноза, их регрессии после проведения химиотерапии, а также и поражения метастазами регионарных лимфатических узлов (103, 117, 147, 169, 179, 197, 210, 238, 239). Достижение не только клинического, но и гистологического ответа опухоли на лечение ОРМЖ имеет большое значение в улучшении выживаемости больных ОРМЖ (119, 140, 145, 154). Пациенты ОРМЖ, ответившие на химиотерапию, являются кандидатами для выполнения мастэктомии и лим- фаденэктомии (141, 145, 201).
Современные прогностические факторы были исследованы Маїїіпег-ТгиТего с соавторами при анализе данных 103 больных местно распространенным РМЖ, включая ОРМЖ. На общую и безрецидивную выживаемость больных при муль- тивариатном анализе влияли 5 прогностических факторов: степень дифференцировки опухоли, уровень сывороточных маркёров (СА-15.3 и РЭА- раково-эмбриональный антиген), признаки ОРМЖ, ответ на неоадъювантную химиотерапию и поражение регионарных лимфоузлов (178). Статистически значимое влияние экспрессии Кі-67 (больше 20% ядерного окрашивания клеток) на общую выживаемость больных ОРМЖ выявлено лишь при унивариатном исследовании при соотношении рисков 1,45 (95% ДИ 1,13-1,88) при р=0,004 (96). По наблюдениям других авторов экспрессии некоторых из генов оказывают влияние на общую выживаемость пациентов ОРМЖ: c-Met (146), МУСЫ, ЕРЕС, БИН (95), р53 (96) и АРНС/РІюС GTPase (163).
В заключении следует отметить, что проведенный анализ литературных данных по лечению больных ОРМЖ однозначно указывает на недостаточность применения только одного или двух методов лечения: хирургического, лучевого и противоопухолевого лекарственного. Наилучшие результаты получены при сочетании неоадъювант- ной химиотерапии с хирургическим или лучевым методом лечения или с тем и другим. При этом решающее значение имеет ответ опухоли на проведенную неоадьювантную химиотерапию. Какие компоненты лечения и в какой последовательности целесообразно применять после неоадьювантной химиотерапии до настоящего времени окончательно не решены. Не ясно как следует лечить больных, у которых не получен эффект от неоадъювантной химиотерапии. Существуют разногласия по проведению локального лечения данных больных. Традиционно многие специалисты ОРМЖ считают не хирургическим заболеванием в связи с плохим прогнозом, однако выживаемость больных улучшилась с введением новых схем химиотерапии в комплексном лечении и роль хирургического метода пересматривается Недостаточно изучено влияние основных факторов прогноза, форм ОРМЖ, объема хирургического вмешательства на эффективность различных методов лечения.
Поэтому дальнейшие исследования по изучению особенностей клинического течения и эффективности различных методов лечения в зависимости от факторов прогноза у больных ОРМЖ является задачей актуальной и позволит улучшить результаты лечения.
Список литературы.
- Адамян А.Т. Клиническая дифференциация отечно-инфильтративной и узловой форм рака молочной железы// Клиническая медицина. — 1986. — №1. — С. 116-118.
- Алферова М.С. Отдаленные результаты лечения рака молочной железы// Вопр. онкол. — 1977. — №8. — С. 10-17.
- Баженова А.П., Экгольм Б.К., Лази- чев Ю.Д. Оценка непосредственных результатов терапии местно-распространенных форм рака молочной железы// Лечебные мероприятия при развитых и далеко зашедших формах рака молочной железы и яичников. — Л.- 1975.- С.63-65.
- Барсуков В.Ю., Селезнева Т.Д. Иммунологические сдвиги у больных с отечно- инфильтративным раком молочной железы// Материалы III международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы».- Санкт-Петербург.- 2006.- Стр.55.
- Борисов В.И., Сарибекян Э.Л. «Неоадъювантная химиотерапия рака молочной железы» // В кн. «Новое в терапии рака молочной железы» под ред. проф. Н.И.Переводчиковой.-
- — С. 43 — 7.
- Возный Э.К., Харченко В.П., Гуров С.Н., и др. Некоторые прогностические факторы в комплексном лечении местнораспространенного рака молочной железы.// Вопросы онкологии.- 2000.- Т.46.-№6.- С.732-736.
- Волков В.Е. Саркома молочной железы// Актуальные вопросы клинической медицины.- Чебоксары.- 1999. — С.120-121.
- Волченко Н.Н., Франк Г.А. Морфологические факторы прогноза при раке молочной железы// Российский онкологический журнал.- 2000.- №3.- С.49-53.
- Гарин А.М. Эндокринная терапия и гормонозависимые опухоли.- М.- Триада.- 2005.- С.144-177.
- Глац С.П. Медико-биологическая статистика. — М.- Практика, 1999.-С.156.
- Горбунова В. А., Бесова Н. С. Значение таксанов в лечении рака молочной железы // Вопросы онкологии.- 2004.- № 2.- С.54-57.
- Горбунова В.А., Артамонова Е.В., Багрова С. Г. и др. Этюды химиотерапии (пять лет спустя).- М.- Литтерра.- 2006.- С.154-173.
- 13.Грицман Ю.Я., Киселева Е.С. Новые направления в комбинированном и комплексном лечении злокачественных опухолей// 3-й Всесоюзный съезд онкологов.- Ташкент.- 1979.- С.407- 408.
- Дагбаева В.О., Бадмаева Г.С. Эффективность различных методов лечения больных с отечно-инфильтративными формами рака молочной железы в Республиканском онкодиспансере за 5 лет в период с 1993-1997г.г.//Актуальные проблемы клинической онкологии.- Улан-уде.-— С.212-213.
- Даценко В.С., Мачнева Л.Е. Лечение инфильтративно-отечных форм рака молочной железы// Материалы 8-й Московской городской онкологической конференции. — М., 1977. — С. 89-90.
- Двойрин В.В., Клименков А.А. Методика контролируемых клинических испытаний. — М., 1985. — 144с.
- Дедкова Е.М., Оконечников А.И. Некоторые клинические аспекты отечной формы рака молочной железы по материалам горонко- диспансера г. Москвы// Вопр. онкол. — 1978. -№12.- С. 102-103.
- Демин В.Н. Лечение рака молочной железы// Хирургия. -1977.-№2.-С. 23-26.
- Демин В.Н. Выступление в прениях на 269-м заседании научного общества онкологов Ленинграда и Ленинградской области от 24.09.1981.//Вопр. онкол.- 1982.- №7.- С. 109.
- Добровольская Н.Ю. Лекарственная и лучевая терапия в лечении местнораспространенного и диссеминированного рака молочной железы.// Автореф. дисс. док. мед. наук. — М., 2007.- С.15.
- Дымарский Д.Ю., Бавли Я.Л. Химиотерапия при раке молочной железы.- М.- Медицина.- 1976.- С.184.
- Дымарский Л.Ю. Рак молочной железы. — М., Медицина, — 1980. — C. 198.
- Заболотская Н. В. Комплексное ультразвуковое исследование больных с отечно — инфильтративной формой рака молочных желез. Новы технологии — новая информация. «SonoAce — International». Русская версия.- 1999.- N5.- С.35.
- Зернов К.Ю., Семиглазов В.Ф., Божок А.А. и соавт. Особенности клиники и морфологического строения опухоли у больных воспалительной формой рака молочной железы// Материалы III международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы».- Санкт-Петербург.- 2006.- Стр.65.
- Исханова С.Т. Рак молочной железы (формы роста и их клинические проявления).- Алма-Ата.- Наука.- 1971.- С.65.
- Исханова С.Т. Результаты лечения рака молочной железы в зависимости от стадии заболевания с учетом клинического проявления и формы роста опухоли// Диагностика и лечение злокачественных новообразований.- Алма-Ата.- 1980.- С.74-77.
- Камчатова А.А. Комплексное лечение больных раком молочной железы с метастазами в кости. — Дисс. канд. мед. наук.- М.-1986.
- Козлова А.В. Лучевая терапия злокачественных опухолей// Медицина.- 1976. -С.138-148.
- Лазичев Ю.Д. Роль регионарной полихимиотерапии в комплексном лечении местно-распространенного рака молочной железы// Автореф. дисс. канд. мед. наук. — М., 1975.- С.20.
- Лазичев Ю.Д. Протокол 250-го заседания научного общества онкологов Москвы и Московской области от 26.01.1978.// Вопр. онкол.— №12.- С.103.
- Летягин В.П., Голдобенко Г.В. Эффективность комбинированного и комплексного методов лечения первичного рака молочной железы// Мед. радиол., радиац. безопасность. -1994.- №6.-С.31-33.
- Летягин В.П., Высоцкая И.В. Первичный рак молочной железы. Диагностика, лечение, прогноз. — М., 1996.- С.160.
- Ли Л.А., Иржанов С.И. К вопросу о вторичноотечной форме рака молочной желе- зы//Вопр. онкол.- 1982.- №9.- С.45-49.
- Ли Л.А. О причинах местного отека при инфильтративно-отечной форме рака молочной железы// Вопр. онкол.- 1984.- №5.- С..35-38.
- Ли Л.А., Демин В.Н. О роли хирургического компонента в лечении больных отечной формой рака молочной железы// Научная конференция онкологов БССР, 5-я: Тез. докл. -Минск,- С.165-166.
- Линченко И.Ф., Михайлов С.М. Роль мастэктомии в комплексном лечении отечно- инфильтративного рака молочной железы// Клиническая хирургия.- 1988.- №6.- С. 7-10.
- Линченко И.Ф., Михайлов С.М. Прогноз отечно-инфильтративного рака молочной железы// Актуальные проблемы практической и теоретической медицины. — Ставрополь. — 1989. —С.172-181.
- Липович М.М. Рентгенологическая характеристика диффузного отека молочной железы// Вестник рентгерадиологии. -1974.-С. 83-88.
- Личиницер М.Р., Вышинская Г.В., Сельчук В.Ю. Клинические рекомендации по лечению больных раком молочной железы в постменопаузе// Русский медицинский журнал. Онкология.- 2005.- Том 13, № 13.- С.893-898.
- Лучевая диагностика заболеваний молочных желез// Руководство для врачей под редакцией проф. Труфанова Г.Е. — ЭЛБИ.- Санкт- Петербург.- 2006.- С. 143-199.
- Лушников Е.Ф. Лучевой патомор- фоз опухолей человека. Москва.- Медицина.— С53.
- Михайлов С.М. Прогностические факторы и тактика лечения при первичном отечно- инфильтративном раке молочной железы.- Дисс. канд. мед. наук.- Ставрополь.- 1988.- С.175.
- Мороз Л.В. Комбинированная химиотерапия некоторых злокачественных новообразований.- Автореферат дисс. докт. мед. наук. — М.- 1978.- С.22
- Нахалова Т.А. Лечение отечно- инфильтративной формы рака молочной железы.- Дисс. канд. мед. наук. — М.- 1992.- С.115.
- Островцев Л.Д. Клинические аспекты регионарного лимфогенного метастазирования рака молочной железы.- Автореф. дисс. докт. мед. наук.- М.- 1982.- С.32.
- Пак Д.Д. Органосохраняющие методы лечения больных локализованными и местнораспространенными формами рака молочной железы// Актуальные вопросы маммологии. Материалы научно-практической конференции. Ижевск.- 1998.- С.167-173.
- Пак Д.Д. Органосохраняющие и функционально-щадящие операции при раке молочной железы. Пособие для врачей. — М.- 2000.-С.15.
- Пак Д.Д., Сарибекян Э.К., Пономарев Р.С. Проблемы продолженного роста при лечении отечных форм рака молочной железы//В кн.: Материалы 3-го съезда онкологов и радиологов СНГ.- Минск.- 2004.- Ч.1.- С.66-67.
- Переводчикова Н.И. Руководство по химиотерапии опухолевых заболеваний.- М.- Практическая медицина.- 2005.- С.254-267.
- Ратнер Л.М. Диагностические ошибки и диагностика рака грудной железы.- М.- 1949.- С.99-107.
- Рожкова Н.И. Синдром отечной молочной железы// В кн.: Рентгенодиагностика заболеваний молочной железы под редакцией А.С. Павлова.- Москва.- Медицина.- 1993.- С.156-159.
- Санчакова А.В. Комплексное лечение диффузно-инфильтративных форм рака молочной железы. Автореферат дис. канд.- Л.-1972.
- Санчакова А.В. Возможности комбинированного и комплексного лечения диффузно- инфильтративных форм рака молочной железы// Вопр. онкол.- 1972.- №4.- С.6-10.
- 54. Святухина О.В., Викманис У.Э. Лечение распространенных и острых форм рака молочной железы//Лечебные мероприятия при развитых и далеко зашедших формах рака молочной железы и яичников.- Л.- 1975.- С.101-102.
- Семиглазов В.Ф. Клиникопатогенетические формы рака молочной железы (новые подходы к планированию лече- ния)//Хирургия.- 1980.- №12.- С.27-31.
- Семиглазов В.Ф. Разработка новых подходов к лечению рака молочной железы// Вопр. онкол.- 1997.- Т.43.- №1.- С.22-26.
- Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях.- М.- Гэотар-мед- 2001.- С.256.
- Сидоренко Л.Н. Гормонотерапия предрака и рака молочной железы.- Л.- Медицина.— 126с.
- Сидоренко Л.Н., Шальнева Т.С., Демин В.Н. Овариоэктомия как составная часть комплексного лечения первично-запущенного рака молочной железы// Лечебные мероприятия при развитых и далеко зашедших формах рака молочной железы и яичников.- Л.- 1975.- С.104-105.
- Слонимская Е.М., Колесников С.В., Карасева В.В. Эффективность применения интенсивного режима химиотерапии с использованием высоких доз 5-фторурацила в комплексном лечении больных отечно-инфильтративными формами рака молочной железы// Маммология.- 1998.- №4.-С.53-58.
- Стенина М.Б. Гормонотерапия диссеминированного рака молочной железы// Практическая онкология.- М. — 2000.- С.12-18.
- Тюляндин С.А. Значение предоперационной химиотерапии у больных раком молочной железы. Материалы !У ежегодной Российской онкологической конференции.- Москва.- 21-23 ноября 2000.- С.43-45.
- Тюляндин С.А. Химиотерапия диссеминированного рака молочной железы// Практическая онкология.- М.- 2000.- С.3-11.
- Харченко В.П., Рожкова Н.И. Синдром отечной молочной железы// В кн.: Лучевая диагностика заболеваний молочной железы, лечение и реабилитация.- 2000.- вып.3.- С.113-114.
- Харченко В.П., Возный Э.К., Галил- Оглы Г.А., Добровольская Н.Ю., Гуров С.Н. Факторы, определяющие планирование адъювантной химиотерапии при местнораспространенном раке молочной железы.// Материалы Всероссийской научно-практической конференции. «Актуальные вопросы маммологии». 2001 год.- С.96-97.
- Холдин С.А., Дымарский Л.Ю., Бав- ли Я.Л. Лечение распространенных и инфильтра- тивных форм рака молочной железы// В кн.: Новости онкологии.- Л.- 1971.- С.61-65.
- Холдин С.А., Дымарский Л.Ю., Бав- ли Я.Л. Принципы лечения, классификация и прогноз при лечении распространенных форм рака молочной железы// Лечебные мероприятия при развитых и далеко зашедших формах рака молочной железы и яичников.- Л.- 1975.- С.111-113.
- Худжадзе Р.Т., Спирина С.К., Уми- кашвили Р.С. Непосредственные результаты комбинированной химиотерапии отечно- инфильтративной формы рака молочной железы// Этиопатогенез, диагностика и лечение опухолей.- Тбилиси.- 1982.-С.183-188.
- Чиссов В.И., Дарьялова С.Л.// Избранные лекции по клинической онкологии.- М.- 2000.- С.361-389.
- Чиссов В.И., Старинский В.В., Петрова Г.В.// Злокачественные новообразования в России в 2005г.- Москва.- 2007.
- Шальнева Т.С., Сидоренко Л.Н., Демин В.Н. Роль химиотерапии в комплексном лечении местно-распространенных отечных форм рака молочной железы//Тез. Всесоюзного симпозиума «Лечебные мероприятия при развитых формах рака молочной железы».- Л.- 1975.- С.118-119.
- Шальнева Т.С., Сидоренко Л.Н., Крупенин А.М. Оценка клинического течения методов лечения и прогноза при отечных формах рака молочной железы// Вопр. онкол.- 1972.- №5.-С.119-120.
- Янишевский Ф.И. Рак молочной железы. — М.- Медицина.- 1966.- С.331.
- Adkins D., Brown R., Trinkaus K., et. al. Outcomes of high-dose chemotherapy and autologous stem-cell transplantation in stage IIIB inflammatory breast cancer.// J Clin Oncol. 1999.- 17(7).- P.2006-2014.
- Alberto V.A., Alberto V. Cancer in- flamatorio de 53 casos pautas de diagnostico y trata- mierto// Gine-dips. -1984.- V.15.- N3.- P.163-178.
- Alpaugh M.L., Tomlinson J.S., Shao Z.M., Barsky S.H: A novel human xenograft model of inflammatory breast cancer// Cancer Res.- 1999.- V.59.- P.5079-5084.
- American Joint Committee on Cancer. AJCC Cancer Staging Manual. 6th ed. Chicago, Ill: Springer-Verlag.- 2002.- P.257-280.
- Amparo R.S., Angel C.D., Ana L.H., et al. Inflammatory breast carcinoma: pathological or clinical entity?// Breast Cancer Res Treat.- 2000.- 64.- P.269 — 73.
- Anderson WF, Chu KC, Chang S. Inflammatory breast carcinoma and noninflammatory locally advanced breast carcinoma: distinct clinico- pathologic entities?// J Clin Oncol.- 2003.- V.21. P.2254-2259
- Arthur D.W., Schmidt-Ulrich R.K., Friedman R.B., et al. Accelerated superfractionated radiotherapy for inflammatory breast carcinoma: complete response predicts outcome and allows for breast conservation// Int J Radiat Oncol Biol Phys.- 1999.- V.44(2).- P.289-296.
- Arun B, Slack R, Gehan E et. al. Survival after autologous hematopoietic stem cell transplantation for patients with inflammatory breast carci- noma// Cancer.- 1999.- V.85.- P.93-99.
- Attia-Sobol J, Ferriere JP, Cure H, et al. Treatment results, survival and prognostic factors in 109 inflammatory breast cancers: univariate and multivariate analysis.// Eur J Cancer.- 1993.- 29A.- P.1081-1088.
- Auquier M.A., Baratte В., Grumbach Y. Conduit a tenir devant un sein inflammatoire// Radiol J. CEPUR .- 1994.- V.10.- P.49-56.
- Ayash L.J. , Elias A., Ibrahim J., et. al. High-dose multimodality therapy with autologous stem-cell support for stage IIIB breast carcinoma// J Clin Oncol.- 1998.- V.16.- P.1000-1007.
- Aziz SA, Pervez S, Khan S, et al. Case control study of prognostic markers and disease outcome in inflammatory carcinoma breast: a unique clinical experience// Breast J.- 2001- V.7.- P.398-404.
- Baloch A., Svastits E., Rahoty P., Toth L., Besznyak I. Primary inflammatory carcinoma of the breast//Acta chir hung.- 1983.- V.24.- N1. P.43-52.
- Barber K.W., Doskerty M.B., Clagett O.T. Inflammmatory carcinoma of the breast// Surg Gynecol Obstet.- 1961.- V.112.- P.406-410.
- Barker J.L., Nelson A.J., Montague E.D. Inflammatory carcinoma of the breast// Radiology.- 1976-V.121(1).- P.173-176.
- Barker J.L., Montague E.D., Peters L.J. Clinical experience with irradiation of inflammatory carcinoma of the breast with and without elective chemotherapy// Cancer. 1980.-V.45(4).- P.625-629.
- Bedwinek J., Rao D., Perez C. At al. Treatment of stage III and localized stage IV breast cancer by irradiation alone versus irradiation plus sur- gery//Int. J. Radiol., Biol., Phys.- 1982.- V.8.- P.31-36.
- Bell C. A system of operative surgery .//Surgery.- London.- Longman.-1807.- Vol.1.- P.180.
- Bertucci F., Finetti P., Rougemont J. et al. Gene expression profiling for molecular characterization of inflammatory breast cancer and prediction of response to chemotherapy// Cancer research.— V.64.- P.8558-8565.
- Bertucci F., Tarpin C., Charafe- Jauffret E. et al. Multivariate analysis of survival in inflammatory breast cancer: impact of intensity of chemotherapy in multimodality treatment// Bone Marrow Transplant.- 2004.- V.33(9).- P.913-920.
- Bieber S., Reiss-Eichler F., Calderoli H. et al. Pre- and post-operative chemotherapy in the treatment of acute breast cancer. Proceedings of the 13-th International Congress of Chemotherapy.- Vienna.- 1985.- Part.244.- P.55-57.
- Bieche I., Lerebours F., Tozlu S., Es- pie M., Marty M., Lidereau R: Molecular profiling of inflammatory breast cancer: identification of a poor- prognosis gene expression signature// Clin Cancer Res.- 2004.- V.10.- P.6789-6795.
- Bonnefoi H., Diebold-Berger S., Therasse P. et al. Locally advanced/inflammatory breast cancers treated with intensive epirubicin-based neoadjuvant chemotherapy: are there molecular markers in the primary tumour that predict for 5-year clinical outcome?//Annals of Oncology.- 2003.- V.14.- P.406-413.
- Bonnier P., Charpin C., Lejeune C., et al. Inflammatory carcinomas of the breast: a clinical, pathological, or a clinical and pathological definition?// Int J Cancer.- 1995.- V.62(4).- P.382-385.
- Bozzetti F., Saccozzi R., De Lena M., Salvadori B. Inflammatory cancer of the breast: Analysis of 114 cases// J Surg Oncol.- 1981.- V.18.- P.355-361.
- Brandi M., Cataldi A., Di Corato G. et al. Efficacy and influence of neoadjuvant epirubicin/vinorelbine chemotherapy (EN) on molecular markers in inflammatory breast cancer (IBC) and preliminary results of a randomized study testing as adjuvant chemotherapy the same EN-combination versus docetaxel (TXT)//. ASCO Meeting Abstracts.- 2005.-V.- P.886.
- Brenner B., Siris N., Rakowsky E., et al. Prediction of outcome in locally advanced breast cancer by postchemotherapy nodal status and baseline serum tumor markers// Br J Cancer.- 2002.- V.87.- P.1404-1410.
- Bryant T. Desease of the breast// London.- Cassell and Co.- 1887. -P.180.
- Buchanan J.B., Bland K.I., Kuchns J.G. Inflammatory mammary carcinoma// Breast, diseases breast.- 1979.- V.5.- N2.- P.22-26.
- Buzdar A.U., Singletary S.E., Booser J., et al. Combined modality treatment of stage III and inflammatory breast cancer. M.D. Anderson Cancer Center experience// Surg Oncol Clin N Am.-1995.-V.4.-P.715-734.
- Сabioglu N., Gong Y., Islam R. et.al. Expression of growth factor and chemokine receptors: new insights in the biology of inflammatory breast cancer// Ann Oncol.- 2007.- V.18(6).- P.1021-1029.
- Cagnoni P.J., Nieto Y., Shpall E.J., et. al. High-dose chemotherapy with autologous hematopoietic progenitor-cell support as part of combined modality therapy in patients with inflammatory breast cancer//J Clin Oncol. 1998.- V.16(5).- P.1661-1668.
- Camp E. Inflammatory carcinoma of the breast. The case for conservatism//Am-J-Surg.- 1976.- Vol.131.- P.588.
- Cancer management: a multidisciplinary approach. Medical, Surgical and Radiation Oncology. 6th ed.- PRR. Inc. Melville, NY.- 2002.- P.195-213.
- Carbone P.P., Davis T.E. Medical treatment for advanced breast cancer. Semin Oncol.— V.5(4).- P.417-427.
- Cerra R., Ruffolo P., Cremona F. et al. Il carcinoma inflammatorio della mammel- la//Med.Oggi.- 1982.- V.2/- N1.- P.79-87.
- Chang S., Parker S.L., Pham T. et al. Inflammatory breast carcinoma incidence and survival: the surveillance, epidemiology, and end results program of the National Cancer Institute, 1975-1992// Cancer.- 1998.- V.82.- P.2366-2372.
- Chang S., Alderfer J.R., Asmar L., Buzdar A.U. Inflammatory breast cancer survival: the role of obesity and menopausal status at diagnosis// Breast Cancer Res Treat.- 2000.- V.64(2).- P.157-163.
- Charafe-Jauffret E, Tarpin C, Bardou VJ, et al. Immunophenotypic analysis of inflammatory breast cancers: identification of an ‘inflammatory signature’// J Pathol.- 2004.- V.202.- P.265-273.
- Charpin C., Bonnier P., Khouzami A., et al. Inflammatory breast carcinoma: an immuno- histochemical study using monoclonal anti-pHER- 2/neu, pS2, cathepsin, ER and PR// Anticancer Res.- 1992.- V.12.- P.591-597.
- Chauvergne J. Durand M., Hoerni B., et. al. La chimiotherapie d’induction dans les cancers du sein a haut risque. Resultats d’une etude therapeu- tique prospective// Bull. Cancer (Paris).- 1979.- V.66(1).- P.9-16.
- Chauvergne J. Durand M., Dilhuydy M.H., et. al. Traitement des cancers du sein inflammatoires//Sem. Hop. Paris.- 1982.- V.58(32).- P.1813-1819.
- Chersevani R., Tsunoda-Shimizu H., Giuseppetti G.M. et al. Breast In: Ultrasound of superficial structures// Churchill Livingstone.- Ed. by L.Solibani, G. Rizzatto.- 1995.-.P.141-199.
- Chevallier B., Asselain B., Kunlin A. et al. Inflammatory breast cancer. Determination of prognostic factors by univariate and multivariate anal- ysis// Cancer.- 1987.- V.60(4).- P.897-902.
- Chevallier B, Bastit P, Graic Y, et. al. The Centre H. Becquerel studies in inflammatory non metastatic breast cancer: combined modality approach in 178 patients// Br J Cancer.- 1993.- V67.- P.594-601.
- Chevallier B, Roche H, Olivier JP, Chollet P, Hurteloup P: Inflammatory breast cancer. Pilot study of intensive induction chemotherapy (FEC- HD) results in a high histologic response rate.// Am J Clin Oncol.- 1993.- №16.- P.223-228.
- Chin P.L., Andersen J.S., Somlo G. et al. Esthetic reconstruction after mastectomy for inflammatory breast cancer: is it worthwhile?// J Am Coll Surg.- 2000.- 190(3).- P.304-309.
- Chu A.M., Wood W.C., Doucette J.A. Inflammatory breast carcinoma treated by radical radiotherapy// Cancer.- 1980.- V.45.- P.2730-2737.
- Cole M.P., Jones C.T.A., Todd I.D.H. A new antiestrogenic agent in breast cancer. A preliminary appraisal of ICI 46, 474// Br. J. Canc.- 1971.- V.25.- P.270-275.
- Colozza M., Gori S., Mosconi A.M. et al. Induction chemotherapy with cisplatin, doxorubicin, and cyclophosphamide (CAP) in a combined modality approach for locally advanced and inflammatory breast cancer. Long-term results// Am J Clin Oncol.— Feb.- V.19(1).- P.10-17.
- Colpaert C.G., Vermeulen P.B., Be- noy I. et al. Inflammatory breast cancer shows angio- genesis with high endothelial proliferation rate and strong E-cadherin expression// Br J Cancer.- 2003.- V.88.- P.718-725.
- Cooper R. Combination chemotherapy in hormonoresistant breast cancer// Proc AACR. — 1969. — Vol.10. — P. 15.
- Cristofanilli M., Gonzalez-Angulo A.M., Buzdar A.U. et. al. Paclitaxel improves the prognosis in estrogen receptor negative inflammatory breast cancer: the M. D. Anderson Cancer Center experience// Clin Breast Cancer.- 2004.- Feb.- V.4(6).- P.415-419.
- Cristofanilli M., Valero V., Buzdar A.U. et al. Inflammatory breast cancer (IBC): patterns of recurrence and micrometastatic homing// Breast Cancer Res Treat.- 2006.- V.100 (Suppl 1).- P.155.- Abstr 3093.
- Cristofanilli M., Boussen H., Baselga J. et al. A phase II combination study of lapatinib and paclitaxel as a neoadjuvant therapy in patients with newly diagnosed inflammatory breast cancer (IBC)// Breast Cancer Res Treat.- 2006.- V.100 (Suppl 1).- P.5.- Abstr 1.
- Curcio L.D., Rupp E., Williams W.L., et al. Beyond palliative mastectomy in inflammatory breast cancer — a reassessment of margin status// Ann Surg Oncol.- 1999.- V.6.- P.249-254.
- De Boer R.H., Saini A., Johnston S.R., et al. Continuous infusional combination chemotherapy in inflammatory breast cancer: a phase II study// Breast.- 2000.- V.9(3).- P.149-155.
- De Boer R.H., Allum W.H., Ebbs S.R.et al. Multimodality therapy in inflammatory breast cancer: is there a place for surgery?// Ann Oncol.- Sep.- V.11(9).- P.1147-1153.
- Delarue J.C., May-Levin F., Mouries- se H. et al. Oestrogen and progesterone cytosolic receptors in clinically inflammatory tumours of the human breast// Br J Cancer.- 1981.- Dec.- V.44(6).- 911916.
- Dodd L.G. Layfield L.J. Fine-needle aspiration of inflammatory carcinoma of the breast// Diagn Cytopathol.- 1996.- Dec.- V.15(5).- P.363-366.
- Doshi A., Wedam S.B., Thomasson
- M. et al. Dynamic contrast enhanced MRI (DCE- MRI) as a potential predictor of clinical response in patients with inflammatory breast cancer (IBC)// AS- CO Meeting Abstracts.- 2005.- V.23.- P.584.
- Droulias C.A., Sewell G.W., Mc Sweency M.B., Powell R.W. Inflammatory carcinoma of the breast: a correlation of clinical radiologic and pathologic findings// Ann.Surg.- 1976.- Vol.184.- №2.- Р.217-222.
- Ellis D.L., Teitelbaum S.L. Inflammatory carcinoma of the breast. A pathologic definition// Cancer.- 1974.- Apr.- V.33(4).- P.1045-1047.
- Elston C.W., Ellis I.O. Pathological prognostic factors in breast cancer. I. The value of histologic grade in breast cancer: experience from a large study with long-term follow-up.// Histopathology.- 1991.- 19.- P.403-410.
- Failla G., Foti E., Palmeri A. et al. Il carcinoma mammario inflammatorio//G.ital.senol.-1987- V.8.- N3. P.151-161.
- Fastenberg N.A., Martin R.G., Buzdar A.U. et al. Management of inflammatory carcinoma of the breast: a combined modality approach// Am J Clin Oncol.- 1985.- N8.- P.134-141.
- Feldman L.D., Hortobagyi G.N., Buz- dar A.U., Ames F.C. Blumenschein GR. Pathological assessment of response to induction chemotherapy in breast cancer// Cancer Res.- 1986.- V.46.- P.2578- 2581.
- Fields J.N., Perez C.A., Kuske R.R., Fineberg B.B., Bartlett N. Inflammatory carcinoma of the breast: treatment results on 107 patients// Int J Radiat Oncol Biol Phys.- 1989.- V.17.- P.249-255.
- Fisher E.R., Gregorio R. M., Fisher B. Et al. The pathology of invasive breast cancer: a syllabus derived from findings of the National Surgical Adjuvant Breast Project (protocol №4)// Cancer.- 1975.- V.36.- P.1-85.
- Fitts W.T. Inflammatory carcinoma of the breast// Surg Gynecol Obstet.- 1958.- V.107.- P.95-96.
- Fitzgibbons P.L., Page D.L., Weaver D, et. al. Prognostic factors in breast cancer. College of American pathologists consensus statement 1999.//Arch. Pathol. Lab. Med.- 2000.- 124.- P.966-978.
- Fleming R.Y., Asmar L., Buzdar A.U., et al. Effectiveness of mastectomy by response to induction chemotherapy for control in inflammatory breast carcinoma// Ann Surg Oncol.- 1997.- V.4.- P.452-461.
- Garcia S., Dales J.P., Jacquemier J. et al. c-Met overexpression in inflammatory breast carcinomas: automated quantification on tissue microarrays// Br J Cancer.- 2007.- V.96(2).- P.329-335.
- Gardin G., Conte P.F., Campora E., et al. Combined modality approach with primary FAC chemotherapy for inflmmatory breast cancer. Analysis of clinical and pathological variables affecting results// ASCO Proseedings.- 1992.- V.82.- P.153.
- Giordano S.H., Hortobagyi G.N. Inflammatory breast cancer: clinical progress and the main problems that must be addressed// Breast Cancer Res.- 2003.- Vol.5(6).- P.284-288.
- Grace W.R., Cooperman A.M. Inflammatory breast cancer// Surg Clin North Am.-1985. — V.65.- P.151-160.
- Gruber G., Ciriolo M., Altermatt H.J. et al. Prognosis of dermal lymphatic invasion with or without clinical signs of inflammatory breast cancer// Int J Cancer.- 2004.- V.109(1).- P.144-148.
- Gutman F., Albertini J.L., Lerebours F. et al. 18-Fluorodeoxyglucose positron emission tomography in initial diagnosis and staging of inflammatory breast tumors// ASCO Meeting Abstracts.- 2005.- V.23.- P.691.
- Haagensen ^D. Diseases of the Breast, 2nd edition// Philadelphia: WB Saunders.- 1971.- P.576-584.
- Hance KW, Anderson WF, Devesa SS, Young HA, Levine PH. Trends in inflammatory breast carcinoma incidence and survival: the Surveillance, Epidemiology, and End Results Program at the National Cancer Institute.// J Natl Cancer Inst. 2005.— P.966-975.
- Harris E.E., Schultz D., Bertsch H., Fox K., Glick J., Solin L.J: Ten-year outcome after combined modality therapy for inflammatory breast cancer// Int J Radiat Oncol Biol Phys.- 2003.- V.55.- P.1200-1208.
- Henderson M.A. , Mc Bride C.M. Secondary inflammatory breast cancer: treatment options// South Med J.- 1988.- V.81(12).- P.1512-1517.
- Hennessy B.T., Gonzalez-Angulo A.M., Hortobagyi G.N. et al. Disease-free and overall survival after pathologic complete disease remission of cytologically proven in flammatory breast carcinoma axillary lymph node metastases after primary systemic chemotherapy// Cancer.- 2006.- V.106 (5).- P.1000- 1006.
- Huggins C., Bergenstal D.M. Inhibition on human mammary and prostatic cancer by adrenalectomy// Canc. Res.- 1952.- V.12.- P.134-140.
- Hutter R. The influence of pathologic factors on breast cancer management//Cancer.- 1980.- V.46.- N4.- P.961-976.
- Jaiyesimi I.A., Buzdar A.U., Hortobagyi G. Inflammatory breast cancer: a review// J Clin Oncol.- 1992.- V.10.- P.1014-1024.
- Kim T., Lau J., Erban J. Lack of uniform diagnostic criteria for inflammatory breast cancer limits interpretation of treatment outcomes: a systematic review//Clin Breast Cancer.- 2006.- V.7(5).-P.386- 395.
- Kleer C.G., van Golen K.L., Merajver S.D. Molecular biology of breast cancer metastasis. Inflammatory breast cancer: clinical syndrome and molecular determinants// Breast Cancer Res.- 2000.- V.2.- P.423-429.
- Kleer C.G., Zhang Y., Pan Q. etal. WISP3 and RhoC guanosine triphosphatase cooperate in the development of inflammatory breast can- cer//Breast Cancer Res.- 2004.- V.6(2).- P.110-115.
- Kleer C.G., Griffith K.A., Sаbel M.S. et al. RhoC-GTPase is a novel tissue biomarker associated with biologically aggressive carcinomas of the breast// Breast Cancer Res Treat.- 2005.- V.93(2).- P.101-110.
- Kokal W.A., Hill R.L., Porudominisky et al. Inflammatory breast carcinoma: A distinct, entity// J — Surg — Oncol. -1985.-Vol.30.-P. 152-155.
- Kushwaha A.C., Whitman G.J., Stelling C.B. et al. Primary inflammatory carcinoma of the breast: retrospective review of mammographic findings// AJR Am J Roentgenol.- 2000.- V.174(2).- P.535-538.
- Lee B.J., Tannenbaum N.E. Inflammatory carcinoma of the breast: A report of twenty eight cases from the breast clinic of the Memorial Hospital// Surg. Gynecol. Obstet.- 1924- V.39.- P.580- 595.
- Leitch A. Peau d’ orange in acute mammary carcinoma: its cause and diagnostic value// Lancet.- 1909.- V.1.- P.861-863.
- Le MG, Arriagada R., Contesso G. et.al.Dermal lymphatic emboli in inflammatory and noninflammatory breast cancer: a French-Tunisian joint study in 337 patients.// Clin Breast Cancer.-2006- V.6(5).- P. 439-445.
- Lerebours F., Bertheau P., Bieche I. et al. Two prognostic groups of inflammatory breast cancer have distinct genotypes// Clin Cancer Res.- 2003.- V.9.- P.4184-4189.
- Levine P.H., Steinhorn S.C., Ries L.G., Aron J.L. Inflammatory breast cancer: the experience of the surveillance, epidemiology, and end results (SEER)program//J Natl Cancer Inst.- 1985.-V.74(2).- P.291-297.
- Liao Z., Strom E.A., Buzdar A.U. et. al. Locoregional irradiation for inflammatory breast cancer: effectiveness of dose escalation in decreasing recurrence// Int J Radiat Oncol Biol Phys.- 2000.- V.47(5).-P.1191-2000.
- Liauw S.L., Benda R.K., Morris C.G., Mendenhall N.P. Inflammatory breast carcinoma: Outcomes with trimodality therapy for nonmetastatic disease// Cancer.- 2004.- V.100(5).- P.920-928.
- Low J.A., Berman A.W., Steinberg S.M. et al. Long-term follow-up for locally advanced and inflammatory breast cancer patients treated with multimodality therapy// J Clin Oncol.- 2004.- V.22(20).- P.4067-4074.
- Lucas F.V., Perez-Mesa C. Inflammatory carcinoma of the breast// Cancer.- 1978.- V.41(4).- P.1595-1605.
- Luft R., Olivecrona H. Experiences with hypophysectomy in man// J. Neurosurg.- 1953.- V.10.- P.301-316.
- Malhaire J.P., Chevallier B., Barral D. et al. Inflammatory breast cancer: Neo-adjuvant chemotherapy with indesin, adramicin and cyclophosphamide// Neo-adjuvant Chemother.- Proc. 2nd Int. Congr.- Paris 19-21 Febr.- 1988.- Paris.-1988.- P.211-214.
- Maloisel F., Dufour P., Bergerat J.P. et al. Results of initial doxorubicin, 5-fluorouracil and cyclophosphamide combination chemotherapy for inflammatory carcinoma of the breast//Cancer.- 1990- V.65(4).- P.851-855.
- Martinez-Trufero J., de Lobera A.R., Lao J. et al. Serum markers and prognosis in locally advanced breast cancer//Tumori.- 2005.- V.91(6).- P.522-530.
- Marty M., Morvan F., Espie M. et al. Prognostic determinants in inflammatory breast cancer// 14 th International cancer congress Budapest.- August 21-27.- 1986.- Abstractsss of Lectires, Symposia and Tree Communications .- V.1.- P.1678.
- Mauriac L., Vafflart J., Trojani M., Durand M. Les cancers du sein inflammatoires correlation entre anatomopathologie et dosage des re- cepteurs steroidiens// Bull Cancer. — 1983. — Vol.70. — №3. — P. 160-164.
- May-Levin F. Hormones et glandes mammal res// Rev. frans. endocrinol., din., nutr. et metabol. — 1976. — Vol.19. — №5. — P. 423-431.
- McCarthy N.J., Yang X., Linnoila I.R., et al. Microvessel density, expression of estrogen receptor alpha, MIB-1, p53, and c-erbB-2 in inflammatory breast cancer// Clin Cancer Res.- 2002.- V.8.- P.3857-3862.
- McGuire W.L., Carbone P.N., Volmer
- P. Estrogen receptors in breast cancer// New York.-Raven Press.- 1975.- Р.232.
- Mendelson E.B., Bragwanani D.G., Bohm-Velez M. Imaging the breast treated by segmental mastectomy and irradiation. In Recent results in cancer research// Springer-Verlag Berlin Heidelberg.- 1990.- Vol.119. — P.175-192.
- Mercel A.C, Sener S.F., Ragin A. et al. Prognostic studies in inflammatory breast cancer// ASCO.- Proceedings.- 1992.- V.89.- P.189.
- Meyer A.C., Dockeerty M.B., Harrington S.W. Inflammatory carcinoma of the breast// Surg Gynecol Obstet.- 1948.- V.87.- P.417-424.
- Miller AB, Hoogstraten B, Staquet M, Winkler A. Reporting results of cancer treatment.- Cancer.- 1981.- 47.- P. 207-214.
- Mogavero G.T., Fishman E.K., Kuhlman J.E. Inflammatory breast cancer: CT evaluation// Clin Imaging.- 1992.- V.16(3).- P.183-186.
- Morris D.M. Mastectomy in the management of patients with inflammatory breast cancer// J. Surg. Oncol. -1983.- V.23.-N4.- P.255-258
- Mourali N., Tabbane F., Muenz L.R., et al. Ten-year results utilizing chemotherapy as primary treatment in nonmetastatic, rapidly progressing breast cancer// Cancer Invest.- 1993.- V.11.- P.363- 370.
- Mustacchi G., Milani S., Saudri P. et al. Trattamento in tegrato dei tumori mammari localmente avanzati// Cital. Oncol. — 1984- Vol.4.- №2.- P. 95-102.
- Nakhlis F., Duggan M.,. Golshan M., and Levin E. Preclinical breast MRI findings in inflammatory breast carcinoma// ASCO Meeting Abstracts.- 2005.- V.23.- P.899.
- Nisce L.Z., Poussin-Rosillo H., Kim J.H. et al. Subtotal-skin electron-beam therapy once a week for inflammatory breast carcinoma// Radiology.-1979- V.130(2).- P.761-764.
- Nishimura R., et al. A case control study on risk factors involved in inflammatory breast recurrence after breast-conserving surgery// Oncology.- 1998.- 55(5). — P. 391-399.
- Noguchi S., Miyauchi K., Nishizawa Y., et al. Management of inflammatory carcinoma of the breast with combined modality therapy including intraarterial infusion chemotherapy as an induction therapy. Long-term follow-up results of 28 patients// Cancer.- 1988.- V.61(8).- P.1483-1491.
- Nussbaum H., Kagan A.R. “Management of inflammatory breast carcinoma” Breast// Dis.Breast,-1977.- V.3.- P.25-28.
- Palangie T., Mosseri V., Mihura J., et al. Prognostic factors in inflammatory breast cancer and therapeutic implications// Eur J Cancer.- 1994.- V.7.- P.921-927.
- Panades M., Olivotto I.A., Speers CH. et al. Evolving treatment strategies for inflammatory breast cancer: A population based survival analysis// J Clin Oncol.- 2005.- V.23 (9).- P.1941-1950.
- Paradiso A., Tommasi S., Brandi M., et al. Cell kinetics and hormonal receptor status in inflammatory breast carcinoma. Comparison with locally advanced disease// Cancer.- 1989.- V.64.- P.1922-1927.
- Pearlman N.W., Guerra O., Fracchia A.A. Primary inoperable cancer of the breast// Surg Gynecol Obstet.- 1976.- V.143.- P.909-913.
- Perez C.A., Fields J.N., Fracasso P.M., et. al. Management of locally advanced carcinoma of the breast. II. Inflammatory carcinoma// Cancer.- 1994.- V.74.- P.466-476.
- Pisansky TM, Schaid DJ, Loprinzi CL, et. al. Inflammatory breast cancer: integration of irradiation, surgery, and chemotherapy.// Am J Clin Oncol. 1992.- V.15.- P.376-387.
- Pollak E.W., Getzen L.C. Inflammatory carcinoma of the breast: a therapeutic approach followed by improved survival.//Am.J.Surg.-1978- V.136.- №6.- P. 722-725,
- Poussin-Rosillo H., Kim J.H., Kelly C., Chu F.C. Subtotal skin electron beam therapy once a week for inflammatory breast carcinoma// Radiology.-1979- V.130(3).- P.761-764.
- Prost S., Le M.G., Douc-Rasy S., et al. Association of c-erbB2-gene amplification with poor prognosis in non-inflammatory breast carcinomas but not in carcinomas of the inflammatory type// Int J Cancer.- 1994.- V.58.- P.763-768.
- Resetkova E, Gonzalez-Angulo AM, Sneige N, et al. Prognostic value of P53, MDM-2, and MUC-1 for patients with inflammatory breast carcinoma.// Cancer.- 2004.- 101.- P.913-917.
- Robbins G.F., Shan J., Rosen P. et al. Inflammatory carcinoma of the breast//Surg. Clin.North.Am.-1974.- V.54.- N4.- P.801-810.
- Rogers C.S., Fitts W.T. Inflammatory carcinoma of the breast, a critique of therapy// Surgery.- 1956.- V.39.- P.367-370.
- Rouesse J., Friedman S., Sarrazin D. et al. Primary chemotherapy in the treatment of inflammatory breast carcinoma: A study of 230 cases from the Institut Gustave-Roussy// J Clin Oncol.-2005- V.4.- P.1765-1771.
- Rouesse J., Friedman S., Mouriesse, Sarrazin D., Spielmann M. Therapeutic strategies in inflammatory breast carcinoma based on prognostic factors// Breast Cancer Res Treat.- 1990.- V.16.- P.15-22.
- Rousseau C., Devillers A., Sagan C., et al. Monitoring of early response to neoadjuvant chemotherapy in stage II and III breast cancer by {18F}Flourodeoxyglucose positron emission tomography// J Clin Oncol.- 2006.- V.24.- P.5366-5372.
- Saltzstein S.L. Clinicalli occult inflammatory carcinoma of the breast// Cancer.- 1974.- V.34(2).- P.382-388.
- Sarrazin D., Le M., Mouriesse H. et al. Radiotherapeutic Studies on Breast Cancer at Villejuif//Cancer Bull. -1982.- V.34.- N.6.- P.2242-249.
- Sawaki M., Ito Y., Akiyama F. et al. High prevalence of Her-2/neu and p53 overexpression in inflammatory breast cancer// Breast Cancer.- 2006.- V.13(2).- P.172-178.
- Schwartzberg L.S., Weaver C.H., Lewkow L. et al. High-dose chemotherapy with peripheral blood stem cell support for stage IIIB inflammatory carcinoma of the breast// Bone Marrow Transplant.- 1999.- V.24.- P.981-987.
- Shao Z., Liu G., Ding J. Establishment and characterization of human inflammatory breast carcinoma neoplasm transplantation in nude mice// Zhonghu Wai Ke Za Zhi.- 2001.- V.39(10).- P.796- 798.
- Sherry M.M., Johnson D.H., Page D.L. et al. Inflammatory carcinoma of the breast. Clinical review and summary of the Vanderbilt experience with multi-modality therapy//Amer. J.med.-1985.- V.79.- N3.- P.355-364.
- Shirakawa K., Tsuda H., Heike Y., et al. Absence of endothelial cells, central necrosis, and fibrosis are associated with aggressive inflammatory breast cancer// Cancer Res.- 2001.- V.61.- P.445-451.
- Silvera D., Formenti S.C., Schneider R.J. et.al. Over-expression of initiation factor eIF4G typifies inflammatory breast cancer and is crucial for tumor growth, VEGF expression and angiogene- sis//Breast Cancer Res Treat.- 2006.- V.100(1).- P.168.
- Smoot R.L, Koch C.A., Degnim A.C. et.al. A single-center experience with inflammatory breast cancer, 1985-2003.// Arch Surg.- 2006.- №141.- P.567-573.
- Somlo G., Frankel P., Chow W., et al. Prognostic indicators and survival in patients with stage IIIB inflammatory breast carcinoma after dose- intense chemotherapy// J Clin Oncol.- 2004.- N22.- P.1839-1848.
- Stocks L.H., Patterson Simmons. Inflammatory carcinoma of the breast//Surg.Gynecol.Obstet.- 1976.- V.143.- N6.- P.885-889.
- Szepesi T., Stadler B. Rolle der Strahlentherapie bei inflammatorischen Lokalrezidiven des Mammakarzinoms: erste Erfahrungen mit Kombinierten Radio-Chemotherapie//Strahnlentherapie. -1983.- V.59.- N12.- S.725-731.
- Tabei T., Sato K., Inoue K, et al. Mul- ticenter, prospective study of radiotherapy without surgery after AC followed by weekly paclitaxel for patients with inflammatory breast cancer: SBCCSG-04 study// ASCO Meeting Abstracts.- 2006.- V.24.- P.10783.
- Tai P., Yu E., Shiels R. et al. Short- and long-term cause-specific survival of patients with inflammatory breast cancer//BMC Cancer.- 2005.- №5.- P.137.
- Takatsuka Y., Gofuku J., Katoh T. et al. A case of inflammatory breast cancer successfully treated with intra-arterial infusion of high-dose epirubi- cin// Gan To Kagaku Ryoho.- 1991.- V.18(8).- P.1363- 1366.
- Talbane F., Bahi J., Rahal K. et al. Inflammatory symptoms in breast cancer. Correlations with growth rate, clinicopathologic variables and evo- lution//Cancer.- 1989.- V.64.- P.2081-2089.
- Tardivon A.A., Viala J., Corvellec Rudelli A. et al. Mammographic patterns of inflammatory breast carcinoma: a retrospective study of 92 cases// Eur J Radiol.- 1997.- V.24(2).- V.124-130.
- Taylor G.W., Meltzer А. Inflammatory carcinoma of the breast//Am J Cancer.- 1938.- V.33.- P.33-49.
- Thomas F., Arriagada R., Spielmann M. et al. Pattern of failure in patients with inflammatory breast cancer treated by alternating radiotherapy and chemotherapy//Cancer.- 1995.- V.76(11).- P.2286- 2290.
- Thoms W.Jr., McNeese M.D., Fletcher G.H. et al. Multimodal treatment for inflammatory breast cancer// Int J Radiat Oncol Biol Phys.- 1989.- V.17(4).- P.739-745.
- Tomlinson J.S., Alpaugh M.L., Barsky S.H. An intact overexpressed E-cadherin/alpha,beta- catenin axis characterizes the lymphovascular emboli of inflammatory breast carcinoma// Cancer Res.-2001- V.61(13).- P.523-541.
- Torres Trujillo R., De la Huerta, Sanchez R., De la Garza T., Salasar J. New therapeutic focus in inflammatory carcinoma of the breast// Gineco — Obstet — Mex. — 1979. — Vol.45. — P. 111-126.
- Treurniet-Donker A.D., Hop W.S., Ho- ed-Sijtsema S. Den. Radiation treatment of stage III mammary carcinoma: a review of 129 patients// Int. J. Radiat. Oncol. Biol. Phys.- 1980.- V.6.-N11.- P.1477- 1482.
- Treves N. The inoperability of inflammatory carcinoma of the breast// Surg Gynecol Obstet.- 1959.- V.109.- P.240-242.
- Tseng M.T., Kuhns J.G., Moore D.C., Wittliff J.L. Ultastructural evaluation of inflammatory carcinoma of the breast//South. Med.J.-1980.-Vol.73.- №9.- P.1189-1193
- Turpin E., Bieche I., P;assa L.F. et al.Increased incidence of ERBB2 overexpression and TP53 mutation in inflammatory breast cancer// Oncogene.- 2002.- V.21.- P.7593-7597,
- Tursz T., Spielmann M., Chevalier T. Et al. Prognostic factors in 332 inflammatory breast cancer patients. A 20 year experience at the institut Gustave-Roussy// ASCO, Proseedings, V.10.- P.1991.
- Ueno N.T., Buzdar A.U., Singletary S.E., et al. Combined-modality treatment of inflammatory breast carcinoma: twenty years of experience at M.D. Anderson Cancer Center// Cancer Chemother Pharmacol.- 1997.- V.40.- P.321-329.
- Vaeth J.M., Clark J.C., Green J.P. Radiotherapeutic management of locally advanced carcinoma of the breast// Cancer.-1972.- V.1.- P.107.
- Vaeth J.M. Inflammatory carcinoma of the breast// Handb. Med. Radiol. Bd. 19, T. 2, Berlin e.a.-1982.- P.441-447.
- Van den Eynden G.G., Van der Au- wera I., Van Laere S. et al.: Validation of a tissue microarray to study differential protein expression in inflammatory and non-inflammatory breast cancer// Breast Cancer Res Treat.- 2004.- V.85.- P.13-22.
- Van der Auwera I., Benoy I., Elst H. et al. Quantitative study of the angiogenic profile of inflammatory and noninflammatory breast cancer using real-time RT-PCR (abstract)// Breast Cancer Res Treat.- 2003.- V.82.- P.135.
- Van der Auwera I., Van Laere S.J., Van den Eynden G.G. et.al. Increased angiogenesis and lymphangiogenesis in inflammatory versus noninflammatory breast cancer by real-time reverse tran- scriptase-PCR gene expression quantification// Clin Cancer Res.- 2004.- V.23 (10).- P.7965-7971.
- Van der Auwera I., Van den Eynden G.G., Colpaert C.G. et al. Tumor lymphangiogenesis in inflammatory breast carcinoma: a histomorphomet- ric study// Clin Cancer Res.- 2005.- V.11 (21).- P.7637- 7642.
- Van Golen K.L., Davies S., Wu Z.F., Wang Y. et.al. A novel putative low-affinity insulin-like growth factor-binding protein, LIBC (lost in inflammatory breast cancer), and RhoC GTPase correlate with the inflammatory breast cancer phenotype// Clin Cancer Res.- 1999.- V.5.-P.2511-2519.
- Van Golen K.L., Wu Z.F., Qiao X.T. et al. RhoC GTPase, a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer phenotype// Cancer Res.- 2000.- 60.- P.5832-5838.
- Van Laere S., Van der Auwera I., Van den Eynden G et al. Distinct molecular signature of inflammatory breast cancer by cDNA microarray analysis// Breast Cancer Res Treat.- 2005.- V.93.- P.237- 246.
- Vanlemmens L., Desauw C., Bel- kacemi Y. et al. Inflammatory breast cancer (IBC): A retrospective analysis of 239 patients treated in a single institution// ASCO Meeting Abstracts.- 2005.- V.23.- P.763.
- Veyret C., Levy C., Chollet P et al. Inflammatory breast cancer outcome with epirubicin- based induction and maintenance chemotherapy: ten- year results from the French Adjuvant Study Group GETIS 02 Trial// Cancer.- 2006.- V.107(11).- P.2535- 2544.
- Wagnerova M., Andrasina I., Sokol L. et. al. Efficacy, tolerance and immunohistological analysis (IHA) in the group of 52 patients in inflammatory stage IIIB breast cancer (IBC) treated with F-FEC regimen// ASCO Meeting Abstracts.- 2005.- V.23.- P.840.
- Wang C.C., Griscom M.T. Inflammatory carcinoma of the breast: results following orthovoltage and super voltage radiation therapy// Clin Radiol.- 1964.- V.15.- V.168-174.
- Wang C.C. Management of inflammatory carcinoma of the breast// Int J Radiat Oncol Biol Phys.- 1978.- V.4(7-8).- P.709-710.
- Wilke D., Colwell B., Dewar R. Inflammatory breast carcinoma: comparison of survival of those diagnosed clinically, pathologically, or with both features// Am Surg.- 1998.- V.64(5).- P.428-431.
- Wingo P.A., Patricia M.J., Young J.L., Gargiullo P. Population-based statistics for woman diagnosed with inflammatory breast cancer (United States)// Cancer Causes and Control.- 2004. — N15.- P.321-328.
- Yang W.T., Le-Petross H.T., Macapin- lac H. et al. Inflammatory breast cancer: PET/CT, MRI, mammography, and sonography findings// Breast Cancer Res Treat.- 2007. Electronic online version.
- Yasumura K., Ogawa K., Ishikawa H., et al. Inflammatory Carcinoma of the Breast: Characteristic Findings of MR Imaging//Breast Cancer.— V.4(3).- P.161-169.
- Zylberberg B., Salat-Baroux J., Ravina J.H. et al. Initial chemoimmunotherapy in inflammatory carcinoma of the breast// Cancer.- 1982.- V.49(8).- P.1537-43.







Комментировать