А.В. Бунин, Е.С. Жолобова, М.Н. Николаева, Кафедра детских болезней ГБОУ ВПО УДКБ Первый МГМУ им И.М. Сеченова МЗ РФ, Москва, РФ
Проведен анализ эффективности этанерцепта у больных с рефрактерным течением ювенильного спондилоартрита (ЮСА). Генно-инженерная биологическая терапия растворимым рецептором к фактору некроза опухоли α (этанерцепт) была использована у 13 детей с ЮСА с неэффективностью предшествующей терапии базисными противоревматическими препаратами. Результат терапии оценивали спустя 12 месяцев. Значительное снижение активности заболевания, соответствующее ACRpedi50, наблюдалось у 85% детей, улучшение ACRpedi70 — у 54%, ремиссия (ACRpedi90) достигнута у 15%, что свидетельствует о высокой эффективности препарата для лечения больных с длительным течением рефрактерного ЮСА.
Ключевые слова: ювенильный анкилозирующий спондилоартрит, дети, рефрактерное течение заболевания, генно-инженерная биологическая терапия, этанерцепт, эффективность лечения.
Ювенильный спондилоартрит (ЮСА) — хроническое системное воспалительное заболевание, приводящее к поражению периферических суставов, сухожильно-связочного аппарата и позвоночника, часто начинающееся преимущественно у мальчиков до 15-летнего возраста [1, 2].
ЮСА относится к группе серонегативных спондилоартритов (ССА). Для него характерна семейная агрегация. Подтверждена ассоциация заболевания с антигеном гистосовместимости HLA B27. В настоящее время классификация ЮСА несовершенна. По клиническим проявлениям, лабораторным данным ЮСА может быть отнесен к энтезитному варианту ювенильного идиопатического артрита (ЮИА) по Дурбанской классификации 1997 г. (ILAR), ювенильному анкилозирующему спондилиту (ЮАС) по классификации Гармиш-Партенкирхен (1987 г.). Также ЮСА попадает в критерии периферической формы спондилоартритов по классификационным критериям ASAS. Во всех этих классификациях и классификационных критериях заболевание описывают как хроническое воспалительное, чаще встречающееся у мальчиков, связанное с антигеном гистосовместимости HLA B27. Оно характеризуется поражением крестцово-подвздошных сочленений, периферических суставов, сухожильно-связочного аппарата, проявляется болью в спине, артритами, наличием энтезитов [1-4].
До настоящего времени «золотым» стандартом диагностики ЮСА является рентгенологически подтвержденное поражение крестцово-подвздошных сочленений или подтвержденное с помощью МРТ в режиме подавления жира поражение крестцово-подвздошных суставов с наличием деструктивно-пролиферативных изменений. Наличие I рентгенологической стадии и/ или внутрикостного отека по данным МРТ при наличии соответствующей клинической картины позволяет отнести пациентов со спондилоар-тритом к группе риска ЮАС [4, 5].
Таким образом, несмотря на то, что речь идет об одном заболевании, его именование в разных классификациях и на разных этапах развития может звучать по-разному. Ребенок с диагностированным вначале энтезитным вариантом ЮИА при присоединении поражения крестцово-подвздошных сочленений может перейти в категорию ЮАС [3, 6, 7].
Рентгенологическая диагностика на ранних стадиях малоинформативна, так как осевой рост подростков продолжается и анкилозирование межпозвоночных суставов не может быть отмечено [5]. Лабораторная диагностика не является специфичной, так как изменения в основном касаются общевоспалительных показателей. Кроме того, при ЮСА в ряде случаев отмечается отсутствие корреляции между клинической и лабораторной активностью. Иммунологическая диагностика в детском возрасте также малоинформативна (поскольку у большинства больных с разными вариантами ЮИА ревматоидный фактор и антинуклеарный фактор отсутствуют) [7].
Лечение ЮСА состоит из нескольких последовательных этапов. В дебюте заболевания, когда еще нет возможности с уверенностью отнести процесс к группе СА, используется симптоматическая терапия, включающая нестероидные противовоспалительные препараты (НПВП), пульс-терапию глюкокортикоидами (ГК), внутрисуставное введение ГК, местную терапию.
При наличии суставного синдрома, высокой активности заболевания, рентгенологических изменений рекомендуется назначение базисной терапии (сульфасалазин в дозировке 30-40 мг/ кг, метотрексат 10-15 мг/м2, реже комбинация сульфасалазина 30-40 мг/кг с метотрексатом 10-15 мг/м2) [1, 3].
При отсутствии эффекта базисной терапии в течение 6 месяцев, сохраняющейся высокой клинико-лабораторной активности, нарастании рентгенологических изменений показано подключение генно-инженерной биологической терапии (ГИБТ). Препаратами выбора являются ингибиторы фактора некроза опухоли α (ФНОα). К ним относят моноклональные антитела, как химерные (инфликсимаб), так и рекомбинантные (адалимумаб), а также растворимые рецепторы к ФНОα (этанерцепт) [1-3, 8-11].
Целью настоящей работы явилось определение эффективности этанерцепта у детей с активным течением ЮСА, не поддающегося коррекции стандартной противоревматической терапии.
Материалы и методы исследования
Диагноз ЮСА выставляли на основании диагностических критериев Гармиш-Партенкирхен (1987):
Основные критерии:
1) асимметричный олигоартрит, с вовлечением тазобедренного, коленного или голеностопного суставов;
2) энтезопатии;
3) боли в поясничном отделе позвоночника или крестцово-подвздошной области;
4) острый иридоциклит;
Дополнительные критерии:
1) периферический артрит более 5 суставов;
2) мужской пол;
3) возраст начала заболевания старше 6 лет;
4) наличие HLA В27-антигена;
5) семейная агрегация заболеваний из группы ССА.
Вероятному ЮАС соответствуют 2 основных критерия или 1-2 основных + 2 дополнительных критерия; достоверному ЮАС соответствуют те же критерии + рентгенологически достоверный сакроилеит (двусторонний сакроилеит II стадии или односторонний сакроилеит не менее чем III стадии).
Все пациенты также соответствовали диагностическим критериям периферической формы СА в соответствии с классификационными критериями ASAS и энтезитному варианту ЮИА в соответствии с классификацией ILAR.
Назначение этанерцепта в дозировке 0,4 мг/ кг 2 раза в неделю или 0,8 мг/кг 1 раз в неделю подкожно проводилось в случае неэффективности базисной терапии как минимум в течение 6 мес. Эффект оценивали через 12 мес, так как ряд больных из отдаленных мест проживания повторно госпитализировались только через 12 мес.
Исходно и через 12 мес от начала терапии этанерцептом оценивали продолжительность утренней скованности, степень выраженности болевого синдрома в спине с помощью визуально-аналоговой шкалы боли (ВАШ). Определяли количество активных суставов, подвижность позвоночника в грудном (проба Отта) и шейном отделах (проба Шобера), общую подвижность позвоночника (проба Томайера), наличие энтезитов. Оценивали также динамику концентрации С-реактивного белка (СРБ, мг/дл), скорость оседания эритроцитов (СОЭ, мм/ч, по Панченко). До назначения терапии этанерцептом оценивали рентгенологическую стадию поражения периферических суставов и крестцово-подвздошных сочленений на основании МРТ с подавлением жира (при необходимости с контрастированием).
Суммарную оценку эффективности проводили в соответствии с критериями ACRpedi, которые включают 6 показателей:
1) число суставов с признаками активности (из 75 суставов);
2) число суставов с ограничением функции (из 75 суставов);
3) значение СОЭ и/или СРБ;
4) общая оценка активности болезни по мнению врача (ВАШ);
5) оценка общего состояния здоровья ребенка (активности болезни) по мнению пациента или его родителя (ВАШ);
6) оценка функциональной способности с помощью опросника по оценке общего состояния здоровья для педиатрических пациентов (Childhood Health Assesment Quesionnare — CHAQ).
Основным критерием эффективности лечения считали достижение как минимум 50% (ACRpedi50) улучшения по критериям Американской коллегии ревматологов. Под 50% улучшением понимали улучшение по сравнению с исходным состоянием минимум на 50% не менее чем по 3 из 6 показателей с ухудшением более 30% не более 1 из 6 показателей. ACRpedi70 ответ — улучшение на 70% не менее чем по 3 из 6 критериев с ухудшением более 30% не более чем по одному критерию соответственно. Аналогичные расчеты использовали для остальных ответов по ACRpedi. При достижении ACRpedi30 эффект оценивали как удовлетворительный, ACRpedi50 — как хороший, ACRpedi70 — как отличный, ACRpedi90, 100 — медикаментозная клинико-лабораторная ремиссия и/или статус неактивной болезни.
В данное исследование были включены 13 детей с диагнозом ЮСА.
Результаты и их обсуждение
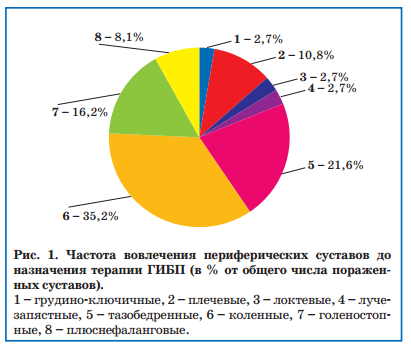
Как видно из табл. 1, преобладали мальчики подросткового возраста, средний возраст на момент начала заболевания составил 11,4±3,45 лет, длительность заболевания до назначения ГИБТ составила 6,03±4,1 лет, HLA В27-позитивных было 77,78% (7 из 9 обследованных).
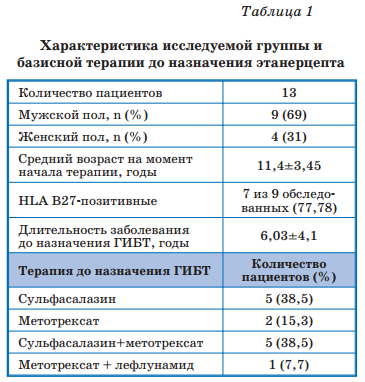
Распределение пораженных периферических суставов у пациентов представлено на рис. 1.
Полученные данные подтверждают, что при ЮСА чаще страдают суставы нижних конечностей (81,1% от общего числа). Возможно, это связано с тем, что при ЮСА в остром периоде часто отмечается нарушение походки, обусловленное поражением тазобедренных и крестцово-подвздошных суставов. В результате меняется нагрузка на поясничный отдел позвоночника и нижние конечности, что служит дополнительным травмирующим и болепровоцирующим фактором.
Характеристика исследуемой группы и базисной терапии до назначения этанерцепта
В табл. 2 представлены данные физикального обследования, оценки уровня болевого синдрома самим пациентом с помощью ВАШ, продолжительности утренней скованности.
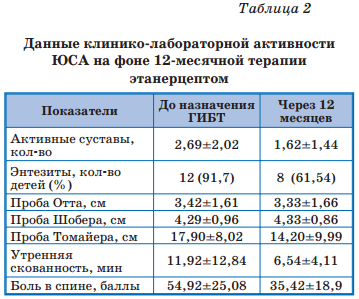
Из табл. 2 видно, что у большинства пациентов суставной синдром был представлен олигоартритом, часто отмечались боли в спине, энтезопатии, в то время как подвижность грудного и поясничного отделов позвоночника была нарушена умеренно, а ограничение общей его подвижности больше было связано с болевым синдромом. Через 12 месяцев после назначения ГИБТ количество активных суставов снизилось на 40%, количество выявляемых энтезитов — на 33%. Пробы подвижности грудного и поясничного отделов позвоночника существенно не изменились, значение пальцеполовой пробы снизилось недостоверно (p>0,05).
В табл. 3 представлены данные лабораторного исследования крови (СОЭ и СРБ как идентификаторов активности системного воспалительного процесса) и их динамика на фоне терапии.
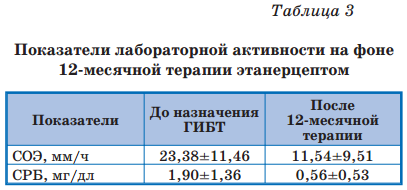
До назначения ГИБП СОЭ была увеличена практически у всех детей, изменения уровня СРБ отмечались чуть реже. Через 12 месяцев лечения этанерцептом средний уровень СОЭ снизился на 51%, уровень СРБ — на 70%, что свидетельствует о снижении иммунологической активности заболевания.
Данные рентгенологического исследования тазобедренных суставов представлены в табл. 4.
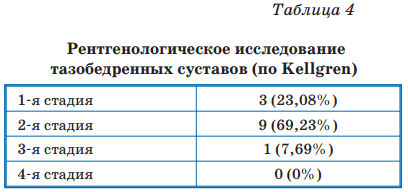
При проведении рентгенологического исследования выявлено поражение тазобедренных суставов у всех (100%) детей. У 3 (23,08%) поражение соответствовало 1-й стадии, у 9 (69,23%) — 2-й стадии и у одного (7,69%) — 3-й стадии. Анкилоз, соответствующий 4-й стадии, не был отмечен ни в одном случае.
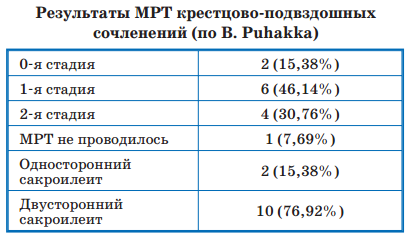
Как показывают данные табл. 5, наличие МРТ-подтвержденного сакроилеита 1-й стадии и выше зафиксировано у 10 из 12 обследованных пациентов. У 2 детей (15,38%) наблюдался односторонний сакроилеит, у 10 детей (76,92%) сакроилеит был двусторонним.
Таким образом, в группе ЮСА преобладали мальчики с длительным течением заболевания, высокой клинической и лабораторной активностью.
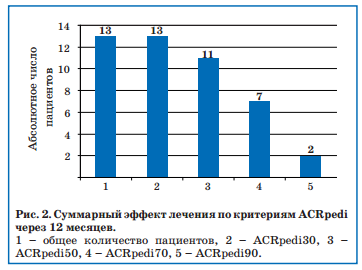
На рис. 2 отображена эффективность терапевтического действия этанерцепта спустя 12 месяцев с момента его назначения пациентам. Все 13 детей достигли ACRpedi30 (удовлетворительная эффективность по критериям ACRpedi), 11 детей (85%) — ACRpedi50 (хорошая эффективность), 7 детей (54%) — ACRpedi70 (отличная эффективность) и 2 ребенка (15%) — ACR90 (клинико-лабораторная ремиссия).
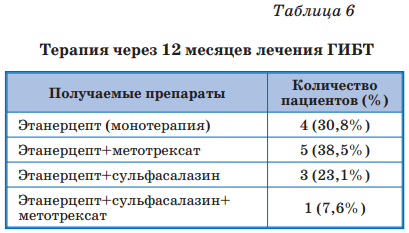
Как видно из табл. 6, у 4 из 13 пациентов (30,8%) лечение этанерцептом позволило полностью отменить прием базисной терапии. Кроме того, лечение этанерцептом позволило отменить прием НПВС у 60% пациентов (10 человек получали НПВС до назначения ГИБТ и лишь 4 — после 12-месячного курса этанерцепта).
Вопрос о возможности отмены НПВС при ЮСА является дискутабельным, поскольку при АС взрослых доказано, что длительный непрерывный прием НПВС тормозит развитие синдесмофитов. При ЮСА преобладают периферический суставной синдром, а поражение позвоночника отсрочено на годы и даже десятилетия.
Вопрос о необходимости постоянного использования НПВС будет решен в дальнейших рандомизированных исследованиях [12, 13].
Если сравнить результаты нашего исследования с результатом открытого исследования эффективности и безопасности этанерцепта при распространенном олигоартикулярном ЮИА, артрите, связанном с энтезитом, и псориатическом артрите часть 1 (12 недель) исследования CLIPPER, то можно отметить совпадение по достижению хорошей эффективности по критериям ACRpedi [14]. В отличие от исследования CLIPPER, где средняя продолжительность заболевания до начала исследования составляло чуть более 1,5 лет, в нашем исследовании от дебюта заболевания до момента назначения этанерцепта пациентам с ЮСА проходило около 6 лет. Полученные результаты свидетельствуют об эффективности этанерцепта, как при раннем, так и при позднем его назначении, у больных с длительным течением рефрактерного ЮСА.
Случаев развития туберкулеза, тяжелых инфекционных осложнений, потребовавших отмены терапии, индивидуальной непереносимости и острых аллергических реакций отмечено не было.
Выводы
- Этанерцепт показал хорошую эффективность при рефрактерном течении ЮСА: у 100% пациентов достигнуто улучшение, соответствующее ACRpedi30, у 85% пациентов — ACRpedi50.
- К 12 месяцам терапии этанерцептом ремиссия ЮСА достигнута у 15% детей.
- Полученные результаты свидетельствуют о высокой эффективности препарата для лечения больных с длительным течением рефрактерного ЮСА.
Литература
- Жолобова Е.С., Шахбазян И.Е., Улыбина О.В. и др. Ювенильный ревматоидный артрит: Руководство по детской ревматологии. Н.А. Геппе, Н.С. Подчерняева, Г.А. Лыскина, ред. М.: ГЭОТАР, 2011: 162-245.
- Жолобова Е.С., Конопелько О.Ю., Бунин А.В. и др. Инфликсимаб в практике лечения больных с активным ювенильным артритом. Вопросы современной педиатрии. 2012; 11 (3): 120-125.
- Бобылева В.Н., Жолобова Е.С., Дагбаева Д.В. Исторический и современный взгляд на ювенильный анкилозирующий спондилоартрит. ДокторРу. 2013; 9 (87): 40-44.
- Бунин А.В., Жолобова Е.С., Перепелова Е.М. и др. Сложный случай артериовенозной мальформации спинного мозга под маской ювенильного анкилозирующего спондилоартрита. Лечащий врач.2012; 4: 32-35.
- Puhakka KB, Jurik AG, Egund N, et al. Imaging of sacroiliitis in early seronegative spondy loarthropath. Assessment of abnormalities by MR in comparison with radiography and CT. Act. Radiol. 2003; 44 (2): 218-229.
- Чебышева С.Н., Мелешкина А.В., Жолобова Е.С. Дифференциальная диагностика суставного синдрома при ювенильных артритах. Лечащий врач. 2013; 6: 10-15.
- Rudwaleit M, D van der Heijde, Khan MA, et al. How to diagnose axial spondyloarthritis early. Ann. Rheum. Dis. 2004; 63: 535-543.
- Козлова АЛ., Алексеева Е.И., Валиева С.И. и др. Эффективность инфликсимаба у больных ювенильным анкилозирующим спондилоартритом. Вопросы современной педиатрии. 2009; 8 (2): 20-26.
- Liu YF, Dong H, Tu SH, et al. Etanercept in the treatment of ankylosing spondylitis: A systematic review and meta-analysis. Exp. Ther. Med. 2014; 8 (5): 1585-1592.
- Baji P, Pentek M, Szan^ S, et al. Comparative efficacy and safety of biosimilar infliximab and other biological treatments in ankylosing spondylitis: systematic literature review and meta-analysis. Eur. J. Health Econ. 2014; 15 (Suppl. 1): S45-52.
- Никишина И.П. Этанерцепт в лечении ювенильных артритов: от опыта клинических исследований до клинической практики. Русский медицинский журнал. 2010; 27: 1686-1691.
- Wanders A, Heijde Dv, Landewе R, et al. Nonsteroidal anti inflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum. 2005; 52 (6): 1756-1765.
- Wanders AJ, Gorman JD, Davis JC, et al. Responsiveness and discriminative capacity of the assessments in ankylosing spondylitis disease-controlling antirheumatic therapy core set and other outcome measures in a trial of etanercept in ankylosing spondylitis. Arthritis Rheum. 2004; 51 (1): 1-8.
- Horneff G, Burgos-Vargas R, Constantin T, еt al. EULAR 2012. Efficacy and safety of open-label etanercept on extended oligoarticular juvenile idiopathic arthritis, enthesitis-related arthritis and psoriatic arthritis: part 1 (week 12) of the CLIPPER study. ARD. 2012; 71 (Suppl. 3): 705.








Комментировать