Остеопороз. Хроническая болезнь почек – распространенность, клиническая картина, факторы риска, диагностика.
Н.В. Карлович, Т.В. Мохорт
РЦ медицинской реабилитации и бальнеолечения, Белорусский государственный медицинский университет
Согласно определению ВОЗ, остеопороз системное метаболическое заболевание скелета, для которого характерны снижение костной массы и нарушения микроархитектоники костной ткани, что приводит к повышению хрупкости кости и предрасполагает к переломам. Остеопороз — чрезвычайно распространенное заболевание, особенно среди женщин в период постменопаузы. Выделяют множество причин развития остеопороза, что наглядно демонстрирует общепринятая классификация. Различают первичный и вторичный остеопороз в зависимости от наличия или отсутствия связи с каким-либо заболеванием, операцией или приемом лекарственных препаратов, которые могут снижать костную массу. Первичный остеопороз составляет до 85% всех случаев заболевания. Классическое его проявление — постменопаузальный остеопороз. Среди причин вторичного остеопороза 8 групп заболеваний, одно из которых — хроническая почечная недостаточность, или, как принято ее называть в настоящее время, хроническая болезнь почек (ХБП).
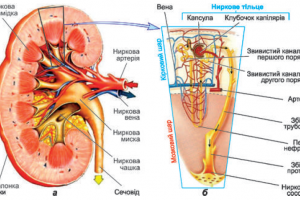
Хроническая болезнь почек ведет к нарушениям водного, электролитного и кислотно-щелочного баланса, вызывает азотемию и нарушения структуры и функции многих систем организма. ХБП изменяет количественные и качественные характеристики кости посредством мультифакториального влияния на костный метаболизм, способствуя развитию остеопении, остеопороза и повышая риск переломов. Проблема остеопороза у пациентов с ХБП в последнее время активно изучается, причем область изучения в основном ограничивается терминальной стадией, т.е. больными с хронической почечно-заместительной терапией и после трансплантации почки. Доказано, что частота встречаемости низкой массы кости и переломов в 3-4 раза выше у диализных пациентов по сравнению с общей популяцией [31]. Более того, перелом бедра у больных на диализе ассоциирован с двухкратным увеличением смертности по сравнению с пациентами с аналогичным переломом без диализа [6, 19, 21, 33]. В целом больные с остеопенией/остеопорозом имеют в 3,3—4,3 раза более высокий риск смертности, чем диализные пациенты с нормальной МПК [28]. Кроме того, известно, что кардиоваскулярные заболевания и поражение костей взаимосвязаны. В исследованиях продемонстрирована обратная взаимосвязь между остеопорозом и кальцификацией коронарных артерий как в общей популяции, так и у пациентов с терминальной стадией ХБП. Сосуществование васкулярных факторов риска и костных нарушений представляет двойную угрозу для качества и продолжительности жизни пациентов с хронической болезнью почек [21].
Распространенность. Частота встречаемости остеопороза у больных с ХБП относительно мало изучена. Опубликованные различными авторами данные значительно варьируют, что обусловлено несколькими причинами. Частота выявления остеопороза зависит, во-первых, от обследованной популяции; во-вторых, от метода диагностики; в-третьих, от области скелета, где диагностирован остеопороз. Большинство исследований выполнено в группах пациентов с терминальной стадией ХБП, получающих почечно-заместительную терапию методами гемодиализа, перитонеального диализа, а также после трансплантации почки. В исследовании А. Negrietal. у диализных пациентов остеопения была зарегистрирована в поясничном отделе позвоночника в 44,6% случаев, в области шейки бедра — в 56,9%, T-критерий соответствовал остеопорозу в позвоночнике у 13,8% больных, в бедре — у 21,5% [23]. В работе Z. Nowaketal. в зависимости от исследуемого региона скелета остеопороз был диагностирован у 2068% женщин и 2-40% мужчин [24]. По данным D. Baszko-Blaszyketal., распространенность остеопороза максимальна в ультрадистальной части лучевой кости, далее следует шейка бедра [7]. При анализе пяти областей скелета (поясничный отдел позвоночника, шейки бедра, ультрадистальная часть и 33% (1/3) лучевой кости, «totalbody») частота остеопороза достигает 48,6%. По данным F. Barretoetal., остеопороз регистрируется у 46% диализных пациентов [6]. Максимальная частота отмечена в работе D. Zayouretal.: остеопороз диагностирован у 55% мужчин и 87% женщин на диализе [33].
Клиническая картина. Остеопороз, как известно, «безмолвная болезнь» и развивается почти бессимптомно до тех пор, пока не появляются переломы. Из-за сниженной прочности кости переломы могут возникать при низком уровне травмы (падение с высоты собственного роста, тряская езда, подъем груза, изменение положения тела) или спонтанно. Типичные локализации переломов — дистальный отдел предплечья, проксимальный отдел бедра (шейка бедра или чрезвертельная область) и позвоночник. Ведущее клиническое проявление остеопороза позвоночника — постоянная боль в спине, вызванная компрессией позвонка или повторяющимися микропереломами, усиливающаяся при перемене положения тела, кашле, чихании, натуживании. Наиболее частая локализация боли — нижнегрудной и верхнепоясничный отделы позвоночника. Важно также заметить, что остеопороз далеко не единственная и отнюдь не самая частая причина синдрома хронической боли в спине, что еще более затрудняет использование данного симптома в диагностике. При объективном исследовании у пациента отмечается снижение роста по сравнению с ростом в молодом возрасте (в 25 лет) на 1-15 см. Наблюдается также укорочение торса, из-за чего пожилой человек с множественными переломами позвонков выглядит длинноруким. В результате деформаций позвонков формируется выраженный грудной кифоз («горб»), который компенсируется поясничным лордозом. Остеопороз конечностей имеет еще меньше клинических симптомов: в большинстве случаев болевой синдром появляется в этих областях только при переломах, условия для возникновения которых аналогичны описанным выше предпосылкам возникновения переломов позвоночника [1-4].
У пациентов на диализе клиническая картина остеопороза еще более стертая, поскольку они предъявляют массу различных жалоб, связанных с осложнениями почечно-заместительной терапии и сопутствующей патологией. Вычленить из этих жалоб те, которые относятся к остеопорозу, зачастую достаточно сложно, и заподозрить наличие остеопороза в данной популяции можно скорее по наличию определенных факторов риска, нежели по клинической картине. Более того, диагностика по клиническим проявлениям, как правило, возможна на поздних стадиях развития заболевания, что осложняет лечебную тактику.
Факторы риска остеопороза у диализных пациентов. Общепризнанные факторы риска потери массы кости в общей популяции (табл.) распространяются и на пациентов с ХБП [9, 13, 14, 21, 26].
Таблица. Основные факторы риска остеопороза и ассоциированных с ним переломов
| Немодифицируемые | Модифицируемые |
| Возраст более 60 летЖенский полПостменопаузаНаличие любого перелома ванамнезе Наличие переломов у близкого родственника Двусторонняя овариэктомия Длительная аменорея (более 6 мес, исключая беременность) Ранняя менопауза | КурениеНизкая масса тела (<57 кг или ИМТ <22 кг/м2)Низкое потребление кальцияАлкоголизмЧастые падения Неадекватная физическая активность Прием медикаментов (стероиды, антиконвульсанты и др.) |
Однако многие из этих факторов у диализных пациентов приобретают особое значение. Так, неадекватная физическая активность, т.е. малоподвижность, присутствует у всех: по 4 часа 3 раза в неделю больные привязаны к больничной койке в связи с диализными сессиями, а после сеанса большинство из них чувствуют себя не настолько хорошо, чтобы быть физически активными. Эти пациенты, как правило, придерживаются диеты, которая направлена на ограничение поступления белка, фосфатов, кальция, т.е. противоречит принципам питания для поддержания нормальной массы кости. Многие пациенты страдают хроническими заболеваниями печени (вирусный гепатит), а также имеют кардиоваскулярную патологию как самостоятельное заболевание или как осложнение ХБП и длительной почечно-заместительной терапии. Регистрируемые в связи с вышеперечисленными причинами гипопротеинемия и гипоальбуминемия являются важными факторами риска развития остеопороза, что было подтверждено в исследовании Р. Lacativa et а1. [13]. Дефицит витамина D широко распространен среди больных ХБП, и причин этому несколько: снижение функции почек нарушает процесс превращения этого витамина в активную форму; особенности образа жизни и питания приводят к снижению поступления витамина D с пищей и недостаточной инсоляции. Все вышеперечисленное вносит определенный вклад в формирование остеопороза у больных ХБП.
Кроме того, в некоторых исследованиях установлено, что риск потери массы кости повышает хронический ацидоз — частый спутник терминальной стадии ХБП [26]. Подтверждением его влияния на кость является тот факт, что остеопороз и остеомаляция имеются у некоторых пациентов с метаболическим ацидозом при нормальной почечной функции. Считается, что метаболический ацидоз влияет на кость путем стимуляции медиированной остеокластами резорбции кости и медиированного остеобластами формирования кости, нарушения действия паратгормона (ПТГ) и витамина D [12].
Как известно, среди причин развития терминальной стадии ХБП сахарный диабет занимает второе место, уступая лишь хроническому гломерулонефриту. При этом сахарный диабет является отдельной рубрикой в классификации вторичного остеопороза, и тот факт, что наличие диабета — фактор риска снижения минеральной плотности кости (МПК) у пациентов с ХБП, не требует особых доказательств [25, 33].
У диализных пациентов часто развиваются ассоциированные с поражением почек гиперпролактинемия и гипогонадизм, что ведет к аменорее и преждевременной менопаузе у женщин, а также к раннему развитию андрогенного дефицита у мужчин. Это является причиной сексуальной дисфункции и вносит вклад в развитие остеопороза [5, 17, 31]. Так, в исследовании F. Albaaj et а1. [5] оценено состояние гипофизарно-гонадной оси у 214 мужчин с различной степенью нарушений почечной функции (преддиализные, диализные и трансплантированные пациенты). Среди обследованных 26,2% имели низкий уровень тестостерона (<10 нмоль/л), 30,3% низконормальный уровень (10-14 нмоль/л), что приводит к нарушениям в периферической конверсии андрогенов в эстрогены. При этом не выявлено значимых изменений со стороны уровней секс-стероидсвязывающего глобулина и гонадотропинов. Авторы делают вывод о том, что половина пациентов с ХБП имеет низкий или низконормальный уровень тестостерона, а это, в свою очередь, — фактор риска остеопороза и сексуальной дисфункции. Такие пациенты — кандидаты для тестостерон-заместительной терапии с целью улучшения МПК, либидо и т.п.
В работе J. Weisinger et а1. [30] выполнено сравнение костного и минерального метаболизма и состояния гипофизарно-гонадной оси в двух группах молодых диализных женщин: с персистирующей аменореей (отсутствие менструаций в течение 6 месяцев и более) и с регулярным менструальным циклом (31 и 43 женщины соответственно). Уровень эстрадиола был в пределах нормы в обеих группах, однако достоверно ниже у женщин с аменореей. В группе с аменореей достоверно выше уровни фолликулостимулирующего гормона и биохимических маркеров костной резорбции, а трабекулярная МПК в поясничном отделе позвоночника достоверно меньше и достоверно коррелировала с уровнем эстрадиола. Таким образом, аменорея у молодых пациенток на диализе ассоциирована с более низкой МПК и усиленной резорбцией кости по сравнению с диализными пациентками с регулярным менструальным циклом.
Наибольшую сложность в проблему остеопороза у больных ХБП вносит то, что данная популяция имеет различные нарушения метаболизма кости, объединенные термином «почечная остеодистрофия» (ПОД) [10, 20, 26]. Различают пять форм ПОД: фиброзный остеит и смешанная остеодистрофия, которые относятся к ПОД с высоким метаболизмом кости; умеренный вторичный гиперпаратиреоз (ВГПТ), который относится к ПОД с нормальным обменом кости; адинамическая костная болезнь и остеомаляция, относящиеся к ПОД с низким метаболизмом кости [20].
Ключевую роль в патофизиологии уремической костной болезни играет паратиреоидный гормон. Доказано, что поддержание уровня ПТГ в пределах от 2-кратного до 4-кратного превышения нормы позволяет предотвратить развитие двух основных форм остеодистрофии — фиброзного остеита и адинамической костной болезни [20, 22, 33]. Вторичный гиперпаратиреоз широко распространен среди пациентов с ХБП, частота его встречаемости, включая умеренный ВГПТ, достигает 50-60%. При этом гиперпаратиреоз в классификации остепороза занимает отдельную рубрику среди эндокринных причин вторичного остеопороза, что повышает риск развития остеопороза при ХБП, сопровождающейся ВГПТ.
Впервые данные о более низкой МПК у диализных пациентов и взаимосвязи ее снижения с повышенным уровнем ПТГ опубликовали Y. Lü et al. [15]. В дальнейшем роль ПТГ в развитии остеопороза у пациентов на диализе подтверждена в ряде других исследований [13, 23]. Как известно, влияние гиперпаратиреоза на снижение МПК неодинаково в различных участках скелета. Под воздействием высокого ПТГ потеря массы кости максимальна в областях скелета, где превалирует кортикальная ткань (трубчатые кости конечностей, кости черепа, тазовые кости), в то время как трабекулярная кость остается относительно сохранной (позвоночник). Р. Miller et al. исследовали влияние ВГПТ на кости у нефрэктомированных крыс. В группе с легким ВГПТ отмечено снижение МПК бедренной кости на 12%, увеличение числа остеокластов при неизменном числе остеобластов и сниженный объем губчатой кости в метафизе большеберцовой кости при отсутствии значимых изменений кортикальной кости в области соединения большеберцовой и малоберцовой костей. Умеренный ВГПТ ассоциирован с отсутствием изменений МПК бедренной кости и объема губчатой костной ткани в большеберцовой кости, однако имеет место значимое увеличение количества остеобластов, повышение скорости периостального, интракортикального и эндокортикального костеобразования и обмена кости, что вносило свой вклад в рост кортикальной порозности. Эти изменения были особенно значительными в группе тяжелого ВГПТ: МПК была ниже в проксимальной, но выше в дистальной части бедренной кости; объем губчатой костной ткани в большеберцовой кости, число остеобластов, остеокластов и скорость костеобразования были увеличены в 6, 7, 3 и 30 раз соответственно. Скорость эндокортикального костеобразования повышена в 31 раз, и прочность кости значимо снижена в связи с экстенсивной кортикальной порозностью. Отмечено отсутствие заметной кортикальной порозности при уровне ПТГ менее 500 пг/мл. Авторы делают вывод, что прогрессивный ВГПТ у крыс ассоциирован с разными эффектами в отношении кости в зависимости от степени повышения ПТГ. ВГПТ легкой степени вызывает потерю губчатой и эндокортикальной кости, при умеренном ВГПТ наблюдается тенденция к поддержанию на должном уровне обоих типов костной ткани, в то время как уровень ПТГ >500 пг/мл приводит к потере кортикальной костной ткани, но к прибавке губчатой [18].
Приведенные данные подтверждены в работе Р. Lacativaetal.: при исследовании МПК по программе «totalbody» и в различных регионах скелета у 42 гемодиализных пациентов с тяжелым гиперпаратиреозом показано, что наиболее низкая МПК у данной категории больных регистрируется в нижних конечностях и других участках скелета, где доминирует кортикальная костная ткань [13].
Является ли рекомендуемый для диализных пациентов целевой уровень (150-300 пг/мл) ПТГ оптимальным с точки зрения МПК? С этой целью D. Zayouretal. оценили уровни ПТГ, МПК поясничного отдела позвоночника, шеек бедренных костей и костей предплечья у 28 пациентов на диализе. Все они были разделены на три подгруппы: с низким, нормальным и высоким уровнем ПТГ. Частота встречаемости сниженной МПК во всех тестированных регионах скелета оказалась минимальной в подгруппе лиц с нормальным уремическим уровнем ПТГ. На основании этого сделан вывод, что поддержание целевого уровня ПТГ ассоциировано с лучшим состоянием минеральной плотности костей у диализных пациентов [33]. Мы не нашли других более крупных исследований, посвященных изучению данного вопроса, т.е. на сегодняшний день убедительного ответа на него нет.
В ряде исследований оценивали влияние длительности почечно-заместительной терапии на развитие остеопороза. L. Tao et al., обследовавшие 50 диализных пациентов, не выявили статистически значимых различий МПК и уровня ПТГ в подгруппах с различным стажем диализа и сделали вывод о том, что МПК и ПТГ не зависят от длительности почечно-заместительной терапии [29]. В то же время в исследовании D. Zayour et al. продемонстрировано, что одним из предикторов низкой МПК является «стаж» диализа [33]. Диаметральная противоположность выводов этих исследований вполне объяснима, поскольку прогрессия ВГПТ, как и снижение МПК с течением времени у диализных пациентов, напрямую зависит от лечебных и профилактических мер. У пациентов, получающих адекватную терапию аналогами витамина D3 и занимающихся профилактикой остеопороза, т.е. модификацией факторов риска снижения МПК, как в исследовании L. Tao et al., вероятность прогрессии ПТГ и снижения МПК минимальна. В то же время при отсутствии данных о терапевтических вмешательствах можно предполагать наличие прогрессии как ВГПТ, так и остеопороза с увеличением длительности почечнозаместительной терапии. Таким образом, по мере увеличения «стажа» диализа наблюдается прогрессия снижения МПК, однако до конца не ясно, является ли длительность почечнозаместительной терапии независимым фактором риска снижения МПК, или потеря МПК обусловлена усугублением различных метаболических нарушений, таких как ВГПТ, ацидоз, диспротеинемия, нарушения фосфорно-кальциевого обмена. В частности, в работе А. Negri et al. минеральное содержимое кости во всем скелете обратно коррелировало с ПТГ (г = -0,34) и общим «стажем» диализа (г = -0,26), однако при мультивариантном анализе только ПТГ обратно коррелировал с минеральным содержимым кости (B = -0,26, Р = 0,03) [23].
В работе N. Lyhne et al. оценена скорость потери МПК у пациентов на перитонеальном диализе, получающих активные формы витамина D3. Отмечено, что МПК осталась практически неизменной у мужчин, а у женщин скорость потери МПК в дистальной части лучевой кости составила 6% в год, тогда как в общей популяции обычно наблюдается потеря 1-2% в год [16].
Так называемые немодифицируемые факторы риска остеопороза также приобретают несколько иную окраску у пациентов с ХБП. Так, влияние пола и возраста на снижение МПК не является столь однозначным и безоговорочным у диализных пациентов, как в общей популяции. В работе Т. Yamaguchi et al. показано, что МПК достоверно ниже у женщин (Р = 0,0001) и достоверно коррелирует с возрастом (Р < 0,001), в то время как у мужчин подобной корреляции не выявлено [32]. В то же время в исследовании А. Negri et al. частота регистрации остеопении была одинаковой у мужчин и женщин, а частота встречаемости остеопороза хотя и различалась у мужчин и женщин, однако эти различия были иными: T-критерий соответствовал остеопорозу в позвоночнике у 10% мужчин и 15,5% женщин, в бедре у 30% мужчин и 17,7% женщин [23]. Влияние расы на МПК у диализных пациентов аналогично общей популяции: риск остеопении ниже у представителей негроидной расы [27].
Диагностика. Традиционно в течение многих лет для диагностики остеопороза использовалась эталонная рентгенография. Однако следует иметь в виду, что рентгенологический диагноз остеопороза возможен только при потере костной массы на 20-30% от первоначальной, т.е. в поздние сроки заболевания. Вместе с тем рентгенография незаменима при диагностике переломов, в том числе деформаций позвонков. Для выявления последних используется метод рентгеноморфометрии позвоночника, когда измеряются и сравниваются друг с другом высоты тел позвонков, что позволяет обнаружить клиновидные, двояковогнутые и компрессионные деформации, характерные для остеопороза и не всегда сопровождающиеся очевидной клинической симптоматикой.
Поскольку прочность кости зависит главным образом от МПК, ее определение считается наиболее объективным методом диагностики остеопороза и определения риска связанных с ним переломов костей уже на ранних стадиях развития болезни. Для оценки МПК в настоящее время применяется рентгеновская, ультразвуковая денситометрия и количественная компьютерная томография (QCT). «Золотым стандартом» денситометрии является двухэнергетическая рентгеновская абсорбциометрия (DEXA). Обычно выполняется денситометрия поясничного отдела позвоночника (Li—L4) и проксимального отдела бедренной кости, реже дистальной части предплечья. Исследование грудного отдела позвоночника не проводится, поскольку грудина и ребра являются помехой для измерения МПК грудных позвонков. Исключение составляет методика моментальной оценки позвоночника при DEXA (instantvertebralassessment — IVA), которая может применяться для диагностики переломов позвонков при остеопорозе. Числовым выражением диагноза остеопороза является Т-критерий количество стандартных отклонений (SD) от показателей МПК молодых здоровых лиц (20-39 лет). Колебания Т-критерия в размахе 1,0 SDотносятся к норме. Остеопению констатируют при снижении МПК между -1 и -2,5 SD, остеопороз при снижении показателей МПК менее -2,5 SDот пиковых показателей (Т-критерий <2,5 SD). Важно помнить, что различные участки скелета неоднородны по МПК, поэтому риск перелома определенной локализации можно прогнозировать только при исследовании данной локализации [1 — 4].
Диагностика остеопороза у пациентов с терминальной ХБП не так легка, как у женщин с постменопаузальным остеопорозом. До сих пор не существует единой точки зрения на этот вопрос. Дело в том, что данная популяция имеет совокупность различных нарушений метаболизма кости, объединенных термином «почечная остеодистрофия» [10]. Мнения различных экспертов варьируют от экстраполирования классического алгоритма диагностики остеопороза до утверждения, что ни переломы, ни критерии минеральной плотности кости, предложенные ВОЗ, не могут использоваться для диагностики остеопороза в данной популяции, так как все формы почечной остеодистрофии могут приводить к переломам или иметь низкий Ткритерий, а диагноз остеопороза у пациентов с ХБП должен устанавливаться в первую очередь путем исключения всех форм ПОД с помощью биохимических исследований или костной биопсии и подтверждением низкого объема трабекулярной кости [19].
Результаты оценки МПК могут указывать на норму при наличии хрупкости скелета, поэтому костная биопсия является лучшим методом оценки статуса костей при ХБП, нежели МПК [11]. Гистоморфометрия биоптата гребня подвздошной кости была и остается золотым стандартом диагностики костной патологии при ХБП. По данным костной биопсии остеопороз определяют при выявлении объема трабекулярной кости (BV/TV) более 1 SDниже нормы (мужчины <17,4%; женщины <14,7%) [6].
Однако в связи со сложностью выполнения и травматичностью процедуры костной биопсии в последнее время ее все больше вытесняют суррогатные маркеры костной патологии, такие как ПТГ, показатели фосфорно-кальциевого обмена, биохимические маркеры костного метаболизма (остеокальцин, костная форма щелочной фосфатазы, Nи Tпептиды проколлагена типа 1, гидроксипролин, гидроксилизин, пиридинолин, диоксипиридинолин, костный сиалопротеин, кислая фосфатаза, тартрат-резистентная кислая фосфатаза, телопептиды коллагена типа 1). Важность определения МПК и маркеров костного метаболизма для оценки остеопороза, риска переломов и типа ПОД до сих пор плохо обоснована. М. DeVita et al. выполнено проспективное обследование 30 гемодиализных пациентов для выяснения, какая из 6 диагностических процедур наиболее информативна для оценки костной патологии у данной категории больных. Тестируемыми диагностическими методами были: рутинное биохимическое исследование, ПТГ, рентгенография рук и ключиц, костная денситометрия методом DEXA, дефероксаминовый стимуляционный тест и биопсия гребня подвздошной кости. Все пациенты со снижением МПК по результатам DEXA имели повышенный уровень ПТГ, что позволило авторам сделать вывод о том, что DEXA не может выявить какую-либо новую костную патологию. Костная биопсия была выполнена у 20 пациентов, и в каждом случае результаты соответствовали уремической остеодистрофии, включая фиброзный остеит у 11 больных и алюминиевую костную болезнь у 2. У 6 пациентов выявлена смешанная остеодистрофия, у 1 — остеопороз. Авторы заключили, что нормальные результаты DEXA или рентгенографии не позволяют исключить наличие костной патологии [8].
Как известно, ценность диагностики остеопороза состоит в возможности прогноза риска переломов.
На примере постменопаузального остеопороза определена значимая корреляция МПК и риска переломов. Сохраняется ли данная взаимосвязь у диализных пациентов? В доступной нам литературе найдены два исследования, посвященных поиску ответа на данный вопрос. В работе А. Negriet al. на основании анализа результатов DEXA и наличия переломов в анамнезе не выявлено разницы между МПК и Т-критериями у пациентов с переломами и без переломов [23]. Т. Yamaguchi et al. была оценена МПК в поясничном отделе позвоночника, 1/3 лучевой кости и ультрадистальной части лучевой кости у 59 мужчин (4 с переломами позвоночника, 4 с переломами других локализаций) и 65 женщин (10 с переломами позвоночника, 9 с переломами других локализаций) на гемодиализе. МПК была достоверно ниже у женщин(Р = 0, 0001). У мужчин МПК как в 1/3, так и в ультрадистальной части лучевой кости обратно коррелировала со «стажем» гемодиализа и уровнями сывороточной щелочной фосфатазы и ПТГ (Р < 0,05), в то время как у женщин подобные взаимосвязи были выражены слабо. С другой стороны, у женщин МПК достоверно коррелировала с возрастом (Р < 0,001). Среди обоих полов МП лучевой кости была достоверно ниже у лиц с переломами в анамнезе (позвоночник: Р < 0,05; другая локализация: Р < 0,01). Авторы заключили, что как абсолютная, так и возраст-зависимая МП лучевой кости является лучшей детерминантой переломов внепозвоночной локализации, чем МПК поясничного отдела позвоночника, в то время как последняя лучше детерминирует переломы позвоночника. У диализных пациентов для выделения группы со всеми типами переломов предпочтительна оценка МПК дистальной части лучевой кости [32]. Таким образом, данные А. Negri et al. свидетельствуют об отсутствии значимой взаимосвязи МПК и наличия патологических переломов в анамнезе, а результаты Т. Yamaguchi et al. указывают на обратное.
В каких регионах скелета у диализных пациентов необходимо оценивать мПк? Как свидетельствуют результаты исследования [32], оптимальной является оценка МПК ультрадистальной части лучевой кости. D. Baszko-Blaszyk et al. установили, что наиболее быстрый и чувствительный метод оценки остеопороза у диализных пациентов определение МПК предплечья (33% дистальной части и ультрадистальная часть) [7].
Целью работы Z. Nowak et al. также было определение оптимального региона скелета для выполнения DEXA с целью диагностики остеопороза у диализных пациентов. Был обследован 71 человек. Частота остеопороза, в зависимости от оцениваемого региона скелета, варьировала от 20 до 68% у женщин и от 2 до 40% у мужчин. Авторы сделали вывод, что оптимальный регион скелета для оценки МПК у диализных пациентов зависит от пола и функционального состояния паращитовидных желез, но не от метода или длительности диализа. Отмечено, что у женщин наиболее чувствительным регионом является предплечье, у мужчин — проксимальная часть бедра [24].
При выполнении DEXA у диализных пациентов необходимо помнить, что у них широко распространена метастатическая (внескелетная) кальцификация, особенно этому подвержены крупные и мелкие сосуды. Поэтому при интерпретации результатов мПк, к примеру, поясничного отдела позвоночника нельзя исключить интерференцию эктопической кальцификации и склеротических изменений межпозвоночных дисков, что является причиной ложного увеличения МПК поясничного отдела позвоночника [13].
Костная болезнь, ассоциированная с терминальной стадией ХБП, является сложным и многофакторным процессом. Подходы к ее диагностике, профилактике и коррекции претерпели значительные изменения в течение последних трех десятилетий. Если ранее превалировали признаки дефицита витамина D (рахит/остеомаляция) и вторичного гиперпаратиреоза (резорбция кости, остеосклероз, метастатическая кальцификация), то в настоящее время эти признаки менее выражены. Это произошло в связи с лучшим пониманием метаболизма витамина D и прогрессом в терапевтических вмешательствах. Однако метастатическая кальцификация мягких тканей и адинамическая костная болезнь остаются проблематичными. Новые осложнения обусловлены лечением (диализ и трансплантация), включая депозиты амилоида, неинфекционную спондилоартропатию, остеонекроз и остеопению / остеопороз.
Остеопения у пациентов с ХБП возникает вторично в связи с множеством факторов, в том числе факторов риска остеопороза в общей популяции и присущих только пациентам с ХБП. Все эти факторы модифицируют риск переломов, распространенность которых у диализных пациентов превышает аналогичные цифры в общей популяции, а последствия значительно более тяжелые.
Термин «остеопороз» необходимо с осторожностью применять у больных уремией, поскольку для данной популяции характерна совокупность различных нарушений метаболизма кости, объединенных термином «почечная остеодистрофия». На сегодняшний день накоплено много данных о факторах риска и исходах, ассоциированных с почечной остеодистрофией, значительно меньше известно об остеопорозе при терминальной стадии ХБП. Мало данных об ассоциированных с остеопорозом неблагоприятных исходах и о влиянии различных терапевтических воздействий.
DEXA — важный метод оценки состояния кости у больных с вторичными причинами остеопороза, несмотря на все его недостатки. Согласно рекомендациям Canadian Panel of the International Society for Clinical Densitometry совместно с приглашенными экспертами, МПК, оцененная посредством DEXA у пациентов с вторичными причинами остеопороза, включая больных ХБП, должна интерпретироваться с учетом всех прочих аспектов болезни, которые участвуют в потере массы кости, так же как должен быть оценен вклад других факторов возникновения переломов. Присутствие вторичных причин потери массы кости может в дальнейшем увеличить риск переломов независимо от МПК и служит предпосылкой для ранней интервенции. Насколько риск переломов ассоциирован с МПК у пациентов с хронической болезнью почек, пока неизвестно.
Литература
- Рожинская Л.Я.Системный остеопороз. Практическое руководство для врачей. М.: Издатель Мокеев, 2000.
- Руденко Э.В.Остеопороз. Диагностика, лечение и профилактика. Минск: Белорусская наука, 2001.
- Сорока Н.Ф.Остеопороз. Практическое руководство для врачей. Минск, 1997.
- Холодова Е.А., Шепелькевич А.П., Забаровская З.В.Эндокринные остеопатии: особенности патогенеза, диагностики и лечения. Практическое руководство для врачей. Минск: Белпринт, 2006.
- Albaaj F., Sivalingham M., Haynes P.et al. //Postgrad. Med. J. 2006. Vol. 82 (972). P. 693—696.
- Barreto F. C., Barreto D.V., Moyses R.M.et al. //Kidney Intern. 2006. Vol. 69 (10). P. 1852—1857.
- Baszko-Blaszyk D., Grzegorzewska A.E., Horst-Sikorska W., Sowinski J.// Adv. Perit. Dial. 2001. Vol. 17. P. 109—113.
- DeVita M.V., Rasenas L.L., Bansal M.et al. //Medicine (Baltimore). 1992. Vol. 71 (5). P. 284—290.
- Ersoy F. F.//Intern. Urol. Nephrol. 2007. Vol. 39 (1). P. 321—331.
- Hodsman A.B.//Perit. Dial. Intern. 2001. Vol. 21, suppl. 3. S. 247—255.
- Khan A.A., Hanley D.A., Bilezikian J.P.et al. //J. Clin. Densitom. 2006. Vol. 9 (1). P. 47—57.
- Kraut J.A.//Adv. Ren. Replace Ther. 1995. Vol. 2 (1). P. 40—51.
- Lacativa P.G., de Mendonca L.M., de Mattos Patricio Filho P.J.et al. //J. Clin. Densitom. 2005. Vol. 8 (3). P. 352—61.
- Lindberg J.S., Moe S.M.//Semin. Nephrol. 1999. Vol. 19 (2). P. 115—122.
- Lyhne N., Pedersen F. B.//Nephrol. Dial. Transplant. 1995. Vol. 10 (3). P. 395— 398.
- Lü Y.M., Xiao H.W., Liang K.H.//J. Tongji Med. Univ. 1995. Vol. 15 (2). P. 95—97.
- Matuszkiewicz-Rowinska J., Skorzewska K., Radowicki S. et al. // Nephrol. Dial. Transplant.- 1999. Vol. 14 (5). P. 1238—1243.
- Miller M.A., Chin J., Miller S.C., Fox J.// Bone. — 1998. Vol. 23 (3). — P. 257—266.
- Miller P.D.//Curr. Osteoporos. Rep. — 2005.- Vol. 3 (1). P. 5—12.
- Moe S., Drueke T., Cunningham J.et al. //Kidney Intern. 2006. Vol. 69. P. 1945— 1953.
Статья опубликована в журнале «Медицинские новости», 2008, №4. Источник: www.mednovosti.by






Комментировать