Остеопороз. Патогенез. Патогенетичні варіанти остеопорозу. Фактори ризику розвитку остеопорозу в постменопаузі. Клініка. Діагностика остеопорозу. Патогенетичне лікування хворих на постменопаузальний та сенильний ОП.
Ю.С. Паращук,
д.м.н, професор, завідуючий кафедрою акушерства та гінекології №2 ХДМУ, м. Харків
Серед патологічних станів, що супроводжуються порушенням у кістковій системі особливе місце належить остеопорозу (ОП). Клінічно це проявляється зниженням щільності кісток (через зменшення їх маси в одиниці об’єму) та порушенням мікроархітектоніки кісткової тканини. Перелічені зміни призводять до високого ризику переломів кісток.
Частота захворювання серед населення, за даними різних авторів, складає від 2 до 10% і значно збільшується з віком. 85% випадків це постменопаузальний остеопороз [5]. Дана патологія спостерігається у 10-30% жінок на протязі 15-20 років після настання менопаузи [3, 4]. Встановлено, що ОП хребта у літньому віці страждає кожна четверта жителька міста. Разом з тим, тривалість життя значно скорочується за рахунок переломів стегна [6].
Патогенез. Мінеральний склад кісткової тканини є відображенням суми впливів не менш ніж чотирьох основних факторів: спадковості, рухливості, характеру харчування та гормонального фону. Через деякий час після досягнення піку маси кісткової тканини починається її вікова втрата. Це відбувається не залежно від статі, раси, професії, дієтичних звичок, економічного положення, географічної зони проживання та історичної епохи [7].
Для кісткової тканини характерні два взаємопов’язані процеси: формування та резорбція. Вони відбуваються з різною швидкістю на протязі всього життя. У значної частини жінок формування та резорбція кістки збалансовані, і тільки в постменопаузі у 10-30% пацієнток резорбція значно перевищує формування, що призводить до розвитку ОП [1]. Середня втрата кісткової тканини у жінок складає 1% за рік від рівня піку маси кісткової тканини репродуктивного віку. Цей процес розвивається прискорено на протязі перших п’яти років постменопаузи і далі плавно знижується. Фізіологічна вікова атрофія скелету з від’ємним балансом кісткової тканини починається після 40 років, супроводжується тенденцією до переваги процесів резорбції над утворенням кісткової тканини і знаходиться в тісному зв’язку з гормональним гомеостазом і обміном кальцію та фосфору. Розвиток ОП може бути проявом первинних змін мінерального гомеостазу, а також носити вторинний характер, супроводжуючи такі патологічні стани, як акромегалія, гіпертиреоз, гіперпаратиреоз, синдром Кушинга, гіпогонадизм, а також тривале застосування кортикостероїдних гормонів [6].
Вікова втрата кісткової тканини в клімактеричному періоді зумовлена гормональними змінами, які властиві для нього, і більше виражена в губчастій тканині кісткового скелету (на її долю припадає 20% від загальної маси останнього), ніж відносна втрата кортикального шару (доля якого в кістковому скелеті 80%). У здорових людей втрата губчатої речовини обмежена, тоді як втрата кортикального шару продовжується до кінця життя. Процес, що розглядається, пов’язаний зі змінами кальцієвого обміну. Результатом цих змін є перехід мінеральних речовин і колагену із кісткового скелету в кров і сечу. Тому в перименопаузі помірно підвищується концентрація калію, фосфору та лужної фосфатази в плазмі крові і екскреція калію та оксипроліну із сечею [6].
Відповідно до сучасних уявлень, у формуванні ОП головна роль належить порушенням в системі, яка регулює обмін кальцію в органах-мішенях [6]. Основне значення в розвитку ОП належить гіпоестрогенії, особливо зниженню кількості естрадіолу. Безпосередні учасники кісткового ремоделювання остеобласти і остеокласти мають рецептори до естрадіолу. Остеобласти відповідають на вплив естрадіолу збільшенням продукції кісткового матриксу. Естрадіол пригнічує активність остеокластів [4]. Естрогени впливають на метаболізм кальцію: зниження їх рівня призводить до підвищення рівня кальцію в крові, тобто «вимивання» його із кісткової тканини. І, на сам кінець, естрогени регулюють вміст вітаміну D, що сприяє реабсорбції кальцію в нирках та абсорбції його в кишечнику [2].
Аналіз даних літератури свідчить, що передчасне згасання функції яєчників або видалення їх в перименопаузі сприяє ранньому розвитку ОП. Доведено, що жінки з видаленою маткою і яєчниками в перименопаузі, на протязі перших трьох років після подібного втручання, мають більш низьку масу кісткової тканини порівняно з тими, які перенесли тільки гістеректомію [8].
Патогенетичні варіанти остеопорозу [2]:
I. Первинний ОП, який існує в двох варіантах:
- Постменопаузальний ОП зумовлений естрогенним дефіцитом. Виражається численними переломами, що виникають на 7-му десятиріччі життя на фоні переважної втрати губчастої речовини кістки. Прогресує на протязі перших 5 років постменопаузи.
- Сенильний ОП виникає у більш пізньому літньому віці (після 70 років) та виражається переломами шийки стегна.
II. Вторинний ОП є наслідком захворювань ендокринних залоз (гіперкортицизм, гіпертиреоз, діабет, гіпогонадизм).
Фактори ризику розвитку остеопорозу в постменопаузі [1]:
- вік старше 45 років;
- тендітна статура, низький ріст;
- раса (Північна Європа та Азія);
- переломи в сімейному анамнезі;
- пізнє менархе (після 15 років);
- рання менопауза (до 50 років);
- олігоабо аменорея в репродуктивному віці;
- хронічна ановуляція та безпліддя;
- велика кількість вагітностей та пологів (більше 3);
- лактація більше 6 місяців;
- зловживання алкоголем, кавою, куріння;
- недостатнє вживання кальцію з їжею;
- знижене або занадто велике фізичне навантаження.
Клініка. Втрата мінеральних речовин на 1-2% щороку після 50 років призводить до зниження маси кісткової тканини на 20-30% до 75 років [6]. За даними І.Б.Манухіна та співавт. [2] в перші 5 років після менопаузи втрата кісткової маси прискорюється і до 70 років жінка втрачає близько 50% кісткової маси. Необхідно підкреслити, що клінічні прояви
ОП в період ранньої менопаузи не виражені, в той же час, саме в цей період втрата кісткової маси досягає максимальної інтенсивності [1].
Остеопороз називають «мовчазною епідемією». Процес розвивається повільно. Втрата кісткової тканини діагностується часто після переломів, які є пізнім проявом цього захворювання. Типові переломи при ОП: нижня третина передпліччя, хребці, шийка стегна [2]. Разом з тим, для хворих ОП досить характерні такі симптоми, як поява тяжких локальних больових відчуттів при звичайних рухах, поява постійного болю в області хребта при зміні положення тіла та рухах. Але поряд з цим, у хворих з численними компресійними переломами больових відчуттів може і не бути. Для системного ОП характерне зменшення росту, поява так званого «горба вдови». До числа клінічних проявів ОП слід віднести ранню появу стоматологічних скарг втрату зубів та необхідність у протезуванні. Розвиток ОП нерідко поєднується, в тому чи іншому ступені, з м’язово-скелетними та суглобовими порушеннями [6].
Для діагностики остеопорозу можуть застосовуватися наступні методи:
- Фізикальне дослідження: визначення ступеню зменшення росту, виявлення кіфозу або втрата поперекового лордозу, визначення відстані між витягнутими в сторони руками (цей розмір в жінок репродуктивного віку і тих, що знаходяться в постменопаузі без порушень з боку кісткового скелету, відповідає росту від п’ят до тім’я) [6].
- Лабораторні методи дослідження:
- визначення концентрації в крові кальцію, фосфору, лужної фосфатази;
- визначення рівня прогестерону в плазмі периферичної крові, який у жінок в постменопаузі вищий при повільній, ніж при швидкій втраті маси кісткової тканини [6];
- проведення неспецифічних діагностичних проб, метою яких є раннє виявлення ОП. При проведенні подібної проби останній прийом їжі має бути напередодні о 18 годині, без вечірнього пиття та сніданку вранці наступного дня. Сечу збирають без катетера з 8 до 10 години ранку і визначають концентрацію кальцію та креатинину; розраховують їх співвідношення. На початкових етапах захворювання відношення менше 0,1; воно збільшується по мірі розвитку патології. Під впливом естрогенів показник знижується протягом 2-4 тижнів. В тій же пробі сечі визначають концентрацію оксипроліну. Рівень кальцію, фосфору та креатинину визначають також в пробі крові, яку набирають о 9 годині ранку. При збереженні вказаних умов, співвідношення між виділеними із сечею кальцієм та креатинином вище 0,16 і відношення оксипролін/креатинин вище 0,0112 дає можливість передбачати швидкий темп розвитку порушень мінерального гомеостазу в кістковій тканині з високою активністю остеокластів [8];
- Рентгенорадіологічне дослідження. У пацієнток із зменшенням мінеральних компонентів кісток на 20-40% виявляються зміни форми хребців і провисання їх трабекулярних відділів; в периферичних відділах скелету дифузна демінералізація з витонченням кортикального шару трубчатих кісток. До числа найбільш розповсюджених методів дослідження відноситься фотоденситометрія метод непрямого вимірювання абсорбції фотонів кістковою тканиною.
Слід відзначити, що інформативність кожного окремого із перерахованих вище методів невисока. Це вимагає комплексного підходу до діагностики та раціонального використання клінічних і лабораторних методів дослідження. В клініці частіше використовують стандартні радіографічні методи, просту фотонову денситометрію або комп’ютерне томографічне сканування. Такі дослідження рекомендується проводити щорічно на протязі 8-10 років менопаузи [6].
Патогенетичне лікування хворих на постменопаузальний та сенильний ОП [5]. Терапія має вирішувати наступні завдання:
1) сповільнення або припинення втрати маси кістки;
2) покращення якості кістки і підвищення її міцності;
3) нормалізація порушених процесів кісткового ремоделювання;
4) попередження переломів кісток;
5) покращення стану пацієнтки, розширення її рухливої активності, максимальне відновлення працездатності при клінічно вираженому ОП.
Всі лікарські засоби патогенетичної терапії та профілактики ОП можна умовно, за переважним механізмом дії, розподілити на три групи [5]:
- Препарати, що сповільнюють кісткову резорбцію: естрогени, селективні модулятори естрогенних рецепторів, кальцитоніни, бісфосфонати, кальцій.
- Препарати, що стимулюють кісткоутворення: фториди, паратиреоїдний гормон, гормон росту, анаболічні стероїди, андрогени.
- Препарати багатопланової дії: активні метаболіти вітаміну D, оссеїн-гідроксиапатитний комплекс, іприфлавон.
На жаль, в наш час ідеального засобу для лікування хворих на ОП немає. В країнах Північної Америки та Західної Європи лікування естрогенами (одними або в сполученні з гестагенами) вважалося золотим стандартом терапії постменопаузального ОП та його профілактики. Поряд із сповільненням кісткових втрат, зниженням частоти переломів кісток та зниженням показників резорбції кісткової тканини замісна гормональна терапія (ЗГТ) зменшує прояви урогенітальних розладів в менопаузі та знижує ризик розвитку серцево-судинних захворювань.
Численними дослідженнями було доведено, що ЗГТ естрогенами в постменопаузі попереджує подальші втрати кісткової маси, знижує показники кісткового метаболізму до передменопаузального рівня, попереджує розвиток нових переломів кісток. Саме естрогени мають антиостеопоретичну дію, затримуючи резорбцію за рахунок пригнічення активності остеокластів і стимуляції ранньої диференціації остеобластів [4].
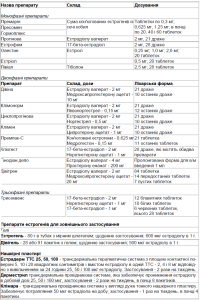
Як видно із табл. 1, в наш час існує великий вибір препаратів ЗГТ для призначення індивідуалізованого лікування. Наприклад, монофазні препарати краще призначати жінкам з видаленою маткою, а лівіал більш старшій віковій групі. Найбільше поширення отримали двохфазні препарати, так як введення прогестинів до лікарської форми попереджує можливий розвиток гіперпластичних процесів в матці та молочних залозах на фоні ЗГТ. Розробка лікарських форм у вигляді пластирів і гелів дозволила призначати ці препарати жінкам, які мають порушення в гепато-біліарній системі, так як препарат всмоктується, минаючи печінку, і жінкам, що не бажають довго приймати ліки у вигляді таблеток. Ефект естрогенів зберігається, доки продовжується терапія. Припинення лікування естрогенами на будь-якому етапі довготривалої терапії знову кової маси поновлюються. збільшує маркери кісткового обміну, і втрати кісткової маси поновлюються.
Таблиця 1. Препарати замісної гормональної терапіі в менопаузі [5]
Широке застосування ЗГТ обмежене низкою протипоказань: порушення функції печінки, схильність до тромбоутворень та тромбофлебітів, наявність гіперпластичних процесів в матці та молочних залозах. Основним недоліком терапії естрогенами при постменопаузальному ОП є можливість їх негативної дії на репродуктивні тканини матку та молочні залози. Додавання прогестинів в схему ЗГТ зменшує ризик цього ускладнення.
Питання про тривалість ЗГТ залишається відкритим. Одні автори рекомендують приймати ЗГТ на протязі 8-10 років, інші обмежують максимальний термін шістьма роками у зв’язку з різким збільшенням ризику розвитку раку ендометрію та молочних залоз. Мінімально ефективний термін застосування складає 5 років [4].
Відомо, що ЗГТ може супроводжуватися такими побічними ефектами, як затримка рідини, зниження або збільшення маси тіла, дискомфортом в нижніх відділах живота та іншими. Перед призначенням гормонотерапії необхідно вивчити анамнез, провести гінекологічне обстеження, ультразвукове дослідження органів малого тазу, контроль за станом ендометрію, мамографію. При необтяженому особистому та сімейному анамнезі у віці 40 50 років мамографія проводиться 1 раз на 2 роки, при обтяженому щорічно, після 50 років щорічно [і].
В контексті пошуку «ідеального» препарату селективні модулятори естрогенних рецепторів були визнані, як речовини, що є антагоністами естрогенних рецепторів по відношенню до таких мішеней, як кісткова тканина, рівень ліпідів. Однією з перших таких речовин був нестероїдний «антиестроген» тамоксифен. Однак широке застосування тамоксифену обмежене його стимулюючою дією на ендометрій. В подальшому були розроблені селективні модулятори естрогенних рецепторів другого покоління (ралоксифен, кеоксифен, дролоксифен), основу хімічної структури яких складає бензотиафенове ядро. Ралоксифен є унікальним антагоністом по відношенню до рецепторів естрогенів і в молочних залозах, і в матці. В наш час є переконливі дані про те, що селективні блокатори естрогенних рецепторів є ефективними і перспективними препаратами для профілактики та лікування ОП і, можливо, серцево-судинних захворювань у жінок в менопаузі [5]. Ефект ралоксифену на мінеральну щільність кісткової тканини (МЩКТ) після 24 місяців прийому відповідає застосуванню ЗГТ [4]. Але на відміну від ЗГТ ралоксифен не знижує ризик розвитку хвороби Альцгеймера і не усуває вазомоторні симптоми та урогенітальні порушення [1].
Основний механізм дії кальцитоніну при ОП гальмування кісткової резорбції за рахунок первинного пригнічення остеокластичної активності та зменшення кількості остеокластів. Також переконливо продемонстровано його анальгетичний ефект. В наш час віддають перевагу інтраназальній лікарській формі у зв’язку із зручністю використання та меншим числом побічних ефектів. Не викликає сумнівів необхідність призначення препаратів кальцитоніну при тяжких формах остеопорозу з вираженим больовим синдромом.
Бісфосфонати є найбільш сильними інгібіторами кісткової резорбції. В порядку збільшення антирезорбуючої активності бісфосфонати можна розмістити наступним чином: етідронат (ксідіфон, дідронель), тілудронат (скелід), клодронат (бонефос, лодронат, остак), памідронат (аредіа, аміномакс), алендронат (фосамакс), різедронат, ібадронат, золодронат. Активність золодронату перевищує активність етідронату в 10000 разів. В Європі найбільш поширений етідронат, який застосовується за схемою циклічної терапії: 400 мг на день щоденно на протязі 2 тижнів, потім 10 тижнів перерва в комбінації з препаратами кальцію і/або вітаміном D. Така схема розроблена у зв’язку з тим, що безперервне лікування та великі дози етідронату можуть викликати порушення мінералізації новоутвореної кістки. В останні три-чотири роки позицію лідера займає алендронат. У великих проспективних дослідженнях відмічено, що препарат добре переноситься.
Препарати, що стимулюють кісткоутворення, застосування обмежено, але теоретично, вони мають велике майбутнє, так як інтенсивний приріст втраченої маси кістки неможливий без посиленого формування нової кістки. Одними із найбільш ефективних в цьому відношенні речовин є солі фтору. Препарати фтору були запропоновані для терапії ОП більш ніж 35 років тому. З того часу проведено багато проспективних досліджень, які довели ефективність фториду натрію (оссін, кореберон) або двонатрієвої солі монофлюорофосфату (трідін, флюокальцик) по відношенню до приросту МЩКТ у трабекулярній кістковій тканині. Застосування фторидів потребує неабиякого терпіння від лікаря та хворого, так як ефект від лікування з’являється повільно, а частота побічних реакцій на протязі перших 6 місяців лікування вища (15-50%), ніж при довготривалій терапії. Теоретично ці препарати більше показані при ОП з низьким кістковим обміном, з переважним пригніченням кісткоутворення, а також із значним ушкодженням трабекулярної кістковоїтканини.
Анаболічні стероїди давно застосовуються при лікуванні хворих на ОП. За хімічною структурою вони відносяться до андрогенів, відрізняючись від них сильною анаболічною дією і значно меншим андрогенним ефектом. Основна дія анаболічних стероїдів на клітини кістки засновується на дозозалежному збільшенні їхньої клітинної проліферації та збільшенні активності лужної фосфатази, що продукується остеобластами. До цього часу анаболічні стероїди втратили значення для монотерапії ОП, так як мають значну кількість побічних ефектів при довгостроковому безперервному застосуванні.
Паратиреоїдний гормон (ПТГ) є головним регулятором обміну кальцію, і більшість лікарів визнають за ним тільки цю властивість, в той час, як переконливо продемонстрований анаболічний ефект ПТГ на кісткову тканину в режимі малих доз. В останні роки знову зросла цікавість до використання фрагментів ПТГ як для монотерапії хворих на ОП, так і в комбінації з іншими препаратами (активними метаболітами вітаміну D, естрогенами, кальцитоніном) для додаткової дії на кортикальну кістку. Побічні явища при лікуванні препаратами ПТГ виникають рідко. В наш час відома ін’єкційна лікарська форма, випробовується ПТГ у вигляді назального спрею, розробляються препарати у вигляді нашкірного пластиру.
Необхідно відзначити універсальність терапії активними метаболітами вітаміну й як при первинному, так і вторинному ОП, і можливість комбінування практично із всіма препаратами для лікування ОП. Важливо підкреслити, що довгострокова терапія активними метаболітами вітаміну D (альфакальцидолом і кальцитриолом) не дає значного приросту маси кістки. Але значно знижується частота нових переломів кісток (майже на 70%), особливо після двох років лікування.
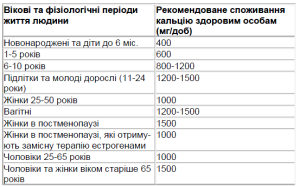
Доведено, що солі кальцію самостійного значення в терапії хворих на ОП не мають, але вони відіграють важливу роль у первинній його профілактиці і необхідні при комплексному лікуванні із застосуванням антиостеопоротичних препаратів [5]. Більшість дослідників згідні з рекомендаціями щодо оптимального споживання кальцію, які розроблені Національним інститутом здоров’я США (опубліковані в 1994 р.) для первинної профілактики ОП (табл. 2). При цьому необхідно враховувати той факт, що середнє споживання з їжею кальцію складає 600-800 мг за добу, і тому для досягнення профілактичного ефекту добавляють кальцій у вигляді його солей. Крім того, жінкам, які приймають ЗГТ в постменопаузі, доцільно призначати 1 г елементарного Са і 400 МО вітаміну D, а тим, які не отримують ЗГТ, 1,5 г елементарного Са і 400-600 МО вітаміну D [9]. В період ранньої менопаузи застосування 1 г Са увечері призводить до пригнічення кісткової резорбції [10]. Це пов’язано з циркадними коливаннями кісткової резорбції, яка максимально виражена в ранкові часи, що зумовлено викидом паратгормону. Таким чином, вечірнє застосування елементарного кальцію є прикладом раціональної хронофармакотерапії [1].
Таблиця 2. Оптимальне споживання кальцію в різні періоди життя людини [5]
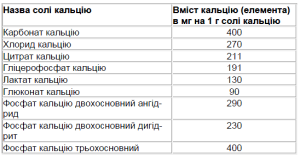
Як видно з табл. 2, додатковий кальцій необхідний майже в усіх періодах життя людини, починаючи з підліткового. Споживання кальцію може розглядатися як міра первинної профілактики ОП. Для вибору препарату кальцію і досягнення оптимальної дози необхідно знати відсотковий вміст кальцію в його солі (табл. 3).
Як видно з табл. 3, найменший його вміст у поширеному в Україні глюконаті кальцію, якого потрібно 11 таблеток по 0,5 г для призначення 500 мг кальцію на день. Найбільша кількість кальцію у карбонаті кальцію. Він показаний пацієнтам з нормальною та підвищеною шлунковою секрецією, а препарати, що містять цитрат кальцію найбільш показані для пацієнтів, що мають гіпота антацидні стани. В наш час на фармацевтичному ринку з’явилася велика кількість препаратів кальцію, що є поєднанням його солей у водорозчинній формі (наприклад, кальцій-форте Сандоз, 1 пігулка вміщує 500 мг кальцію), так і комбінацію солі кальцію з вітаміном D і/або різноманітними мікроелементами. Додавання фізіологічної дози вітаміну D (як правило, в 1 пігулці вміщується половина добової фізіологічної дози вітаміну) покращує всмоктування кальцію. Прикладом таких препаратів можуть служити вітрум-кальціум D або кальційD-З, 1 пігулка яких вміщує 500 мг кальцію і 200 од вітаміну D.
Не всі дослідники поділяють концепцію підвищеного споживання кальцію, вважаючи, що високий його вміст не попереджує втрати маси кістки та переломів кісток. Але практично жодна терапевтична програма лікування не планується без призначення солей кальцію додатково до базового лікувального препарату. Це зумовлено гіпокальціємічною дією більшості антирезорбтивних препаратів, можливими порушеннями мінералізації як в результаті застосування ряду антиостеопоротичних засобів, так і при поєднанні ОП та остеомаляції, особливо у літніх людей.
Сучасні критерії ефективності лікування ОП передбачають:
— оцінку динаміки МЩКТ за даними кісткової денситометрії (найбільш поширене вимірювання МЩКТ у поперекових хребцях, проксимальних відділах стегнової кістки методом подвійної енергетичної рентгенівської абсорбціометрії DEXA),
— оцінку впливу терапії на біохімічні маркери метаболізму кісткової тканини, на частоту появи нових переломів кісток за даними рентгенографії, а також на клінічні прояви ОП [5].
До профілактичних заходів ОП відносяться [2]:
— застосування комбінованих оральних контрацептивів у репродуктивному віці;
— раціональне харчування з достатнім вмістом кальцію;
— відмова від нікотину та алкоголю;
— рухлива активність;
— ЗГТ в клімактеричному віці (до 50 років).
Отже, профілактика та лікування хворих на ОП є важливою медико-соціальною проблемою внаслідок широкого поширення даної патології та значних економічних витрат на лікування. Тому особливу увагу необхідно приділяти популяризації здорового способу життя, визначенню груп ризику, первинній профілактиці, ранній діагностиці та лікуванню. Терапія ОП в постменопаузі вимагає диференційованого, індивідуального підходу з врахуванням гінекологічної та соматичної патології. Цілеспрямоване призначення лікарських препаратів приносить безсумнівну користь жінкам. Notelovitz [7] сказав, що в сучасних умовах основними патологічними станами, які супроводжують постменопаузу, є «не напливи жару, а загрожуючі кожній четвертій жінці до 65 років стани фізичної та психічної інвалідності». З цією думкою дуже важко не погодитися і саме це пояснює зростаючу роль лікаря акушера-гінеколога в попередженні патології клімаксу.
Література
- Кудрина Е.А., Курочкина И.В. Остеопороз в постменопаузе // Акушерство и гинекология. 2003. № 4. С. 711.
- Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические лекции по гинекологической эндокринологии. М.: Медицинское информационное агентство, 2001. 247 с.
- Поворознюк В.В., Григор’єва Н.В. Менопауза та остеопороз. К., 2002. 356 с.
- Риггз Б.Л., Мелтон Л.Дж. Остеопороз: Пер. с англ. М.; СПб, 2000.
- Рожинская Л.Я. Патогенетическое лечение постменопаузального и сенильного остеопороза // В мире лекарств. 1999. № 1. с. 40-45.
- Руководство по эндокринной гинекологии: 3-е изд., стер. / Под ред. Е.М.Вихляевой. М.: Медицинское информационное агентство, 2002. 768 с.
- The climacteric and osteoporosis. Material to forthcoming symposia. Ed. Notelovitz //Clin. Obstet. Gynecol. 1987, Vol. 30, № 4, р.787884.
- Gallager J., Nordin B. Oestrogen and calcium metabolism // Ageing and estrogens. Basel: Karger, 1973, Vol. 2, р. 98-117.
- Osteoporosis: review of the evidence for prevention, diagnosis and treatment and costeffectiveness analysis //Osteoporos. Int. 1998. Vol. 8. Suppl. 4. P. 31-35.
- Parfitt A.M. //The Osteoblast and Osteocyte /Ed. B. K. Hall. Caldwell, N. J., 1990. р. 351-429.











Комментировать