М.М. Островський, д.м.н., професор,
М.П. Стовбан, Івано-Франківський національний медичний університет
Незважаючи на низку досягнень та успіхів у вивченні причин виникнення та лікуванні хворих на негоспітальну пневмонію (НП), і на сьогоднішній день запалення легень залишається поширеною та соціально значущою нозологією, актуальною для різних вікових груп населення [1].
Парадокс полягає в тому, що за останні десятиліття досягнуто вражаючих результатів у дослідженні етіопатогенезу та оптимізації діагностики й лікування НП [2], а з другого – перебіг запалення легень за наявності супутньої соматичної патології набуває більш агресивного і неконтрольованого характеру [3], що призводить до зростання смертності [4]. У сучасній літературі є чимало досліджень, присвячених вивченню особливостей діагностики та лікування пацієнтів із легеневою патологією та порушеннями з боку інших систем, проте кількість даних щодо поєднання пневмонії та анемічного синдрому (АС) обмежена.
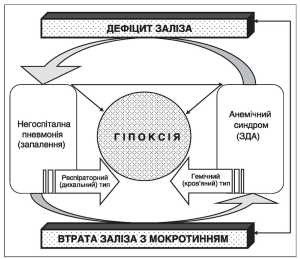
За наявності АС, зокрема залізодефіцитної анемії (ЗДА), окрім анемічної гіпоксії і сидеропенії, які розвиваються внаслідок порушення обміну заліза, спостерігаються глибокі вторинні порушення обміну низки біологічно активних речовин, що зумовлюють появу й прогресування синдрому ендогенної метаболічної інтоксикації [5], глибина та вираженість якого залежать від ступеня анемії та гіпоксії [6] (рис.). Вказані процеси можуть спричиняти вторинні імунні порушення. У разі подальшого наростання гіпоксії, за умови розвитку НП, відбувається активація міофібробластів та фібробластів із подальшим синтезом ними колагену IV типу [5]. Ці зміни сприяють посиленню клінікофункціональних проявів НП, а також зумовлюють потребу в інтенсифікації медикаментозної терапії.
Як видно з рисунка, у разі поєднання НП з АС виникають два типи гіпоксії – респіраторний (дихальний) та гемічний (кров’яний), які посилюють один одного.
Дисфункція клітин респіраторного відділу, наслідком якої є порушення вентиляції легень, газообміну, проникності легеневих капілярів, та зміни цитоплазматичних мембран ендотеліальних та епітеліальних клітин [7] призводять до гіпоксії дихального типу, яка пошкоджує аерогематичний бар’єр легень із подальшою десквамацією епітелію, мікроділянками некрозу та абсцедуванням [7]. У результаті цих процесів розвивається первинний набряк тканини легень, а потім внутрішньоальвеолярний [7].
Під час пневмонії шляхом виділення мокротиння відбувається втрата заліза, а це значно обтяжує вже існуючу гіпоксію та сповільнює клінічне видужання пацієнтів [8]. Гіпоксія, у свою чергу, викликає звуження артерій легенів, що сприяє перерозподілу крові з погано вентильованих відділів легень у відділи з кращою вентиляцією. Однак при цьому підвищується легеневий судинний опір, що збільшує навантаження на правий шлуночок [8]. Різні подразники (інфекція, біологічно активні речовини, токсини) збуджують дихальний центр, що супроводжується збільшенням частоти дихання та зменшенням його глибини. Задишка, що виникає при цьому, призводить до кисневої недостатності; на розвиток останньої впливає також порушення дифузії.
Кисневу недостатність посилює і вторинний бронхоспазм, наслідком якого є респіраторна гіпоксемія. Наростаюча киснева недостатність призводить до збільшення задишки і зростання вираженості гіпоксемії, виникає своєрідне хибне коло, яке стимулює продукцію радикалів кисню в клітинах, що беруть участь у фагоцитозі (нейтрофілах, макрофагах), та супроводжується респіраторним вибухом [8].
Рис. Виникнення гіпоксії в організмі хворих на негоспітальну пневмонію, поєднану з анемічним синдромом
Отже, цілком закономірним є припущення, що вказані особливості патогенезу відображені в певних клінічних характеристиках розвитку та перебігу НП у хворих із АС. Ми спробували виділити найбільш характерні синдроми НП на фоні АС на підставі оцінки даних 152 хворих. Слід зазначити, що в осіб, у яких поєднувалися НП та АС, кашель супроводжувався виділенням слизово-гнійного мокротиння, яке в більшості пацієнтів було в’язким, «іржавим» або з прожилками крові. Для пацієнтів лише з НП був характерний переважно сухий кашель, який тривав упродовж усього періоду хвороби, а кількість мокротиння була незначною; воно мало світлий колір та в’язку консистенцію.
Пацієнти із НП на фоні АС в 1,4 раза частіше (р<0,05) скаржилися на біль у грудях (переважно колючий, локалізований на стороні ураження), який часто посилювався під час кашлю та глибокого дихання, що свідчило про ураження плеври. Одними з типових скарг хворих із НП у поєднанні з АС були нежить та біль у горлі, що супроводжувався порушенням ковтання (синдром ПламмераВінсона). Наявність задишки під час звичайних фізичних навантажень практично у всіх пацієнтів із НП у поєднанні з АС свідчила про поглиблення респіраторного типу гіпоксії шляхом приєднання гіпоксії гемічного типу. На міалгії та запаморочення скаржились у 2,0 рази більше (р<0,05) хворих із НП у поєднанні з АС порівняно з пацієнтами із НП без супутньої патології.
У хворих із НП у поєднанні з АС гіпертермія набувала постійного або інтермітуючого характеру з великими добовими коливаннями протягом одного тижня (у 100% випадків супроводжувалася ознобом та вираженою пітливістю), тоді як в осіб із НП частіше спостерігалося разове гектичне підвищення температури тіла до ≥39 °С.
Слід відзначити, що серед хворих із НП у поєднанні з АС переважали пацієнти молодого віку, які працюють у великих колективах і які захворіли гостро в осінньозимовий період та мали в анамнезі часті простудні захворювання. Цікаво, що отримані нами дані стосовно епідеміології співставні з даними Д.Р. Ракити і співавт. [9]: у пацієнтів із НП у поєднанні з АС найчастіше виявлялися пневмокок і Mycoplasma pneumoniae.
Аналіз результатів дослідження периферійної крові показав, що в переважної більшості хворих показники червоної крові були дещо нижчими від норми. Проте під час перебігу НП у поєднанні з АС у пацієнтів спостерігалася тенденція до зростання ШОЕ понад 30 мм/год, а для НП характерними були високий нейтрофільний лейкоцитоз та ШОЕ у межах 20-30 мм/год.
Отримані результати лабораторно-інструментального аналізу свідчать, що у пацієнтів із запаленням легень на фоні АС відбувається значне виснаження системи сурфактанта легень, що, ймовірно, необхідно розцінювати як наслідок дисбалансу системи альвеолярних макрофагів в умовах перевантаження антигенними стимулами та продуктами запалення. Подальші дослідження імунної системи встановили наявність вторинного імунодефіциту, який був більш вираженим у разі поєднання НП й АС та проявлявся зменшенням в бронхоальвеолярному вмісті рівнів IFNα — аза (р<0,05), зростанням концентрацій TNFα 1,14 (р<0,05) та ІЛ-6 у 2,2 раза. Аналіз отриманих даних свідчить про достовірне зниження рівня лізоциму в бронхоальвеолярному вмісті у хворих із НП у поєднанні з АС у 1,6 раза (р<0,05) порівняно з таким показником у пацієнтів із НП.
Слід звернути увагу на те, що у хворих із АС, у яких розвинулася НП, показник лізоциму та рівень сироваткового заліза мають прямий і середній кореляційний зв’язок (rx,y=0,68±0,02); рівень ІЛ-6 та залізо сироватки крові – зворотний сильний зв’язок, коефіцієнт лінійної кореляції rx,y=-0,86±0,06 (р<0,05); вміст TNFα іза – зворотний сильний зв’язок, коефіцієнт парної кореляції rx,y=0,84±0,13 (р<0,05).
Таким чином, величина змін імунної реактивності (порушення місцевої бар’єрної функції слизових оболонок дихальних шляхів, цитокінового каскаду та системи ендогенних інтерферонів) чітко корелює з наявністю супутнього АС у НП.
У пацієнтів із НП відсутній сидеропенічний стан, у той же час розвиток НП у хворих із АС характеризується збільшенням рівня колагену ІV типу, що є свідченням активації фібробластів в умовах поєднання гемічної та дихальної гіпоксії.
Розвиток НП у хворих із АС частіше може ускладнюватися плевритом, бронхообструктивним синдромом, набувати затяжного перебігу (понад 28 днів) – про це у своїх роботах вказують S. Blackwell і співавт. [10]. За нашими даними, у результаті НП на фоні АС частіше розвивається постпневмонічний пневмосклероз («одужання з дефектом»), що підтверджено в отриманих нами даних стосовно динаміки синтезу колагену ІV типу.
На думку багатьох науковців, у сьогоднішніх умовах подолати зростання захворювань, спричинених бактеріальною інфекцією, за допомогою лише антибіотиків практично неможливо. Ми вважаємо, що використання методів, які стимулюють репаративні процеси і модулюють імунну відповідь, дасть можливість не тільки прискорити процеси інволюції запального процесу, а й зменшити загальний термін лікування, особливо у разі супутньої патології. Застосування в комплексному лікуванні хворих із НП у поєднанні з АС лікарських засобів, що мають антигіпоксичну, мембраностабілізуючу та антиоксидантну дію, сприяє більш ранньому усуненню вторинних метаболічних порушень.
У більшості випадків антибіотики пригнічують життєздатність та розмноження збудників захворювання, але кінцева їх елімінація з організму є результатом діяльності імунної системи [11]. Оптимальний клінічний ефект може бути досягнутий за наявності синергізму дії захисних сил організму та антимікробних лікарських засобів [11]. У ситуації, що склалася, все більшу увагу вчених привертають макроліди, які характеризуються високою активністю не лише стосовно пневмокока, а й відносно M. pneumoniae – одного з основних атипових збудників запалення легень за наявності супутнього АС [11]. Макроліди покращують фагоцитарну активність нейтрофілів і макрофагів [12], мають антиоксидантні властивості й пригнічують утворення та вивільнення з альвеолярних макрофагів NO, що також зменшує інтенсивність запалення у дихальних шляхах [12].
З урахуванням вищесказаного у разі призначення антибактеріальної терапії пацієнтам із НП у поєднанні з АС слід дотримуватися таких принципів.
1. Призначення лікування згідно чинного протоколу [4], проте в комбінації з одним із антимікробних препаратів необхідно застосовувати макролід (зважаючи на наявні етіологічні особливості НП).
2. Через 48-72 год від початку антибіотикотерапії слід оцінити її дієвість та ефективність. Основними критеріями останньої в ці терміни слід вважати зменшення вираженості інтоксикації, зниження температури тіла, відсутність ознак дихальної недостатності. Якщо на початку лікування у пацієнта не було цих проявів захворювання, слід орієнтуватися на його загальний стан та показники загального клінічного аналізу крові (кількість лейкоцитів, ШОЕ). За наявності позитивної динаміки наведених показників продовжувати призначену антибактеріальну терапію.
3. Використовувати ступінчасту терапію двоетапне застосування антибактеріальних препаратів із переходом з парентерального на непарентеральний (як правило, пероральний) шлях введення в максимально короткі терміни з урахуванням клінічного стану пацієнта. Основна ідея ступінчастої терапії полягає в скороченні тривалості парентерального введення антибактеріального препарату, що може привести до значного зниження вартості лікування, зменшення терміну перебування в стаціонарі та збереження високої клінічної ефективності терапії. Тривалість переходу з парентерального на пероральний шлях введення антибіотика становить 48-96 год. Умови такого переходу: досягнення клінічного покращення та відсутність у хворого факторів ризику несприятливого прогнозу пневмонії. Використовують пероральну форму того ж препарата, який застосовувався парентерально; якщо така відсутня, обирають пероральний антибіотик із аналогічним спектром активності. Особливе значення має режим дозування, від якого залежить комплаєнс. Перевагу надають антибіотикам, які приймають 1-2 рази на добу.
4. Забір матеріалу для мікробіологічного обстеження необхідно здійснювати до початку антибіотикотерапії. У разі дотримання правил збору та обробки мокротиння за результатами із певною вірогідністю можна зробити висновок про мікрофлору нижніх відділів дихального тракту та патологічного вогнища в легеневій паренхімі. Забір мокротиння необхідно проводити до їди, після полоскання горла та порожнини рота теплою водою або розчином питної соди (1 чайна ложка на склянку води). Мокротиння під час вільного відкашлювання (краще першуранкову порцію) необхідно зібрати в стерильний контейнер із кришкою. Якщо воно відділяється погано, напередодні слід прийняти відхаркувальні засоби. Характерними ознаками неправильно зібраного мокротиння є такі:
- пінистий або слизовий характер;
- водянистість;
- білий колір, наявність частинок їжі.
5. Під час лікування хворих із НП у поєднанні з АС слід звернути увагу на подолання патогенетичних ознак анемії: дефіциту заліза та ендогенної метаболічної інтоксикації. З цією метою такі пацієнти повинні отримувати препарати заліза (наприклад, заліза сульфат (ІІ) з аскорбіновою кислотою по 1 таблетці 2 р/добу для відновлення дефіциту заліза в крові та тканинах) та засоби з імуностимулюючим, антиоксидантним та десенсибілізуючим ефектом (наприклад, 0,25% розчину хлорофіліпта, який необхідно вводити повільно внутрішньовенно по 2 мл, попередньо розчинивши в 38 мл стерильного ізотонічного розчину, протягом 3 днів, у подальшому – у дозі 0,025 г/добу по 1 таблетці кожні 4-5 год. упродовж 7 днів). Завдяки акцепторній дії щодо активних форм кисню хлорофіліпт впливає на ацидоз і гіперкапнію, усуває респіраторний тип гіпоксії [14]; за рахунок антиоксидантних властивостей здатен потенціювати дію заліза сульфату (ІІ) з аскорбіновою кислотою, що, у свою чергу, пришвидшує відновлення вмісту заліза в організмі [14].
Отже, недооцінка впливу супутньої патології, зокрема АС, на перебіг НП призводить до підвищення ризику розвитку у хворих затяжного перебігу запалення легень та низки інших ускладнень (постпневмонічного пневмосклерозу, плевриту, бронхообструктивного синдрому); порушення локального захисного бар’єру слизових оболонок дихальних шляхів; пригнічення імунної відповіді.
Своєчасне виявлення у хворих із НП супутнього АС надасть змогу використовувати випереджувальну лікувальну тактику і суттєво зменшить витрати та термін госпіталізації, покращить ефективність і дієвість лікування пацієнтів, якість їхнього життя.
Література
1. Фещенко Ю.І. Раціональна антибіотикотерапія інфекцій нижніх дихальних шляхів / Ю.І. Фещенко, О.Я. Дзюблик // Здоров’я України. – 2011. – № 2 (255). – С.19-10.
2. Read R. Respiratory tract infections and fluoroquinolones / R. Read, I. Morrissey, J. Ambler. –2002. – Р. 85.
3. Синопальников А.И., Козлов Р.С. Внебольничные инфекции дыхательных путей. Руководство для врачей. – М.: Премьер МТ, Наш Город, 2007. –352 с.
4. Наказ МОЗ України № 128 від 19.03.2007 р.«Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Пульмонологія». – К., 2007. – 146 с.
5. Testa U. Recent developments in the understanding of iron metabolism / U. Testa // The Hematology J. –2002. – № 3. – P. 63-89.
6. Видиборець С.В. Патогенетичні механізми формування синдрому метаболічної інтоксикації у хворих на залізодефіцитну анемію та його корекція / С.В. Видиборець // Буковинський медичний вісник. – 2002. – Т. 6, № 1. – С. 26-29.
7. Шевченко Ю.Л. Гипоксия. Адаптпция, патогенез, клиника / Ю.Л. Шевченко. – СПб.: ООО «ЭЛБИ-СПб», 2000. – 384 с.
8. Колпакова А.Ф. Содержание некоторых биоэлементов и электронные парамагнитные характеристики биосред больных хроническими неспецифическими заболеваниями легких на Севере / А.Ф. Колпакова, К.Р. Седов, Н.Г. Максимов // Пульмонология. – 1995. – № 3. – С. 70-74.
9. Пневмония: Методические указания / Д.Р. Ракита [и др]. – Рязань, 2004. – 28 с.
10. Blackwell S. Common anemias: what lies beneath / S. Blackwell, P.C. Hendrix // Clin. Rev. – 2001. – Vol. 11, № 3. – P. 53-62.
11. The Alexander project 1998-2000 / M.R. Jacobs [et al.] // J Antimicrob Chemother. – 2003. – № 52 (2). – Р. 229-246.
12. Macrolides and lower respiratory tract infections /J. Dorca [et al.] // In book: Antibiotics and the Lung. –ERM, 2004.– Vol. 9.– P. 78-93.
13. Островський М.М. Оцінка впливу азитроміцину на перебіг негоспітальної пневмонії та вміст маркерів запалення в бронхоальвеолярному секреті /М.М. Островський, М.П. Стовбан // Ліки України. –2008. – № 9. – С. 58-63.
14. Надтока В.Л. Результаты экспериментального и клинического изучения хлорфиллипта / В.Л.Надтока // Микробиология, эпидемиология и клиника инфекционных болезней: Сб. науч. тр. /Харьк. мед. ин-т. – Харьков. – 1978. – Т. 9. – С. 93-97.
Источник: health-ua.com








Комментировать