Закладка и формирование органов иммунной системы. Особенности формирования органов иммунной системы в онтогенезе. Принципы гигиенической гипотезы и ранняя профилактика аллергии.
Л.П. Титов, Е.Ю. Кирильчик, Т.А. Канашкова
Белорусский НИИ эпидемиологии и микробиологии, Минск
Белорусский государственный медицинский университет
Развитие индивидуума в онтогенезе происходит в соответствии со свойственной ему стратегией генома, т.е. совокупностью и особенностями реализации генетической информации, закрепленной предшествующей эволюцией и унаследованной от родителей. В определенные периоды происходят события, включающие/выключающие механизмы регуляции некоторых групп генов иммунной системы, ответственных за морфофункциональное становление, единство, эффекторную и регуляторную эффективность неспецифических и специфических процессов иммунологического надзора и противоинфекционного иммунитета.
С этой точки зрения наиболее важными в развитии иммунной системы человека являются внутриутробный и детский периоды.
Закладка и формирование органов иммунной системы
Фетальная печень играет важную роль в кроветворении плода и по своей функции вполне может рассматриваться как орган иммунной системы. В фетальной печени и кровяных островках желточного мешка на 3–8-й неделе эмбриогенеза появляются первые стволовые клетки. Наибольшее значение печень имеет для развития, созревания и дифференцировки В-клеток.
Костный мозг закладывается на 4–5-й неделе эмбриогенеза и с этого времени выполняет все функции центрального органа иммунитета.
Тимус формируется в области 3–4-го глоточных карманов. Его закладка происходит на 4–5-й неделе. К 6-й неделе тимус характеризуется эпителиальной структурой, на 7–8-й — заселяется лимфоцитами, а к концу 12-й недели его формирование завершается.
Селезенка также закладывается на 5–6-й неделе.
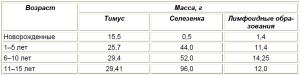
На 5–6-й неделе происходит закладка лимфатических узлов и других вторичных лимфоидных органов. На 9–14-й неделе закладываются миндалины (вначале нѐбная и глоточная), затем начинают развиваться лимфоидные узелки аппендикса и лимфоидные бляшки тонкой кишки (14–16-я неделя), языка (24–25-я) и трубные миндалины (28–32-я). Закладка лимфоидных образований происходит под эпителием пищеварительной трубки в виде скопления эпителия, трансформирующегося в ретикулярную ткань. Именно в эту ткань впоследствии заселяются лимфоидные клетки и их предшественники. Окончательное формирование первичных и вторичных лимфоидных органов заканчивается в постнатальном периоде (табл. 1).
Таблица 1.


Таблица 2. Эволюция массы органов иммунной системы и лимфоидных образований
Особенности формирования органов иммунной системы в онтогенезе:
- ранняя закладка органов иммунной системы e) выраженная вариабельность (в 2–3 раза) в эмбриогенезе; массы лимфоидной ткани и количественного
- морфофункциональную основу паренхимы содержания клеток иммунной системы (поорганов составляет лимфоидная ткань; лиморфно- и мононуклеарных фагоцитов,
- к моменту рождения основные органы дости- лимфоцитов) в популяции детей и взрослых; гают достаточной для развития адекватного f) ранняя возрастная инволюция (старение) адаптивного иммунного ответа зрелости; лимфоидной ткани, особенно тимуса, замещение ее соединительной и жировой тканью.
Формирование неспецифических механизмов резистентности в онтогенезе
Неспецифические механизмы иммунной системы играют первостепенную роль в защите организма ребенка на ранних этапах онтогенеза. Они включают гуморальные и клеточные факторы.
В эмбриональном периоде общая активность системы комплемента плода по классическому пути выявляется уже на 6–8-й неделе и составляет около 60% таковой взрослого человека, а активность альтернативного пути — примерно 35– 50%. Соответственно выявляется и гемолитическая активность отдельных компонентов — С1–С9, а также факторов альтернативного пути данной системы — В, I, Р, Н. Основную роль в биосинтезе компонентов комплемента играет печень.
Содержание фибронектина (компонента внеклеточного матрикса) у плода составляет 50% концентрации взрослых. Он выполняет важную защитную функцию. При снижении его биосинтеза у детей развиваются респираторные инфекции, респираторный дистресс-синдром, бактериемия и сепсис.
Биосинтез цитокинов (интерферонов и некоторых интерлейкинов) отмечается на 10-й неделе и также составляет 40–50% уровня взрослых.
Фагоцитарная функция гранулоцитов плода формируется к 12-й неделе беременности и, как правило, носит незавершенный характер. Это обусловлено сниженным хемотаксисом, а также несовершенством внутриклеточных механизмов бактерицидности.
Система мононуклеарных фагоцитов (моноциты, макрофаги) плода в это время тоже функционально неполноценна.
Одним из важнейших факторов естественного иммунитета являются дендритные клетки (ДК). У плода и новорожденных они характеризуются выраженной недостаточностью антигенпрезентирующей функции и способности стимулировать CD4+Tх 1 типа. ДК нуждаются в поступлении в организм микроорганизмов и их компонентов, которые стимулируют их созревание и повышают продукцию цитокинов (ИЛ-12), поддерживающих развитие Tх 1 типа. Определенную роль играет полиморфизм рецепторов, способных распознавать паттерны патогенности микроорганизмов, – TLRs и CD14. Уровень экспрессии этих рецепторов на мембране клеток естественного иммунитета и наличие в окружающей среде компонентов микробного происхождения (ЛПС, РНК, ДНК, пептидогликанов) обеспечивают постоянную стимуляцию ДК, более эффективное созревание и способствуют «обучению» CD4+Tх 1 типа, повышают их количественное содержание и функциональную активность.
Функция естественных киллеров отличается низким уровнем активности.
Формирование иммунологической компетентности В-система лимфоцитов плода
Пре-В-лимфоциты выявляются у плода в фетальной печени на 8-й неделе гестации. Экспрессия Влимфоцитами s-IgM проявляется на 10-й неделе. Фетальные В-клетки экспрессируют только молекулы IgM, без экспрессии IgD. Экспрессия s-IgA, IgG и IgD определяется с 11–12-й недели беременности. В этот же период отмечается повышенная экспрессия В-лимфоцитами молекулы CD5.
В-лимфоциты новорожденных дифференцируются в плазматические клетки, секретирующие IgM, но они не могут переключаться в клетки, продуцирующие IgG и IgA. Это объясняется недостаточно эффективной помощью со стороны СD4+ Тлимфоцитов-хелперов.
Синтез собственных специфических антител IgM изотипа плазматическими клетками плода отмечается на 20–24-й неделе беременности, в крови присутствует незначительное количество IgM и IgA.
Содержащиеся в крови плода антитела IgG класса имеют материнское происхождение и защищают плод от того спектра патогенов, к которым у матери в процессе жизни сформировался постинфекционный или поствакцинальный приобретенный иммунитет. Транспорт их через плаценту (трансплацентарная передача антител) начинается на 8-й неделе. В концентрации ниже 0,1 г/л они циркулируют в крови плода примерно до 17–20-й недели. Затем их концентрация начинает возрастать (до 30-й недели) и составляет около 5–10% материнского уровня. Эти же антитела формируют пассивный иммунитет, защищающий ребенка от инфекции в первые 3–6 месяцев постнатального периода жизни.
У преждевременно рожденных детей концентрация иммуноглобулинов в крови заметно ниже, чем у родившихся в срок.
Содержание В-лимфоцитов у новорожденных повышенное. Они экспрессируют на мембране клеток молекулы IgM и IgD. В пуповинной крови новорожденных определяются IgM и IgG. IgA и IgE либо не выявляются, либо обнаруживаются крайне редко.
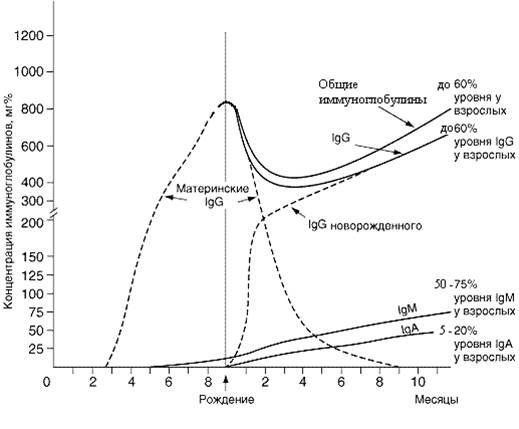
К 3–4-му месяцу жизни происходит становление биосинтеза собственных IgG, и их концентрация к этому времени составляет примерно 30–40% уровня взрослых. В последующем их содержание постепенно возрастает и к концу первого года жизни достигает 50–60% уровня взрослых, уровень IgM сыворотки крови ребенка также практически достигает уровня взрослых. Повышенное содержание IgM в крови новорожденных является неблагоприятным признаком и часто свидетельствует о внутриутробном инфицировании плода (краснуха, сифилис, герпес, ВИЧ и др.).
Специфический иммунный ответ плода развивается на разнообразные внутриматочные инфекции, а также на иммунизацию матери анатоксинами и вакцинами. При внутриутробном инфицировании плода отмечается активация всех компонентов иммунной системы. Продуцируются в основном IgM. Следствием внутриутробного инфицирования плода является повышение вероятности (риска) формирования
разнообразной иммунопатологии в раннем или отдаленном периоде. В ряде случаев синтез антител иммунной системой новорожденного может начинаться с существенной задержкой или вовсе отсутствовать. Ответ иммунной системы на полисахаридные антигены отмечается у новорожденного с 6-го месяца. Иммунный ответ на белковые антигены возможен преимущественно при оказании помощи Влимфоцитам со стороны Т-лимфоцитов посредством прямого контакта, но он значительно слабее, чем у детей старших возрастов и взрослых.
Продукция собственных IgА заметно отстает и к концу первого года составляет только 25–30% уровня взрослых. Секреторные IgA и специфические антитела данного изотипа в секретах появляются на 3–4-м месяце жизни. Содержание IgG и IgA у детей 5–6 лет достигает уровня взрослых. Уровень секреторных IgA у детей в 3–4 раза ниже, чем у взрослых, и достигает их концентрации только к 10–15 годам. Иммунный ответ детей на полисахаридные вакцины – гемофилюс инфлуенца, псевдомонас и пневмококк — ослаблен вплоть до 2-летнего возраста.
В крови новорожденных IgE не выявляются, 4–6 годам их концентрация увеличивается и к 8–11 годам достигает уровня взрослых.
Т-система иммунитета плода и новорожденного
Протимоциты-CD7+-клетки выявляются в фетальной печени и желточном мешке плода на 7-й неделе беременности. Т-клетки с фенотипом CD4+ и CD8+ появляются в фетальной печени и селезенке плода на 14-й неделе гестации.
В кроветворных и лимфоидных органах 14–28недельных плодов человека отсутствуют клетки с классическим мембранным фенотипом Treg (CD4+CD25+) при одновременном наличии Тклеток с экспрессией гена FOXP3, кодирующего фактор транскрипции, который контролирует развитие Treg. У плода отмечается повышенное соотношение CD4+/CD8+ Т-клеток, которое к периоду новорожденности постепенно снижается до 3,0– 2,5, а в возрасте 6–7 лет соответствует таковому взрослых.
Все неонатальные Т-лимфоциты экспрессируют молекулу CD38+ (маркер тимоцитов). 90% неонатальных Т-клеток экспрессируют CD45RA (маркер наивных Т-клеток), до 60% Т-клеток — CD45RO (маркер клеток памяти).
Неонатальные Т-клетки и Т-клетки новорожденных пролиферируют на митогены – КонА, ФГА (а также аллогенные антигены и суперантигены) существенно слабее, чем Т-лимфоциты взрослых. Они продуцируют определенный спектр цитокинов – ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4 (примерно 10% уровня взрослых), ИЛ-5, ИЛ-6, ИЛ-8 (10–50% уровня взрослых).
Содержание интерферонов α и β, ФНО-α соответствует уровню взрослых, а γ-интерферона составляет 10% нормы.
Регуляторная функция Т-системы лимфоцитов несовершенная и ослабленная. Низкое содержание иммуноглобулинов и невозможность переключения классов иммуноглобулинов связаны с недостаточностью образования соответствующих цитокинов, снижением экспрессии их рецепторов (ИЛ-2R) и молекулы CD40L на мембране Тлимфоцитов.
Цитотоксическая активность Т-лимфоцитов составляет 30–60% уровня активности Т-клеток взрослого человека.
Способность Т-системы плода к реакциям отторжения начинает проявляться с 13-й недели внутриутробного периода, а к реакциям гиперчувствительности замедленного типа — гораздо позже.
Формирование атопического статуса плода и новорожденного
Воздействие аллергенов, характер питания, курение и инфекции у матери играют первостепенную роль в стимуляции иммунной системы плода, развитии потенций и направленности иммунного ответа. Т-клеточный иммунный ответ на первичное воздействие аллергена может диктовать природу и направление формирования иммунологической памяти в последующие, более поздние периоды жизни ребенка.
Раннее воздействие на организм аллергенов, когда иммунная система менее зрелая, наиболее предпочтительно для преимущественной и избыточной стимуляции функции Tх 2 типа. Особенно ярко это проявляется у генетически предрасположенных к иммунопатологии индивидуумов.
Иммунная система плода, как правило, реагирует на воздействие аэро- и пищевых аллергенов, поступающих в материнский организм в период беременности, специфическим лимфопролиферативным иммунным ответом и биосинтезом аллергенспецифических антител. Таким образом, спектр неблагоприятных привычек матери, ее профессиональная деятельность в экологически агрессивной среде и особенности поведения в значительной мере определяют направленность сенсибилизации и специализированного аллергенспецифического обучения иммунной системы плода. То есть иммунная система плода оказывается своеобразным заложником наследования генетических, поведенческих и средовых факторов матери, предрасполагающих к развитию аллергии или, наоборот, защищающих его.
Существенные различия в способности развивать аллергенспецифический ответ имеются у «атопических» и «неатопических» индивидуумов. Иммунный статус новорожденных характеризуется доминированием функции СD4+Tх 2 типа и повышенным синтезом соответствующего спектра цитокинов (ИЛ-4, ИЛ-5, ИЛ-13). С другой стороны, у новорожденных с высоким риском развития атопии понижена продукция ИФН-γ и, соответственно, функция CD4+Tх 1 типа. В постнатальном периоде, в первые годы жизни у «неатопических» детей избыточная функция Tх 2 типа быстро падает, при этом достигается баланс между количественным и функциональным состоянием субпопуляций Tх2/Tх1, характерный для иммунного статуса нормального индивидуума. В противоположность этому у детей с «атопическим» статусом избыточная функция CD4+Tх 2 типа поддерживается и впоследствии может усугубляться. Так, у новорожденных содержание Т-лимфоцитов составляет 2500–4000 кл./мкл, что существенно выше, чем у ребенка и взрослого. В табл. 3 представлены данные о количественном содержании Т-лимфоцитов у детей разных возрастных групп. С возрастом отмечается снижение общего содержания Т-лимфоцитов и субпопуляций CD4+ и CD8+ Т-клеток, причем количество CD4+ Т-лимфоцитов уменьшается более быстрыми темпами.
Принципы гигиенической гипотезы и ранняя профилактика аллергии
Гигиеническая гипотеза, предложенная Strachan в 1989 г., обосновывала взаимосвязь между количеством членов семьи, семейной/персональной гигиеной и чувствительностью к аллергическим заболеваниям.
На основании полученных данных были сформулированы основные положения гигиенической гипотезы:
- в больших семьях риск развития аллергии снижен;
- повышенный уровень воздействия микроорганизмов на иммунную систему детей защищает их от развития сенсибилизации аллергенами, т.е. обеспечивает профилактику аллергии.
Гигиеническая гипотеза была подкреплена многими исследованиями эпидемиологии атопических заболеваний в развивающихся и развитых странах мира, а также результатами экспериментов.
Предполагают, что первичными мишенями для микробной стимуляции клеток естественного иммунитета (дендритные клетки, моноциты, макрофаги) являются мембранные рецепторы CD14+ и Toll-like. Взаимодействие структур микроорганизмов с этими рецепторами стимулирует повышение активности клеток и их адекватное ситуации созревание. Активированные таким образом ДК «инструктируют» еще незрелую систему Тлимфоцитов к образованию специфических CD4+ и CD8+ эффекторных клеток, Т-клеток памяти и Treg (рис. 2).

Рис. 2.
Особенности внутриутробных инфекций и инфекций первого года жизни
Гистопатологические изменения органов при внутриутробных вирусных инфекциях показывают, что эмбрион человека на ранних стадиях формирования характеризуется исключительной чувствительностью к вирусной инфекции и ее деструктивным эффектам. Этот феномен объясняется множеством факторов:
- быстро делящиеся и метаболически высокоактивные клетки эмбриона — идеальная среда для репликации вирусов;
- клетки незрелого плода больше, чем зрелого, восприимчивы к вирусам;
- противоинфекционные защитные механизмы эмбриона и плода в совокупности не развиты;
- первичные и вторичные лимфоидные органы значительной части плодов отстают в росте и дифференциации;
- неспецифические механизмы защиты и эффективная регуляция специфического иммунного ответа отстают в развитии и неэффективны.
В результате вирусной инфекции в органах развиваются типичные гистопатологические изменения. Они проявляются: интенсивной репликацией вирусов в тканях у места входных ворот; отсутствием тканевого и органного тропизма, т.е. диссеминацией вируса в большинство органов;
персистенцией вирусов в клетках-мишенях, формированием персистенции и хронического течения;
отсутствием выраженной воспалительной реакции, характерной для инфекций постнатального периода; формированием первичных и вторичных эффектов (гибели клеток, ингибиции митоза, ингибиции синтеза интерферонов, токсической деструкцией); интенсивной экскрецией вируса выделительными системами организма.
На возникновение и течение внутриутробных инфекций указывают:
- высокая частота выявления микробоспецифических антител у беременных; высокая частота возникновения инфекции у женщин на разных стадиях беременности; соотношение числа клинических и бессимптомных случаев инфекции при рождении и среди новорожденных; наличие тератогенного эффекта и генетических врожденных дефектов после перенесения вирусной инфекции.
- Наиболее распространенными внутриутробными вирусными инфекциями являются краснуха, герпесвирусная инфекция 1, 2, 3 и 5 типов, корь, гепатит В, лимфоцитарный хориоменингит (ЛХМ), ВИЧ-инфекция, эпидемический паротит.
- Врожденные бактериальные инфекции часто вызываются гонококками, трепонемами, стрептококками, стафилококками, листериями, хламидиями, микоплазмами, уреаплазмами, микобактериями.
- Среди инфекций, вызываемых простейшими, чаще всего выявляется токсоплазмоз.
- У новорожденных присоединяется ряд кишечных вирусных инфекций (ротавирусная, аденовирусная, коксаки-, экхо-, астро-, полио-), а также респираторно-синцитиальная и др. К данным патогенам отмечается повышенная восприимчивость организма новорожденных. Эти инфекции широко распространены во всем мире.
Таким образом, эмбриональный период развития иммунной системы индивидуума характеризуется формированием и созреванием основных звеньев неспецифического (фагоцитарные клетки — микро- и макрофаги, система комплемента, цитокины, естественные киллеры и другие факторы) и адаптивного (В- и Т-системы лимфоцитов; биосинтез иммуноглобулинов (антител) и антигенспецифических рецепторов) иммунитета к встрече с еще неизвестными, но многочисленными факторами окружающей среды биологической или иной природы. Однако иммунная система плода, ее системные и локальные механизмы к моменту рождения являются незрелыми, недостаточно эффективными и не имеющими опыта взаимодействия и организации многоуровневой защиты против опасных патогенов и других факторов агрессии. Кроме того, иммунная система новорожденного находится в состоянии непрерывного созревания, дифференцировки, обучения, совершенствования ее функции и накопления специфической иммунологической памяти о своих естественных врагах и весьма уязвима к воздействию факторов окружающей среды.
На рис. 3. изображен развивающийся в матке плод.
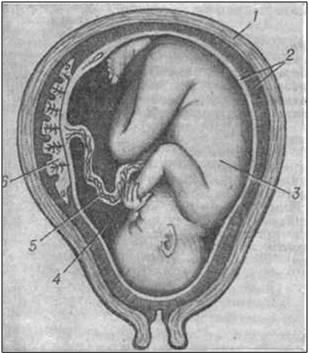
Основная особенность беременности заключается в том, что плод по отношению к матери является генетически наполовину чужеродным организмом, который до положенного срока не отторгается. Аллогенность (чужеродность) плода означает, что помимо гаплоидного набора ГКГС-антигенов матери все клетки содержат также гаплоидный набор ГКГС-антигенов отца.
Особую опасность для клеток плода представляет иммунный ответ матери с развитием клонов Ткиллерных клеток (CD8+), специфичных к отцовским антигенам ГКГС I и II классов, ЕКК (CD16+ клетки) и цитотоксических антител против отцовских антигенов. Поэтому с первых часов после зачатия и до момента родов развиваются супрессорные механизмы, которые не позволяют иммунной системе матери осуществлять иммунную атаку на плод и вызывать его отторжение на всех этапах гестации.
Роль иммуносупрессии в иммунологических реакциях мать—плод впервые описана в 1953 г. Говорят о состоянии иммунотолерантности матери к своему плоду. Результаты научных работ последних лет существенно расширили понимание этой проблемы. Развивающаяся супрессия многофакторна и формируется за счет изменений в системных (особенность функционирования иммунной системы матери в период беременности) и местных иммунных реакциях (функционирование фетоплацентарной единицы).
Во время беременности особую важность приобретает фетоплацентарная единица, которая индуцирует изменения в гормональном спектре матери и отвечает за динамическую перестройку иммунной системы.
Роль фетоплацентарной единицы:
- Трофобласт как плацентарный барьер изолирует кровоток плода от кровотока матери.
- Плацента («природный щит»):
а) нейтрализует материнские цитотоксические антитела против отцовских антигенов «антикомплементарными молекулами» (МСР — Membrane Cofactor Protein и DAF — Decay Accelerating Factor).DAF контролирует угрозу, исходящую из клеточного звена материнского иммунитета, из которого «классически» опасными считаются клетки Т-киллеры;
б) является источником иммуносупрессивных факторов (в том числе супрессорного фактора, изменяющего подвижность рецепторов к ИЛ-2), гормонов и негормональных белков, связанных с беременностью, что позволяет, с одной стороны, сохранить клеткам матери иммунокомпетентность для поддержания иммунного гомеостаза в организме, а с другой — эффективно защищать плод от иммунной агрессии со стороны материнских лимфоцитов.
Гормоны и белки беременности: избирательно регулируют функциональную активность зрелых иммунокомпетентных клеток, результатом чего является антигенспецифическая супрессия; выступают в качестве медиаторов иммунной системы, ростовых или супрессорноиндуктивных факторов.
Под влиянием повышенного уровня прогестерона активированными Т-клетками секретируются два фактора: PIBF и TJ6. Эти факторы являются иммуносупрессивными молекулами, они клонируют друг друга и регулируют активность СD3+ и CD16+ клеток (в присутствии PIBF в активированных лимфоцитах вырабатывается в 8 раз большее количество ИЛ-10 (цитокина Тх 2 типа), чем в его отсутствие).
Т-супрессоры – цитотоксические лимфоциты (CD8+) имеют рецепторы к белку ранней фазы беременности. В результате их взаимодействия Тклетки проявляют супрессорную активность.
Спектр гормонов и белков беременности достаточно велик, что позволяет создавать разнообразные комбинации (иммуномодулирующие коктейли), обеспечивающие выполнение задач каждого этапа беременности.
Во время беременности происходят существенные сдвиги во всех звеньях иммунной системы, которые чрезвычайно динамичны и адаптируют ее к конкретным потребностям в защите матери и плода, меняющимся в зависимости от сроков беременности.
Изменения в иммунной системе матери, которые обеспечивают физиологическое течение беременности:
- Уменьшение массы тимуса на фоне гипертрофии селезенки и регионарных по отношению к матке лимфоузлов. Эти изменения зависят от срока беременности.
- Состав иммунокомпетентных клеток зависит от срока гестации.
В первом триместре беременности отмечается снижение количества CD3+-Т-лимфоцитов (за счет низкого содержания CD4+-Т-хелперов) и ЕККклеток на фоне повышения В-лимфоцитов. В третьем триместре беременности: снижение В-клеток и повышение ЕКК-клеток. В течение беременности меняется соотношение CD4/CD8.
В клинической практике данные показатели используются для прогнозирования невынашивания беременности (характерна обратная картина).
- Функциональная активность (в частности, митоген-индуцированный ответ) иммунокомпетентных клеток снижена. Это обусловлено супрессирующим влиянием плазмы крови беременных (функциональная активность лимфоцитов не страдает).
- Гуморальный иммунитет также зависит от сроков беременности. Предполагается, что стимуляция гуморального иммунного ответа в ранние сроки является одним из механизмов компенсации угнетения клеточного иммунитета и направлена на защиту матери от инфекционных антигенов. Отмечено увеличение изотипа IgGl, с которым связывают защиту плодных антигенов от материнских эффекторных клеток и специфическую индукцию роста и дифференцировки плодных клеток и тканей по типу гормон — IgG рецептор — антигены ГКГС плода.
- Со стороны фагоцитарного звена отмечается резкое увеличение количества, поглотительной и метаболической активности фагоцитарных клеток.
- Репертуар молекул ГКГС при беременности:
- отсутствие классических молекул I и II классов ГКГС на трофобласте;
- экспрессия молекул ГКГС-G, С, Е.
Молекула ГКГС -G: экспрессируется только плацентой; не имеет межиндивидуальных различий; не проявляет иммунологически некоторых своих участков.
С молекулой ГКГС -G связывают следующие эффекты:
блокада киллерной активности ЕКК в отношении плаценты (предупреждение иммунологических реакций);
регуляция активности материнских Тлимфоцитов (через связывание их распознающих рецепторов); активация продукции цитокинов, способствующих росту плода.
- Цитокиновый профиль при беременности. В настоящее время доминирует мнение о том, что цитокиновый профиль Тх 2 типа (ИЛ-4, ИЛ-5, ИЛ10) работает на поддержание беременности, а Тх 1 типа (ИФН-γ, ФНО-α, ИЛ-2) – на отторжение зародыша. При нормальном течении беременности наблюдается динамическое равновесие цитокиновых профилей (с временным преобладанием в зависимости от сроков беременности).
В клинической практике эти данные используются для прогнозирования беременности: увеличение продукции ФНО-α и ИФН-γ на фоне снижения ИЛ4 характерно для угрозы прерывания беременности.
Роль других цитокинов (например, ИЛ-12 и ИЛ-18) активно изучается.
- Роль апоптоза при беременности. Ограничение материнского иммунного ответа достигается связыванием пептида FasL, находящегося на поверхности клеток трофобласта, с рецепторами Fas на активированных лимфоцитах матери, что приводит к апоптозу последних.
Функционирование иммунной системы в постнатальном периоде
Здоровый ребенок, родившийся в срок от здоровой матери, имеет в достаточной мере сформированные центральные и периферические органы иммунной системы и обладает определенными гомеостатическими количественными и функциональными параметрами и резервами (табл. 3).
Таблица 3.
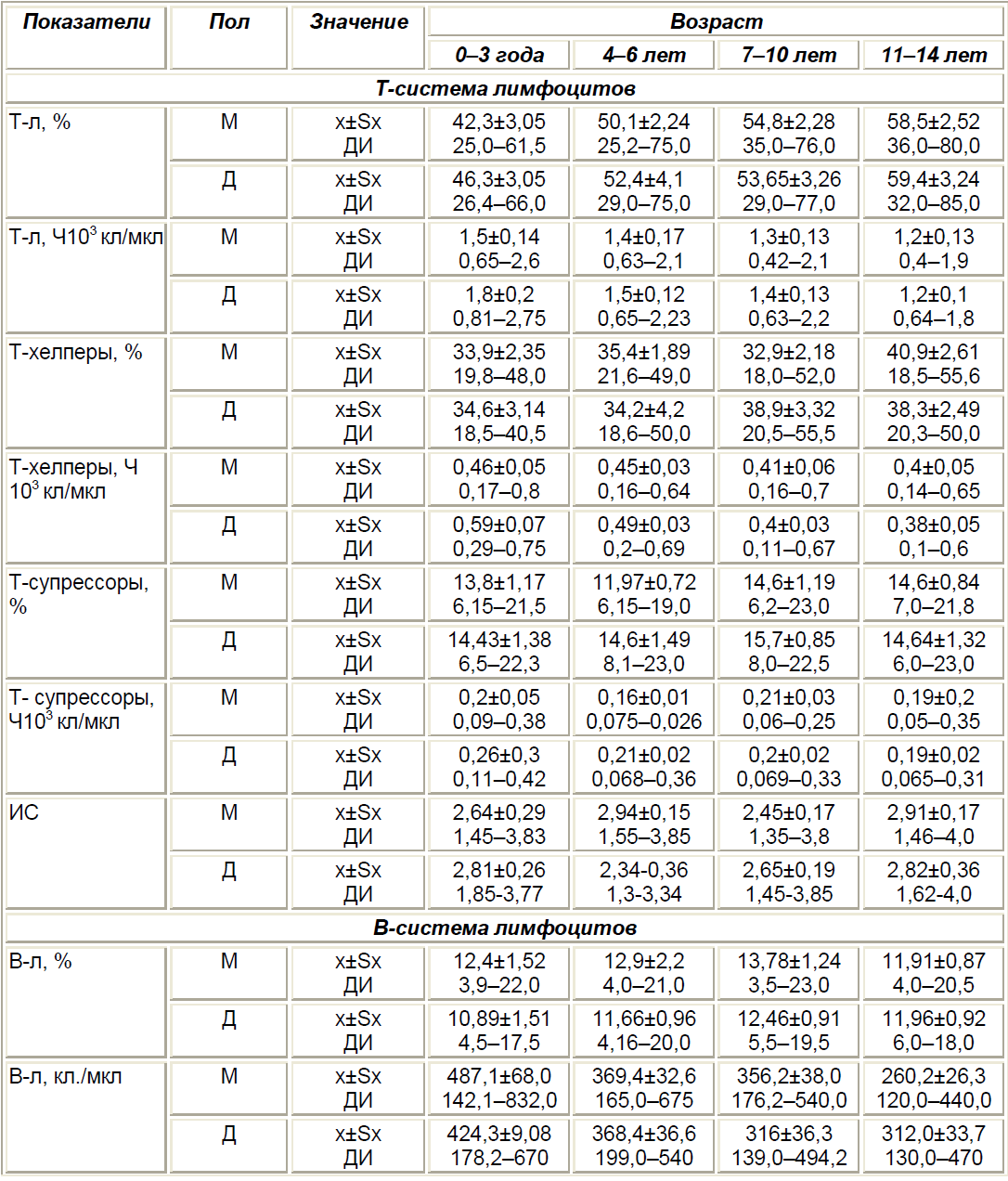
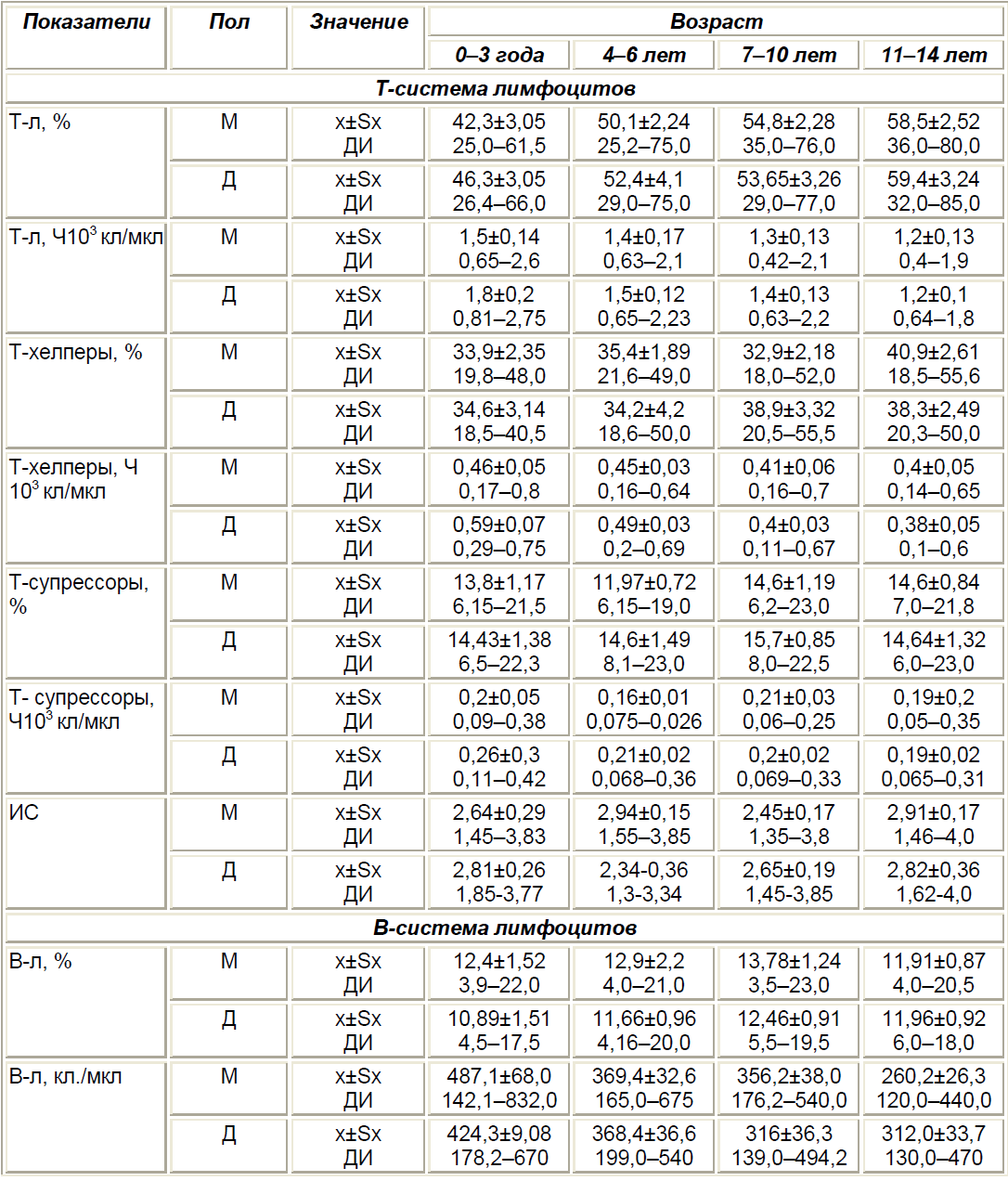
На проникновение в организм патогенов лимфоидные органы детей раннего возраста отвечают выраженной гиперплазией, что сопровождается развитием ответной воспалительной реакции, увеличением объема и массы периферических лимфоидных органов — лимфатических узлов, аденоидов, селезенки.
Вместе с тем период новорожденности является периодом риска инфицирования и агрессии по отношению к нему микроорганизмов. Организм новорожденного — весьма привлекательная среда для заселения и репродукции не только представителей нормальной микрофлоры, но и множества потенциально патогенных микроорганизмов.
Адаптация новорожденного к условиям окружающей среды является обязательным условием выживания. В разных регионах мира на популяцию детского населения воздействуют разные по характеру и интенсивности факторы – природные (климатические, ионизирующее и солнечное излучение, температура), антропогенные (химическое и микробное загрязнение воды и воздуха), социоэкономические (бедность, недостаточное и несбалансированное питание, некачественное медицинское обслуживание). Еще в XV в. детская смертность составляла 300 на 1000 родившихся. С развитием медицинской науки, здравоохранения, экономики она существенно снизилась и в развитых странах составляет 6–10 на 1000 родившихся. Однако от инфекций и недостаточности питания в мире умирают более 5 млн детей ежегодно.
Иммунобиология лактации
С точки зрения возможности противостояния организма новорожденных инфицированию первостепенное значение имеет грудное вскармливание ребенка. В молочных железах матери происходит секреция иммуноглобулинов из сыворотки крови, а также локальный биосинтез антител, поэтому грудное молоко играет важную роль в обеспечении иммунологической защиты новорожденного. В первые 5 суток лактации секретируется молозиво, затем транзиторное, или промежуточное, молоко; начиная с 15-го дня образуется зрелое молоко. Молозиво и грудное молоко содержат все классы сывороточных иммуноглобулинов и секреторный IgA, белки системы комплемента, лактоферрин, лизоцим, цитокины (интерфероны и интерлейкины), практически все типы иммунокомпетентных клеток — макрофаги, Т- и Влимфоциты, а также жизнеспособные нейтрофилы и другие лейкоциты.
Клинические наблюдения указывают на положительную роль грудного молока в создании и поддержании пассивного естественного иммунитета в основных биотопах организма новорожденного (желудочно-кишечном, бронхолегочном и урогенитальном), поэтому вскармливание детей грудью значительно снижает частоту кишечных и респираторных инфекций.
Содержание в молозиве женщин иммуноглобулинов А класса существенно выше, чем других классов. Более 90% из них составляет секреторный IgА. Нейтрофилы, моноциты и макрофаги способны к фагоцитозу и уничтожению бактерий, грибов, а также проявлению антителозависимой цитотоксичности. Макрофаги содержат внутриклеточно и продуцируют лизоцим, лактоферрин, компоненты комплемента, цитокины. В молоке присутствуют эффекторные и регуляторные Т-лимфоциты, Тклетки памяти. Все это облегчает возможность иммунной системы новорожденного отвечать на различные вирусные и бактериальные антигены. Эти клетки и продукты их активации стимулируют В-лимфоциты к биосинтезу специфических иммуноглобулинов А.
Молекулы и клетки иммунной системы матери, содержащиеся в молоке, компенсируют незрелость иммунной системы новорожденного. Компенсация достигается поступлением антигенспецифических антител в желудочно-кишечный тракт новорожденного, а затем в респираторный тракт и другие области организма.
Грудное молоко содержит также огромное количество неспецифических протективных факторов с разным механизмом антимикробного действия:
- полисахариды и гликопротеиды, предотвращающие адгезию патогенов к эпителию слизистой (ротавирусы, ВИЧ, кишечная палочка, пневмококк, кампилобактер);
- лактоферрин (полипептид из 18 аминокислот), обладающий бактерицидной активностью;
- К-казеин, ингибирующий адгезию хеликобактера;
- лизоцим, обладающий бактериостатическим эффектом;
- жирные кислоты и моноглицериды, вызывающие литический эффект в отношении простейших, вирусов и бактерий;
- гормоны и ростовые факторы молока, способствующие созреванию желудочнокишечного и респираторного тракта, снижающие потенциальную инвазивность широко распространенных патогенов.
Установлена обратная зависимость между концентрацией в грудном молоке матери секреторного иммуноглобулина А и частотой высеваемости кишечной палочки из фекалий новорожденных. Секреторные антитела — IgA грудного молока взаимодействуют с пневмококками, стрептококками, энтеровирусами, а также нейтрализуют эндо- и экзотоксины грамотрицательных бактерий.
Критические периоды развития иммунной системы детского организма
Критический период – этап развития и функционирования детского организма, характеризующийся наиболее низким уровнем защищенности, неэффективностью функции иммунной системы и необычайно высокой восприимчивостью к инфекции и сопряженный с нейрогуморальными, структурно-функциональными и (или) геномическими перестройками организма в соответствии с возрастной стратегией развития. Отражением физиологических процессов развития иммунной системы детского организма является перестройка миело- и лимфопоэза (рис. 4) в разные возрастные периоды жизни.

Рис. 4.
В период внутриутробного развития критическими считаются 8–12 недель — время закладки основных структур иммунной системы,
отлаживания механизмов дифференцировки клеток и органов иммунной системы плода.
В постнатальном развитии иммунной системы ребенка выделяют несколько таких периодов.
Первый период ассоциирован с новорожденностью и длится в среднем 25–35 дней. В это время отмечаются существенные изменения лейкоцитарной формулы — снижение количества клеток гранулоцитарного ряда и повышение лимфоцитарного пула клеток (абсолютный лимфоцитоз). При этом организм ребенка впервые подвергается атаке ранее незнакомых иммунной системе многочисленных эндо- и экзогенных патогенов и их антигенов. Гуморальный и клеточный иммунитет, неспецифические факторы видового иммунитета в это время еще незрелы и малоэффективны. Пассивный материнский иммунитет варьирует и также относителен (у значительной части новорожденных материнские антитела отсутствуют или находятся на невысоком уровне). Именно в этот период отмечается наибольшая восприимчивость детей к патогенным и условно-патогенным микроорганизмам с развитием локальных (гнойновоспалительных, респираторных, кишечных) и системных (бактериемия, сепсис) инфекций.
Второй период формируется между 3-м и 6-м месяцами жизни ребенка. Он обусловлен двумя факторами: а) постепенным ослаблением и исчезновением пассивного специфического материнского иммунитета; б) отставанием морфофункционального созревания иммунной системы части детей. Период характеризуется слабыми возможностями для развития собственного гуморального и клеточного иммунного ответа, непродолжительной иммунологической памятью, развитием ненапряженного противоинфекционного активного естественного и искусственного иммунитета. При этом развивается преимущественно первичный иммунный ответ с синтезом низкоаффинных полиспецифических антител – IgM. Местный иммунитет также ослаблен. Для развития вторичного протективного иммунного ответа на детские вакцины против дифтерии, столбняка, коклюша, полиомиелита, кори требуется трехкратная иммунизация. Незрелость иммунной системы проявляется обычно повышенной чувствительностью таких детей к респираторным вирусным инфекциям (аденовирусам, вирусам гриппа и парагриппа, РСВ). К этому периоду среди новорожденных выявляются дети, для которых характерно относительно более частое возникновение и длительное течение инфекций. Это своеобразный индикатор того, что у части из них могут иметься определенные типы первичных генетических дефектов иммунной системы (преимущественно Взависимых).
Особенностью перестройки иммунной системы детей этого периода является спонтанное возникновение у них синдрома внезапной смерти. Этот синдром — ведущая причина летальности детей постнатального периода в развитых странах. Пик летальности приходится на возрастной промежуток между 1-й неделей и 1-м годом (наиболее часто возникает между 2-й неделей и 4-м месяцем) после рождения. Большинство случаев смерти приходится на зимний период. Синдром, как правило, возникает у детей с респираторной патологией, родившихся от курящих матерей. Смерть наступает внезапно во время сна в положении ничком. Возможные причины синдрома исследуются. Этиологическими факторами предположительно являются: а) измененная иммунологическая реактивность; б) инфекционные агенты респираторного тракта и их токсины. К инфекционным агентам, способствующим высокому риску развития синдрома внезапной смерти, относят возбудителей респираторной патологии преимущественно бактериальной природы — стафилококки, бордетелла, гемофилюс инфлуенца, клостридии, кишечная палочка, геликобактер и их токсины. Особое место в генезе синдрома отводят экзотоксинам этих микроорганизмов, являющимся суперантигенами, которые вызывают гиперстимуляцию Т-системы лимфоцитов и избыточную продукцию ими цитокинов. Гиперпродукция цитокинов — IL-1, IL-6, TNF, а также высокий уровень IgE и повышенная функция Tх 2 типа в связи с этими синдромом интенсивно обсуждаются.
Третий период проявляется на втором году жизни ребенка. На это время приходится важный физиологический переход формирования адаптивного иммунитета – созревание способности переключения изотипов иммуноглобулинов с IgM на IgG (вначале приобретается возможность синтеза IgG1, IgG3, а затем IgG2 и IgG4). В целом системный и особенно местный иммунитет остаются еще недостаточно эффективными, сохраняется высокая восприимчивость к инфекциям. Это связано с недостаточностью регуляторной функции CD4+Tх
1 типа, продукции -интерферона, взаимодействия CD4+ Tх 2 типа с В-лимфоцитами.
Четвертый период проявляется между 4-м и 6м годами развития ребенка. Он связан со второй перестройкой в кроветворении и изменением содержания основных типов форменных элементов. Следует отметить, что к этому возрасту у большинства детей иммунологические параметры уже близки к уровню взрослых. Иммунная система ребенка имеет достаточный персональный опыт по организации специфической защиты от естественной локальной и системной инфекции, а также иммунного ответа на вакцинные препараты. Достаточно четко формируется группа часто и длительно болеющих респираторной патологией детей (ЧДБ). Частота респираторных инфекций в течение года может достигать 6–10 раз. Особенностью иммунной системы таких детей является сниженный уровень секреторного иммуноглобулина А или его селективный дефицит. У значительной части детей при этом отмечается повышение биосинтеза иммуноглобулинов Е, что является свидетельством доминирования функции CD4+ T-клеток Tх 2 типа над субпопуляцией Tх 1 типа. Для таких детей характерно более частое развитие атопических, паразитарных и иммунокомплексных процессов.
Пятый период приходится на подростковый возраст и обусловлен половой дифференциацией и процессами созревания организма. Он начинается в возрасте 13–14 лет у мальчиков и 11–13 лет у девочек. Половые гормоны — андрогены и эстрогены — воздействуют на органы и клетки-мишени иммунной системы, стимулируют или ингибируют определенные субпопуляции, регуляторные и эффекторные механизмы. При этом отмечается снижение массы лимфоидных органов. Под действием андрогенов происходит подавление клеточного и стимуляция гуморального звена иммунитета. В этот период возможно формирование ряда иммунопатологических процессов, которые впоследствии могут способствовать развитию определенных иммунопатологических заболеваний. Базируются они на основе некоторых первичных или сформировавшихся к этому времени вторичных иммунодефицитных состояний.
Таким образом, становление иммунной системы ребенка продолжается многие годы и представляет собой сложный, многоэтапный процесс. Каждый период характеризуется определенными онтогенетическими особенностями, в основе которых лежат геномические, функциональные, структурные, нейрогуморальные перестройки, детерминированные возрастной стратегией развития организма. Периоды повышенной чувствительности иммунной системы к действию эндо- и экзогенных повреждающих факторов (критические периоды) определяют проявление наследственных вариаций силы иммунного ответа и иммунопатологических диатезов. Знание особенностей строения, развития и функционирования иммунной системы детского организма необходимо для адекватной диагностики, лечения и профилактики широкого спектра заболеваний детского возраста.
Литература
- Белозеров Е.С., Буланьков Ю.И., Митин Ю.А. Болезни иммунной системы. – Элиста: АПП «Джангар», 2005. – Т. 2.
- Бобова Л.П., Кузнецов С.Л., Сапрыкин В.П. Гистофизиология крови и органов кроветворения и иммуногенеза: учеб. пособие. – М.: ООО «Издательство Новая Волна», 2003.
- Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. – М.: ООО «Медицинское информационное агентство»,2001.
- Бурместер Г.–Р. Наглядная иммунология / пер. с англ. – М.: БИНОМ, Лаборатория знаний, 2007.
- Галактионов В.Г. Иммунология. – М.: Академия, 2004.
- Дранник Г.Н. // Клиническая иммунология и аллергология. – Одесса: Астро Принт, 1999. – С. 294–300.
- Корнев М.А., Петрова Т.Б. Развитие и возрастные изменения органов иммунной системы человека: учеб.–метод. пособие. – СПб.: ГПМА, 2000.
- Лесков В.П. Клиническая иммунология для врачей. – М.: Медицина, 1997.
- Сапин М.Р., Никитюк Д.Б. Иммунная система, стресс и иммунодефицит. – М.: АПП «Джангар», 2000.
- Сапин М.Р., Этинген Л.Е. Иммунная система человека. – М.: Медицина, 1996.
- Стефани Д.В., Вельтищев Ю.Е. Клиническая иммунология и иммунопатология детского возраста: руководство для врачей. – М.: Медицина, 1996.
- Титов Л.П. // Медицина. –1997. – № 2. – С. 36–38.
- Титов Л.П. // Медицина. – 1997. – № 3. – С. 34–35.
- Титов Л.П. // Медицина. – 1997. – № 4. – С. 32–35.
- Титов Л.П. // Медицина.–1998.–№1.– С.29–
- 16. Титов Л.П. // Весцi НАН Беларусi. Сер.мед.–бiял. навук. – 2001. – № 2. – С. 68–71. 17. Титов Л.П. // Весцi НАН Беларусi. Сер. мед.–бiял. навук. – 2006. –№ 2.
- Титов Л.П. Иммунология: терминол. словарь. – Минск: Белорусская наука, 2004.
- Титов Л.П., Карпов И.А. // Мед. журнал.– 2007. – № 1. –С. 4–14.
- Хаитов Р. М. // Аллергия и клин. иммунология. – 1999. – № 1. – С. 6–20.
- ЯрилинА.А. // Rus. J. Immunol. – 1998. – Vol. 3(2). – P. 5–20.
- Ярилин А.А. Основы иммунологии. – М.: Медицина, 1999.
- Fuzzi B., Rizzo R., Cristoli L. et al. // Eur. J. Immunol. – 2002. – Vol. 32 (2). – P. 311–315.
- Leviton A., Paneth N., Reuss M.L. et al. // Pediatr. – 1999. – Vol. 45 (5).
- Seghaye M.-C., Heyl W., Grabitz R.G. et al. // Biology of the Neonate. – 1998. – Vol. 73 (4). – P. 220–227.
Медицинские новости. 2009. №5.









Комментировать