Снежицкий В.А., Яцкевич Е.С., Долгошей Т.С., Cнежицкая Е.А., Мадекина Г.А., Рубинский А.Ю. Гродненский государственный медицинский университет, Беларусь, Гродненский областной клинический кардиологический центр, Беларусь
Резюме. Обследованы 75 пациентов с фибрилляцией предсердий (ФП) на фоне сердечно-сосудистой патологии, из них 48 (1 группа) с пароксизмальной ФП, 27 (2 группа) – с персистирующей. Третью, контрольную, группу составили 19 пациентов с различными формами ишемической болезни сердца и/или артериальной гипертензией без эпизодов ФП в анамнезе. Структурно-функциональное состояние сердца оценивали при проведении двухмерной трансторакальной эхокардиографии с использованием расчетных формул, характеризующих структуру и функцию левого предсердия (ЛП). Также изучали линейные и нелинейные показатели вариабельности ритма сердца. Дальнейший анализ данных (частота рецидивов ФП, методы восстановления ритма, антикоагулянтная и антиаритмическая терапия) проводился спустя год после госпитализации. У пациентов с пароксизмальной/персистирующей формами ФП уровень значений приблизительной энтропии (ApEn) был не только значимо ниже (0,09 (0,007–0,96) и 0,02 (0,003–0,88) соответственно против 1,03 (0,94–1,10) (p<0,05) в контрольной группе), но и ассоциировался как с Эхо-показателями, характеризующими систолическую функцию левого желудочка, так и с некоторыми показателями ЛП, характеризующими его структуру и функцию. Количество рецидивов ФП в течение года после госпитализации имело отрицательную корреляционную связь со значением ApEn (r= –0,2385, p<0,05), а также было взаимосвязано с размером ЛП. Таким образом, у пациентов с пароксизмальной/персистирующей формой ФП снижение АpEn взаимосвязано как с частотой рецидивов ФП, так и со структурными изменениями в сердце, связанными с его ремоделированием.
Ключевые слова: фибрилляция предсердий, вариабельность ритма сердца, линейный и нелинейный анализ, эхокардиография, структурно-функциональное ремоделирование.
Накоплен огромный материал о вариабельности ритма сердца (ВРС) при различных функциональных и патологических состояниях организма [1, 5, 6, 24]. Наибольшее значение анализ ВРС имеет в кардиологии. Существует четкая взаимосвязь между состоянием вегетативной нервной системы (ВНС) и смертностью от сердечно-сосудистых заболеваний. Эта взаимосвязь реализуется через высокую склонность к угрожающим жизни сердечным аритмиям у больных с нарушениями ВНС. Недостаточно изучена взаимосвязь вегетативной регуляции с особенностями клинического течения фибрилляции/трепетания предсердий (ФП/ТП), наиболее распространенного нарушения сердечного ритма. Частота госпитализаций по причине этой аритмии составляет 40 % от всего количества госпитализаций по поводу нарушений сердечного ритма. Не до конца ясны также механизмы влияния ВНС на запуск, поддержание и персистенцию ФП [5, 9].
Роль ВНС при ФП. Вагусные и симпатические влияния модулируют электрофизиологические характеристики предсердных клеток (длительность потенциала действия, рефрактерность и скорость проводимости). Симпатические стимулы способствуют триггерной активности, а парасимпатические – возникновению механизма re-entry. Во многих исследованиях было показано, что возникновение пароксизмов ФП зависит от изменений вегетативного тонуса [15, 18]. Есть доказательства усиления симпатической предсердной иннервации у пациентов с персистирующей формой ФП, в подтверждение того факта, что автономное ремоделирование является частью предсердного субстрата, участвующего в поддержании ФП [21]. По-видимому, имеется первичное повышение симпатического тона, но перед началом пароксизма ФП отмечается преимущественное вагусное влияние. Этот механизм присущ и пароксизмальной ФП, зарождающейся в легочных венах, и послеоперационной ФП. В одном исследовании с участием пациентов с ранними рецидивами аритмии авторы показали повышение вагусного тона, наступающее сразу же после кардиоверсии [14]. В другом популяционном исследовании было показано влияние тонуса ВНС на начало ФП, что проявлялось нарушением вегетативной регуляции, которое и отображает нарушение ВРС [27]. Однако доказательство связи между ВНС и ФП не имело статистической значимости и указанная связь могла была быть опосредствована влиянием традиционных факторов риска для ФП.
Чтобы ответить на вопрос, какой из отделов ВНС играет более важную роль при ФП, в экспериментальных исследованиях была тщательно изучена вегетативная иннервация предсердий. Структурные и электрофизиологические предсердные изменения могут возникать как при продолжительном повышении предсердной частоты, так и при постоянной форме ФП. Это было показано в экспериментальных исследованиях с быстрой предсердной кардиостимуляцией. По-видимому, электрофизиологическое ремоделирование ассоциируется с нарушенной вегетативной регуляцией.
В последние годы у пациентов с ФП исследуется состояние ВНС с помощью оценки линейных параметров ВРС. Представляют интерес сообщения об изменениях ВНС перед началом пароксизма ФП по данным анализа ВРС [12, 13, 16, 31]. Имеются сообщения о возможности применения метода ВРС во время пароксизма ФП и у больных с постоянной формой ФП [22, 23]. Все больше используется анализ ВРС с целью контроля состояния ВНС и оценки эффективности антиаритмической терапии [25].
Новые методы оценки ВРС. В литературе сообщается о практическом использовании таких новых методов анализа ВРС, как нелинейный анализ (non-linearanalysis) и волновое преобразование (Wavelet transformation) [17, 19, 20, 26, 28, 33]. Развитие этих методов продиктовано тем, что традиционные методы анализа ВРС не в состоянии интерпретировать всю сложность регуляции сердечного ритма. Представляется интересным направление исследований по сравнению традиционных и новых методов анализа ВРС [28].
ВРС отражает сложную многоконтурную систему регуляции сердечного ритма [11]. На ритм сердца оказывают постоянное воздействие как стационарные влияния (центральная и вегетативная нервная система, насыщение крови кислородом и углекислым газом, рефлексы), так и нестационарные (к ним относятся и нарушения ритма, которые существенно влияют на регулярность сердечных сокращений). Нестационарный, или переходный, процесс характеризуется тем, что он имеет определенную тенденцию к развитию во времени и его характеристики зависят от начала отсчета [8].
Методику оценки сложности нерегулярных процессов предложил S. Pincus [29]. Среди методов нелинейной динамики используются методы фазового портрета, построения пространственных карт, вычисление размерности вложения или экспоненты Ляпунова, энтропии и др. [4].
Приблизительная энтропия (ApEn) служит количественной мерой регулярности, предсказуемости и сложности для нестационарных временных рядов. Так, для регулярных сигналов ее значение мало, для непредсказуемых, сложных сигналов, наоборот, велико. Показатель энтропии применим для широкого класса нестационарных сигналов, в том числе биомедицинских. ApEn служит количественной мерой хаоса сердечного ритма. Таким нарушениям сердечной деятельности, как атриовентрикулярная блокада, ишемия, кардиомиопатия, соответствует более регулярный и предсказуемый тип ритма, характеризуемый меньшим значением энтропии ApEn. Для здоровых лиц, наоборот, ритму характерны более случайные флуктуации и, соответственно, большие значения энтропии ApEn. Такая однозначность послужила основанием предпочтения изучения данного нелинейного параметра [3, 17].
Цель исследования – изучение нелинейных параметров ВРС (ApEn, K(HF/LF)) у пациентов с пароксизмальной/персистирующей формой ФП, их взаимосвязи с Эхо-показателями и с частотой рецидивов ФП в течение года после госпитализации.
Материалы и методы
На базе отделения нарушений ритма УЗ «Гродненский областной клинический кардиологический центр» было обследовано 75 пациентов с ФП (59 мужчин, 16 женщин) на фоне различной сердечно-сосудистой патологии без выраженного структурного поражения миокарда. Из них первую группу составили 48 пациентов с пароксизмальной формой ФП (64 %), средний возраст 55,5 (50; 63,5) лет, вторую группу – 27 пациентов с персистирующей формой ФП (36%), средний возраст 52,5 (46; 61) лет. С целью сравнительной оценки изучаемых нами показателей была сформирована третья (контрольная) группа из 19 пациентов, средний возраст которых составил 56 (49,0; 61,0) лет, с различными формами ИБС и/или АГ без эпизодов ФП в анамнезе. В исследование не включали пациентов с тиреотоксикозом, острым нарушением мозгового кровообращения, острым инфарктом миокарда, острым миокардитом, сердечной недостаточностью – ФК 2 стадии и выше (по NYHA), сахарным диабетом, хронической почечной недостаточностью, некомпенсированными сопутствующими заболеваниями, беременных женщин.
Ряд пациентов до включения в протокол исследования получали гипотензивную (лизиноприл, эналаприл, бисопролол, метопролол и др.) и антиаритмическую терапию (амиодарон, соталол, этацизин), однако лечение имело эпизодический характер. Во время пребывания в стационаре терапия пациентов с пароксизмальной ФП соответствовала стратегии контроля ритма с назначением антиаритмических препаратов I, II либо III классов. Пациентам группы 2 выполняли электрическую кардиоверсию. В течение последующего года наблюдения пациенты принимали назначенную им в стационаре антиаритмическую и антикоагулянтную терапию (стратегия контроля ритма).
Наряду с клиническим исследованием и общепринятыми методами лабораторно-инструментальной диагностики выполняли анализ ВРС на основе пятиминутной регистрации электрокардиограммы с расчетом геометрических, временных, спектральных и нелинейных параметров, используя электрокардиографический комплекс «Интекард» («Интекард», Беларусь) и программное обеспечение к нему «Бриз XP». Изучали линейные (Min, Max, Med, Мо, АМо, TI, SI, SDNN, pNN50, rMSSD, VLF, LF, HF, LF/HF, TP) и нелинейные (K(LF/HF), АрЕn) параметры ВРС.
Структурно-функциональное состояние сердца оценивали при проведении двухмерной трансторакальной эхокардиографии, используя стандартные позиции на ультразвуковой системе «Philips», IE -33 с помощью широкополосного фазированного датчика S5-1 с технологией PureWaveCrystal (монокристалл) с расширенной частотной полосой от 1 до 5 МГц. Кроме стандартных Эхо-показателей, изучались показатели, характеризующие структуру и функцию левого предсердия (ЛП): ударный объем, объем, индекс объема, фракция выброса ЛП для двух- и четырехкамерной позиций, бипланового метода, метода «площадь – длина», а также показатели ЛП (длина, площадь, объем) в двух- и четырехкамерной позициях в систолу и диастолу левого желудочка (ЛЖ). Расчет производился по формулам оценки параметров ЛП [7].
Большинство данных обрабатывалось непараметрическими методами с использованием пакета статистических программ Statistica 6.0. Количественные данные представлены в виде медианы и межквартильного размаха (между 25 и 75 процентилями), качественные данные в виде абсолютных и относительных частот. Для оценки значимости различий количественных параметров между двумя независимыми выборками использовали критерий Манна – Уитни, между двумя связанными выборками – критерий Уилкоксона. При оценке достоверности различий частоты качественных показателей применяли двухсторонний точный критерий Фишера. Для выявления зависимости между показателями с ненормальным распределением применяли коэффициент ранговой корреляции Спирмена (Rs), при нормальном распределении признака – критерий Пирсона. Различия считали статистически достоверными при p<0,05.
Исходные клинико-анамнестические и эхокардиографические характеристики пациентов в группах исследования представлены в табл. 1 и 2.
Таблица 1. Характеристика исследуемых групп пациентов
| Параметры | 1 группа (n=48) | 2 группа (n=27) | 3 группа (n=19) | ||
| Возраст, лет | 55,5 (50; 63,5) | 52,5 (46; 61) | 56 (49; 61) | ||
| Пол (м), n (%) | 37 (77,08 %) | 22 (81,48%) | 12 (63,16%) | ||
| АГ, n (%) | Нет АГ | 9 (18,75%) | 5 (18,52 %) | 2 (10,53%) | |
| 1 ст. | 13 (27,08%) | 6 (22,22%) | 3 (15,79%) | ||
| 2 ст. | 24 (50%) | 27 (59,26%) | 13 (68,42 %) | ||
| 3 ст. | 2 (4,17%) | – | 1 (5,26%) | ||
| ИБС, n (%) | Нет ИБС | 7 (14,58%) | 6 (22,22%) | 5 (26,32%) | |
| ИБС: атеросклеросклеротический кардиосклероз | 24 (50%) | 16 (59,26%) | 1 (5,26%) | ||
| СН | ФК 1 | 1 (2,08%) | 3 (11,11%) | 3 (15,79%) | |
| ФК 2 | 16 (33,33%) | 2 (7,4%) | 10 (52,63%) | ||
| ХСН (ФК 1 по NYHA), n (%) | 5 (10,42 %) | 8 (29,63%) | 1 (5,26%) | ||
Таблица 2. Сравнительная характеристика параметров левого предсердия и стандартных Эхо-показателей у пациентов исследуемых групп
| Параметры | 1 группа (n=48) | 2 группа (n=27) | 3 группа (n=19) | |
| Ударный объем ЛП, мл | LA SV 4 | 35,05 (27,89; 43,12) | 27,74 (17,68;36,78)# | 35,50 (22,89;44,57) |
| LA SV 2 | 32,00 (26,00; 39,00) | 30,00 (19,00;35,50) | 37,50 (27,00;43,00) | |
| LA SV BP | 34,66 (26,90; 39,82) | 28,63 (24,25;35,50) | 35,39 26,35;44,00) | |
| LASV(A-L) | 36,50 (29,60;44,50) | 30,10 (23,45;36,85)# | 43,10 (29,00;46,90) | |
| Объем ЛП, мл | LA V BPs | 70,55 (54,70;81,00) | 75,21(62,75;91,91)* | 58,79 (49,49;77,60) |
| LA V BPd | 33,56 (23,34;39,19) | 46,62 (37,64;55,25)*# | 25,38 (21,21;33,60) | |
| LAVd(A-L) | 34,70 (24,70;42,20) | 50,05 (39,80;58,55)*# | 26,65 (23,20;36,20) | |
| LAVs(A-L) | 74, 75 (59,20;84,80) | 80,55 (66,10;93,90) | 66,30 (52,00;76,80) | |
| Индекс объема ЛП, мл/м2 | LAVsI2 | 32,75 (27,00;39,50) | 37,10 (28,75;45,00) | 31,00 (26,9; 37,40) |
| LAVsI(A-L) | 35,10 (28,80;41,00) | 40,60 (31,40;47,00)* | 29,90 (24,90;40,90) | |
| LAVsI4 | 32,50 (27,60; 39,00) | 37,65 (30,30;45,90) | 27,0 (26,10;38,40) | |
| LAVdI4 | 14,90 (11,20;17,70) | 23,85 (18,50;28,70)*# | 12,90 (8,60;14,30) | |
| LAVdIBP | 15,80 (11,50;18,30) | 23,95 (18,65;28,30)*# | 13,10 (9,50;16,70) | |
| LAVsIBP | 33,50 (29,00;38,80) | 37,55 (31,40;45,50) | 29,70 (26,80;38,00) | |
| Фракция выброса ЛП, % | LAEF4 | 57,15 (46,74;62,45) | 38,28 (25,84;43,24)*# | 58,14 (53,70;67,76) |
| LAEF2 | 51,85 (42,19;60,67) | 39,20 (28,14;52,47)*# | 59,56 (54,00;65,00) | |
| LAEFBP | 53,92 (46,46;59,78) | 37,30 (32,12;45,76)*# | 57,44 (52,99;64,21) | |
| LAEF(A-L) | 54,60 (46,70;60,60)* | 35,05 (30,60;46,05)*# | 61,20 (56,60;65,50) | |
| Передне-задний размер ЛП, см | LADimen2D | 3,70 (3,50; 4,00) | 3,90 (3,70;4,10)* | 3,60 (3,30;3,90) |
| Длина ЛП, см | LAA4d1 | 4,55 (4,11; 4,83)* | 5,24 (4,56;5,53)*# | 4,12 (3,12;4,49) |
| LAA4s1 | 5,84 (5,43; 6,01)* | 6,17 (5,64;6,44)*# | 5,16 (4,75;5,56) | |
| LAA2d1 | 4,49 (4,09;4,84) | 4,99 (4,69;5,45)*# | 4,04 (3,50;4,64) | |
| LAA2s1 | 5,72 (5,52;6,07)* | 6,02 (5,73;6,35)* | 5,38 (5,06;5,60) | |
| Площадь ЛП, см2 | LAA4d2 | 13,30 (11,0; 14,80)* | 17,65 (15,0;20,70)*# | 11,50 (8,59;12,40) |
| LAA4s2 | 22,30 (20,0; 24,90) | 24,60 (21,20;27,00)* | 19,70 (17,20;23,50) | |
| LAA2d2 | 13,50 (10,50; 15,0) | 16,65 (13,80;19,35)*# | 11,45 (9,37; 13,10) | |
| LAA2s2 | 22,05 (18,80;24,50) | 23,55 (20,60; 25,95)* | 20,15 (18,50;23,00) | |
| Объем ЛП, мл | LAA4d3 | 31,11 (23,31;37,33) | 49,00 (35,84;60,90)*# | 25,56 (14,91;27,77) |
| LAA4s3 | 66,31 (57,97; 82,23) | 77,77 (59,52; 90,15)* | 60,15 (47,18;72,34) | |
| LAA2d3 | 32,50 (23,00; 40,00) | 42,00 (31,50;58,00)*# | 24,00 (21,00;34,00) | |
| LAA2s3 | 67,00 (54,00; 80,00) | 72,50 (59,50; 88,50) | 60,00 (50,00;74,00) | |
| Размеры ЛП в 4-камерной позиции, см | M/L4max | 4,27 (4,02;4,49) | 4,26 (3,86;4,59) | 4,15 (3,85;4,22) |
| A/I 4max | 5,62 (5,33; 5,85)* | 5,81 (5,28;6,40)* | 5,11 (4,57;5,39) | |
| M/L4min | 3,20 (2,87;3,56) | 3,50 (3,27; 3,99)*# | 3,05 (2,70;3,11) | |
| A/I 4min | 4,32 (3,90;4,60)* | 4,99 (4,31;5,38)*# | 3,79 (3,26;4,38) | |
| АО, мм | 34 (32; 36)* | 35 (32; 37) * | 32,5 (30; 33) | |
| АК, мм | 22 (21; 23) | 22 (21; 23) | 21 (20; 22) | |
| ЛП, мм | 38 (36; 40) * | 41 (38; 43)*# | 36 (35; 37) | |
| МЖП, мм | 12 (12; 13) | 12 (12; 13) | 12 (11; 13) | |
| ЗСЛЖ, мм | 11 (11; 12) | 12 (11; 12) | 11 (10; 12) | |
| КДД, мм | 52 (49; 54) | 51 (48; 55) | 50 (47; 54) | |
| КСД, мм | 32 (30; 35) | 33 (31; 37) * | 31 (29; 32) | |
| КДО, мл | 126,5 (112; 143) | 26 (110; 149) | 119 (105; 139) | |
| КСО, мл | 41,5 (35; 51) | 44,5 (38; 60)* | 37 (31; 42) | |
| УО, мл | 84,5 (75; 94) | 75,5 (70; 88) | 76 (72; 96) | |
| ФВ, % | 67 (62; 69) | 62 (58; 66) *# | 68,4 (66; 70) | |
| ПЖ, мм | 23 (20; 25) | 24 (23; 26) | 22,5 (20; 24) | |
П р и м е ч а н и е: Показатели оценивали только у пациентов при синусовом ритме; * – разница показателей достоверна по сравнению с таковыми у лиц контрольной группы (р<0,05), # – разница показателей достоверна по сравнению с таковыми у лиц группы c пароксизмальной формой ФП (р<0,05); АО – диаметр аорты на уровне АК, АК – раскрытие створок аортального клапана, ЛП – размер левого предсердия, МЖП – толщина межжелудочковой перегородки, ЗС ЛЖ – толщина задней стенки левого желудочка (ЛЖ), КДД – конечно-диастолический диаметр ЛЖ, КСД – конечно-систолический диаметр ЛЖ, КДО – конечно-диастолический объем ЛЖ, КСО – конечно-систолический объем ЛЖ, УО – ударный объем, ФВ – фракция выброса ЛЖ, ПЖ – диаметр правого желудочка.
Результаты и обсуждение
Анализ исходных данных показал, что уровень ApEn в контрольной группе составил 1,03 (0,94–1,10), что значимо (p<0,05) выше, чем в группах 1 и 2 (0,09 (0,007–0,96) и 0,02 (0,003–0,88) соответственно). Между группами с пароксизмальной и персистирующей формами ФП статистически значимых различий не выявлено. Кроме того, найдены достоверные различия в значении К (LF/HF) в группе 2 по отношению к контрольной группе (табл. 3).
Таблица 3. Характеристика изучаемых параметров ВРС у пациентов с пароксизмальной и персистирующей формами ФП по сравнению с контрольной группой
| Параметры | 1 группа (n=48) | 2 группа (n=27) | 3 группа (n=19) |
| Min, мс | 754,0 (425,0; 944,0) | 843,0 (632,5; 973,5) | 749,5 (610,0; 819,0) |
| Max, мс | 1085,0 (993,0; 1227,0) | 1088,5 (1046,0; 1312,5) | 1043,5 (935,0; 1156,0) |
| Med, мс | 988,0 (902,0; 1079,0) | 1013,0 (933,5; 1044,5) | 921,0 (841,0; 1041,0) |
| SDNN, мс | 36,1 (25,6; 69,4) | 41,3 (27,0; 51,3) | 32,4 (26,4; 50,9) |
| rMSSD, мс | 27,3 (16,6; 55,6) | 29,75 (17,3; 53,8) | 27,95 (20,7; 44,7) |
| NN50 | 3,0 (0,000; 13,0) | 4,0 (0,5; 10,5) | 2,5 (1,0; 5,0) |
| pNN50, % | 1,0 (0,000; 4,6) | 1,3 (0,15; 4,1) | 0,75 (0,3; 1,3) |
| Mо, мс | 980 (900; 1080) | 1000 (925; 1045) | 930 (820; 1040) |
| AMо,мс | 51 (42; 64) | 55,5 (44; 65) | 59 (41; 70) |
| рAMо | 16,5 (12,7; 19,3) | 17,3 (13,6; 20,0) | 15,9 (13,8; 20,2) |
| Mо50 | 980 (900; 1080) | 1000 (925; 1045) | 930 (820; 1040) |
| AMо50 | 173 (139; 216) | 185,5 (141; 216) | 185,5 (127; 227) |
| рAMо50 | 53,40 (43,40; 65,30) | 54,75 (43,60; 68,20) | 55,30 (44,20; 73,20) |
| TI | 6 (5; 7) | 5,5 (4,5; 7) | 6 (4; 7) |
| SI | 117,2 (41,2; 195,9) | 86,1 (46,3; 194,6) | 93,55 (53,7; 170,9) |
| HF, % | 51,3 (41,4; 61,5) | 50,1 (42,65; 55,85) | 41,75 (38,1; 52) |
| LF, % | 33,50 (28; 39,5) | 34,35 (28,3; 38,95) | 36,15 (31,60; 42,10) |
| VLF, % | 15,20 (9,00; 19,30) | 15,55 (11,35; 19,95) | 17,10 (14,40; 22,20) |
| LF/HF | 0,65 (0,64; 0,68) | 0,69 (0,66; 0,70) | 0,87 (0,83; 0,81) |
| ApEn | 0,09 (0,007; 0,96)* | 0,02 (0,003; 0,88)* | 1,03 (0,94; 1,10) |
| K(LF/HF) | 0,69 (0,355; 4,13) | 1,25 (0,407; 3,92)* | 0,44 (0,28; 0,77) |
| N1 | 0,84 (0,327; 1,45) | 0,85 (0,443; 1,38) | 0,78 (0,25; 1,33) |
| N2 | 41,50 (22,50; 53,80) | 41,35 (29,30; 57,30) | 39,10 (20,20; 51,30) |
| N3 | 0,71 (0,29; 1,17) | 0,71 (0,415; 1,34) | 0,64 (0,25; 1,05) |
| TP, мс2 | 842,2 (634,7; 1394,6) | 1597,4 (700,4; 2194,5) | 981,7 (659,5; 1444,9) |
| HF, мс2 | 328,1 (294,8; 590,9) | 811,8 (246,4; 1026,3) | 510,4 (321,1; 666,0) |
| LF, мс2 | 303,6 (250,0; 420,7) | 530,1 (245,9; 860,5) | 299,7 (259,2; 480,2) |
| VLF, мс2 | 149,3 (131,2; 176,1) | 255,5 (107,3; 313,4) | 160,7 (117,6; 268,1) |
| TP, мс2 | 1210,50 (766,40;2430,70) | 1125,25 (788,0; 2018,55) | 1021,15 (659,5; 1444,9) |
П р и м е ч а н и е : Показатели оценивали только у пациентов при синусовом ритме; * – разница показателей достоверна по сравнению с таковыми у лиц контрольной группы (р<0,05).
Дальнейший анализ показал отрицательную корреляционную связь между значением ApEn и Эхо-показателями во всей выборке пациентов: Ао (r= –0,307), ЛП (r= –0,242), ЗСЛЖ (r= –0,267), КДД (r= –0,285), КСД (r= –0,370), КДО (r= –0,282), КСО (r= –0,353) и положительную – с показателем ФВ (r= 0,236) (р<0,05). Также с диаметром аорты на уровне АК и ЛП положительно коррелировал К (HF/LF): r= 0,305 и r= 0,259 соответственно (р<0,05).
Кроме того, обнаружена достоверная взаимосвязь между значением ApEn и отдельными Эхо-показателями ЛП среди пациентов всех групп: объемом ЛП LA BPd (r= –0,298), индексом объема LAVdI4 (r= –0,374), фракцией выброса LAEF4 (r=0,28), LAEFBP (r= 0,355) и LAEF(A-L) (r= 0,372), а также площадью и объемом ЛП в четырехкамерной позиции в систолу и диастолу ЛЖ: LAA4d2 (r= –0,413), LAA4s2 (r= –0,339), LAA4d3 (r= –0,399), LAAs3 (r= –0,314), минимальным и максимальным размерами ЛП в этой же позиции: Med/Lat 4max (r= –0,321), Ant/Inf 4 min (r= –0,377) (p<0,05).
Результаты дальнейшего анализа возникновения рецидивов ФП у исследуемых пациентов через год после госпитализации представлены в табл. 4.
Таблица 4. Анализ частоты рецидивов ФП у исследуемых пациентов через год после госпитализации
| Частота рецидивов | Группа 1 (n=48) | Группа 2 (n=27) | ||
| Кол-во | ||||
пациентов%Кол-во
пациентов%Не было1531,251555,561 раз48,3327,42 раза48,33––3 раза714,5827,44 раза12,08––5 раз24,1613,71 раз в месяц48,33––1 раз в неделю816,6727,4Почти каждый день12,0827,4Переход
в постоянную форму24,16311,1
Количество рецидивов ФП имело отрицательную корреляционную связь с показателем ApEn среди исследуемых пациентов (рисунок).
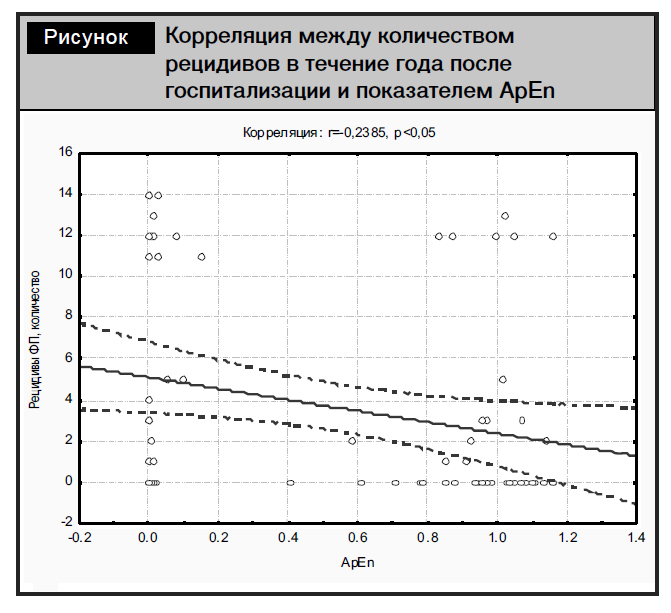
Следующие достоверные положительные корреляции выявлены между количеством рецидивов ФП и размером ЛП в стандартном Эхо-исследовании (r=0,28), а также длиной ЛП в систолу ЛЖ в двух- и четырехкамерной позициях: LAA2s1 (r=0,250), LAA4s1 (r=0,244) и максимальным передне-задним размером ЛП: Ant/Inf 4 max (r=0,277) (p<0,05).
Полученные данные указывают на существование статистически подтверждаемой связи между значением ApEn и структурно-функциональным состоянием миокарда, а также взаимосвязи этого показателя с наличием эпизодов ФП, что позволяет рассматривать снижение АpEn как достаточно значимый фактор риска и рецидивов ФП и структурных изменений в сердце, связанных с его ремоделированием.
И симпатический, и парасимпатический отделы ВНС играют важную роль в инициировании и поддержании ФП. Имеются весомые доказательства роли электрофизиологического предсердного ремоделирования при пароксизмальной и персистирующей формах ФП [30].
Развитие методов нелинейной оценки ВРС продиктовано тем, что традиционные методы не в состоянии интерпретировать всю сложность регуляции сердечного ритма. [28]. Очевидно, показатель ApEn имеет свои определенные границы нормальных значений, в пределах которых есть индивидуальные колебания, в том числе изменения в ответ на возмущающие воздействия. Вероятно, нет четко очерченного диапазона «нормальных» и «патологических» значений; возможно, большая выборка как больных, так и условно здоровых пациентов позволит разграничить данные значения [2]. Отмечается, что методы, основанные на принципах нелинейной динамики, лучше выявляют пациентов с высоким риском внезапной сердечной смерти [32] и изменения в показателях ВРС у больных перед началом фибрилляции желудочков [19]. Можно предположить, что ApEn может лучше выявлять пациентов с высоким риском рецидивов ФП.
Однако необходимо помнить о неоднозначной на сегодняшний день физиологической интерпретации показателей ВРС. Это во многом обусловлено сложным взаимодействием симпатической и парасимпатической вегетативной нервной системы, гуморальными факторами, оказывающими влияние на работу сердца [8]. Характерный ответ сердечно-сосудистой системы на растяжение как правого предсердия, так и правого желудочка – замедление ритма сердечных сокращений, снижение артериального давления и общего периферического сопротивления. Растяжение камер левой половины сердца вызывает увеличение потока афферентной импульсации, проходящей преимущественно в волокнах блуждающих нервов. Это влечет за собой угнетение симпатического сосудосуживающего тонуса, уменьшение эфферентной симпатической импульсации к внутренним органам и кожно-мышечным областям [10]. Значительное влияние на формирование картины ВРС оказывают не только тонус ВНС, но и состояние миокарда, проводящей системы сердца, что существенно для больных с кардиальной патологией. Таким образом, и структурно-функциональное ремоделирование может влиять на ВНС, а значит, и на результаты линейных и нелинейных параметров ВРС [2].
Выводы:
- У пациентов с пароксизмальной или персистирующей формой ФП, развившейся на фоне АГ и/или ИБС, значение ApEn значимо ниже, чем у пациентов с аналогичной сердечно-сосудистой патологией, но без данной аритмии.
- Значение ApEn ассоциировано как с Эхо-показателями, характеризующими систолическую функцию левого желудочка, так и с некоторыми показателями левого предсердия, характеризующими его структуру и функцию.
- Значение ApEn имело отрицательную корреляционную связь с количеством рецидивов ФП в течение года после госпитализации.
- Количество рецидивов ФП взаимосвязано с размерами левого предсердия, характеризующими его структуру и функцию.
Л И Т Е Р А Т У Р А
- Вариабельность ритма сердца: применение в кардиологии / В.А.Снежицкий [и др.]. – Гродно: ГрГМУ, 2010 – 211 с.
- Исследование вариабельности сердечного ритма при анализе аритмий / А.К.Колюцкий [и др.] // Рос. кардиол. журн. – 2006. – Вып.4. – режим доступа: hptt://medi.ru/ rkj.
- Нелинейные аспекты анализа сердечного ритма / А.В.Фролов [и др.] // Функциональная диагностика. – 2009. – Вып. 1. – С.23–26.
- Пархоменко, А.Н. «Детерминированный хаос» и риск внезапной сердечной смерти / А.Н.Пархоменко // Терапевт. архив. – 1996. – Вып.68 (4). – С. 43–44.
- Писарук, А.В. Вариабельность ритма сердца и гомеостаз / А.В.Писарук. – К., 2003. – 225 с.
- Рекомендации: вариабельность сердечного ритма (Стандарты измерения, физиологической интерпретации и клинического использования) // Вестн. аритмологии. – 1999. – №11. – С.53–77.
- Рыбакова, М.К. Практическое руководство по ультразвуковой диагностике. Эхокардиография / М.К.Рыбакова, М.Н.Алехин, В.В.Митюков. – М.: Видар, 2008. – 115 с.
- Рябыкина, Г.В. Вариабельность ритма сердца / Г.В.Рябыкина, А.В.Соболев. – М., 1998. – 216 с.
- Снежицкий, В.А. Методологические аспекты анализа вариабельности сердечного ритма в клинической практике / В.А.Снежицкий // Мед. новости. – 2004. – №4. – С.5–8.
- Ткаченко, Б.И. Кардиоваскулярные рефлексы / Б.И.Ткаченко, С.А.Поленов, А.К.Агнаев. – М.: Медицина, 1975. – 324 с.
- Федоров В.Ф. О некоторых неиспользованных возможностях статистических методов в кардиологии / В.Ф.Федоров, А.В.Смирнов // II науч.-практ. конф. «Клинические и физиологические аспекты ортостатических расстройств». – М., 2000. – C. 138–148.
- Analysis of heart rate variability five minutes before the onset of paroxysmal atrial fibrillation / M.Fioranelli [et al.] // Pacing Clin. Electrophysiol. – 1999. – Vol.5, N22. – P.743–749.
- Andresen, D. Heart rate variability preceding onset of atrial fibrillation / D.Andresen, T.Bruggemann // J. Cardiovasc. Electrophysiol. – 1998. – Vol.9 (Suppl.8). – P.526–529.
- Autonomic modulation of the sinus node following electrical cardioversion of persistent atrial fibrillation: relation with early recurrence / E.Bertaglia [et al.] // Int. J. Cardiol. – 2005. – Vol.102. – P.219–223. – режим доступа: www.af-symposium.org.
- Bettoni, M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation / M.Bettoni, M.Zimmermann // Circulation. – 2002. – Vol.105. – P.2753–2759.
- Changes of autonomic tone before the onset of paroxysmal atrial fibrillation / J.L.Huang [et al.] // Int. J. Cardiol. – 1998. – Vol.30. – N66(3). – P.275–283.
- Chaos and spectral analyses of heart rate variability during head-up tilting in essential hypertension / S.Kagiyama [et al.] // J. Auton. Nerv. Syst. – 1999. – Vol.76(2-3). – P.153–158.
- Competing autonomic mechanisms precede the onset of postoperative atrial fibrillation / D Amar [et al.] // J. Am. Coll. Cardiol. – 2003. –Vol.42. – P.1262–1268.
- Detection of cardiac function by fractal dimension analysis / T.Yambe [et al.]// Artif. Organs. – 1999. – Vol.23(8). – P.751–756.
- Differences in heart rate dynamics before the spontaneous onset of long and short episodes of paroxysmal atrial fibrillation / S.Vikman [et al.] // Ann. Noninvasive Electrocardiol. – 2001. – Vol.6(2). – P.134–142.
- Evidence for increased atrial sympathetic innervation in persistent human atrial fibrillation / P.A.Gould [et al.] // Pacing Clin. Electrophysiol. – 2006. – Vol.29. – P.821–829.
- Evolution of changes in the ventricular rhythm during paroxysmal atrial fibrillation/ M.M.Gallagher [et al.] // Pacing. Clin. Electrophysiol. – 1998. – Vol.11 (Pt. 2). – P.2450–2454.
- Heart rate variability in patients with atrial fibrillation is related to vagal tone / M.P.Van-den-Berg [et al.] // Circulation. – 1997. – Vol.96(4). – P.1209–1216.
- Hohnloser, S. Noninvasive diagnostic methods for cardiac arrhythmias / S.Hohnloser // ACC Сurr. J. – 1997. – Vol.4 (8). – P.28–31.
- Influence of anti-arrhytmia agents on heart rate variability / B.Brembilla-Perrot [et al.] // Ann. Cardiol. Angeiol. Paris. – 1997. – Vol.46(3). – P.129–134.
- Influence of forced respiration on nonlinear dynamics in heart rate variability / J.K.Kanters [et al.] // Am. J. Physiol. – 1997. – Vol.272 (4), pt.2. – P.1149–1154.
- Is baseline autonomic tone associated with new onset atrial fibrillation? Insights from the framingham heart study / J.P.Singh [et al.] // Ann. Noninvasive Electrocardiol. – 2004. – Vol.9. – P.215–220.
- Non-linear algorithms for processing biological signals / S.Cerutti [et al.] // Comput. Methods Programs Biomed. – 1996. – Vol.51(1-2). – P.51–73.
- Pincus, S. Approximate entropy as a measure of system complexity / S.Pincus // Proc. Nat. Aadem. Sci. USA. – 1991. – Vol.88. – P.2291–2301.
- Role of atrial electrophysiology and autonomic nervous system in patients with supraventricular tachycardia and paroxysmal atrial fibrillation / Y.J.Chen [et al.] // J. Am. Coll. Cardiol. – 1998. – Vol.32. – P.732–738.
- Role of autonomic tone in facilitating spontaneous onset of typical atrial flutter / Z.C.Wen [et al.] // J. Am. Coll. Cardiol. – 1998. – Vol.31(3). – P.602–607.
- The application of methods of nonlinear dynamics for the improved and predictive recognition of patients threatened by sudden cardiac death / A.Voss [et al.] // Cardivasc. Res. – 1996. – Vol.31(3). – P.419–433.
- The chaotic component of human heart rate variability shows a circadian periodicity as documented by the correlation dimension of the time-qualified sinusal R-R intervals / M.Curione [et al.] // Clin. Ter. – 1998. – Vol.149(6). – P.409–412.
Медицинские новости. – 2014. – №11. – С. 81-87.
Читайте также: ЛЕЧЕНИЕ НАРУШЕНИЙ СЕРДЕЧНОГО РИТМА У ПАЦИЕНТОВ С НЕДОСТАТОЧНОСТЬЮ КРОВООБРАЩЕНИЯ













Комментировать