Тенденции. Метод ПЖХ. Исследование микробиоты с использованием ПЖХ. Результаты проведенных исследований..
РМЖ, Мескина Е.Р.
Современные данные свидетельствуют о том, что вирусные диареи занимают лидирующие позиции в структуре острых кишечных инфекций (ОКИ) у детей [1-3]. В настоящее время патогенез вирусных кишечных инфекций в целом изучен, подходы к лечению разработаны. Рекомендованы безлактозная диета, регидратационные мероприятия, сорбенты и пробиотики [4-6]. Тем не менее остаются нерешенными ряд проблем. Не ясны особенности течения вирусной диареи у детей с отягощенным преморбидным состоянием и дисбиозом кишечника, окончательно не обозначены особенности функционального состояния желудочнокишечного тракта (ЖКТ) после перенесенной инфекции. Дискутируется необходимость назначения антибактериальной терапии пациентам первых месяцев жизни, с отягощенным преморбидным состоянием или сопутствующими заболеваниями. Не разработана тактика ведения больных в периоде реконвалесценции, поскольку не выделены контингенты пациентов, нуждающихся в реабилитационных мероприятиях. Исследования, направленные на изучение функционального состояния ЖКТ в остром периоде вирусной диареи и в периоде реконвалесценции, позволяют оценить объемы необходимой терапевтической тактики, и в конечном итоге направлены на минимализацию последствий заболевания.
В последние годы заслуженную популярность в качестве диагностического метода, оценивающего состояния микробиоты толстой кишки, приобретает исследование спектра короткоцепочечных (летучих) жирных кислот (КЖК) с помощью газожидкостной хроматографии (ПЖХ) [7,8]. По мнению исследователей, спектр КЖК является биомаркером микробиологического состояния толстой кишки и показателем функционального благополучия кишечника [9,10]. КЖК играют важные физиологические функции в организме: обеспечивают энергией эпителиоциты, участвуют в обмене электролитов и воды, иммунных, пролиферативных процессах в кишечнике [9-12].
С точки зрения диагностики микробиологических нарушений этот метод интересен тем, что позволяет оценить состояние анаэробных популяций бактерий толстой кишки, что недоступно общепринятым бактериологическим посевам фекалий.
Методом ПЖХ определяют абсолютные концентрации уксусной (С2), пропионовой (С3), масляной (С4), изомасляной 0С4), валериановой (С5), изо-валериановой 0С5), капроновой (С6) и изо-капроновой (Ю6) жирных кислот, продуцируемых совокупностью бактерий, присутствующих в толстой кишке. Дополнительно рассчитываются: суммарное содержание (общий уровень) КЖК, позволяющее судить об интегральной активности микрофлоры; сумма изо-кислот (сумма Юп) признак активности протеолитической микрофлоры; анаэробный индекс (АИ) отношение суммы концентраций кислот, кроме уксусной, к концентрации С2; индекс изокислот (ИИ) суммарное отношение нормальных кислот к изо-формам и отношения Ю4/С4, Ю5/С5, Ю6/С6, отражающие соотношение протеолитической и сахаролитической активности анаэробной микрофлоры. Анаэробный индекс показатель популяционного соотношения строгих анаэробов к факультативноанаэробным, поскольку продуцентами С3-С6 являются только строгие анаэробы, а уксусной кислоты почти вся индигенная микрофлора. Кроме того, оцениваются доли С2-С4 в их сумме (профиль КЖК) показатель, отражающий сбалансированность анаэробной микрофлоры.
Концентрации КЖК в фекалиях у здоровых детей находятся в прямой зависимости от возраста и отличаются в следующих возрастных группах: дети первого года жизни, 12-18 месяцев, 1,5-4 года, старше 4 лет [13]. Поэтому нами был предложен способ унификации результатов ПЖХ путем расчета для каждого пациента отклонений от нормы (выраженных в процентах) индивидуальных концентраций КЖК и соответствующих индексов. Это позволяет оценить уровень нарушений показателей в каждой возрастной группе, а также общую
их динамику в группах, состоящих из детей разных возрастов.
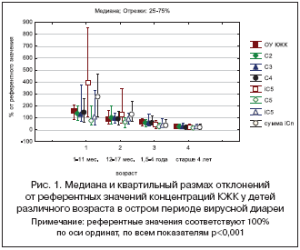
Исследование микробиоты с использованием ПЖХ было проведено у 139 детей с подтвержденной вирусной диареей и госпитализированных в стационар. Выявлено, что метаболическая активность микрофлоры в остром периоде болезни существенно отличается в зависимости от возраста и находится в обратной корреляции с ним (рис. 1). Если у детей первого года жизни в основном обнаруживались высокие концентрации КЖК (50-70%), что свидетельствовало об увеличении численности анаэробных бактерий в толстой кишке, то у пациентов старше 4 лет в 100% наблюдений отмечены очень низкие концентрации КЖК до 20-30% от нормы (признак резкого угнетения микрофлоры).
В динамике лечения вирусной диареи отмечены тенденции к восстановлению микробиоценоза, однако к моменту нормализации стула не выявлено нормализации ее метаболической активности, так как референтные значения отдельных КЖК обнаруживались только у 10-40% пациентов вне зависимости от возраста. Следует подчеркнуть, что к моменту ликвидации симптомов заболевания нормальная структура микробиоты (соотношение сахаролитических и протеолитических анаэробов) диагностировалась не более чем у половины пациентов (33-50%). Отклонение анаэробного индекса в область резко отрицательных значений (преобладание строгих анаэробов с протеолитическими возможностями) наблюдалось в 43, 36, 54 и 26% случаев в вышеуказанных возрастных группах соответственно (p>0,05). Активация строгих анаэробов является неблагоприятным прогностическим критерием, так как способствует дисфункции ЖКТ и поддерживает длительный дисбиоз.
Был проведен поиск факторов, оказывающих негативное влияние на структуру микробиоты в раннем периоде реконвалесценции. Интерес представляет анализ клинико-лабораторных данных у детей от 1 года до 4 лет, поскольку в этой возрастной группе чаще всего регистрируются вирусные диареи. Выявлено, что худшее ее состояние обнаруживалось у пациентов с отягощенным преморбидным состоянием. В качестве клинически значимых преморбидных факторов у пациентов этого возраста следует отметить следующие: частые повторные респираторные заболевания, наличие гастроинтестинальных жалоб и дисфункции ЖКТ в анамнезе, атопический дерматит.
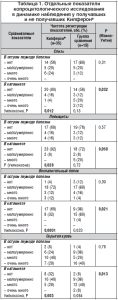
У детей, имевших указанные факторы в анамнезе (n=50), в остром периоде болезни установлена большая частота гемодинамических нарушений (68 против 34%, р=0,006), колитических примесей в стуле (64 против 38%, р=0,034), а также более продолжительная рвота (1,7±0,1 против 1,2±0,1 дня, р=0,05). В отличие от детей, не имевших указанные факторы в анамнезе (n=32), у них обнаруживались низкие концентрации уксусной кислоты в фекалиях (Ме=55,3 против Ме=82,7% от нормы, р=0,027) и более высокие количества воспалительного белка (р=0,020, рис. 2). Эти данные указывают на меньшую численность сахаролитических анаэробов (основными продуцентами уксусной кислоты являются облигатные бактерии) и более выраженный воспалительный процесс в кишечнике. Комплекс клинико-лабораторных отличий, характеризующий детей с отягощенным преморбидным состоянием, позволяет заподозрить активацию бактериальной микрофлоры в кишечнике на фоне вирусной ОКИ.
Несмотря на равную продолжительность диарейного синдрома (3,1±0,2 и 3,0±0,2 дня), у детей с отягощенным преморбидным состоянием обнаруживалось худшее состояние микробиоценоза в периоде ранней реконвалесценции. У них по-прежнему сохранялось низкое содержание уксусной кислоты в фекалиях (Ме=52,1 против 78,7% от нормы, р=0,034). Но более существенным является то, что у большинства этих пациентов была существенно нарушена структура микробиоценоза в пользу преобладания продуцентов масляной кислоты. Частота обнаружения ее высокой доли в профиле КЖК была достоверно большей (р=0,0007), а низкой доли уксусной кислоты меньшей (р=0,004, рис. 3).
Основными продуцентами масляной кислоты у детей раннего возраста являются бактерии рода Clostridium[13]. Активация маслянокислого брожения и снижение активности уксуснокислого свидетельство преобладания строгих анаэробов (в большей мере клостридий) над облигатными бактериями, что является крите-
рием микробиологического неблагополучия в толстой кишке. Вероятно, вирусная диарея у детей с неблагоприятным анамнезом усугубляет фоновый структурный дисбиоз, сутью которого является преобладание строгих анаэробов и дефицит облигатных «сахаролитиков». Эти дети нуждаются в разработке корригирующих мероприятий как в стационаре, так и в периоде реконвалесценции.
Учитывая полученные ранее данные о том, что препараты интерферона благоприятным образом сказываются на сроках выздоровления пациентов с ОКИ [14], нами была предпринята попытка оценить эффективность препарата Кипферон® суппозитории для вагинального или ректального введения, содержащего рекомбинантный человеческий а2-интерферон и иммуноглобулины классов G, А, М, у детей с отягощенным преморбидным состоянием, госпитализированных в стационар с вирусной диареей. Особое внимание было уделено оценке состояния микробиоты кишечника, как показателю полноты клинического выздоровления. Исследование микробиоты было проведено с использованием метода ПЖХ.
В исследование было включено 50 детей от 1 года до 4 лет, 90% пациентов дети раннего возраста. Критериями включения пациентов в исследование были: подтвержденная вирусная диарея, среднетяжелая форма инфекции, отягощенное преморбидное состояние по сочетанию не менее трех преморбидных факторов.
В числе последних регистрировались: гастроинтестинальные жалобы и нарушения характера стула в анамнезе 58%, частые повторные ОРВИ 32%, сопутствующая респираторная инфекция 64% (протекавшая в осложненной форме у 20%), отягощенный аллергический анамнез 46%, клинические признаки атопического дерматита 18%, кандидоз слизистых полости рта и кожи в перианальной области 20%. В течение месяца до настоящей госпитализации 40% детей перенесли ОРЗ, в том числе 24% получали антибактериальную терапию, 14% лечились в стационаре. Ротавирусный гастроэнтерит был подтвержден у 70%, норовирусный у 24%, микст-вирусные инфекции у 6% детей (для диагностики вирусных инфекций использовались реакция непрямой гемагглютинации (РНПА) и полимеразная цепная реакция с флуорисцентной детекцией в режиме реального времени (ПЦР-РВ)). У всех пациентов заболевание протекало по типу гастроэнтерита. Комплекс лечения включал: оральную регидратацию или при необходимости инфузионную (62%) терапию, безлактозную диету, смектит диоктаэдрический и пробиотики (100%). Парэнтеральная антибактериальная терапия по поводу сопутствующих заболеваний была назначена 6% пациентов, флуконазол по поводу грибковой инфекции 8%. Кипферон® был назначен с первого дня госпитализации по 1 суппозиторию дважды в сутки 25 детям в течение 5-7 дней. Дети группы сравнения Кипферон® не получали. Сравниваемые группы были сопоставимы по всем клиническим показателям (р>0,05).
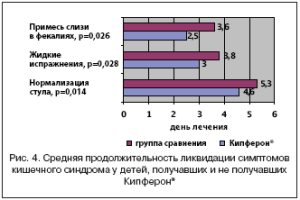
Наблюдение за пациентами продемонстрировало быстрые сроки ликвидации симптомов интоксикации и гипогидратации без достоверных отличий в сравниваемых группах, что было обусловлено эффективной регидратацией и правильной диетой. Вместе с тем у детей, получавших Кипферон®, отмечены более короткие сроки устранения диареи, в том числе жидкого характера фекалий, и что крайне важно слизи (рис. 4). Эффективность лечения в сравниваемых группах была высокой и составила 100 и 96%. Статистически не отличалась и частота вирусологической санации к моменту нормализации стула (36 и 20%).
Вместе с тем у пациентов, получавших Кипферон®, в соответствии с данными клинического наблюдения отмечены более быстрые сроки ликвидации местного воспалительного процесса по всем копроцитологическим признакам (табл. 1). Следует отметить, что у трети пациентов с отягощенным преморбидным состоянием, получавших общепринятое лечение, в раннем периоде реконвалесценции, несмотря на нормальный стул, сохранялся местный выраженный воспалительный процесс с признаками повреждения морфологической целостности кишечного эпителия.
Коррелирующие данные получены и при исследовании метаболической активности анаэробной микрофлоры. Дополнительно подтверждено резкое угнетение бактериальной ферментации и, следовательно, численности бактериальных популяций в толстой кишке в остром периоде болезни у детей с отягощенным преморбидным состоянием (рис. 5А). Одновременно выявлены признаки преобладания бактериального протеолиза,
в том числе популяций с гемолитической активностью, поскольку индекс изо-кислот (Ме=152 и 144% от нормы) и отношение Ю5/С5 (Ме=183,7 и 218,9%) в сравниваемых группах были очень высокими (р>0,05). Это соответствует выраженному местному воспалительному процессу.
В периоде ранней реконвалесценции у получавших Кипферон® отмечено нарастание концентрации всех КЖК (рис. 5Б) за исключением масляной и изо-валериановой кислот. Это способствовало в целом нормализации метаболической активности микробиоты и отражало полноту выздоровления пациентов. У детей группы сравнения не обнаруживалось достоверно значимой динамики групповых показателей. Причем концентрация общего уровня КЖК, С2, С3 и С5 у этих пациентов была достоверно более низкой, чем у получавших иммунотропную терапию (р<0,05). В качестве еще одного положительного аспекта лечения Кипфероном® следует отметить более низкие значения соотношения Ю5/С5 после лечения (Ме=139,9 против 272,4%, р=0,003), что указывает на снижение активности гемолитической микрофлоры и сопоставляется с более низким содержанием скрытой крови и воспалительного белка в фекалиях.
Интересно, что благодаря восстановлению численности сахаролитических бактерий, продуцентов уксусной кислоты, у получавших Кипферон® реже наблюдалась задержка опорожнения кишечника в раннем периоде реконвалесценции (24% против 48%, р=0,048), что расценивалось как косвенное свидетельство нормализации и моторной функции кишечника за счет восстановления общего пула КЖК, играющих важную роль в осуществлении этой функции ЖКТ [9,11,15].
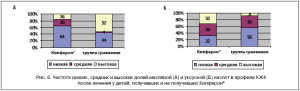
В целом структура микробиоценоза у пациентов после лечения Кипфероном® была более сбалансированной и соответствовала таковой у детей без отягощенного преморбидного фона, поскольку не наблюдалось активации маслянокислого брожения за счет подавления уксуснокислого у большинства пациентов (рис. 6А и Б).
Таким образом, поскольку обнаружена существенная разница микробиоты в остром периоде болезни у детей различных возрастных категорий при вирусной ОКИ, лечебные мероприятия, в целом направленные на коррекцию патогенетических нарушений, должны учитывать указанное обстоятельство. Поэтому тактика ведения и реабилитации детей разного возраста, перенесших вирусную диарею, должна совершенствоваться.
У детей от 1 года до 4 лет, чаще болеющих вирусной диареей, отдельные преморбидные факторы негативно сказываются на состоянии микробиоты, обусловливая активацию бактериальной микрофлоры, как в остром периоде болезни, так и в периоде реконвалесценции. Поэтому эти пациенты нуждаются в дополнительных корригирующих мерах, причем обязательно щадящих.
Настоящее исследование продемонстрировало, что использование Кипферона® сокращает сроки выздоровления, и что особенно важно улучшает состояние ЖКТ, в частности, толстой кишки, в раннем периоде реконвалесценции.
Представляется, что иммунокорригирующие эффекты интерфероновых препаратов, в том числе и на местном уровне, позволяют нивелировать неблагоприятное влияние бактериальных популяций, в том числе и строгих анаэробов в кишечнике у детей с неблагоприятным преморбидным состоянием и способствуют более быстрому восстановлению функции ЖКТ и выздоровлению.
Полученные данные свидетельствуют, что несмотря на признаки активации бактериального процесса в толстой кишке на фоне вирусной диареи у детей с отягощенным преморбидным состоянием, они в большинстве своем могут лечиться без использования антибактериальных препаратов, особенно находясь под наблюдением в стационаре. Более того, назначение антибиотиков этим детям нежелательно, так как значительно ухудшает состояние микробиоценоза, подавляя активность облигатных сахаролитических бактерий. Введение в программу лечения иммунотропного препарата Кипферон® приводит к более быстрому наступлению клинического выздоровления за счет модуляции иммунных реакций, в том числе и на местном уровне. Более быстрое восстановление микробиоты у получавших Кипферон® косвенное свидетельство ликвидации воспалительного процесса и элиминации бактериальных патогенов, активация которых на фоне вирусной диареи у детей с отягощенным преморбидным состоянием особенно велика.
Литература
- Учайкин В.Ф. Решенные и нерешенные проблемы инфекционной патологии у детей// Детские инфекции. 2003. №4. С. 3-7.
- Тихомирова О.В., Сергеева Н.В., Сироткин А.К. Вирусные диареи у детей: особенности клинического течения и тактика терапии//Детские инфекции. 2003. №3. С. 7-11.
- Ротавирусная инфекция у детей: особенности клинического течения, диагностические подходы и тактика терапии: Пособие для врачей/ О.В.Тихомирова, Н.В.Сергеева, О.А. Аксенов. СПб., 2005. 32 с.
- Клинические рекомендации по диагностике и лечению острых кишечных инфекций у детей: Пособие для врачей/А.В. Горелов, Л.Н. Милютина, Д.В. Усенко. М., 2006. 91 с.
- Горелов А.В. Современные подходы к стартовой терапии острых кишечной инфекций у детей//Вопросы современной педиатрии. 2003. Т.2, №2,3. С. 2-4.
- Мазанкова Л.Н., Боровик Т.Э., Рославцева Е.А. Осмотическая диарея у детей и принципы патогенетического лечения//Вопросы современной педиатрии. 2003. Т.2, №4. С. 47-54.
- Иконников О.А., Ардатская М.Д., Дубинин А.В. и др. Способ разделения смеси жирных кислот, фракций С2-С7 методом газожидкостной хроматографии, Патент РФ №9910669/12. Приоритет от 04.04.1999 г.
- Определение метаболической активности микрофлоры кишечника в комплексной оценке микроэкологических и функциональных нарушений толстого кишечника: Пособие для врачей // О.А. Кондракова, В.Н.Бабин, Е.А. Грубова и др. М., 2003. 26 с.
- Colonic health: fermentation and short chain fatty acid/J.M.Wong, R. de Souza, C.W. Kendall at al. // J Clin Gastroenterol. 2006., Vol. 40. №3. P. 235-243.
- Cook SI., Sellin JH. Review article: Short chain fatty acids in health and disease // Aliment Pharmacol Ther. -1 998. Vol. 12. P 499-507.
- Short-Chain Fatty Acid Reguiate the Enterc Neurons and Control Neurons and Control Gastrointestinal Motility in Rats / R. Soret, J. Chevalier, P. Coppet et al. // Gastroenterology. 2010. Vol.138. P. 1772-1782.
- Stimulation of sodium chloride absorption from secreting rat colon by short-chain fatty acids / S. Krishnan, B.S. Ramakrishna, H.J. Binder // Dig Dis Sci. 1999. Vol.44. P.1924-1930.
- Метаболические критерии дисбактериоза кишечника при острых кишечных инфекциях у детей/ Н.О. Ильина, Л.Н. Мазанкова, О.А. Кондракова О.А., Затевалов А.М. // Consiliummedicum. Приложение Гастроэнтрология. 2010, №1 С. 32-38.
- Оптимизация методов лечения детей с вирусно-бактериальными инфекциями различной этиологии. ФС № 2009/326 от 30 сентября 2009г: Новая медицинская технология // Л.В. Феклисова, Е.Р.Мескина, Л.А. Галкина и др. М., 2010.-16с.
- The relationship between the effects of short-chain fatty acids on intestinal motility in vitro and GPR43 receptor activation. / N.B. Dass, A.K. John, A.K. Bassil et al.//Neurogastroenterol Motil. 2007. Vol.19.P. 66-74.










Комментировать