Шилов А.М., Дулаева М.С., Осия А.О., Абдуллаева А.Т.
Для современного больного характерна множественность сопутствующих заболеваний – полиморбидность (независимое сочетание различных болезней у одного пациента), которые могут оказывать взаимовлияние на течение и клинические проявления патологий (принцип суперпозиции). С увеличением возраста пациента возрастает и частота хронических болезней и их сочетаний, что вызывает трудности для врача общей практики в своевременной диагностике и подборе адекватного комплексного лечения. Современное представление о ведении пациентов с сердечно– сосудистыми заболеваниями (ССЗ), в том числе больных артериальной гипертонией (АГ) и хронической сердечной недостаточностью (ХСН), предусматривает многофакторный метод лечения, направленный не на один или несколько, а на все существующие факторы риска (ФР) у конкретного пациента. Такой подход диктует необходимость совместного применения препаратов с различной фармакологической направленностью, что создает определенные трудности в достижении необходимого терапевтического эффекта. Появление в распоряжении практикующего врача препарата с плейотропными свойствами (сочетание одновременного воздействия на различные ФР) будет способствовать повышению приверженности пациентов к лечению.
АГ в экономически развитых странах относится к числу наиболее распространенных хронических неинфекционных заболеваний среди взрослого населения с высоким риском поражения органов– мишеней: мозговые инсульты, инфаркт миокарда, первичный нефросклероз и развитие ХСН.
За последние 5–10 лет во взглядах ведущих специалистов в области кардиологии на патофизиологию, диагностику и лечение АГ произошли весьма существенные изменения, которые были отражены в Европейских рекомендациях по диагностике и лечению АГ (2003 г.). Окончательно признана полигенность эссенциальной АГ, что означает необходимость ее рассмотрения не только как болезни хронически повышенного АД, но и как сложный комплекс взаимосвязанных гемодинамических, метаболических и нейрогуморальных нарушений. В настоящее время гетерогенность этиологии и механизмов формирования высоких показателей АД – общепринятая концепция среди кардиологов–клиницистов. Подобная «мозаичная теория» подразумевает тесное взаимодействие различных подсистем, составляющих интегральную систему регуляции АД [2,3,6].
Современные рекомендации по диагностике и лечению ССЗ большое значение придают выявлению и коррекции ФР развития заболеваний сердечно–сосудистой системы (ССС). Эти ФР во многом универсальны, то есть характерны для большинства ССЗ, и хорошо известны. В настоящее время ФР подразделяют на:
модифицируемые – ЧСС, ожирение, уровень холестерина, уровень АД, наличие НТГ или СД 2 типа, курение;
немодифицируемые – возраст, пол, расовая принадлежность, отягощенный семейный анамнез;
мягкие – агрегационное состояние крови, низкий уровень ЛПВП и α–липопротеина, высокий уровень С–реактивного протеина, гомоцистеина, мочевой кислоты, тканевого активатора плазминогена–1, ФНО–α, ИЛ и т.д.
Каждый ФР имеет свой удельный вес в вероятности развития того или иного заболевания ССС. При этом совместное воздействие нескольких ФР на одного пациента способствует существенному увеличению риска развития сердечно–сосудистых осложнений (ССО) – c 5,5% у пациентов с 1 ФР до 21,8% у пациентов с 8 и более ФР [2].
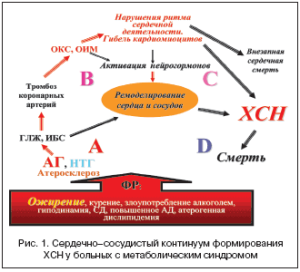
В 1991 г. V. Dzau и E. Braunwald сформулировали понятие единого «сердечно–сосудистого континуума», которое в течение последних 20 лет конца ХХ и начала ХХI века прочно вошло в научно–медицинскую практику. Применительно к практической медицине «континуум» (от английского «continuous» – постоянный, непрерывный) подразумевает непрерывную последовательность этапов развития заболевания – от ФР до летального исхода (рис. 1).
В 2001 г. на совместном заседании Американского колледжа и Американской ассоциации сердца были разработаны и рекомендованы этапы (стадии) сердечно–сосудистого континуума:
cтадия А – это формирование ФР, начало профилактики и лечения каких–либо первых признаков заболевания с целью предупреждения развития ХСН;
стадия В – это годы лечения с использованием всех лечебно–профилактических мероприятий, включением методов эффективного восстановления насосной деятельности сердца;
стадия С – это месяцы лечения с помощью всех мероприятий стадий А и В с использованием лекарственных средств, направленных на устранение осложнений и клинических признаков СН;
стадия D – самая сложная стадия, когда пациент нередко нуждается в наблюдении и лечении в блоках интенсивной терапии, в ряде случаев врачи вынуждены применять кардиореанимационные мероприятия, подсадку искусственного левого желудочка, клеточную терапию, пересадку сердца, т.е. то, что требует серьезных финансовых затрат (рис. 1) [2].
Проведение лечебно–профилактических мероприятий на ранней стадии болезни может улучшить качество (снизить заболеваемость) и прогноз жизни (снизить смертность) в отношении ХСН. Следовательно, логичны ранняя профилактика и устранение ФР (адекватное лечение АГ, ИБС, СД 2 типа).
Современную кардиологию невозможно представить без препаратов группы β–адреноблокаторов, которых в настоящее время известно более 30 наименований. За последние 50 лет клинической практики β–адреноблокаторы заняли прочные позиции в профилактике осложнений и в фармакотерапии ССЗ: АГ, ИБС, ХСН, метаболического синдрома (МС). Традиционно в неосложненных случаях медикаментозное лечение АГ начинают с β–адреноблокаторов и диуретиков, снижающих риск развития ИМ, нарушения мозгового кровообращения, ХСН и внезапной кардиогенной смерти.
Общепринятая модель патогенеза АГ недостаточно учитывает вклад нарушений реологических свойств крови, определяемых углеводно– белково–липидным составом (гипергликемия, гиперфибринемия, атерогенная дислипидемия) и функциональным состоянием форменных элементов крови (тромбоциты, эритроциты, лейкоциты), в формирование высоких значений АД как интегрального показателя нарушений центральной и периферической гемодинамики.
Ожирение признано неинфекционной эпидемией конца ХХ – начала ХХI века из–за широкой распространенности среди населения, особенно в странах с развитой экономикой, высокого риска развития ССЗ, ранней инвалидизации больных и преждевременной смертности. Сегодня в мире наблюдается настоящая эпидемия – 30% населения Земли страдают ожирением, не считая тех, кто имеет просто избыток массы тела. Ожирение – это не только избыточный объем жировой ткани, обладающий тенденцией к прогрессированию в отсутствие специфической терапии, но и сложный комплекс метаболических нарушений. Отечественных клиницистов также волновал вопрос ожирения и сопутствующих заболеваний.
В 1930–е гг. Г.Ф. Ланг указывал на связь АГ с СД, ожирением: «Гипертония наблюдается часто у лиц, которые в силу социального и экономического положения и связанных с этим привычек едят много, злоупотребляют алкоголем, много курят и ведут сидячий образ жизни. Необходимо подчеркнуть, что в большинстве случаев эти факторы действуют не в отдельности, а совместно» [7,8].
Основной причиной увеличения количества случаев ожирения принято считать изменение образа жизни современного человека в сторону избыточного потребления высококалорийной пищи и снижения физической активности, произошедшее среди населения высокоразвитых индустриальных стран за последние десятилетия. Лидером по распространенности ожирения являются США. В России, по данным НИИ питания РАМН от 2005 г., 55% россиян имеют избыточную массу тела, из них 22% страдают ожирением [7].
Одним из важных результатов исследования регистра REACH (REduction of Aterotrombosis for Continued Health), основанного на включении 63 857 пациентов из 44 стран, является вывод о высокой распространенности избыточной массы тела и ожирения, особенно в странах Северной Америки. Распространенность ожирения, по данным измерения ИМТ, коррелирует с частотой ожирения, диагностируемого на основании увеличения окружности талии (ОТ) [13,14,16].
Диагностика типа ожирения базируется на определении соотношения ОТ и обхвата бедер (ОБ). Абдоминальный тип ожирения – ОТ/ОБ = > 1,0 для мужчин и более 0,85 для женщин. По результатам метарегрессивного анализа 15 проспективных исследований, посвященных МС, была выявлена достоверная связь между ОТ/ОБ и риском возникновения ССЗ: каждый лишний сантиметр талии увеличивает риск ССЗ на 2%, а при повышении ОТ/ОБ на 0,01 риск ССЗ возрастает на 5%.
У мужчин и женщин увеличение массы тела часто сопровождается повышением артериального давления, сопряженным с активацией симпатического тонуса и ренин–ангиотензин–альдостероновой системы (РААС), с задержкой натрия и жидкости, увеличением объема циркулирующей крови (ОЦК), вызванных развитием резистентности к инсулину (ИР), нарушением уровней липидов плазмы в сторону атерогенной дислипидемии. Эти изменения имеют тенденцию к прогрессированию при дефиците эстрогенов, гормонов щитовидной железы. Таким образом, ожирение – один из факторов в созвездии метаболических нарушений, которые приводят к развитию АГ и ХСН [9,10,13].
В последние годы в центре внимания находится проблема лечения пациентов с АГ, сочетающейся с метаболическими нарушениями со стороны липидного и гликемического профилей. Решением этой проблемы является использование вместо неселективных β–блокаторов и тиазидных диуретиков метаболически нейтральных кардиоселективных блокаторов адренорецепторов у «проблемных» пациентов с АГ. Выбор антигипертензивной терапии у больных АГ сложен [3,4,8,9,11,12]. Он обусловлен необходимостью исключения препаратов, оказывающих неблагоприятные воздействия на процессы метаболизма глюкозы и липидов. Одновременно с этим лекарственные средства должны обладать нефро– , кардио– и сосудистым протективными эффектами.
Современное представление о ведении пациентов с АГ предусматривает многофакторный метод лечения. Такой подход диктует необходимость совместного применения препаратов с различной фармакологической направленностью для достижения необходимого терапевтического эффекта.
Все вышеизложенное мотивировало проведение данного исследования для оценки метаболической нейтральности и терапевтической эффективности кардиоселективного β–блокатора – Бисогамма® («Вѐрваг Фарма») у больных с АГ и избыточной массой тела с целью профилактики развития ХСН.
Материал, методы обследования и результаты лечения
В клиническое обследование были включены 96 пациентов с АГ I–II степени (52 мужчины, 44 женщины) в возрасте от 20 до 40 лет (средний возраст по группе составил 32,4±3,5 года), у 76 пациентов (79,2%) ИМТ ≥ 25 кг/м2 и в среднем по группе составил 31,2±1,3 кг/м2. По исходным демографическим и антропометрическим данным подгруппы мужчин и женщин с АГ не различались между собой (табл. 1).
Таблица 1. Демографические и антропометрические данные в зависимости от пола пациентов с АГ
| Параметр | Мужчины (n=52) | Женщины (n=44) |
| Средний возраст (лет) | 31,9±3,4 | 33,0±4,1 |
| САД (мм. рт. ст.) | 153,4±3,2 | 156,5±4,1 |
| ДАД (мм. рт. ст.) | 95,9±2,9 | 97,8±3,1 |
| ИМТ (кг/м2) | 30,2±1,2 | 32,4±1,5 |
| ОТ/ОБ | 0,97±0,09 | 0,94±0,12 |
Всем больным, включенным в программу исследования, до и после лечения проводилось суточное мониторирование АД и ЭКГ на бифункциональном мониторе Card(X)plore. ЭхоКГ и, c целью изучения структурного состояния магистральных сосудов, исследование величины комплекса интима–медиа (КИМ) дистальных участков общей сонной и бедренной артерий было проведено с помощью допплер–УЗ–исследования в В–режиме на аппарате ELEGRA фирмы Siemens линейным датчиком 5–10 мГц. У всех наблюдаемых пациентов с АГ до, после 4–недельной (выписка из стационара) и 4–месячной терапии (амбулаторно) исследовали липидный спектр (с расчетом индекса атерогенности – ИА = [ОХС – 0,5ТГ – ЛПВП]/ ЛПВП) и углеводный профиль крови (глюкоза натощак), оценивали агрегационную активность тромбоцитов (ААТр), электрофоретическую подвижность эритроцитов (ЭФПЭ), содержание Mg в волосах. У 37 пациентов (38,5%) при исходном обследовании уровень содержания магния в волосах был меньше нормативной величины (n=17 мкг/кг) и в среднем составил 13,2±1,4 мкг/кг.
Селективный β1–блокатор – Бисогамма® применялся в качестве гипотензивной монотерапии по нарастающей схеме в зависимости от клинического эффекта от 2,5 мг до 10,0 мг однократно– двукратно в сутки в течение 4 мес. у 59 пациентов с АГ (средняя суточная доза составила 7,2±0,9 мг) и у 37 больных АГ с сопутствующим дефицитом магния (Mg в волосах < 17,0 мкг/кг). К гипотензивной терапии (средняя суточная доза Бисогаммы® составила 6,1±0,6 мг) был добавлен Магнерот® в дозе 2 г/сут.
Одновременно с целью нормализации липидного профиля всем больным в программу лечения был включен фенофибрат 145 мг 1 раз в сутки, рекомендована ежедневная физическая нагрузка – ходьба в течение 40–60 мин.
Результаты исследования до и после лечения (через 4 мес.) представлены в таблице 2.
Таблица 2. Динамика показателей у больных АГ до и после 4 мес. лечения
| Показатель | До лечения | После лечения |
| САД (мм. рт. ст.) | 154,8±5,2** | 136,7±4,8** |
| ДАД (мм. рт. ст.) | 96,8±3,8** | 84,1±2,9** |
| ИМТ (кг/м2) | 31,2±1,3 | 30,9±0,9 |
| Глюкоза натощак (ммоль/л) | 6,3±0,42* | 5,46±0,21* |
| ≤5,5 (29 пациентов) | 5,29±0,15 | 5,1±0,19 |
| >5,5 (67 пациентов) | 6,7±0,18** | 5,6±0,17** |
| ИА | 3,2±0,29* | 2,85±0,28* |
| ≤2,5 (23 пациента) | 2,2±0,15 | 2,3±0,16 |
| >2,5 (73 пациента) | 3,5±0,16** | 3,01±0,12** |
| Mg в волосах (мкг/кг) | 16,2±1,5 | 17,4±1,4 |
| ≥17,0 (59 пациентов) | 18,1±0,9 | 17,9±0,5 |
| <17,0 (37 пациентов) | 13,2±1,4* | 16,7±1,1* |
| ААТр (%) | 67,4±4,9*** | 47,2±4,3*** |
| ЭФПЭ (мкм/см/сек-1/В-1) | 0,862±0,012** | 1,095±0,017** |
| КИМ ОСА | 1,153±0,03 | 1,151±0,04 |
| КИМ ОБА | 1,23±0,03 | 1,231±0,04 |
| ФВ (%) | 47,9±3,9 | 56,3±4,1*** |
| Примечание: * р<0,05; **р<0,01; ***р<0,001 | ||
Как видно из таблицы 2, к концу исследования (контрольная точка) САД снизилось (статистически достоверно) по сравнению с исходным уровнем на 11,7%, ДАД уменьшилось на 13,1%, т.е. через 4 мес. лечения в среднем по группе были достигнуты целевые уровни давления (САД – 136,7±4,8 мм рт. ст., ДАД –84,1±2,9 мм рт. ст.).
Следует сказать, что при лечении больных АГ II ст. с дефицитом магния (Mg в волосах – 13,2±1,4 мкг/кг) Бисогаммой® в дозе от 5 до 7,5 мг в сутки (средняя суточная доза – 6,1±0,6 мг) в сочетании с Магнеротом® (2 г в сутки) практически в 90% наблюдений отмечено снижение диастолического давления в среднем на 15,6±6,5 мм рт. ст. (на 16,3%, p<0,01).
Нормализация липидного профиля у больных АГ на фоне лечения Бисогаммой® подтверждается результатами наших исследований: ИА в целом по группе снизился на 11% (р<0,05), преимущественно за счет его статистически достоверного уменьшения на 14% в подгруппе больных с ИА > 2,5 (от 3,5±0,16 до 3,01±0,12, р<0,01). Уменьшение ИА произошло в результате суммарного изменения липидного спектра крови в сторону антиатерогенного состава: ХС ЛПВП увеличился на 15,6% (от 0,96±0,04 ммоль/л до 1,11±0,07 ммоль/л, р<0,01), концентрации ТГ и ХС ЛПНП снизились соответственно на 23,8% (от 2,1± до 1,6± ммоль/л, р<0,01) и на 6,0% (от 3,36± до 3,16± ммоль/л, р<0,05).
За период 4–месячного наблюдения не было выявлено случаев изменений углеводного уровня крови в сторону его патологического увеличения. В подгруппе больных с исходным уровнем глюкозы натощак > 5,5 ммоль/л к концу контрольного исследования отмечено статистически достоверное снижение глюкозы натощак на 16,4% (в среднем по подгруппе от 6,7±0,18 ммоль/л до 5,6±0,17 ммоль/л, р<0,01).
После проведенного лечения ААТр снизилась на 30,0% по сравнению с исходными величинами; ЭФПЭ увеличилась на 27,0%. Увеличение ЭФПЭ к концу исследования на 27,0% суммарно по всей группе больных АГ на фоне лечения Бисогаммой®, возможно, опосредовано через нормализацию липидного профиля в сторону антиатерогенности. Известно, что нарушение липидного состава эритроцитарных мембран является одной из причин снижения способности эритроцитов к деформации, а следовательно, к нарушению их подвижности и, в целом, текучести крови, что способствует повышению ПСС и АД. Снижение агрегационной активности тромбоцитов к концу исследования на 30,0% суммарно по всей группе косвенно свидетельствует о наличии в тромбоцитарной мембране β–адренорецепторов. Использование β–адреноблокаторов при лечении АГ оказывает эффект «успокоения» тромбоцитов, делая их нечувствительными к катехоламинам, что подтверждается результатами исследований ряда авторов и нашими наблюдениями [5].
Метаболическая нейтральность (отсутствие «атерогенного и диабетогенного» эффектов), достоверная гипотензивная и дезагрегационная активность делают Бисогамму® предпочтительным β–блокатором перед другими препаратами этой группы в программе лечения пациентов с АГ и ИМТ > 25 кг/м2, сочетающихся с нарушением липидного и гликемического профилей сыворотки крови.
КИМ в ОСА и ОБА на протяжении всего периода наблюдения не отличался от исходного уровня (р>0,05) независимо от программы лечения, что свидетельствует о профилактическом эффекте Бисогаммы® в отношении прогрессирования ремоделирования резистивных сосудов у больных АГ.
Суммарно можно отметить улучшение реологических свойств крови, нормализацию углеводного и липидного спектров крови, снижение АД, что опосредованно способствует восстановлению микроциркуляции и насосной деятельности сердца. В нашем исследовании ФВ к концу лечения (Бисогамма®, Магнерот®) статистически достоверно увеличилась на 17,5% (р<0,01).
Обсуждение результатов лечения
Препараты из группы β–блокаторов отличаются друг от друга наличием или отсутствием кардиоселективности, внутренней симпатической активности, мембраностабилизирующим, вазодилатирующим свойствам, растворимости в липидах и воде, влиянию на агрегацию тромбоцитов, по продолжительности действия и путям выведения.
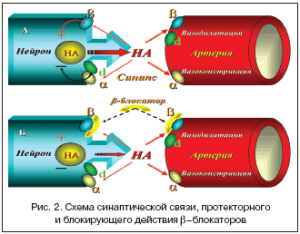
Общеизвестно, что применение кардиоселективных β–адреноблокаторов при лечении АГ направлено на уменьшение МОС за счет отрицательного хронотропного и инотропного эффектов, т.е. уменьшение ударного объема (УО) и ЧСС, т.к. МОС=УОхЧСС; ингибирование продукции ренина и, как следствие, снижение уровня ангиотензина II; ослабление центральных адренергических влияний за счет блокады пресинаптических адренорецепторов (рис. 2).
Важная роль среди эффектов β–адреноблокаторов отводится подавлению прямых кардиотоксических воздействий катехоламинов за счет снижения их выброса из нейронов через блокаду пресинаптических β–адренорецепторов (рис. 2). На фоне гипотензивного эффекта β–адреноблокаторы оказывают кардиопротективное действие через ингибирование апоптоза кардиомиоцитов, активируемое β– адренергическими путями. Этот же механизм β– адреноблокаторов способствует снижению агрегации тромбоцитов, увеличению подвижности эритроцитов, предотвращает разрывы атеросклеротических бляшек и, как следствие, тромбообразование.
В настоящее время многие страны мира переходят на использование дженериковых препаратов для улучшения показателей фармакоэкономики – современной науки о возможностях качественного лечения большего числа пациентов за счет выверенного экономического подхода к терапии. Дженерик, произведенный с соблюдением правил GMP в соответствии со строгим контролем качества, является удачной бюджетной альтернативой при использовании для широких слоев населения. Особого внимания заслуживают компании, осуществляющие брендирование (продвижение) дженериков, обеспечивая тем самым их узнаваемость, а значит, имеющие все основания и способные отвечать за высокое качество таких препаратов.
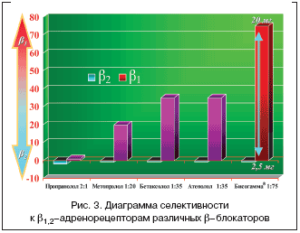
Бисогамма® – брендовое название дженерика бисопролола. Бисогамма® (бисопролол) – гидролипофильный высокоселективный β1–адреноблокатор с мембраностабилизирующим эффектом, не обладающий внутренней симпатомиметической активностью, с длительным периодом полувыведения (10–12 ч). Индекс β– селективности (ci/β1 к ci/β2) для Бисогаммы® равен 75:1, для атенолола и бетаксолола – 35:1, для метопролола – 20:1 (рис. 3). В терапевтически рекомендуемых дозах (от 2,5 до 20 мг) препарат почти не проявляет антагонистической активности в отношении β2–адренорецепторов и поэтому не вызывает таких метаболических эффектов, как гипергликемия, дислипидемия или гипокалиемия, не оказывает ангиоспастического влияния на периферические артерии, не вызывает бронхоспазм [14].
Фармакокинетической особенностью Бисогаммы® (бисопролола) как кардиопротектора является его высокая биодоступность (>90%) и растворимость одновременно в липидах и в воде (амфофильность), что обусловливает двойной путь элиминации – через печень и почки, не требует коррекции терапевтической дозы при заболевании этих органов. Фармакокинетика бисопролола не зависит от патологических изменений белкового состава плазмы крови, например при повышении концентрации кислых α1–гликопротеидов, т.к. только 30% активного вещества в крови связано с белком плазмы.
Бисогамма® (бисопролол) при длительном применении не влияет на уровни фракций атерогенного холестерина (триглицериды, ХС ЛПНП). В исследовании (в течение 13 мес.) среди больных АГ, которые получали бисопролол в суточной дозе от 5–10 мг, не было зарегистрировано статистически достоверных изменений содержания ОХС, ХС ЛПНП, снижения концентрации ХС ЛПВП в сторону атерогенности [14–16].
Последние годы клинической практики характеризуются повышенным вниманием к изучению процессов агрегации тромбоцитов, эластичности и подвижности эритроцитов в сопоставлении с плазменными компонентами крови у больных АГ [5,10]. Имеются данные, что под влиянием β– адреноблокаторов снижается агрегационная активность тромбоцитов и увеличивается подвижность эритроцитов за счет улучшения эластичности мембраны. β–адреноблокаторы способствуют уменьшению проницаемости мембран клеточных элементов крови для Na+ и Cl– cо снижением внутриклеточной концентрации Ca2+. Подобная динамика электролитов улучшает морфофункциональные характеристики тромбоцитов и эритроцитов, что суммарно улучшает кровоток на уровне резистивных артериол и капиллярного русла [4,6]. В наших исследованиях при лечении больных АГ Бисогаммой® документировано снижение ААТр на 30,0% с одновременным увеличением подвижности эритроцитов на 27%, что также внесло свой вклад в снижение САД и ДАД соответственно на 11,7 и 13,1%.
Таким образом, данные литературы и результаты исследования, представленные в этой статье, свидетельствуют о многокомпонентном гипотензивном эффекте Бисогаммы® с метаболической нейтральностью, что позволяет рекомендовать данный кардиоселективный β–блокатор при лечении больных АГ, сочетающейся с ожирением, нарушениями липидного и гликемического профилей сыворотки крови. Многопрофильность фармакологического воздействия Бисогаммы® на континуум ССЗ определяет возможность профилактики с его помощью развития ХСН.
Литература
1. Арабидзе Г.Г. Принципы лечения артериальной гипертонии. Место антагонистов кальция //«Кардиология 99»: Труды первого международного научного форума, 1999. – С. 54–57.
2. Беленков Ю.Н. Вклад различных факторов риска в сердечно–сосудистую смертность. Что их объединяет? // Пленум. Приложение к журналу «Сердце». – 2006.– №5 (5). – С.1–3.
3. Ерофеева С.Б., Белоусов Ю.Б. Место β–адреноблокатора Бисопролола в лечении артериальной гипертензии // Фарматека. – 2004. – № 6. – С. 23–26.
4. Евдокимова М.А., Затейщиков Д.А. Место селективного бета–адреноблокатора Конкора (Бисопролола) в лечении ишемической болезни сердца // Фарматека. – 2005. – № 10. – С. 21–26.
5. Задионченко В.С., Богатырева К.М., Станкевич Т.В. Тромбоцитарно–сосудистый гемостаз и реологические свойства крови при лечении атенололом больных гипертонической болезнью // Кардиология.– 1993. – № 3. – С. 40–44.
6. Марцевич С.Ю. β–адреноблокаторы в лечении гипертонической болезни – роль бисопролола (Конкор) // РМЖ. – 2005. – №15 (10). – С. 25–28.
7. Корнеева О.Н. Клинические варианты метаболического синдрома: дисс… к. м. н. – М.,2007.
8. Недогода С.В., Барыкина И.Н., Брель У.А. и др. Возможности коррекции факторов риска у больных артериальной гипертензией на фоне ожирения // Лечащий врач. – 2008.– № 4. – С. 91–92.
9. Мычка В.Б., Чазова И.Е. Метаболический синдром. Возможности диагностики и лечения. (Подготовлено на основе Рекомендаций экспертов ВНОК по диагностике и лечению метаболического синдрома). –2008. – С.1–16.
10. Терещенко С.Н., Жиров И.В. Амлодипин в лечении хронической сердечной недостаточности //CardioСоматика. – 2011.– № 3. – С. 57–62.
11. Beteridge D.J. The interplay cardiovascular risk factors in the metabolic syndrome and type 2 diabetes // European Heart Journal (Supplements G). – 2004. – Vol.6. – P. 3–7.
12. Fogari R., Zoppi A., Tettamanti F. et al. β–blocer effects on plasma lipids in antihypertensive therapy // J.Cardiovasc. Pharmacol. – 1990. – Vol. 16 (Suppl. 5). – P.76–80.
13. Koning L., Merchant A.T., Pogue J. et al. Waist circumference and waist–to–hip ratio as predictors of cardiovascular events: meta–regression analysis of prospective studies // European Heart Jornal. – 2007. – Vol. 28(7). – P. 850–856.
14. Leopold G. Bisoprolol: pharmacokinetic profile // Reviews in Contemporary Pharmacotherapy. – 1997. – Vol. 8.– P. 35–38.
15. Mengden Th., Vetter W. The efficacy of bisoprolol in the treatment of hypertension // Reviews in Contemporary Pharmacotherapy. – 1997. – Vol. 8. – P. 55–56.
16. Steg P.G. Регистр REACH: глобальная оценка атеротромбоза у амбулаторных пациентов в стабильном состоянии // Ишемическая болезнь сердца. – 2007. – №3. – C. 2–3.
Источник: www.rmj.ru









Комментировать