Данные решения экспертов Всероссийского научного общества кардиологов (ВНОК) в 2004 г. о принятии целевых уровней артериального давления. Комбинированная схема применения антигипертензивных средств как инструмент нормализации повышенного артериального давления. Анализ истории и данных проводимых исследований.
Профессор В.С. Задионченко, к.м.н. Г.Г. Шехян, Н.Ю.Тимофеева, А.М. Щикота, к.м.н. А.А. Ялымов
МГМСУ
Множество завершившихся в последние годы исследований наглядно продемонстрировали, что только «жесткий» контроль артериального давления (АД) может достоверно снизить частоту сердечно–сосудистых осложнений (ССО) – инфаркта миокарда (ИМ), острого нарушения мозгового кровообращения (ОНМК), хронической сердечной недостаточности (ХСН) у пациентов с артериальной гипертензией (АГ). С учетом результатов этих исследований были определены желательные целевые уровни АД. Согласно рекомендациям экспертов Всемирной организации здравоохранения (ВОЗ) и Международного общества артериальной гипертонии (МОАГ) (1999), целевым уровнем АД для лиц молодого и среднего возраста, а также больных сахарным диабетом (СД) признаны величины, не превышающие 130/85 мм рт. ст., для лиц пожилого возраста – 140/90 мм рт. ст. В 2003 г. Европейским обществом по гипертонии (ЕОГ) совместно с Европейским обществом кардиологов (ЕОК) были приняты рекомендации по ведению больных с АГ и опубликован 7–й доклад Американского объединенного национального комитета (JNC) по профилактике, обнаружению, определению и лечению высокого АД. В этих документах за целевой уровень АД также приняты величины не выше 140/90 мм рт. ст., а для пациентов с СД и поражением почек – не выше 130/80 мм рт. ст. Экспертами Всероссийского научного общества кардиологов (ВНОК) в 2004 г. были приняты аналогичные целевые уровни АД.
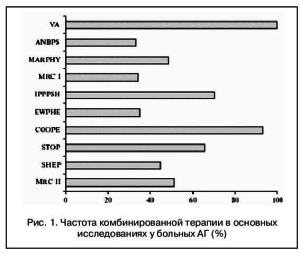
Достижение целевых уровней АД с помощью одного антигипертензивного препарата (АГП) возможно лишь у 5–50% больных с 1 и 2–й степенью тяжести АГ, а у пациентов с 3–й степенью тяжести АГ, при наличии поражения органов–мишеней, СД, признаков ССО монотерапия эффективна лишь в редких случаях. Еще в 1989 г. данные исследования Glasgow Blood Pressure Clinic подтвердили доминирующую роль достигнутого в результате лечения уровня АД в прогнозе АГ и отчетливо продемонстрировали высокие показатели сердечно–сосудистой смертности и заболеваемости при недостаточной степени его снижения. Позднее эти положения были подтверждены в исследовании НОТ. Сходные данные были получены при ретроспективном анализе большинства цитируемых исследований по АГ (рис. 1).
Комбинированная схема применения антигипертензивных средств как инструмент нормализации повышенного АД всегда присутствовала в фармакотерапевтическом арсенале АГ, однако взгляды на место комбинированной терапии в лечении АГ повторно пересматривались. В случае неэффективности комбинированной терапии переходят к назначению препаратов, входящих в состав использовавшейся комбинации в полной дозе, или добавляют третий препарат в низкой дозировке. Если и эта терапия не приводит к достижению целевых уровней АД, то назначается комбинация 2–3 препаратов в обычных эффективных дозах. До сих пор остается открытым вопрос, каким пациентам можно назначать комбинированную терапию уже на первом этапе лечения.
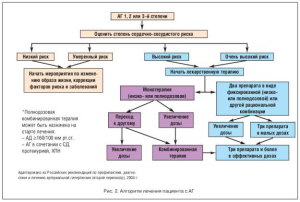
Для более простого принятия решения о том, как же лечить больного с АГ, пришедшего на прием впервые или повторно, мы предлагаем врачам использовать алгоритм, представленный на рисунке 2.
Даже если пациент пришел впервые, у нас есть возможность измерить АД и предварительно оценить степень сердечно–сосудистого риска. Если риск низкий или умеренный, мы можем начать с рекомендаций относительно изменения образа жизни и желтой стороны алгоритма, если риск высокий или очень высокий, необходимо сразу назначить медикаментозное лечение, идя по красной стороне. Преимущество алгоритма еще и в том, что, помогая быстро принять решение, он оставляет доктору полную свободу выбора в лечении пациента с АГ.
Историческая справка
Еще в начале XX в. стало известно о влиянии нейрогуморальных факторов на развитие АГ. В 1930– х гг. было открыто вещество, которое в настоящее время называется ангиотензин II. В 1950–х гг. было доказано, что оно напрямую стимулирует синтез альдостерона, и через 10 лет была изучена роль ангиотензинпревращающего фермента (АПФ) в нейрогуморальной регуляции давления крови, и сформулирована концепция о функционировании ренин–ангиотензин–альдостероновой системы (РААС). Начался поиск веществ, способных подействовать на данном уровне. Первый препарат – антагонист к рецепторам ангиотензина II был синтезирован в 1969 г., им стал саралазин. Препарат обладал мощным, но крайне плохо прогнозируемым антигипертензивным эффектом, при одинаковой дозе он мог вызвать коллапс или, наоборот, – привести к резкому росту АД.
Несмотря на неудачу, работы в этом направлении продолжились, и в 1971 г. был синтезирован первый в мире ингибитор АПФ – тепротид. Интересна история его создания: в 1965 г. бразильский ученый Ferreira, исследуя яд гремучей змеи, обнаружил его способность стабилизировать брадикинин. Выделенный из яда змеи препарат очень недолго использовался в клинической практике. Причинами этого были высокая токсичность препарата, малая длительность эффекта и необходимость внутривенного введения.
Продолжение исследований механизма функционирования РААС привело к тому, что в 1975 г. был создан первый таблетированный ингибитор АПФ – каптоприл. Это было революционным открытием, начавшим новую эру в терапии АГ и сердечной недостаточности.
В 1980 г. сотрудниками Merck был синтезирован эналаприл. Продолжительность его клинического эффекта составляла около 12–24 ч. Несколько десятилетий препарат активно применяется в клинической практике и продолжает оставаться эффективным средством контроля АД.
Диуретики являются наиболее старым классом антигипертензивных препаратов, начало их использования относится к 1950–м гг. (табл. 1). Несмотря на активное внедрение новых классов антигипертензивных препаратов, прежде всего антагонистов кальция и ингибиторов АПФ, интерес к классу диуретиков отнюдь не убавился. Во–первых, в современных крупных клинических исследованиях в области гипертензиологии в качестве стандартного препарата сравнения с доказанной эффективностью обычно используется диуретик тиазидного ряда. Во–вторых, в современных международных рекомендациях по АГ диуретик является обязательным компонентом комбинированной антигипертензивной терапии, которая применяется уже на начальном этапе лечения больных с АГ. В– третьих, существенно пересмотрена тактика применения диуретиков для длительного лечения АГ с целью повышения отдаленной безопасности.
Первые фиксированные комбинации антигипертензивных препаратов (резерпин + гидралазин + гидрохлоротиазид; α–метилдопа + гидрохлоротиазид; гидрохлоротиазид + калийсберегающие диуретики) появились в начале 1960–х гг. В 1970–е и 1980–е гг. ведущее место заняли комбинации диуретика, как правило, в высокой дозе, с β–адреноблокаторами или препаратами центрального действия. Однако вскоре, в связи с появлением новых классов препаратов, популярность комбинированной терапии существенно снизилась. Ей на смену пришла тактика дифференцированного выбора препаратов с применением их в максимальных дозах в режиме монотерапии.
Монотерапия высокими дозами антигипертензивных средств нередко приводила к активации контррегуляторных механизмов, повышающих АД, и/или развитию нежелательных явлений. В связи с этим неудивительно, что в последующее десятилетие не оправдались надежды на более высокую антигипертензивную активность ингибиторов АПФ, и маятник отношения к комбинированной терапии вернулся в исходную позицию, т.е. была признана ее необходимость большинству пациентов с АГ.
В конце 1990–х гг. появились фиксированные низкодозовые комбинации антигипертензивных препаратов: не содержащие диуретик (антагонист кальция + ингибитор АПФ; дигидропиридиновый антагонист кальция + β–адреноблокатор) или содержащие его в низких дозах. Уже в 1997 г. в списке антигипертензивных препаратов в докладе Объединенного национального комитета США было представлено 29 фиксированных комбинаций. Целесообразность низкодозовой комбинированной рациональной антигипертензивной терапии, особенно у пациентов с высоким риском развития ССО, была подтверждена в последних рекомендациях ВОЗ / Международного общества по артериальной гипертонии (1999) и ДАГ–1 (2000).
Рациональная комбинированная терапия должна отвечать ряду обязательных условий, таких как:
безопасность и эффективность компонентов;
вклад каждого из них в ожидаемый результат;
разные, но взаимодополняющие механизмы действия;
более высокая эффективность по сравнению с таковой монотерапии каждым из компонентов; сбалансированность компонентов по биодоступности и продолжительности действия; усиление органопротективных свойств;
воздействие на универсальные (наиболее частые) механизмы повышения АД;
уменьшение количества нежелательных явлений и улучшение переносимости.
В таблице 2 приведены нежелательные последствия применения основных классов препаратов и возможности их устранения при добавлении второго препарата.
Комбинированные препараты, состоящие из ингибитора АПФ и тиазидного диуретика, длительное время применяются в клинической практике и в настоящее время являются одной из наиболее часто используемых групп препаратов для лечения АГ, сердечной недостаточности и ишемической болезни сердца (ИБС). В патогенезе этих состояний важную роль играет активация двух нейрогуморальных систем организма: РААС и симпато–адреналовой (САС). Процесс активации вызывается такими неблагоприятными факторами, как снижение сердечного выброса, ишемия органов, потеря натрия и воды, значимое изменение рH и др. В результате происходит образование ангиотензина II – биологически активного вещества, которое является мощным вазоконстриктором, стимулирует выброс альдостерона, а также повышает активность САС (стимулирует выброс норадреналина). Норадреналин, в свою очередь, может активировать РААС (стимулирует синтез ренина).
В конечном итоге повышение активности этих двух систем организма, вызывая мощную вазоконстрикцию, увеличение ЧСС, сердечного выброса, поддерживает функцию кровообращения на оптимальном уровне, сохраняет гомеостаз организма. В норме активации прессорных систем организма (РААС и САС) «противостоит» действие депрессорной системы (калликреин–кининовой: ключевое звено – брадикинин), вызывающее системную вазодилатацию. Однако при длительном действии различных патологических факторов, описанных выше, нормальная регуляция нарушается, и в результате преобладают эффекты прессорных систем. Ингибиторы АПФ тормозят эффекты прессорных систем и одновременно активируют депрессорные системы.
Основные эффекты иАПФ (эналаприла) обусловлены блокадой ангиотензинпревращающего фермента: устранение вазопрессорного, антидиуретического и антинатрийуретического действия ангиотензина II, усиление сосудорасширяющего, диуретического и натрийуретического действия брадикинина и других эндогенных вазодилататоров (простагландинов J2 и E2, натрийуретического пептида, эндотелиального фактора релаксации), а также опосредованной блокадой активности САС путем торможения синтеза норадреналина. Антигипертензивный эффект тиазидного диуретика – индапамида обусловлен, с одной стороны, натрийуретическим действием, которое устраняет перегрузку сосудистой стенки натрием и уменьшает ее гиперреактивность к различным вазопрессорным агентам (катехоламинам, ангиотензину II и др.), с другой – прямым вазодилатирующим действием благодаря блокированию медленных кальциевых каналов в гладкомышечных клетках сосудистой стенки, повышению синтеза простациклина в сосудистой стенке и простагландина Е2 (ПГЕ2) в почках и подавлению синтеза эндотелийзависимого вазоконстрикторного фактора.
Фармакокинетика комбинированного препарата Энзикс ®
Эналаприл: после приема внутрь около 60% всасывается из ЖКТ, биодоступность препарата составляет 40%. Эналаприл быстро и полностью гидролизуется в печени с образованием активного метаболита – эналаприлата, который является более активным ингибитором АПФ, чем эналаприл. Эналаприлат легко проходит через гистогематические барьеры, исключая гематоэнцефалический барьер (ГЭБ), небольшое количество проникает через плаценту и в грудное молоко. T1/2 эналаприлата – около 11 ч. Выводится эналаприл в основном почками – 60% (20% – в виде эналаприла и 40% – в виде эналаприлата), через кишечник – 33% (6% – в виде эналаприла и 27% – в виде эналаприлата).
Индапамид: после приема внутрь быстро и полностью всасывается из ЖКТ; биодоступность – 93%. Индапамид проходит через гистогематические барьеры (в т.ч. плацентарный), проникает в грудное молоко, метаболизируется в печени. T1/2 препарата – 14–18 ч. Почками выводится 60–80% в виде метаболитов (в неизмененном виде – около 5%), через кишечник – 20%. У больных с хронической почечной недостаточностью (ХПН) фармакокинетика не меняется и не кумулирует.
Рациональная комбинированная терапия позволяет достичь хорошего антигипертензивного эффекта, который сочетается с отличной переносимостью и безопасностью лечения. В связи с тем, что комбинированная терапия становится одним из основных направлений при лечении больных АГ, широкое распространение получили фиксированные комбинации антигипертензивных препаратов, содержащие в одной таблетке два лекарственных средства. Их использование позволяет получить устойчивый антигипертензивный эффект с минимальным количеством побочных явлений. Конечно, комбинированная терапия необходима для достижения и поддержания целевого уровня АД, однако следует помнить, что данная терапия – это прием как минимум двух лекарственных препаратов, кратность назначения которых может быть различной.
Следовательно, применение препаратов в виде комбинированной терапии должно отвечать следующим условиям:
- препараты должны обладать взаимодополняющим действием;
- должно достигаться улучшение результата при их совместном применении;
- должно быть усилены органопротективные свойства;
- препараты должны иметь близкие фармакодинамические и фармакокинетические показатели, что особенно важно для фиксированных комбинаций.
Применение комбинации двух препаратов, имеющих сходные фармакодинамические свойства, может привести к различным последствиям с точки зрения количественных параметров взаимодействия: сенситизации (0+1=1,5); аддитивному действию (1+1=1,75); суммированию (1+1=2) и потенциированию эффекта (1+1=3). В связи с этим достаточно условно можно выделить рациональные и нерациональные комбинации антигипертензивных препаратов (табл. 3).
Комбинированная терапия не всегда означает усиление антигипертензивного эффекта и может привести к нарастанию нежелательных явлений (табл. 4).
К достоинствам низкодозовых комбинированных антигипертензивных препаратов можно отнести следующие:
- простота и удобство приема для пациента;
- облегчение титрования доз;
- простота прописывания препарата;
- повышение приверженности пациентов к лечению;
- уменьшение частоты нежелательных явлений за счет снижения доз компонентов;
- снижение риска использования нерациональных комбинаций; уверенность в оптимальном и безопасном дозовом режиме; уменьшение цены.
Недостатками являются:
- фиксированные дозы компонентов;
- трудности в идентификации причины нежелательных явлений;
- отсутствие уверенности в необходимости всех применяемых компонентов.
Дополнительные требования к комбинированным препаратам – отсутствие непредсказуемых фармакокинетических взаимодействий и оптимальное соотношение остаточного и максимального эффектов. Рациональный подбор компонентов создает предпосылки для назначения один раз в сутки препаратов, которые при монотерапии приходится применять два или даже три раза в сутки (некоторые β–адреноблокаторы, ингибиторы АПФ и антагонисты кальция).
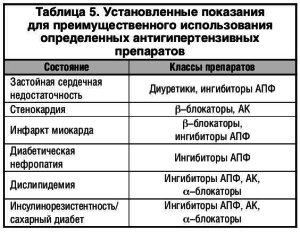
Тиазидный диуретик + ингибитор АПФ – высокоэффективная комбинация, обеспечивающая воздействие на два основных патофизиологических механизма АГ: задержку натрия и воды и активацию РААС. Эффективность таких комбинаций продемонстрирована при низко–, нормо– и высокорениновой АГ, в том числе у пациентов, не отвечающих на блокаторы ренин–ангиотензиновой системы (например, у афро-американцев). Частота контроля АГ повышается до 80%. Ингибиторы АПФ устраняют гипокалиемию, гипо-магниемию, дислипидемию, нарушения углеводного обмена, которые могут развиться при монотерапии диуретиками. Подобные комбинации весьма перспективны у пациентов с гипертрофией левого желудочка (ГЛЖ) и диабетической нефропатией. Потенциально полезным комбинированным препаратом такого состава является Энзикс® (Штада) (эналаприл 10 мг + инда-памид 2,5 мг). Показания для преимущественного назначения препарата Энзикс® отражены в таблице 5.
Немаловажное значение имеет предполагаемая приверженность пациентов к лечению АГ (табл. 6). Если она низкая, то также следует более активно рекомендовать применение фиксированных комбинаций.
Органопротективные эффекты комбинированного препарата Энзикс® Кардиопротективный эффект
Кардиопротективный эффект обеспечивается влиянием препарата Энзикс на ГЛЖ – предупреждением ее развития или возможным регрессом ГЛЖ. В многоцентровом исследовании LIVE (Left ventricle hypertrophy: Indapamide Versus Enalapril) проводилось изучение влияния терапии индапамидом и эналаприлом на регрессию массы миокарда левого желудочка (ММЛЖ).
Терапия индапамидом приводила к достоверному снижению ММЛЖ (p<0,001). Индапамид также в большей степени снижал выраженность гипертрофии левого желудочка (ГЛЖ), чем эналаприл (p<0,049).
В исследовании Bocker W. было установлено, что индапамид уменьшает ММЛЖ, подавляет активность альдостерона в плазме и активность АПФ в плазме и миокарде.
В ряде исследований была доказана способность длительной терапии эналаприлом и индапамидом улучшать прогноз жизни больных АГ (TOMSH, STOP–Hypertension 2, ABCD, ANBP2). В рандомизированном двойном слепом плацебо–контролируемом исследовании TOMHS в параллельных группах проводилось сравнение ацебутолола, амлодипина, хлорталидона, доксазо-зина, эналаприла и плацебо. АД снижалось во всех группах, но достоверно больше – в группах активной терапии, чем в группе плацебо. Летальность и основные сердечно–сосудистые события были недостоверно выше в группе плацебо, значимых различий между группами активной терапии не выявлено.
В рандомизированном открытом со слепой конечной точкой проспективном исследовании STOP– Hyper ten -sion 2 сравнивали применение β–блокаторов в комбинации с диуретиками (2213 б–х: метопролол, атенолол или пиндолол в комбинации с гидрохлоротиазидом и амило-ридом), кальциевые блокаторы (2196 б–х: фелодипин или исрадипин) и ингибиторы АПФ (2205 б–х: эналаприл или лизиноприл). Достоверных различий в частоте смертельных сердечно–сосудистых событий, инсульта, инфаркта и другой сосудистой летальности не получено.
Рандомизированное открытое со слепой оценкой конечной точки исследование ANBP2 (6083 больных, длительность – 4,1 года) по сравнению применения эна-лаприла и диуретиков выявило, что риск сердечно–сосудистых событий или смерти у больных, получавших ингибиторы АПФ, был на 11% меньше, чем у принимавших диуретики (р=0,05). Способность эналаприла уменьшать риск осложнений и летального исхода была особенно выражена у мужчин в отношении риска ИМ.
Во многих клинических исследованиях по лечению АГ была выявлена способность эналаприла, помимо снижения АД, обеспечивать кардиопротективный эффект (CATCH, PRESERVE). В 5–летнем исследовании, изучавшем влияние эналаприла на выраженность ГЛЖ и дисперсию интервала QT у больных АГ с ГЛЖ на фоне достижения и поддержания нормального уровня АД, было выявлено достоверное снижение ММЛЖ на 39% (p<0,001), улучшение сократительной способности миокарда ЛЖ в виде увеличения ФВ (p<0,05) и достоверное уменьшение дисперсии интервала QT, что, помимо снижения риска развития ХСН, может сопровождаться снижением риска развития желудочковых аритмий и улучшением прогноза.
В рандомизированном двойном слепом плацебо–контролируемом с параллельными группами сравнения исследовании АВСD (Appropriate Blood pressure Control in Diabetes), изучавшем влияние 5– летнего интенсивного и умеренного снижения АД с помощью нисолдипина и эналаприла у пациентов с СД 2 типа с АГ (n=470) в сравнении с нормотензивными пациентами с СД 2 типа (n=480), было показано достоверное снижение частоты ИМ в группе эналаприла (5 против 25 случаев, p=0,001) по сравнению с группой нисолдипина при одинаковом снижении АД, уровня глюкозы и липидов крови.
В рандомизированном двойном слепом исследовании HANE в параллельных группах проводилось сравнение гидрохлоротиазида (215 больных), атенолола (215 больных), нитрендипина (218 больных) и эналаприла (220 больных). Целевое АД достигнуто к 8–й неделе: в группе атенолола – у 63,7%, в группе эналаприла – у 50%, в группах гидрохлоротиазида и нитрендипина – у 44,5%. К 48– й неделе эффективность была 48,0%, 42,7%, 35,4% и 32,9% соответственно. Достоверно чаще больные прекращали применение нитрендипина (28 больных, р=0,001).
В рандомизированном исследовании SLIP в параллельных группах проводилось сравнение верапамила SR и эналаприла. Монотерапии было достаточно в 65,1% случаев. Оба препарата значимо снижали АД и уровни общего холестерина, триглицеридов и липопротеидов низкой плотности. Эффективность применения эналаприла у пациентов с ХСН II–IV стадии подтверждается данными ряда плацебо–контролируемых исследований, проведенных двойным слепым методом (American Heart Association, 1984; Finland, 1986). Полученные результаты показали, что применение эналаприла обеспечивает долгосрочное улучшение гемодинамики, выражающееся в уменьшении размеров левого желудочка (по данным Эхо–КГ), значительном увеличении фракции выброса (по данным радионуклидной вентрикулографии), снижении давления наполнения и увеличении систолического индекса. Кроме этого, отмечались устойчивое облегчение симптомов (по субъективным оценкам больных) и существенное увеличение толерантности к физическим нагрузкам (оцениваемое по продолжительности упражнений на велоэргометре).
Данные, полученные в ходе исследовательской программы CONSENSUS, завершившейся в 1987 г., свидетельствовали о том, что эналаприл в дозе до 40 мг/сут. в сочетании с терапией сердечными гликозидами и мочегонными препаратами при приеме в течение 6 мес. снижал риск смерти у больных с ХСН IV стадии на 40%, а при приеме в течение 12 мес. – на 31% по сравнению с плацебо. После 1 года все больные были переведены на прием эналаприла.
В 1999 г. был проведен анализ судьбы всех больных, участвовавших в этом исследовании. Данные, собранные за 10 лет, свидетельствуют: риск смерти от ХСН в исследуемой группе был на 30% ниже, чем в среднем по популяции. Проведенное исследование показало, что эналаприл повышает продолжительность жизни больных с ХСН в среднем в 1,5 раза. Применение эналаприла ведет к росту качества жизни пациента.
Антиангинальный эффект эналаприла в дозировке 10 мг/сут. (как однократно, так и дробно в два приема) проверялся в ходе ряда двойных слепых рандомизиро-ванных плацебо–контролируемых исследований (Klinische Pharmakologie, Universität Frankfurt am Main, 1988; Institute of Cardiology, University of Cagliari, Italy, 1990) на больных с подтвержденной ИБС и нормальным АД. Эффективность отслеживалась по динамике изменений на ЭКГ, вызываемых физическими нагрузками. Уже после первой дозы отмечалось 22–процентное улучшение по показателю снижения интервала ST, после 15–дневного курса улучшение составило 35%. Кроме того, при применении эналаприла значительно повышался порог проявления стенокардии и увеличивалась длительность выполнения физических упражнений. Уровень АД при этом существенно не изменялся, то есть наблюдаемый эффект, предположительно, был связан именно с улучшением коронарного кровотока.
Нефропротективный эффект
Ингибиторы АПФ в настоящее время с успехом применяются в нефрологической практике. Нефро про -тективный эффект этой группы препаратов, связанный с устранением неиммунных механизмов прогрессиро-вания почечной патологии, остается максимальным в сравнении с другими лекарственными средствами. Применение иАПФ показано как при первично–почечных заболеваниях (гломерулонефритах различного происхождения), так и при вторичных нефропатиях (особенно – при диабетической). Нефропротективный эффект иАПФ проявляется на всех стадиях поражения почек. Имеются данные клинического исследования, включавшего 30 больных АГ I—II стадий (14 мужчин и 16 женщин, средний возраст – 55,7±2,1 года), с длительностью АГ 12,4±1,8 года без нарушения функции почек, выявившего корригирующее влияние 12–недельной терапии эналаприлом в дозе 10–20 мг/сут. на скорость клубочковой фильтрации (СКФ), рассчитанной в пробе Реберга. У больных достоверно снизилось АД: со 157,4±2,3/ 93,6±1,7 до 132,6±6,5/85,5±2,0 мм рт. ст. (p<0,001) с достижением целевого АД у 60% больных. Через 1 мес. терапии в целом достоверно увеличилась СКФ: с 82±3,5 до 110,8±9,0 мл/мин (p<0,05), оставаясь на этом уровне после 3 мес. лечения (111,2±10,2 мл/мин). Исходно сниженная СКФ увеличилась с 72,9±3,6% до 105,5±10,8% (p<0,01); нормальная СКФ не изменилась (97,1±3,6% против 96,3±6,0%). Разнонаправленная динамика СКФ у больных с исходно нормальной и сниженной СКФ свидетельствует об улучшении функционального состояния почек и нефро-протективном эффекте эналаприла.
Ингибиторы АПФ с успехом применяются при лечении реноваскулярной АГ, однако противопоказаны при наличии двусторонних стенозов почечных артерий или стеноза артерии единственной почки из–за опасности снижения суммарной клубочковой фильтрации и развития азотемии.
Несомненный интерес представляют исследования эффективности эналаприла у больных АГ и диабетической нефропатией. Ravid M. и соавт. обнаружили, что эналаприл при длительном применении предотвращает развитие дисфункции почек у больных СД 2 типа с микроальбуминурией (МАУ).
Прицельный анализ спектра иАПФ, применявшихся больными СД с сохранной функцией почек и отсутствием прогрессирования диабетической нефропатии, выявил, что у пациентов, получавших эналаприл, не отмечалось прогрессирования почечной патологии при сроках наблюдения 15 лет и более.
Нефропротективный эффект антигипертензивных препаратов заключается в предупреждении развития ХПН. Маркерами нефропротективного эффекта являются микропротеинурия – наиболее ранний признак нарушения функции почек, клиренс креатинина и индекс альбуминурия/креатинин (ИАК>3,4). ИАК в 3 раза выше у больных с АГ и в 9 раз выше у больных с СД и, как и микропротеинурия, является фактором риска ССО. Нефропротективный эффект индапамида изучался в исследовании NESTOR. У 570 больных с АГ и СД 2 типа сравнивалось влияние индапамида и эналаприла на МАУ в течение 1 года лечения. Различий в гипотензивной эффективности между препаратами не было: степень снижения САД/ДАД составила 23,8/13 мм рт. ст. в группе индапамида и 21/12,1 мм рт. ст. – в группе энала-прила. ИАК у больных, включенных в исследование, составил 6,16, а скорость экскреции альбуминов – 58 мкм/мин, при этом нарушения клиренса креатинина не отмечалось. Через 1 год лечения наблюдалось снижение ИАК до 4,03 (на 35%) в группе индапамида и до 3,74 (на 39%) – в группе эналаприла, а скорость экскре-ции альбуминов снизилась на 37% и 45% соответственно. Таким образом, нефропротективный эффект инда-памида оказался сопоставимым с таковым эналаприла.
Влияние на эндотелиальную дисфункцию и микроциркуляцию
Данные о способности терапии эналаприлом улучшать эндотелиальную функцию (ЭФ) при АГ были получены в открытом сравнительном рандомизированном перекрестном исследовании длительностью 12 недель, в которое вошло 30 мужчин в возрасте 30–65 лет с мягкой и умеренной АГ. Эффективность эналаприла (10–20 мг/сут.) сравнивалась с антагонистом кальция недигидропиридинового ряда дилтиаземом (180–360 мг/сут.). Оценка ЭФ проводилась на основании эндотелий–зависимой вазодилатации (ЭЗВД) плечевой артерии (манжеточная проба) и биохимических маркеров – стабильных метаболитов NO в сыворотке крови, экспрессии и активности фермента еNOS в культуре клеток.
В исследовании была установлена практически одинаковая антигипертензивная эффективность дил-тиазема и эналаприла. Выявлено также улучшение ЭФ на фоне лечения обоими препаратами. Прирост ЭЗВД на фоне лечения дилтиаземом составил 4,5±1,2%, а на фоне лечения эналаприлом – 6,5±1,0%. В обоих случаях прирост ЭЗВД по сравнению с исходным был достоверным (р<0,005). Улучшение ЭФ на фоне лечения обоими препаратами подтверждалось динамикой биохимических маркеров ЭФ, однако механизм влияния этих препаратов на ЭФ различался: дилтиазем улучшал ЭФ за счет увеличения активности еNOS, тогда как эналаприл – за счет увеличения экспрессии еNOS. Показатель ЭЗВД после лечения эналаприлом был сопоставим с уровнем, который отмечался у обследованных без факторов риска. Таким образом, на фоне лечения эналаприлом происходило выраженное улучшение ЭФ. Возможно, свойство эналаприла улучшать ЭФ (что, по сути, означает дополнительный антиатерогенный эффект) обеспечивало более эффективное уменьшение осложнений в группе пациентов, получавших указанный препарат в исследовании АВСD. При изучении влияния препаратов на метаболические показатели (общего холестерина, триглицеридов, холестерина липопротеидов высокой плотности и глюкозу крови) не было выявлено достоверной динамики, что свидетельствует об их метаболической нейтральности.
Имеются данные другого клинического исследования, выявившего корригирующее влияние 12– недельной терапии эналаприлом в дозе 10–20 мг/сут. на микроциркуляцию (МКЦ) у больных АГ. В исследование были включены 30 больных АГ I–II степени: 14 мужчин и 16 женщин 24–73 лет (средний возраст – 55,7±2,1 года) с длительностью ГБ 12,4±1,8 года. Состояние МКЦ изучалось методом лазерной допплеровской флоуметрии. У больных достоверно снизилось АД: со 157,4±2,3/93,6±1,7 до 132,6±6,5/85,5±2,0 мм рт. ст. (p<0,001) с достижением целевого АД у 60% больных. Выявлено корригирующее действие эналаприла на все диагностированные патологические типы МКЦ за счет уменьшения спазма и разгрузки венулярного звена микроциркуляторного русла, что сопровождается улучшением тканевой перфузии.
Таким образом, терапия эналаприлом оказывает не только адекватный антигипертензивный эффект с нормализацией АД у 60% больных АГ I–II степени, но и корригирующее влияние на состояние системы МКЦ за счет уменьшения спазма и разгрузки венулярного звена микроциркуляторного русла. Полученные данные свидетельствуют об ангиопротективном эффекте терапии, основанном на улучшении перфузии тканей.
Метаболические эффекты
Энзикс® не оказывает неблагоприятного влияния на углеводный обмен, липидный состав крови и концентрацию мочевой кислоты, т.е. не активирует факторы риска ИБС, поэтому показан для длительной терапии АГ пациентам, имеющим факторы риска.
Влияние на качество жизни
Открытое неконтролируемое исследование влияния эналаприла на качество жизни больных АГ включало 244 больных АГ I–II степени в возрасте от 25 до 76 лет (средний возраст – 55,0±2,27 года). В течение 1 недели до начала исследования больные не принимали антигипертензивных лекарственных средств. Затем им назначали эналаприл в дозе 5–10 мг 1 раз/сут. в течение 60 дней. Качество жизни оценивали по основным из показателей, приведенных в опроснике General Well– Веing Question naire: физическое благополучие, работоспособность, психологическое самочувствие, сексуальные способности. Нормализация АД произошла у 62,9% больных, получавших эналаприл в дозе 10 мг/сут., и у 55,3% больных, получавших 5 мг/сут. Таким образом, хорошего и очень хорошего терапевтического эффекта удалось добиться у 81,17–90,56% больных (в зависимости от дозы препарата). Кроме того, терапия эналаприлом привела к улучшению качества жизни у 51,5–59,7% больных (в зависимости от дозы препарата).
Побочные эффекты комбинированного препарата Энзикс
Энзикс® противопоказан при беременности (относится к препаратам категории C в первом триместре и к категории D – во втором и третьем) в связи с тератогенным действием на плод, а также в период грудного вскармливания (проникает в грудное молоко). За новорожденными и грудными детьми, которые подвергались внутриутробному воздействию ингибиторов АПФ, рекомендуется вести тщательное наблюдение для своевременного выявления выраженного снижения АД, олигурии, гиперкалиемии и неврологических расстройств, возможных вследствие уменьшения почечного и мозгового кровотока. При олигурии необходимо поддержание АД и почечной перфузии путем введения соответствующих жидкостей и сосудосуживающих лекарственных средств. В целом, по результатам клинических исследований отмечается хорошая переносимость препарата.
Однако вследствие клинических эффектов препарата Энзикс®, связанных с его воздействием на метаболизм АПФ и приводящих к снижению АД, существует ряд патологических состояний, при которых его следует применять с осторожностью из–за риска развития опасных побочных эффектов. Так, необходимо соблюдать осторожность при назначении препарата пациентам со сниженным объемом циркулирующей крови (при ограничении потребления поваренной соли, проведении гемодиализа, диарее и рвоте). Это обусловлено высоким риском внезапного и выраженного снижения АД после применения даже начальной дозы препарата Энзикс®, что, в свою очередь, может привести к потере сознания и ишемии внутренних органов.
Во время приема препарата также следует соблюдать осторожность при выполнении физических упражнений и при жаркой погоде из–за риска развития дегидратации и сопутствующего снижения ОЦК.
При приеме препарата Энзикс® у больных с указанием на развитие ангионевротического отека в анамнезе (наследственный, идиопатический или на фоне терапии ингибиторами АПФ) имеется повышенный риск его развития.
Использование препарата Энзикс® в небольшом проценте случаев может вызывать кашель за счет эналаприла, входящего в состав. Обычно кашель носит непродуктивный, настойчивый характер и прекращается после окончания лечения.
В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (возможно головокружение, особенно после приема начальной дозы.
Заключение
Энзикс® (Штада) – современный антигипертензивный препарат, который обеспечивает не только эффективный контроль АД, но и за счет доказанного протективного эффекта в отношении всех органов–мишеней улучшает прогноз жизни больных АГ.
В современных условиях ограниченности финансирования здравоохранения при выборе антигипертензивной терапии учитываются не только клинические аспекты, но и экономические. Изучение затратной эффективности применения гипотензивных препаратов позволяет выявлять их экономические преимущества. Так, при ретроспективном фармакоэкономическом анализе нескольких крупных клинических исследований Энзикс® показал лучшие коэффициенты затратной эффективности в оценке как степени снижения АД, так и регресса ГЛЖ и МАУ в сравнении с наиболее часто назначаемыми гипотензивными препаратами из разных классов.
Таким образом, Энзикс® является представителем современных комбинированных антигипертензивных препаратов, имеет благоприятный профиль эффективности и безопасности, доказанный в крупных клинических исследованиях.
Литература
1. Агеев Ф.Т., Мареев В.Ю., Е.В. Константинова с соавт. Эффективность и безопасность ингибитора АПФ эналаприла в лечении больных с умеренной сердечной недостаточностью. // Кардиология.–1999. – № 1. – С. 38–42.
2. Арутюнов Г.П., Вершинин A.A., Степанова Л.В. и др. Влияние длительной терапии ингибитором АПФ эналаприлом (ренитеком) на течение постгоспитального периода острого инфаркта миокарда.// Клиническая фармакология и фармакотерапия. – 1998. – № 2. – С. 36–40.
3. Ахмедова Д.А., Казанбиев Н.К., Атаева 3.Н. и др. Влияние комбинированной терапии на ремоделирование левого желудочка гипертонического сердца. // Тезисы докладов 5–го Российского национального конгресса «Человек и лекарство». – М., 1998. – С. 15.
4. Задионченко B.C., Хруленко С.Б. Антигипертензивная терапия у больных артериальной гипертонией с метаболическими факторами риска. // Клин. фармакол. тер. – 2001. – № 10 (3). – С. 28–32.
5. Зонис Б.Я. Антигипертензивная терапия у больных сахарным диабетом. // Русский медицинский журнал. – 1997. – Т. 6., № 9. – С. 548–553.
6. Кобалава Ж.Д., Морылева О.Н., Котовская Ю.В. и др. Артериальная гипертония после менопаузы: лечение ингибитором АПФ моэксиприлом. // Клиническая фармакология и фармакотерапия. –1997. – № 4. – С. 63–74.
7. Мареев В.Ю. Рекомендации по рациональному лечению больных с сердечной недостаточностью.// Consilium medicum. – 1999. – Т. 1., № 3. – С. 109–146.
8. Морозова Т., Сюмакова С. Возможности ингибитора ангиотензинпревращающего фермента эналаприл в лечении артериальной гипертонии у женщин в постменопаузе // Врач. – 2007. – № 11. – С.32–34.
9. Небиеридзе Д.В., Толпыгина С.Н., Шилова Е.В. Изучение органопротективных свойств ингибитора ангиотензинпревращающего фермента эналаприла при лечении артериальной гипертонии. // КВТиП. – 2003. – № 5. – С. 33–42.
10. Ольбинская Л.И., Пинская Э.В., Большакова Т.Д. и др. Активность некоторых систем нейрогуморальной регуляции, состояние электролитного баланса и клиническая эффективность ренитека у больных гипертонической болезнью. // Терапевтический архив. – 1996. – Т. 68. – № 4. – С. 54–57.
11. Ольбинская Л.И., Андрушишина Т.Б., Захарова В.Л. Антигипертензивная эффективность по данным суточного мониторирования АД, безопасность и влияние на морфофункциональные показатели сердца ингибитора ангиотензинпревращающего фермента эднита у больных гипертонической болезнью. // Кардиология. – 1997. – Т. 37., № 9. – С. 26–29.
12. Павлова Я.Я., Сабиров И.С. Возможности использования иАПФ эналаприла у больных гипоксической легочной гипертонией. // Вестник КРСУ. – 2003. – № 7.
13. Преображенский Д.В., Сидоренко Б.А., Романова Н.Е., Шатунова И.М. Клиническая фармакология основных классов антигипертензивных препаратов. // Consilium Medicum. – 2000. – Т. 2., № 3. – С. 99–127.
14. Терещенко С.Н., Дроздов В.Н., Левчук Н.Н. и др. Изменение плазменного звена гемостаза при лечении периндоприлом у больных с застойной сердечной недостаточностью. // Клиническая фармакология и фармакотерапия. – 1997. – № 4. – С. 83–87.
15. Терещенко С.Н., Дроздов В.Н., Демидова И.В. и др. Ингибитор ангиотензинпревращающего фермента периндоприл при лечении застойной сердечной недостаточности. // Терапевтический архив.– 1997. – Т. 69., № 7. – С. 53–56.
16. Терещенко С.Н., Кобалава Ж.Д., Демидова И.В. и др. Изменение суточного профиля артериального давления у больных с застойной сердечной недостаточностью при терапии ингибитором ангиотензинпревращающего фермента периндоприлом. // Терапевтический архив. – 1997. – Т. 69., №12. – С. 40–43.
17. Тихонов В.П., Туренко Е.В. Эффективность лечения капотеном больных артериальной гипертонией в зависимости от состояния почек. // Тезисы докладов 3–го Российского национального конгресса «Человек и лекарство». – М., 1996. – С. 220.
18. Тхостова Э.Б., Пронин А.Ю., Белоусов Ю.Б. Применение эналаприла у больных мягкой и умеренной артериальной гипертонией по данным суточного мониторирования АД. // Кардиология. –1997. – Т. 37., № 10. – С. 30–33.
19. Фатенков В.Н., Фатенков О.В., Щукин Ю.В. и др. Ингибиторы ангиотензинпревращающего фермента в лечении сердечной недостаточности у больных ИБС. // Тезисы докладов 5–го Российского национального конгресса «Человек и лекарство». – М., 1998. – С. 223.
20. Федорова Т.А., Сотникова Т.И., Рыбакова М.К. и др. Клинико–гемодинамические и гемореологические эффекты каптоприла при сердечной недостаточности. // Кардиология. – 1998. – Т. 38., № 5. – С. 49–53.
21. Филатова Н.П. Применение периндоприла (престариума) при артериальной гипертонии. // Терапевтический архив. – 1995. – Т. 67., № 9. – С. 81–83.
22. Филатова Е.В., Вихерт О.А., Рогоза Н.М. и др. Сравнение влияния капотена (каптоприла) и рамиприла на суточный профиль артериального давления и периферическую гемодинамику больных гипертонической болезнью в сочетании с сахарным диабетом. // Терапевтический архив. – 1996. – Т. 68., № 5. – С. 67–70.
23. Фукс А.Р. Влияние ломира и энапа на диастолическую функцию левого желудочка у больных артериальной гипертензией. // Клиническая фармакология и фармакотерапия. –1997. – № 1. – С.27–28.
24. Хлынова О. В., Гуев А.В., Щекотов В. В. Динамика показателей венозного и центрального кровообращения у больных артериальной гипертонией при лечении эналаприлом. // Клиническая фармакология и фармакотерапия. – 1998. – № 1. – С. 59–61.
25. Шестакова М.В., Шереметьева С.В., Дедов И.И. Тактика применения ренитека (ингибитора ангиотензинпревращающего фермента) для лечения и профилактики диабетической нефропатии. // Клиническая медицина. – 1995. – Т. 73., № 3. – С. 96–99.
26. Шехян Г.Г., Ялымов А.А. Тактика лечения осложненной артериальной гипертензии. // РМЖ.–2011.– Т. 19., № 7 (401). – С. 448–449.
27. Шустов С.Б., Баранов В.Л., Кадин Д.В. Влияние ингибитора ангиотензинпревращающего фермента периндоприла на состояние миокарда левого желудочка у больных акромегалией после радикального лечения. // Кардиология. – 1998. – Т. 38., № 6. – С. 51–54.
28. Щербань Н.Н., Пахомова С.П., Каленский В.X. и др. Сравнение эффективности сублингвального применения капотена и празозина в лечении гипертонических кризов. // Клиническая медицина. –1995. – Т. 73., № 2. – С. 60.
29. Grimm R.H. Jr, Grandits G.A., Cutler J.A. et al. Relationships of quality–of–life measures to long–term lifestyle and drug treatment in the Treatment of Mild Hypertension Study Arch Intern Med. 1997;157:638–48.
30. Hansson L., Lindholm L.H., Ekbom T. et al. Randomised trial of old and new antihypertensive drugs in elderly patients: cardiovascular mortality and morbidity the Swedish Trial in Old Patients with Hypertension–2 study. // Lancet 1999;354:1751–6.
31. Estacio R.O., Jeffers B.W., Hiatt W.R. et al. The effect of nisoldipine as compared with enalapril on cardiovascular outcomes in patients with non–insulin–dependent diabetes and hypertension. // N Engl J Med 1998;338:645–52.
32. Wing L.M.H., Reid C.M., Ryan P. et al. A comparison of outcomes with angiotensin–converting–enzyme inhibitors and diuretics for hypertension in elderly. // N Engl J Med 2003;348:583–92.
33. Philipp T., Anlauf M., Distler A. et al. Randomised, double blind, multicentre comparison of hydrochlorothiazide, atenolol, nitrendipine and enalapril in antihypertensive treatment: results of the HANE study. // BMJ 1997;315:154–9.
34. Libretti A., Catalano M. Lipid profile during antihypertensive treatment. The SLIP study Drugs. 1993;46 Suppl 2:16–23.
35. Cuspidi C., Muiesan M.L., Valagussa L. et all. Comparative effects of candesartan and enalapril on LVH in patients with essential hypertension: the candesartan assessment in the treatment of cardiac hypertrophy (CATCH) study. // J Hypertens 2002;20:2293–300.
36. Devereux R., Dahlof B., Levi D. Comporasion of enalapril versus nifedipine to decrease LVH in ystemic hypertension (the PRESERVE trial). // Am J Cardiol 1996;78:61–5.
37. J.R. Gonzales–Juanately, J.M. Caria–Acuna, A. Pose et al. Reduction of QT and QTc dispersion during long–term treatment of systemic hypertension with enalapril. // Am J Card 1998;81:170–174.
38. Ravid M., Brosh D., Levi Z. et al. Use of enalapril to attenuate decline in renal function in normotensive normoalbuminuric patients with type 2 diabetes mellitus – // Ann. Intern. Med. 1998;128 (12):982–8.
39. Schror К. Role of prostaglandins in the cardiovascular effects of bradykinine and the angiotensin–converting enzyme inhibitors. // J. Cardiovasc Pharmacol. 1992, 20 (Suppl. 9), 68, 73.
40. Simpson P.С., Kariya К., Kams L.R. et. al. Adrenergic hormones and control of cardiac myocyte growth. // Mollecular and Cellular Biochem. 1991;104:35–43.
41. Van Belle E., Vallet B. Jt., Anffray J.–L., Bauters C. et al. NO syntehesis is involved in structural and functional effects of ACE inhibitors in injured arteries. // Am J. Physiology. 1997, 270, 1, 2, 298–305.
Опубликовано: РМЖ. Кардиология. № 21, 2011














Комментировать