Поражение печени. Результаты проведенных исследований.
Профессор М.Е. Стаценко, профессор С.В.Туркина, к.м.н. Н.Н. Шилина, М.А. Косивцова, ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Поражение печени при хронической сердечной недостаточности (ХСН) у пациентов с нарушениями углеводного обмена (НУО) развивается в достаточно большом числе случаев. Показатели ремоделирования сердца и структурно-функциональные изменения печени при этом тесно взаимосвязаны и взаимообусловлены, а тяжелое поражение печени ассоциируется с плохим прогнозом при ХСН [1]. При этом механизмы формирования структурных и функциональных нарушений печени при ХСН ишемического генеза при ее сочетании с НУО имеют определенные особенности, опосредуемые присутствием как ХСН, так и неалкогольной жировой болезни печени (НАЖБП). НАЖБП наиболее распространена прежде всего в популяции пациентов с метаболическим синдромом (МС) и сахарным диабетом (СД) 2-го типа [2].
В основе формирования поражения печени у пациентов с ХСН ишемического генеза лежат прежде всего гемодинамические механизмы, что сопровождается повышением механического давления в печеночных синусоидах и желчных канальцах, повышением уровня γ-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ) в сыворотке крови даже при начальных проявлениях сердечной недостаточности, а выраженность холестаза коррелирует с классом ХСН [3]. По данным исследования CHARM (2009) [4], повышенный уровень билирубина был наиболее важным предиктором госпитализаций по поводу декомпенсации ХСН и кардиоваскулярной смертности. Венозный застой, ишемия за счет снижения сердечного выброса, артериальная гипоксемия приводят к формированию гипоксии печеночной ткани и ее ишемическому повреждению. Клиническими формами поражения печени при ХСН ишемического генеза являются: застойная гепатопатия, ишемический гепатит, кардиальный фиброз и цирроз печени [5].
В основе формирования поражения печени при МС и СД 2-го типа — НАЖБП (стеатоз, стеатогепатит, фиброз) лежат иные патогенетические механизмы и прежде всего феномен инсулинорезистентности (ИР). Отмечено, что НАЖБП статистически значимо ассоциирована как с печеночной ИР, так и с ИР жировой и периферических тканей [6], в результате чего повышается периферический липолиз и увеличивается количество свободных жирных кислот (СЖК), доступных для захвата и последующего окисления гепатоцитами, формируется каскад реакций, ведущих к интенсификации синтеза атерогенных фракций липопротеинов. Увеличение поступления СЖК в печень, снижение скорости β-окисления СЖК в митохондриях печени, а также повышенный синтез жирных кислот в митохондриях печени, которые являются высокоактивным субстратом перекисного окисления липидов (ПОЛ), по мнению D. Pessoyre et al. (2000) [7], способствуют запуску внутриклеточной выработки митохондриями субстанций окислительного стресса, вызывающих индукцию цитокинов, FAS-лигандов и, в итоге, воспаление и некроз гепатоцитов, развитие фиброза и в дальнейшем цирроза печени. Кроме того, повышенное содержание СЖК и триглицеридов (ТГ) в гепатоците коррелирует с формированием феномена «липотоксичности» на уровне гепатоцита [8], что рассматривается как ключевой фактор активации фиброгенеза в клетках Ито [9].
Следует отметить и еще один неблагоприятный результат «печеночной липотоксичности» — нарастание в крови содержания атерогенных форм липопротеинов низкой и очень низкой плотности, способствующих развитию и прогрессированию атеросклеротического процесса. М. Ekstedt et al. (2006) показали, что 14-летний риск смерти от сердечно-сосудистых заболеваний (ССЗ) у пациентов с неалкогольным стеатогепатитом (НАСГ) был вдвое выше, чем в общей популяции [10]. Тяжесть кардиальной патологии прямо коррелирует с сердечно-сосудистыми исходами [11].
Поэтому для оценки особенностей гепатокардиальных взаимоотношений у пациентов с ХСН и НАЖБП в рамках МС или СД в клинике внутренних болезней Волгоградского государственного медицинского университета было проведено проспективное исследование в параллельных группах, в которое были включены 410 пациентов в возрасте от 45 до 65 лет. Все больные проходили стационарный этап реабилитации после перенесенного инфаркта миокарда (ИМ).
В зависимости от наличия МС или СД пациенты были рандомизированы в группы. 1-я группа (n=50) была представлена пациентами с ХСН функционального класса (ФК) по классификации ОССН (2002) на 22-30-е сут после перенесенного ИМ с клинико-лабораторными проявлениями МС (ВНОК, 2009) без нарушений углеводного обмена (33 мужчины, 17 женщин, средний возраст — 56,4±3,5 года).-
2- я группа (n=50) включала пациентов с ХСН и МС с нарушениями углеводного обмена (17 мужчин, 33 женщины, средний возраст — 57,4±3,6 года), из которых 32% пациентов имели нарушение гликемии натощак, 68% — нарушение толерантности к углеводам.
3- я группа включала 210 пациентов в возрасте от 45 до 65 лет (средний возраст — 60,8±4,8 года) с ХСН ФК на 22-30-е сут после перенесенного ИМ и СД 2-го типа. На момент включения в исследование у пациентов имелась компенсация углеводного обмена, достигнутая с помощью диеты и пероральных сахароснижающих средств в соответствии с клиническими рекомендациями Российской ассоциации эндокринологов (2011).
4- я группа (n=100) была представлена пациентами в возрасте от 45 до 65 лет (средний возраст — 58,6±4,2 года) с ХСН ФК на 22-30-е сут после перенесенного ИМ без клинико-лабораторных проявлений МС или СД 2-го типа (группа контроля).
Все пациенты получали базисную терапию сердечной недостаточности (бисопролол, периндоприл, ацетилсалициловая кислота, клопидогрел, симвастатин, диуретики (фуросемид или индапамид), спиронолактон, при необходимости — нитраты) и базисную сахароснижающую терапию (метформин и/или глибенкламид). Средние дозы базисных препаратов, применяемых для лечения ХСН и СД 2-го типа, статистически достоверно не различались между группами.
Всем пациентам проводили физикальное обследование, рассчитывали индекс массы тела (ИМТ). Пациенты выполняли нагрузку в виде теста 6-минутной ходьбы (ТШХ), у них определяли уровень N-терминального мозгового натрийуретического пептида (NT-proBNP) иммуноферментным методом (Biomedica, Slovakia). Оценку структурно-функционального состояния сердца проводили с помощью эхокардиографии по общепринятой методике на аппарате Siеmens Sonoline G50 (Германия) с допплеровским датчиком. Вариабельность ритма сердца (ВРС) проводили на приборе «Варикард-1.41» (Россия). Запись ЭКГ осуществляли в течение 5 мин утром в состоянии покоя в одном из стандартных отведений в положении лежа через 15 мин после адаптации больного к обстановке и во время активной ортостатической пробы с расчетом основных показателей (Баевский Р.М. и др., 2001). Оценка структурного состояния печени проводилась на ультразвуковом сканере My Lab-90 (Esaote, Италия). Изучение функционального состояния печени включало определение активности аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз, ЩФ и ГГТП, общего белка и альбумина, общего билирубина, тимоловой пробы и протромбинового индекса в сыворотке крови по общепринятым методикам на биохимическом анализаторе Liasys-2 (AMS, Италия). Рассчитывали индекс стеатоза печени по Lee Jeong-Hoon et al. (2010) по формуле:
ИС = 8 х (АЛТ/АСТ) + ИМТ (+2 у женщин; +2 при наличии СД),
где ALT — показатель активности АЛТ в Е/л, AST — показатель активности АСТ в Е/л, ИМТ — индекс массы тела (кг/ м2).
Изучение состояния углеводного и липидного обмена, оценка ИР проводились с помощью общепринятых методик.
Статистическая обработка результатов исследования осуществлялась при помощи пакета прикладных программ для обработки медицинской и биологической информации Statistica 7.0 (StatSoft, Inc., США) с привлечением встроенных функций программы MC Excel и программы Statistica 7.0 (StatSoft,Inc. При поиске патогенетических особенностей ХСН при разной степени выраженности нарушения углеводного обмена в целях удобства анализа снижение размерности фазового пространства до фазовой плоскости использовали с привлечением либо аппарата пошагового линейного дискриминантного анализа, либо канонической корреляции.
Программа и протокол исследования рассмотрены и одобрены региональным этическим комитетом (протокол № 154-212 от 12 марта 2011 г).
При ультразвуковом исследовании печени гепатомегалия была отмечена у 48% пациентов с ХСН и МС без НУО, 68% и 92% пациентов с ХСН и МС с НУО и СД 2-го типа соответственно vs в 36% случаев в группе пациентов с «изолированной» ХСН. У 100% у больных с ХСН и СД 2-го типа были отмечены признаки стеатоза печени, который, по данным многофакторного регрессионного анализа, в группе ХСН и НУО был связан с показателями оценки вариабельности сердечного ритма
(ИСП=27,981+0,01156*SIс-0,002*TPл+0,2778*LFл-1,121*LF/HFл, R2 =0,316),
глюкозы крови натощак
(ИСП=14,1197+4,9083*глю, R2 =0,3098),
липидного профиля
(ИСП=30,652+2,437*ОХС+3,7226*ТГ-3,97*ХСЛНП +1,8224*ИА-5,7741* ХС ЛПОНП, R2 =0,2375),
окислительного стресса
(ИСП=-6,4938+5,2133*МДА+0,027*Кат, R2 =0,2813).
Анализ распределения пациентов разных групп в пространстве функций «Гепато» и «Кардио» показывает, что в группах больных с ХСН и МС как без НУО, так и с НУО, ХСН и СД 2-го типа и ХСН имеет место различный характер гепатокардиальных взаимоотношений (рис. 1).
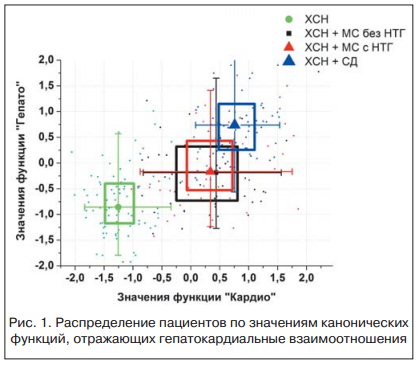
Анализ распределения пациентов разных групп в пространстве функций «Гепато» и «Кардио» (рис. 2) показывает, что снижение медиальных значений функции «Гепато» в ряду «ХСН — ХСН+МС без НУО — ХСН+МС с НУО — ХСН+СД» сопровождается одновременным снижением медиальных значений функции «Кардио». Таким образом, полученные результаты свидетельствуют о том, что в группах больных с ХСН и МС как без НУО, так и с НУО, ХСН и СД 2-го типа и ХСН имеет место различный характер гепатокардиальных взаимоотношений.
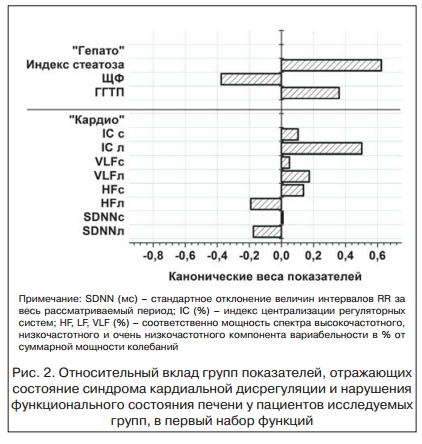
Анализ полученных в ходе исследования данных свидетельствуют о том, что повышение активности СНС в группе пациентов с ХСН и МС с НУО и ХСН и СД 2-го типа, опосредованное как наличием ХСН, так и присутствием МС, сопровождается нарастанием индекса стеатоза печени и повышением уровня ГГТП. С другой стороны, по данным L. Puthtmana et al. (2001) [12], НАЖБП может способствовать дальнейшему прогрессированию автономной дисфункции, что приводит к формированию факторов дополнительного кардиоваскулярного риска у пациентов с ХСН и НУО, а также может усугублять структурно-функциональные нарушения co стороны сердца. В ходе исследования было показано: показатель индекса стеатоза печени, а также частота встречаемости гиперферментемии ГГТП, АСТ и АЛТ в группах больных с ХСН и МС, СД 2-го типа оказались взаимосвязанными с различными типами ремоделирования сердца, что может говорить о существовании гепатокардиального континуума.
Гепатокардиальные взаимоотношения в группе пациентов с изолированной ХСН носят иной характер, что, по-видимому, связано с тем, что в основе формирования поражения печени у пациентов с ХСН ишемического генеза лежат прежде всего гемодинамические механизмы (нарушения портальной гемодинамики, снижение линейной скорости кровотока по портальным венам, значительное расширение печеночных и нижней полой вены, увеличение застоя в воротной вене). Эти изменения сопровождаются повышением механического давления в печеночных синусоидах и желчных канальцах, что может приводить к повышению уровня ЩФ в сыворотке крови даже при самых умеренных уровнях сердечной недостаточности [3]. Пассивный венозный застой, ишемия за счет снижения сердечного выброса, артериальная гипоксемия формируют гипоксию печеночной ткани — «ишемическую гепатопатию» [1], а гиперсимпатикотония, отмечаемая в группе пациентов с ХСН, выступает лишь как триггер сердечно-сосудистых нарушений.
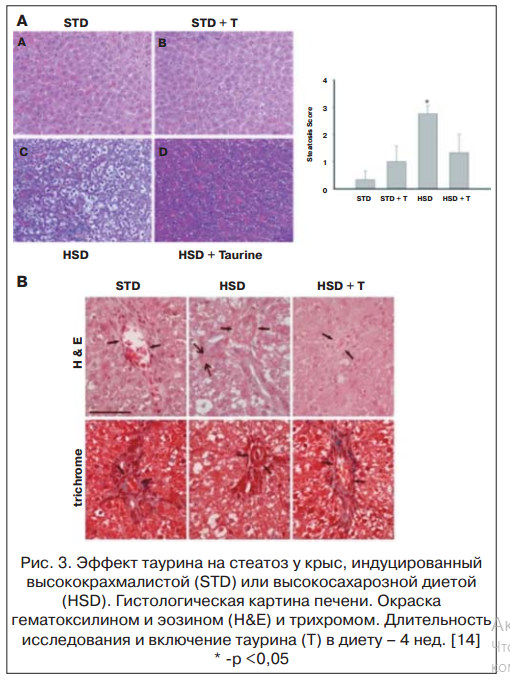
Безусловно, основой профилактики ремоделирования и развития фиброза сердца и печени у пациентов с ХСН является использование препаратов, влияющих на активность ренин-ангиотензин-альдостероновой системы (РААС). [13], что связано с существенной ролью внутриорганной РААС в регуляции роста, пролиферации, апоптоза клеток, образования активных форм кислорода, воспаления и фиброгенеза. Однако присутствие НАЖБП у пациентов с ХСН и особенности формирования гепатокардиальных взаимоотношений диктуют необходимость использования дополнительной гепатопротекторной терапии у этой категории пациентов. Интерес представляют экспериментальные данные, свидетельствующие о гепатопротекторных свойствах таурина в лечении НАЖБП. Результаты экспериментального исследования Gentile et al. (2011) говорят о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, подавлять активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах. Кроме того, таурин подавлял аккумуляцию ТГ в гепатоцитах, что позволяет рассматривать его как перспективный препарат для профилактики и лечения НАЖБП [14]. На модели НАСГ у крыс было показано, что при диете, обогащенной жирами, таурин существенно уменьшает вес печени, активность трансаминаз в сыворотке, уровень ТГ и глюкозы, окислительный стресс, количество экспрессируемой mRNA фактора некроза опухоли а, трансформирующего ростового фактора в и проколлагена 1; значительно увеличивает экспрессию адипонектина по сравнению с таковой в опытной группе.
Поэтому на втором этапе исследования в нашей клинике проводилась оценка эффективности таурина (Дибикор, ООО «ПИК-ФАРМА», Россия) в составе комбинированной терапии ХСН у пациентов с СД 2-го типа 4-месячная терапия Дибикором в дозе 500 мг 2 р./сут в составе комбинированной терапии у пациентов с СД 2-го типа и ИБС позволила не только дополнительно снизить уровень атерогенных липидов (обнаружено статистически значимое снижение уровня ХС ЛПНП (Δ, % = -17%) и ТГ (Δ, % = -16%) в группе пациентов, принимавших таурин в дополнение к базисной терапии ХСН и СД 2-го типа), но и способствовала снижению уровня ферментов цитолиза на фоне приема статинов, что может быть опосредовано его модулирующим (индуцирующим) действием на систему CYP450 3А4 и гепатопротекторным действием [15]. Результаты наших исследований согласуются с данными исследования Н.В. Лосева и Е.Е. Моисеенко [16], в котором таурин продемонстрировал гепатопротекторное и дополнительное липидснижающее действие у пациентов с НАСГ, ассоциированным с ожирением и СД, в виде положительного влияния на динамику печеночных проб у пациентов, принимающих статины. Благоприятное влияние таурина на уровень ТГ является патогенетически важным, т. к. их избыток коррелирует с формированием феномена липотоксичности на уровне гепатоцита, способствуя активации их апоптоза [17].
Исходно повышение активности АСТ и АЛТ выше нормальных значений (но не более 3-кратного превышения верхней границы нормы) отмечалось в 20% случаев во 2-й группе и в 23,3% — в1-й группе. Через 16 нед. приема таурина в составе комбинированной терапии СД 2-го типа и ХСН и ни у одного пациента во 2-й группе не регистрировалась гиперферментемия, тогда как в 1-й группе в 10% случаев сохранилось повышение уровня активности АСТ. Различие между группами статистически значимо. Кроме того, отмечено достоверное снижение активности АСТ и АЛТ во 2-й группе пациентов, дополнительно принимающих таурин (Δ, % = -39,06 и -26,93 соответственно vs Δ, % = — 4,1 и -0,98 в 1-й группе).
Выявлено снижение активности как ЩФ, так и ГГТП у пациентов, получающих комбинированную терапию с включением таурина. Активность ЩФ снизилась на 22,7% во 2-й vs 0,34% в 1-й группе (р<0,05), а ГГТП — на 41,86% vs 6,94% во 2-й и 1-й группах соответственно (р<0,05). Кроме того, в группе пациентов, получающих таурин в составе комбинированной терапии ХСН и СД 2-го типа, статистически значимо уменьшился процент больных с гиперферментемией ГГТП (с 26,7 до 0%), тогда как в 1-й контрольной группе повышение ГГТП выше 54 ед/л у мужчин и более 35 ед/л у женщин сохранилось у 20% пациентов. Обращает на себя внимание достоверное увеличение ПТИ во 2-й группе (Δ, % = 7,54 vs Δ, % = -1,04 в 2-й и 1-й группах соответственно, р<0,05) (табл. 1).
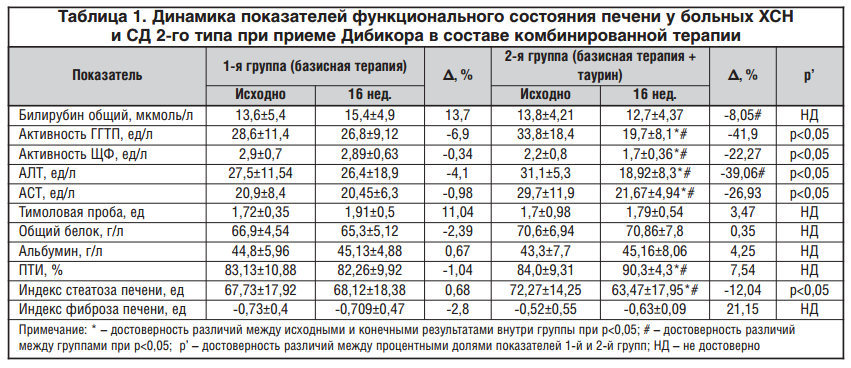
Установленное в ходе исследования положительное влияние таурина на функциональные показатели, характеризующие синдром цитолиза и холестаза, по-видимому, обусловлено доказанными антиоксидантными и противовоспалительными свойствами таурина [18].
Нами проводилась оценка индекса стеатоза печени (FLI) [19] и фиброза печени (NFS) [20], рекомендованного EASL — ALEN для неинвазивной диагностики тяжести поражения печени (2015) в различных клинических ситуациях [21].
FLI = (e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745) / (1 + e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745) * 100 и NAFLD Fibrosis Score (NFS) = (-1,675 + 0,037 x возраст (года) + 0,094 x ИМТ (кг/м2 ) + 1,13 x НТГ/СД (да = 1, нет = 0) + 0,99 x АСТ/AЛТ отношение – 0,013 x число тромбоцитов (x109 /л) – 0,66 x альбумин г/дл).
Полученные результаты свидетельствуют о том, что назначение таурина в составе комбинированной терапии пациентам с ХСН и СД 2-го типа с НАЖБП сопровождалось достоверным снижением индекса стеатоза печени на Δ, % = -12,4% vs Δ,% = 0,68% в контрольной группе. Различия между группами достигли статистической значимости. Результаты согласуются с данными экспериментального исследования C.L. Gentile et al. (2011), которые показали высокий терапевтический потенциал таурина при неалкогольном стеатозе печени [14] (рис. 3).
Таким образом, применение таурина в клинике и эксперименте свидетельствуют о его значимых органогепатопротекторных эффектах и может быть использовано для коррекции метаболических нарушений и усиления липидоснижающего действия статинов при НАЖБП.
Литература
- Сторожаков Г.И., Эттингер О.А. Поражение печени при хронической сердечной недостаточности // Сердечная недостаточность. 2005. № 1. С. 28-32.
- eedogni G. et a. Prevalence of and risk factors for nonalcoholic fatty liver disease: The Dionysos nutrition and liver study // Hepatology. 2005. Vol. 42. P. 44-52.
- Vasconcelos L., Almeida E, Bachur L. Clinical Evaluation and Hepatic Laboratory Assessment in Individuals with Congestive Heart Failure //Arq. Bras. Cardiol. 2007. Vol. 88. № 5. P. 524-529.
- Larry A et al. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) program /// European Journal of Heart Failure. 2009. № 11. P. 170-117.
- Giallourakis C.C., Rosenberg P.M., Friedman L.S. The liver in heart failure// Clin Liver Dis. 2002. Vol. 6. № 4. P. 947-967.
- Bugianesi Е. et a. Insulin resistance in non-diabetic patients with non-alcoholic fatty liver disease: sites and mechanisms / // Diabetologia. 2005. № 8. P. 634-642.
- Pessayre D., Mansouri A., Fromenty B. Nonalcoholic steatohepatitis: potential causes and pathogenic mechanisms // In: Hepatology 2000. Falk symposium 117. Kluwer Academic publishers 2000. Р. 57-76.
- Vida-Puig A. NAFLD, lipotoxicity and metabolic syndrome. Role of nuclear receptors//Joint EASL AASLD Monothematic Conference «Nuclear Receptors and Liver Disease», Vienna, Austria, 2009. Program and Abstracts. P. 17.
- Trauner M., Arrese M., Wagner M. Fatty liver and lipotoxicity // Biochim Biophys Acta. 2010. Vol. 1801. № 3. P. 299-310.
- Ekstedt M. et al. Long-term follow-up ofpatients with NAFLD and elevated liver enzymes// Hepatology. 2006. № 44. P. 865-873.
- Petta S. et al. Epicardial fat, cardiac geometry and cardiac function in patients with non-alcoholic fatty liver disease: association with the severity of liver disease //J Hepatol. 2015. №62. P.928-933.
- Puthumana L., Chaudhry V., Thuluvath P.J. Prolonged QTc interval and its relationship to autonomic cardiovascular reflexes in patients with cirrhosis // J Hepatol. 2001. Vol. 35. № 6. P. 733-738.
- Munshi M.K., Uddin M.N., Glaser S.S. The role of the renin-angiotensin system in liver fibrosis // Exp Biol Med. 2011. Vol. 236 (5). P. 557-566.
- Gentile C.L. et al. Experimental evidence for therapeutic potential of taurine in the treatment of nonalcoholic fatty liver disease // Am J Physiol Regul Integr Comp Physiol. 2011. Vol. 301 (6). Р. 1710-1722.
- Ших Е.В., Махова А.А., Шумянцева В.В. Возможности использования таурина в качестве средства, предупреждающего лекарственное поражение печени // РМЖ. Гастроэнтерология. Хирургия. 2015. № 13.
- Лосева Н.В., Моисеенко Е.Е. Опыт применения препарата Дибикор в комплексной терапии неалкогольной жировой болезни печени // Фарматека. 2010. №. 13. C. 63-67.
- Unger R.H. Lipid overload and overflow: metabolic trauma and the metabolic syndrome // Trends Endocrinol Metab. 2003. № 14. P. 398-403.
- Walczewska M., Marcinkiewicz J. Taurine chloramine and its potential therapeutical application // Przegl Lek. 2011. Vol. 68 (6). P. 334-337.
- Bedogni G. et al. The Fatty Liver Index: a simple and accurate predictor of hepatic steatosis in the general population // BMC Gastroenterology. 20006. № 6. P. 33-38.
- Angulo Р. et al. The NAFLD Fibrosis Score: A Noninvasive System That Identifies Liver Fibrosis in Patients with NAFLD // Hеpatology. 20007. Vol. 45. № 4. P. 846-854.
- Castera L. et al. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis // Journal of Hepatology. April 2015. doi :10.1016/j.jhep.2015.04.006.





Комментировать