Артериальная гипертензия: общая «картина» и основные тенденции развития данного заболевания. Лечение изолированной систолической АГ у пожилых больных с метаболическим синдромом.
Драпкина О.М.
В России демографическая ситуация развивается таким образом, что идет очень быстрое нарастание числа пожилых лиц. Уже сегодня пятую часть населения нашей страны составляют лица пенсионного возраста, около 11% – старше 80 лет. В докладе «Старение и здоровье человека» («Men ageing and health», ВОЗ, 2001) к пожилым отнесены люди в возрасте ≥ 65 лет. В возрасте старше 60 лет, по данным различных авторов, доля лиц с метаболическим синдромом (МС) составляет 42–43,5%.
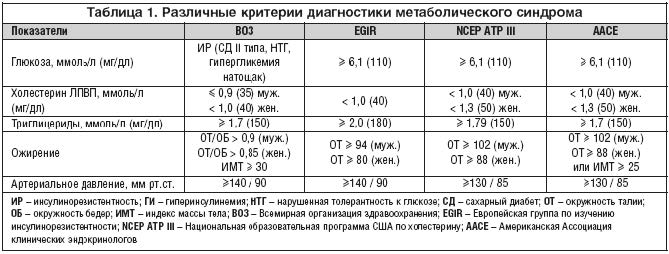
Артериальная гипертензия (АГ) является не только составляющей, но и одним из важнейших звеньев патогенеза МС (табл. 1). Частота повышенного артериального давления (АД) у больных с МС составляет 30,5% и в подавляющем большинстве случаев (90%) сопряжена с различными его компонентами [3]. У лиц старше 65 лет АГ встречается у 50% и приблизительно в 2/3 случаев диагностируется изолированная систолическая артериальная гипертензия (ИСАГ).
Острота проблемы ИСАГ связана с распространением ошибочных представлений о физиологическом характере повышения АД с возрастом и нежелательности его снижения у пожилых людей из–за риска усиления цереброваскулярной недостаточности. Это важно, поскольку у пожилых лиц профилактические и лечебные мероприятия имеют целью не только продление жизни, но и сохранение достаточно высокого уровня качества жизни.
Согласно рекомендациям ВОЗ и Международного общества по изучению АГ, под ИСАГ понимают повышение уровня систолического артериального давления (САД) до 140 мм рт.ст. и выше при диастолическом артериальном давлении (ДАД) менее 90 мм рт.ст. Повышенное САД при ИСАГ – уже установленный фактор риска развития всех сердечно–сосудистых осложнений (ишемической болезни сердца, инсульта, сердечной и почечной недостаточности) и смертности от сердечно–сосудистых заболеваний [4,5].
Этиология ИСАГ требует уточнения. Есть основания полагать, что частично она определяется возрастными изменениями в организме, в том числе сосудов. Хотя, конечно, повышение АД не является закономерным следствием старения. В генезе повышения АД имеют значение как гемодинамические факторы, так и нейрогормональная дисфункция.
Результаты Фрамингемского исследования, другие эпидемиологические наблюдения позволяют утверждать, что существуют возрастные изменения АД [6]. Они заключаются в следующем:
- повышение САД в возрасте от 5 до 20 лет;
- плато САД и пульсового АД в возрасте от 20 до 40 лет;
- повышение САД и пульсового АД в возрасте старше 40 лет;
- снижение ДАД в возрасте старше 50 лет;
- относительное постоянство среднего АД у взрослых.
Гемодинамические механизмы первичной ИСАГ у пожилых лиц окончательно не установлены. Абсолютное большинство исследователей считают основной ее причиной снижение растяжимости аорты и артерий, что, в свою очередь, связано с процессом старения (потеря эластичности волокон стенки артерий и отложение в ней коллагена, эластина, глюкозаминогликанов и кальция). Многие гистологические изменения в стенке сосудов, связанные с возрастом, схожи с атеросклеротическими, тем не менее вопрос о роли атеросклероза в патогенезе ИСАГ остается спорным. С одной стороны, атеросклеротический процесс, широко распространенный среди лиц пожилого возраста, уменьшает растяжимость крупных артерий. Это приводит к увеличению САД в результате того, что выброс крови из левого желудочка осуществляется в более ригидную и менее эластичную аорту. Такое снижение эластичности аорты и других крупных артерий вследствие атеросклероза может явиться одним из патофизиологических факторов развития ИСАГ. С другой стороны, у многих больных с тяжелой формой распространенного атеросклероза САД остается в пределах нормы, и наоборот, в некоторых группах населения с низкой распространенностью атеросклероза САД с возрастом повышается и развивается ИСАГ [7].
В основе патогенеза ИСАГ при метаболическом синдроме лежит инсулинорезистентность и вызванная ею компенсаторная гиперинсулинемия. Предполагается, что концентрация инсулина связана с АГ независимо от наличия нарушения толерантности к глюкозе или ожирения. В настоящее время не вызывает сомнений факт чрезвычайно частого сочетания АГ и нарушений углеводного обмена [8].
Как известно, инсулин является прямым вазодилататором, и формирование АГ при его участии происходит во взаимодействии с нейрогуморальными механизмами. Рассматриваются следующие механизмы возникновения и прогрессирования АГ при гиперинсулинемии (рис. 1) [9,10]:
• Стимуляция активности симпатической нервной системы.
Инсулин принимает участие в регуляции активности симпатической нервной системы в ответ на прием пищи. После приема пищи секреция инсулина увеличивается. Острое и хроническое повышение концентрации инсулина в крови стимулирует активность симпатоадреналовой системы и повышает содержание катехоламинов в крови. Кроме того, постоянная гиперсимпатикотония способствует нарушению микроциркуляции в скелетных мышцах, что ведет к снижению количества функционирующих капилляров [Ortlepp J.R., Breuer J. et al., 2002], в результате происходит нарастание инсулинорезистентности и гиперинсулинемии. Таким образом, повышение активности симпатоадреналовой системы приводит к повышению АД.
• Активация ренин–ангиотензин– альдостероновой системы (РААС).
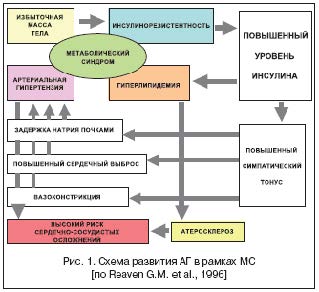
Одним из ведущих компонентов развития АГ при метаболическом синдроме является активация РААС, индуцированная гиперсимпатикотонией. Существует тесная связь между пострецепторными сигналами системы ангиотензина II и инсулина (рис. 2). Инсулин после взаимодействия со своими рецепторами на поверхности клеток индуцирует тирозинфосфолирирование белков IRS–1 и IRS–2. Далее молекулы IRS активируют PI3–K, через которую осуществляются передача сигнала и реализация метаболических и сосудорасширяющих эффектов инсулина (транспорт глюкозы в клетки, синтез оксида азота). Ангиотензин II блокирует PI3–K – сигнальный путь инсулина в клетках сосудов и других инсулинзависимых тканей, одновременно стимулируя другую сигнальную систему инсулина (ras, raf, MEK, MARK), ведущую к активации митогенных и пролиферативных процессов. Таким образом, ангиотензин II блокирует основной метаболический эффект инсулина – транспорт глюкозы в клетки – и усиливает атерогенное действие инсулина [11].
- Повышение реабсорбции натрия в проксимальных и дистальных канальцах нефрона способствует задержке жидкости и развитию гиперволемии, повышению содержания натрия и кальция в стенках сосудов.
- Блокада трансмембранных ионообменных механизмов (натрий, калий, кальций– зависимой АТФазы) повышает содержание натрия и кальция и уменьшает калий, что в итоге приводит к увеличению чувствительности сосудистой стенки к прессорным воздействиям.
- Стимуляция пролиферации гладкомышечных клеток сосудистой стенки влечет за собой сужение артериол и повышение общего периферического сопротивления.
- Гиперлептинемия.
В настоящее время активно обсуждается роль гиперлептинемии в патогенезе АГ в рамках МС. Оказалось, что концентрация лептина в плазме больных с МС прямо пропорциональна степени ожирения, а уровень лептина тесно коррелирует с индексом массы тела, уровнем АД, ангиотензина и норадреналина. В исследовании, проведенном в Японии, была выявлена причинная связь между гиперлептинемией, повышенной активностью симпатической нервной системы и АГ у пациентов, страдающих ожирением [12].
• Эндотелиальная дисфункция.
В настоящее время установлено, что инсулинорезистентность и эндотелиальная дисфункция, в том числе продукция основного вазодилататора оксида азота, являются тесно ассоциированными состояниями и формируют порочный круг [13,14]. У больных с метаболическим синдромом в условиях инсулинорезистентности и гиперинсулинемии наблюдается снижение реакции эндотелия на вазодилатационное и усиление на вазоконстрикторное воздействие, что обусловлено снижением активности оксида азота, уменьшением образования простациклина и увеличением продукции вазоконстрикторных субстанций (эндотелин–1, тромбоксан А2, простагландин F2).
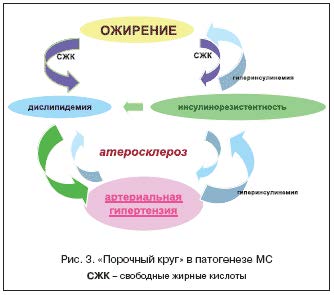
Роль инсулинорезистентности в развитии АГ трудно переоценить. Однако и АГ может быть первичным звеном в патогенезе метаболического синдрома. Длительная, нелеченная или неадекватно леченная гипертензия вызывает ухудшение периферического кровообращения, что приводит к снижению чувствительности тканей к инсулину и, как следствие, к относительной гиперинсулинемии и инсулинорезистентности, а последняя, в свою очередь, запускает развитие всех составляющих метаболического синдрома (рис. 3) [15].
Клиническая картина и течение ИСАГ у пожилых больных имеет целый ряд особенностей:
- уровень САД позволяет прогнозировать сердечно–сосудистый риск;
- АГ характеризуется высоким пульсовым давлением, являющимся дополнительным фактором риска ССЗ. По данным Фрамингемского исследования, повышение пульсового давления до уровня более 60 мм рт.ст. является неблагоприятным прогностическим фактором в отношении риска сердечно–сосудистых осложнений и смертности. Высокое пульсовое давление является маркером биологического возраста артерий и по определению является основной характеристикой ИСАГ;
- примерно у половины больных ИСАГ протекает практически бессимптомно, у другой части отмечаются различные субъективные расстройства. Больные, как правило, имеют большую давность заболевания, а повышение АД дает очень скудную клиническую симптоматику, вплоть до полного отсутствия жалоб у пациентов. Вместе с тем клинически выявляются метаболические нарушения (дислипидемия, сахарный диабет, подагра и другие составляющие метаболического синдрома);
- при ИСАГ отмечается гипокинетический тип гемодинамики с увеличением общего периферического сопротивления;
- во многих наблюдениях отмечается высокая солечувствительность АД [16];
- частота симптоматических АГ значительно меньше, чем в молодой популяции пациентов, однако выявление гипертензии в пожилом возрасте часто требует исключения клинически значимого стеноза почечных артерий;
- кроме перечисленных особенностей течения АГ у пожилых больных отмечается нарушение циркадного ритма АД.
Обследование больных с ИСАГ должно проводиться в соответствии с международными и российскими рекомендациями по диагностике и лечению больных с АГ [17]. Кроме того, диагностический поиск должен быть направлен на выявление всех возможных компонентов метаболического синдрома, комплексная оценка которых позволяет определить прогноз и выбрать оптимальную тактику лечения таких больных.
Следует остановиться на некоторых особенностях измерения АД у пожилых больных. При измерении АД пожилым людям необходимо помнить о следующих обстоятельствах:
- во время первого визита рекомендуется измерять АД на обеих руках, в положении сидя, стоя и лежа. Постуральные изменения АД регистрируются после 1–3 мин пребывания пациента в положении стоя;
- существуют особые ситуации при измерении АД у больных пожилого возраста:
- Псевдогипертония. С возрастом наблюдается утолщение и уплотнение стенки плечевой артерии, она становится ригидной. Требуется более высокий (выше внутриартериального) уровень давления в манжетке для достижения компрессии ригидной артерии, в результате чего происходит ложное завышение уровня АД (феномен «псевдогипертонии», феномен Ослера).
- Изолированная «офисная» гипертензия (так называемая гипертензия белого халата). У ряда пациентов пожилого возраста имеется неоспоримое повышение АД исключительно на приеме у врача, тогда как значения АД за 24 ч находятся в пределах нормы. Современные данные говорят о высокой распространенности данного феномена (до 10% в общей популяции), а также о том, что он встречается достаточно часто у пожилых больных с уже диагностированной АГ. Данное состояние не является абсолютно «невинным» с клинической точки зрения и требует обязательного суточного мониторирования АД [18] .
- Аускультативный провал. У больных пожилого возраста часто регистрируется феномен аускультативного провала – период временного отсутствия звука между фазами I и II тонов Короткова может продолжаться до 40 мм рт.ст., наблюдается при высоком САД. В этой ситуации необходимо нагнетать воздух не менее чем до 250 мм рт.ст. и спускать его очень медленно.
В настоящее время основным объективным методом оценки уровня АД является суточное мониторирование АД (СМАД). Анализ результатов СМАД позволяет определенным образом характеризовать суточный профиль, вариабельность, нагрузку давлением, величину и скорость утреннего подъема АД, которые являются независимыми факторами риска развития сердечно–сосу-дистых и церебральных осложнений. И, наконец, данная методика позволяет изучить действие различных антигипертензивных препаратов на все эти показатели во времени [19,20].
Суточный профиль АД у пожилых пациентов с ИСАГ имеет ряд особенностей [21], которые увеличивают риск развития сердечно–сосудистых осложнений:
- вариабельность АД является самостоятельным фактором риска развития сердечно– сосудистых катастроф и имеет тенденцию к росту вместе с увеличением возраста;
- выявлена высокая частота различных нарушений циркадного ритма АД (по различным данным от 75 до 85%), при этом основную массу составляют пациенты с недостаточным снижением АД в ночные часы и с ночной АГ. Преобладание в группе пожилых гипертоников non–dippers является прогностическим фактором, отражающим степень риска сердечно–сосудистых осложнений, поскольку частота осложнений именно на фоне ночной гипертонии приближается к 100%;
- вследствие высокой частоты атеросклеротического поражения сосудов головного мозга у пациентов пожилого возраста с АГ они более чувствительны и к противоположному нарушению суточного профиля АД – чрезмерному его снижению во время сна и ночной гипотонии. Пациенты с таким изменением суточного профиля (т.е. степень ночного снижения АД>20%, или over–dippers) имеют больший риск развития как симптомных (транзиторные ишемические атаки, инсульты), так и немых повреждений головного мозга, в том числе лакунарных инфарктов;
- у пожилых больных имеет свои особенности и утренний подъем АД. Так, по данным Carmona J. и др., при сравнении величины и скорости подъема АД в течение 6 утренних часов (3 ч до подъема пациента и 3 ч после), у пациентов старше 60 лет внезапный скачок АД регистрируется значительно чаще, чем у пациентов молодого и среднего возраста.
Краеугольным камнем в лечении ИСАГ у больных с метаболическим синдромом являются немедикаментозные мероприятия, направленные на снижение массы тела путем изменения стереотипов питания и увеличения приверженности пациентов к дозированной физической активности. Кроме того, важными мерами являются отказ от курения и злоупотребления алкоголем. Параллельно, учитывая оценку степени риска сердечно– сосудистых заболеваний, должна проводиться лекарственная терапия, направленная на достижение целевых уровней АД, а также коррекцию всех метаболических нарушений.
Препарат, использующийся для лечения ИСАГ у пожилых больных с метаболическим синдромом, не должен иметь отрицательного воздействия на метаболизм, в первую очередь глюкозы и липидов. Он должен влиять на основные патогенетические механизмы развития заболевания (натрий–объем–зависимость, повышенная солечувствительность, повышение общего периферического сопротивления из–за нарушения эластичности и функции расслабления сосудов и миокарда), не вызывая ортостатическую гипотензию.
На вопрос, с чего начать лечение пожилого больного с ИСАГ, дали ответ многие многоцентровые исследования: SYST–EUR (Европейское исследование плацебо против антагониста кальция, ингибитора АПФ), MRC – Medical Research Council (сравнивался эффект диуретика, b–блокатора и плацебо), SHEP (ИСАГ и лечение тиазидным диуретиком и при необходимости добавлялся b– блокатор), STOP–Hypertension 2 – Swedish Trial in Old Patients with Hypertension 2 (сравнивалось влияние диуретиков, b–блокаторов и антагонистов кальция, ингибиторов ангиотензинпревращающего фермента на уровень сердечно–сосудистой смертности и частоту инсульта, инфаркта миокарда и внезапной смерти у пожилых больных с гипертонией) [4]. Результаты проведенных исследований показали высокую эффективность диуретиков и антагонистов кальция в лечении пожилых пациентов с АГ.
Основу комбинированной антигипертензивной терапии составляют антагонисты кальция дигидропиридинового ряда. Способность пролонгированных антагонистов кальция снижать частоту сердечно–сосудистых осложнений и улучшать качество жизни больных продемонстрирована в исследованиях: SYST–EUR, SYST CHINA, ELSA, STONE, STOP–Hypertension 2 и др. [4]. Одним из эффективных и безопасных препаратов дигидропиридиново ряда является амлодипин. Препарат характеризуется высокой антигипертензивной способностью и метаболической нейтральностью, что делает его привлекательным в лечении пожилых коморбидных гипертоников. Доказана способность данного препарата уменьшать степень гипертрофии миокарда левого желудочка. И, что особенно важно для больных с метаболическим синдромом, амлодипин не оказывает неблагоприятного влияния на обмен углеводов и липидов. Напротив, имеются данные о благотворном влиянии амлодипина на процессы атеросклероза, особенно в сочетании со статинами. В клинической практике мы часто пользуемся качественным дженерическим препаратом амлодипина Теноксом («КРКА»): обладающий достоверным гипотензивным и органопротективным эффектами, он может быть рекомендован в качестве препарата выбора для моно– или комбинированной терапии у пациентов с артериальной гипертонией и при ее сочетании с ишемической болезнью сердца, сахарным диабетом.
Безусловно, эффективность лечения АГ в рамках метаболического синдрома напрямую зависит от комбинированной терапии всех его составляющих, а грамотно подобранная антигипертензивная терапия способствует улучшению показателей углеводного, липидного обменов, повышает чувствительность тканей к инсулину [23].
Таким образом, лечение изолированной систолической АГ у пожилых больных с метаболическим синдромом – это искусство, и оно требует от пациентов и врачей неустанного внимания и кропотливой работы.
Литература
- Диагностика и лечение метаболического синдрома. Российские рекомендации. Кардиоваскулярная терапия и профилактика. 2007; 6, приложение 2.
- Zimmer P, Shaw J, Alberti G. Preventing type 2 diabetes and the dysmetabolic syndrome in the real world: a realistic view. Diabetic medicine. 2003; 20 (9): 693–702.
- Оганов Р.Г., Александров А.А. Гиперинсулинемия и артериальная гипертония: возвращаясь к выводам United Kingdom Prospective Diabetes Study. Русский медицинский журнал. 2002; 10; 11: 486–491.
- Моисеев В.С., Кобалава Ж.Д. АРГУС. Артериальная гипертония у лиц старших возрастных групп. МИА, Москва. 2002.
- Prospective Studies Collaboration. Age – specific relevance of usual blood pressure to vascular mortality: a meta–analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002; 360: 1903–1913.
- Franklin S, Larson MG, Khan SA, Wong ND, Leip EP, Kannel WB, Levy D. Does the relation of blood pressure to coronary heart disease risk change with aging? The Framingham Heart Study. Circulation. 2001; 103: 1245–1249.
- Остроумова О.Д., Корсакова Н.К. и др. Артериальная гипертензия и сосудистая деменция: влияние гипотензивной терапии на когнитивные функции у пожилых больных (клинические и фармакоэкономические аспекты). Consilium Medicum. 2003; 5; 5: 261–264.
- Grundy S.M., Cleeman J.I. et al. Diagnosis and Management of the Metabolic Syndrome. An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005. Sep. 12
- Чазова И.Е, Мычка В.Б. Метаболический синдром. Consilium medicum. 2002; 4; 11: 587–592.
- Метаболический синдром. Под редакцией Ройтберга Г.Е. МЕДпресс–информ. 2007.
- Дедов И.И., Шестакова М.В. Сахарный диабет и артериальная гипертензия. МИА, Москва. 2006.
- Filer J.S. Leptin resistance and obesity. Presented at the 60th scientific sessions of the American diabetes association. June 13, 2000; San– Antonio, Texas.
- Шестакова М.В. Дисфункция эндотелия – причина или следствие метаболического синдрома? РМЖ. 2001; 9: 2.
- Arcaro G., Cretti A., Balzano S. at al. Insulin causes endothelial dysfunction in humans: sites and mechanisms. Circulation. 2002; 105: 576–582.
- Чазова И.Е., Мычка В.Б. Метаболический синдром. Медиа Медика, Москва. 2004.
- Bihorac A., Tezcan H., Ozener C. et al. Association between salt sensitivity and target organ damage in essential hypertension. Am. J. Hypertens. 2000; 13: 864–872.
- Рекомендации по диагностике и лечению артериальной гипертензии Европейского общества по АГ и Европейского общества кардиологов, 2003. Артериальная гипертензия. 2004; 10; 2: 65–90.
- Sega R., Trocino G., Lanzarotti A. et al. Alterations of cardiac structure in patients with isolated office, ambulatory or home hypertension. Data from the general PAMELA population. Circulation. 2001; 104: 1385–1392.
- Горохова С.Г, Старостина Е.Г., Аракелянц А.А. Суточное мониторирование артериального давления. Особенности у больных сахарным диабетом и артериальной гипертонией. НЬЮДИАМЕД, Москва. 2006.
- Кобалава Ж.Д., Котовская Ю.Г., Хирманов В.Н. Артериальное давление в исследовательской и клинической практике. Реафарм, Москва. 2004.
- Школьникова Е.Э. Изолированная систолическая артериальная гипертония: суточный профиль артериального давления, качество жизни, эффекты индапамида. Дисс. канд. мед. наук, Москва. 1998.
- Seux M., Thijs L., Forette F. et al. Correlates of cognitive status of old patients with isolated systolic hypertension: the Syst – Eur Vascular Pementia Project. J. Hypertens. 1998; 16: 963–69.
- Мычка В.Б., Чазова И.Е. Влияние гипотензивной терапии на инсулинорезистентность у пациентов с метаболическим синдромом. Consilium medicum. 2004; Приложение 1: 16–8.














Комментировать