Внутриартериальная полихимиотерапия. Вариабельность, частота и причины возникаемых осложнений.
Ищенко Р.В., Седакова Ю.И., Донецкий областной противоопухолевый центр, Донецк
Внутриартериальная полихимиотерапия — один из основных компонентов комплексного лечения больных с метастатическим поражением печени при колоректальном раке. С целью разработки эффективных мер профилактики изучены вариабельность, частота и причины возникаемых осложнений.
Введение
Успехи в онкологии определяются в значительной мере развитием химиотерапии, внедрением в практику ряда новых схем лечения и улучшением ближайших и отдаленных результатов терапии. Некоторые авторы [7] объясняют успехи в химиотерапии разработкой новых методов введения химиопрепаратов: аутолимфотерапия, внутриартериальная и эндолимфатическая терапии и др. Особую актуальность приобрела проблема качества жизни пациентов, в частности качества жизни в процессе проведения им химиотерапии. Именно поэтому нежелательные эффекты химиотерапии, проявляющиеся в виде медикаментозной токсичности, определяют одну из наиболее важных составляющих качества жизни онкологических больных [2].
Применение современной интенсивной химиотерапии требует внедрения системы дополнительных мероприятий обеспечивающих как получение ожидаемого эффекта, так и качества жизни больного в процессе лечения.
Следует отметить, что по данным отдельных авторов [6] при использовании внутривенного способа введения цитостатиков наблюдались, как правило, нежелательные эффекты, возникающие при достижении терапевтической концентрации химиопрепаратов и не связанные с концентрацией препарата в плазме крови. Достижение токсической концентрации препарата в плазме крови больных при внутриартериальном пути введения химиопрепаратов практически трудно осуществимо, поскольку значительная часть вводимых препаратов подвергается биодеградации в тканях инфузируемой зоны, что особенно наглядно при введении препаратов в режиме непрерывной длительной инфузии.
Немногочисленные работы зарубежных авторов [7] относительно проблемы изучения химиотоксичности в терапии рака молочной железы посвящены анализу известных схем системной полихимиотерапии. В доступных литературных источниках отсутствуют сведения об исследованиях токсичности химиопрепаратов и осложнений при внутриартериальной полихимиотерапии рака молочной железы, что и послужило основанием для изучения данного вопроса.
В настоящее время для обеспечения режима непрерывной длительной инфузии химиопрепаратов применяют рентгенэндоваскулярные доступы к сосудам молочной железы через бедренную артерию по Сельдингеру [6]. Основным ограничением проведения этой методики является отсутствие в большинстве клиник необходимого дорогостоящего оборудования. Кроме того, протяженное (около 1 м) расположение катетера в просвете магистральных сосудов несет угрозу развития тромботических осложнений, как сообщали М. Tatsuta и соавторы в 1998 г. [4], что ограничивает сроки проведения внутриартериальной полихимиотерапии несколькими днями [8].
Разработанные в Донецком областном противоопухолевом центре способы преследовали цель упрощения и усовершенствования доставки химиопрепаратов к очагу поражения и зонам регионарного метастазирования по сравнению с рентгенэндоваскулярными методами селективной катетеризации сосудов.
Для предотвращения или уменьшения выраженности этих нежелательных последствий целесообразно использовать профилактические меры. При установке катетера интраоперационно контролируют правильность его внутрисосудистого расположения путем струйного введения 5-8 мл 1% раствора метиленового синего на 25% растворе глюкозы [4] или методом ангиографии. Кроме того, следует обеспечить адекватную фиксацию дистального конца катетера. С одной стороны, она должна обеспечивать герметичность стенки артерии для предотвращения подтекания лекарственных препаратов, а с другой — быть достаточно надежной для избежания самоизвлечения катетера, а также повреждения интимы и запуска процесса тромбообразования.
Формирование мобилизованной культи сосуда для катетеризации в виде ангиостомы практически исключает развитие кровотечения и образования гематом после извлечения катетера [3]. При несоблюдении правил эксплуатации катетера возможна обтурация его просвета тромбом, поэтому целесообразно использование антикоагулянтов в течение всего курса химиотерапии.
Для снижения общей токсичности химиопрепаратов применяют следующие методы:
- Распределение суточной дозы на несколько равных частей или использование режима непрерывной длительной инфузии.
- Введение липосомальных форм препаратов, которые обладают более пролонгированным действием и менее токсичны [2].
- Масляная эмболизация печеночной артерии. Эффект связан с более длительной задержкой цитостатика в опухоли и снижением его дозы за счет увеличения времени экспозиции [1].
- Для предотвращения токсического действия химиопрепаратов непосредственно на гепатоциты используют прием, известный как «артериализация» печени, подразумевающий не только естественное поступление артериальной крови через собственную печеночную артерию, но и дополнительное, искусственно созданное, введение артериальной крови через пупочную либо воротную вены. Этот метод особенно эффективен при наличии сопутствующих заболеваний печени (цирроз, гепатит, печеночная недостаточность различной этиологии) [4].
Цель исследования — разработать методы профилактики осложнений СВПХТ при лечении первичного и метастатического поражения печени.
Объект и методы исследования
Основой для исследования послужили сведения о 86 больных с метастатическим поражением печени при колоректальном раке, которым проведено лечение с применением СВПХТ в Донецком областном противоопухолевом центре в период с 1999 по 2009 г.
Для проведения СВПХТ используют введение лекарственных препаратов через собственную печеночную артерию. Для этого выделяют правую желудочно-сальниковую артерию, пересекают последнюю и производят мобилизацию сосуда в дистальном направлении путем лигирования пристеночных сосудов. Путем рассечения мобилизованной артерии вскрывают просвет сосуда, вводят в указанную артерию катетер. Проводят катетер из правой желудочно-сальниковой артерии через желудочно-двенадцатиперстную артерию в собственную печеночную артерию. Наличие катетера в собственной печеночной артерии контролируют пальпаторно. Катетер фиксируют в правой желудочно-сальниковой артерии посредством лигатуры. В круглой связке печени формируют тоннель в продольном направлении. Выводят на переднюю брюшную стенку, через сформированный тоннель — в контрапертурный прокол, конец мобилизованной правой желудочно-сальниковой артерии с введенным в нее катетером [3].
Для катетеризации использовали полихлорвиниловый катетер для эпидуральной анестезии длиной 1 м № 16-17 с наружным диаметром 1-1,2 мм.
Преимуществом данного способа катетеризации, обеспечивающего максимальную терапевтическую концентрацию химиопрепарата в органе-мишени и в зоне лимфогенного метастазирования в ворота печени, является возможность проведения повторных курсов полихимиотерапии при отсутствии тромболитических осложнений.
Во всех случаях катетеризации сосудов интраоперационно производился хроматоскопический контроль правильности установки катетера, для чего в установленный и фиксированный катетер медленно вводился 1% раствор метиленового синего, при этом в качестве растворителя применялся раствор глюкозы 5%. Как правило, через 1015 с наступает окрашивание зоны, кровоснабжаемой катетеризированным сосудом. При необходимости установка катетера корригировалась. Введение метиленового синего является дополнительным лечебным мероприятием, поскольку это контрастное вещество обладает бактерицидным и бактериостатическим эффектом, а тот факт, что содержимое желчных протоков в 17,2% имеет сапрофитную флору, позволил включить в лечебную стратегию (наряду с внутриартериальным введением химиопрепаратов) введение антибиотиков широкого спектра действия — цефалоспоринов, фторхинолонов [1, 5, 6].
Курс внутриартериальной химиотерапии начинали с 3-5-го дня после операции, по мере восстановления перистальтики кишечника.
Внутриартериальная химиотерапия проводилась по модифицированной схеме, разработанной в Донецком областном противоопухолевом центре. Наиболее часто в качестве препарата первой линии использовался флуороурацил. Комплексное лечение больных исследуемой группы предполагало проведение до четырех последовательных курсов внутриартериальной полихимиотерапии. По данным Донецкого областного противоопухолевого центра, наиболее оптимальным является введение химиопрепаратов по принципу: «1 день — 1 препарат». При этом ежедневно в режиме непрерывной длительной инфузии с использованием дозаторов лекарственных веществ ДШ07 или 1Ж2/50 вводили суточную дозу препарата с сохранением курсовой дозы.
Результаты и их обсуждение
В процессе или после лечения осложнения возникли у 17 (19,72%) больных. При определении степени токсичности реакций была использована шкала NCI — CTC (1999).
Токсические реакции I степени выявлены у 5 (5,8%), II степени — у 7 (8,12%), III степени — у 4
(4,64%), а IV степени — у 1 (1,16%) больного соответственно.
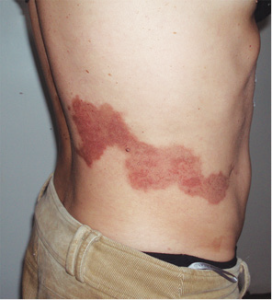
Наибольшее количество осложнений (847%) было связано с общетоксическим действием химиопрепаратов. У 6 (35,29%) больных возникли осложнения, связанные с пребыванием катетера в сосуде, причем у половины отмечался тромбоз катетера в ранний послеоперационный период, у 1 больного — артериит, у 1 больного — стойкий ангиоспазм, у 1 — пролежень сосуда. В связи с некорректной установкой внутриартериального катетера у 1 больного был зафиксирован ожог мягких тканей по ходу поясничных артерий (рис. 1, 2). Местные реакции в виде дерматита выявлены у 1 пациента, функциональные нарушения — также у 1 больного. Сенсорные нарушения не зафиксированы.
Рис. 1. Ожог кожи и мягких тканей по ходу поясничных артерий
Рис. 2. Ожог кожи и мягких тканей по ходу поясничных артерий
Для предотвращения описанных осложнений необходимо использовать следующую схему мероприятий:
- Технически грамотное осуществление установки катетера, с формированием ангиостомы.
- Профилактика тромбоза катетера посредством инфузии раствора гепарина, которая проводится круглосуточно через каждые 3 ч в течение всего времени пребывания катетера в сосуде.
- Определенная последовательность введения препарата — 1 препарат в течение 1 дня.
- Соблюдение режима непрерывной длительной инфузии химиопрепаратов.
- Необходимость разведения химиопрепарата на 50-100 мл изотонического раствора ЫаО!, воды для инъекций.
- Длительность цикла — не менее 9 дней.
- Снижение начальной дозы химиопрепарата [6].
- Строгий контроль показателей крови в процессе лечения. При выявлении гематологической токсичности необходимо прекращение химиотерапии или редуцирование дозы, переливание форменных элементов крови и назначение колониестимулирующих факторов.
- Внутриартериальное введение гепатопротекторов при повышении уровня аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы и билирубина.
- При возникновении локальных реакций — редуцирование дозы химиопрепарата, либо системное введение оставшейся дозы химиопрепарата с внутриартериальным введением местных анестетиков, гормонов, сосудистых препаратов.
- Для предотвращения нарушений со стороны желудочно-кишечного тракта назначают обволакивающие средства, парабиотики и витамины А и Е, специальная диета.
- Возникновение симптомов нефротоксичности сопровождается назначением расширенного питьевого режима, соблюдением диеты, инстилляции противовоспалительных вяжущих средств, обезболивающих препаратов, введением спазмолитиков.
- Проведение профилактических мероприятий, предупреждающих развитие нейротоксичности включает в себя применение глутаминовой кислоты, витаминов В1, В6, В12 и галантамина. При появлении центральной и периферической симптоматики назначаются ноотропы, сосудистые препараты, транквилизаторы и седативные средства.
Вывод
Предложенный комплекс мероприятий позволяет уменьшить количество осложнений при проведении СВПХТ и снизить токсическое влияние химиопрепаратов на организм больных.
Литература
- Бондарь Г.В., Седаков И.Е. (2004) Вариантная анатомия внутренней грудной артерии. Травма, 5(2): 180-188.
- Ганцев Ш.Х. (2004) Онкология: Учебник. Медицинское информативное агентство, Москва, 51б с.
- Гаспарян С.А., Островерхов Г.Е., Трапезников Н.Н. (1979) Регионарная длительная внутриартериальная химиотерапия злокачественных опухолей. Медицина, Москва, с. 124-12б.
- Дедерер Ю.М., Крылова Н.П. (1975) Атлас операций на печени. Медицина, Москва, 200 с.
- Комаров Ф.И., Хазанов А.И., Калинин В. и др. (199б) Болезни органов пищеварения и системы крови. Под ред. Ф.И. Комарова. Медицина, Москва, 528 с.
- Малиновский Н.Н., Северцев А.Н., Брехов Е.И. и др. (2000) Циторедуктивная хирургия злокачественных опухолей печени: интраартериальная регионарная и гипертермическая интраоперационная интраперитонеальная химиотерапия. Кремлевская медицина. Клин. вестн., 2: 7-12.
- Седаков И.Е., СмирновВ.Н. , Тюменцев П. и др. (199б) Оптимизация комплексного лечения местно-распространенного рака молочной железы. I Съезд онкологов стран СНГ, Москва: Сб. науч. тр., с. 514.
- Седаков І.Е. (2003) Місцево-поширений, первинно-неоперабельний рак молочної залози: патоморфологічна оцінка ефективності комбінованого лікування. Медико-соціальні проблеми сім’ї, 8(4): 55-б1.













Комментировать