Татарчук Т.Ф., Косей Н.В.
В связи с неуклонным ростом частоты доброкачественных гиперпролиферативных заболеваний репродуктивной системы, среди которых первое место занимает лейомиома матки, специалистами постоянно ведется поиск новых и совершенствование уже имеющихся методов лечения данной патологии [1,2,3].
В последние десятилетия в медицине вообще, и в гинекологии в том числе, отмечается тенденция к более широкому внедрению щадящих органосохраняющих и минимально инвазивных методик [1,2,3,4,5].
До второй половины прошлого века лечение лейомиомы матки было исключительно хирургическим, в котором основная роль принадлежала гистеректомии. Этот метод лечения миомы матки и на сегодня остается ведущим [1,6,7]. Однако успехи современной фармацевтической промышленности и хирургической техники дают возможность использования более щадящих методик лечения симптомов лейомиомы матки, представляющих на сегодня достойную альтернативу радикальной операции.
К тому же современные женщины все чаще настаивают на сохранении матки как органа по причине желания родить ребенка либо просто с целью избежать значительной хирургической травмы, сохранить менструальную и полноценную половую функцию.
В последние десятилетия произошло кардинальное изменение тактики ведения больных с лейомиомой матки — на сегодня выжидательная тактика, принятая ранее, считается недопустимой, и лечить опухоль необходимо с момента ее выявления [1,4,6,8]. Имеющееся на сегодня разнообразие методов консервативного и органосохраняющего миниинвазивного лечения данного заболевания создает условия для эффективного лечения клинических проявлений миомы и улучшения «качества жизни» этой категории женщин без удаления органа.
В то же время выбор оптимальной тактики и метода лечения, при наличии множества современных методов терапии, является для врача-практика иногда довольно сложной задачей. При выборе наиболее подходящего метода лечения важно учитывать величину и локализацию узлов лейомиомы, их структуру, темп роста опухоли, наличие сопутствующей патологии эндометрия и придатков, а также возраст женщины, ее репродуктивные планы, психологический настрой пациентки по отношению к различным методикам лечения.
Довольно часто сочетание различных методов лечения, позволяющее максимально выгодно использовать положительные их свойства, значительно расширяет возможности лечения лейомиомы матки, особенно сложных ее форм и локализаций.
Использование комбинированных методов позволяет повысить эффективность и безопасность вмешательств, снизить частоту осложнений и рецидивов.
Эра гормональной терапии лейомиомы матки началась с 1996 г, когда Goldzieger впервые использовал местранола ацетат.
Дольше всего в медикаментозном лечении лейомиомы матки применяются прогестагены, переводящие имеющуюся у женщин с миомой абсолютную или относительную гиперэстрогению в относительную гипоэстрогению за счет преобладания гестагенов. Кроме того, препараты данной группы обеспечивают стромальную супрессию эндометрия, что очень важно при наличии сопутствующих гиперпластических процессов эндометрия, снижают активность эстрогенных рецепторов на ядерной мембране, активизируют секрецию эстрадиол-конвертирующих энзимов. Гестагены также угнетают инкорпорацию тимидина клетками эндо- и миометрия, снижая их чувствительность к эстрогенам, способствуют угнетению матричных металлопротеиназ и стимулируют синтез белка, связывающего инсулиноподобный фактор роста-1 (ИПФР-1), за счет чего снижают пролиферативную активность миоцитов [8,9,10]. При длительном использовании гестагенов в непрерывном режиме происходит также угнетение овуляции за счет подавления выброса ЛГ. Применение препаратов данной группы в непрерывном режиме эффективно купирует мено- и метроррагии, особенно при сочетании миомы с гиперпролиферативной патологией эндометрия, однако на размеры опухоли влияют незначительно. Поэтому их применение целесообразно при лечении миом небольших размеров и особенно — при сочетанной патологии матки и эндометрия. Длительность приема ограничена общей нагрузкой на желудочно-кишечный тракт и метаболизм в печени, а в некоторых случаях и наличием синдрома непереносимости гестагенов [9,10].
Иногда для симптоматической терапии маточных кровотечений (после диагностического выскабливания цервикального канала и полости матки) эффективно применяются оральные контрацептивы (ОК). Длительный прием низкодозированных ОК, по данным некоторых авторов [8], способствует стабилизации размеров небольших миом (до 2 см в диаметре), не уменьшая их размеров. В возрасте после 40 лет ОК могут применяться ограничено лишь на короткий период и только с целью симптоматической терапии для остановки маточного кровотечения, учитывая их влияние на свертывающую систему крови и риск развития тромбоэмболических осложнений.
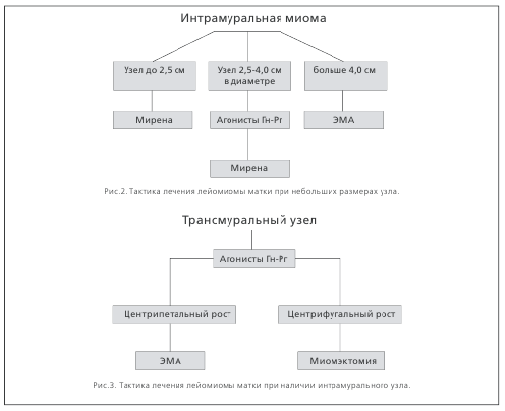
В настоящее время для лечения лейомиомы небольших размеров (с размерами узлов до 2,5 см в диаметре) широко применяется леоноргестрелвыделяющая внутриматочная система «Мирэна». Отличительной особенностью данного метода лечения миомы является минимизация системных эффектов и снижение риска развития синдрома непереносимости гестагенов. Действие левоноргестрела не ограничивается местным эндометрийсупрессивным эф фектом, он одновременно снижает синтез ИПФР—1 и стимулирует продукцию связывающего его белка, а также подавляет продукцию эстрогенов и прогестерона в эндометрии и угнетает экспрессию рецепторов к ним [11,12,13]. Все это усиливает гестагенное воздействие и способствует купированию мено— и метроррагий. Применение «Мирены» у пациенток с небольшими размерами миомы (до 2,5 см в диаметре) в нашей клинике показало уменьшение объема менструальной кровопотери на 69,4%, а также длительности менструаций с 6,7±дней до лечения до 3,2±0,41 (р1–2<0,05) через 3 и до 1,9±0,35 дней (р1–3<0,05) — через 12 месяцев применения «Мирены». Кроме того, через 6 месяцев применения системы было отмечено достоверное уменьшение среднего объема доминантного узла, а через 9 мес — и среднего количества фиброматозных узлов [14,15].
Однако на cегодня доказано, что прогестерон и другие прогестагены в некоторых случаях могут участвовать в инициировании митотической активности клеток миометрия, стимулировать активность эпидермального фактора роста [10,12,16], в связи с чем было предложено использование антипрогестерона — мифепристона (Ru-475). В настоящее время получены данные о том, что мифепристон оказывает не только антагонистические свойства по отношению к прогестерону и глюкокортикоидам, обладая высокой степенью сродства по отношению к рецепторам последних, но и снижает секрецию пролактина в опухоли и содержание ИПФР-1 [16,17].
Проведенные в нашей клинике исследования эффективности мифепристона в дозе 25 мг в сутки показали исчезновение маточных кровотечений, переходящее в аменорею, у всех пациенток, сопровождавшееся уменьшением размеров опухоли на 26,5% [14]. При этом по данным денситометрии, не происходило снижения минеральной плотности костной ткани, риск развития которой ограничивает длительность применения агонистов Гн-Рг.
Патогенетически обоснованным в лечении доброкачественных опухолей матки, учитывая их доказанную гормонзависимость, является подавление продукции любых групп половых стероидных гормонов — как эстрогенов, так и прогестерона. В настоящее время наиболее распространенным методом блокады секреции половых стероидов яичниками является создание управляемой медикаментозной гипогормонемии под воздействием агонистов Гн-Рг. При этом действие данных препаратов не ограничивается десенситизацией гонадотропных рецепторов гипофиза и блокадой стероидной продукции в яичниках. Указанные препараты угнетают синтез ИПФР-1, чувствительность рецепторов эпидермального, туморнекротизирующего факторов роста, уменьшает захват тимидина клетками миометрия, блокируя экспрессию эстрогенных и прогестероновых рецепторов. Кроме того, аГн-Рг подавляют ароматазную активность тканей матки, способствуя снижению локальной продукции эстрогенов и оказывают прямое действие на ткань миомы с активацией апоптоза. Такое комплексное воздействие агонистов Гн-Рг обеспечивает более быструю, чем при естественной менопаузе, регрессию опухоли — за 4–5 месяца на 30–40% [17,18,19]. Однако длительность применения препаратов данной группы ограничена возникновением эстрогендефицитных расстройств, наиболее серьезным из которых является уменьшение минеральной плотности костной ткани. Поэтому аГн-Рг должны назначаться длительностью не более 5–6 мес. А учитывая обратимость их действия, наиболее выгодно их назначение в комбинации с другими методами — консервативной миомэктомией, введением левоноргестерлвыделяющей внутриматочной системы и др. В качестве монотерапии возможно назначение аГн-Рг лишь у женщин в перименопаузе с целью введения их в меностаз.
Наибольшее распространение получила комбинированная трехэтапная методика с применением на первом этапе 2–3-х инъекций агонистов, затем на втором этапе — проведением консервативной миомэктомии, и на третьем этапе — еще 1–2 инъекций аГн-Рг. Агонисты Гн-Рг по праву считаются «золотым стандартом» в подготовке к проведению консервативной миомэктомии, так как существенно уменьшают кровопотерю и длительность операции вследствие предоперационного уменьшения размеров узлов и их васкуляризации, укорачивают период реабилитации за счет уменьшения объема регрессии гипертрофиро- ванного миометрия, а также снижают частоту рецидивов [4,14,18]. Следует помнить, что консервативная миомэктомия возможна лапаротомным, лапароскопическим и вагинальным доступами, выбирать которые желательно в зависимости от количества, вели— чины и локализации узлов, а также квалификации вра— ча [4,6,14].
Перспективным представляется сочетанное применение агонистов Гн-Рг и левоноргестрелвыделяющей системы «Мирена». В случаях, когда узлы лейомиомы больше 2 см, но менее 4 см в диаметре, в нашей клинике с успехом применяется такая комбинированная методика, при которой на фоне медикаментозной менопаузы (2–3 инъекции аГн-Рг) проводится введение «Мирены». Преимуществом ее является предварительное купирование маточных кровотечений и уменьшение размеров узлов перед введением внутриматочной системы, что повышает эффективность и приемлемость метода [15].
При наличии субмукозной миомы показана ее гистероскопическая резекция, которая наиболее эффективна при наличии узлов 0 или I типа размером не более 5 см в диаметре. В тех случаях, когда размеры узла превышают 3 см в диаметре, показано предоперационное его уменьшение путем назначения аГн- Рг. В случаях наличия узлов II типа эффективность гистероскопической операции гораздо ниже с риском необходимости повторного вмешательства до 80% случаев, поэтому в случаях наличия указанной локализации миомы целесообразно отдавать предпочтение другим методам ее лечения [6,14].
В последнее время широко развиваются новые органосохраняющие методики, среди которых лапароскопический миолизис с использованием лазерного луча, криовоздействия или диатермокоагуляции миомы, трансцервикальная гистероскопическая аблация или резекция эндометрия, высокочастотный ультразвук и билатеральная рентгенхирургическая эмболизация маточных артерий [4,6,21,22,23,24,25,26].
Одной из наиболее перспективных и уже получивших довольно широкое признание в мире и в Украине в том числе миниинвазивных методик является эмболизация маточных артерий (ЭМА). В Украине данная методика проводится с 1998 года. Метод представляет собой катетеризацию под рентгенконтролем a.uterina с обеих сторон после пункции бедренной артерии по методике Сельдингера с последующим введением в них эмболизирующего субстрата с целью окклюзии указанных сосудов. Это приводит в дальнейшем к ишемии, некрозу, склерозу, гиалинозу и кальцинозу узлов миомы, что клинически сопровождается исчезновением или уменьшением степени выраженности симптомов и уменьшением размеров опухоли. По данным различных исследователей, эффективность эмболизации маточных артерий в лечении симптомной лейомиомы матки, колелется от 80 до 98% [18,23,24,25,27].
В нашей клинике имеется опыт совместного с отделением рентгенхирургии Института сосудистой хирургии и трансплантологии проведения более 500 технически успешных ЭМА. По результатам наших статистически обработанных наблюдений, эффективность данной методики в отношении купирования мено- и метроррагий составила 87,1%, симптомов сдавления опухоли — 85,0%, болевого синдрома — 79,1%, альгоменореи — 53,3% [27,28]. После проведенной билатеральной эмболизации маточных артерий наблюдалось уменьшение размеров опухоли и матки в целом, наиболее значимое в течение первого года. При этом было отмечено уменьшение среднего объема доминантного узла на 71,2%, а матки в целом — на 66,3% [28]. Следует помнить, что ЭМА, в отличие от гормональной терапии, является методом лечения только лейомиомы матки и не влияет на сопутствующую довольно часто патологию эндоме трия и шейки матки. Поэтому при применении данного метода очень важна предоперационная диагностика и коррекция гиперпролиферативных состояний эндометрия, а также предопухолевой патологии шейки матки. Это повышает эффективность, приемлемость и безопасность вмешательства. Эмболизация маточных артерий может проводиться при наличии узлов размерами более 3–4 см в диаметре практически любой локализации, в том числе и при сложном для удаления расположении (шеечная локализация, интрамуральный с центрипетальным ростом узел больших размеров, многоузловая миома), кроме случаев субсерозно расположенного узла на ножке. При такой локализации миомы после проведения ЭМА возможно отшнурование некротизированного узла от матки в брюшную полость с риском развития перитонита.
В некоторых случаях при больших размерах лейомиомы проведения ЭМА бывает недостаточно, так как даже при существенном уменьшении величины опухоли объем оставшихся узлов все же велик и является препятствием для возникновения беременности и вынашивания ребенка. В таких случаях возможна комбинация органорсохраняющих методов, а именно — проведение консервативной миомэктомии после предварительно проведенной ЭМА, являеющейся наиболее эффективным методом подготовки к операции и существенно уменьшающей интраоперационную кровопотерю. Преимуществами проведения миомэктомии после ЭМА является существенное уменьшение перед операцией размеров удаляемых узлов, значительное уменьшение интенсивности кровотечения во время операции вплоть до его отсутствия, а также четкое отграничение и отличие по цвету измененной некротизированной ткани узлов от здорового миометрия (рис.1).
Дискуссионным вопросом в современной гинекологии является возможность сочетанного применения ЭМА и агонистов Гн-Рг. Некоторые исследователи сообщают о рецидивах роста миомы при применении ЭМА на фоне медикаментозной менопаузы, что связывают с исчезновением спазма сосудов матки после отмены аГн-Рг, возникающего при их применении, и последующей реканализацией сосудов вследствие этого с восстановлением интранодулярного кровообращения [18,24]. Однако в нашей клинике разработана методика, минимизирующая этот риск. Согласно предложенным рекомендациям, ЭМА при больших размерах миомы проводится через 1 месяц после первой инъекции аГн-Рг, после чего назначаются еще 3–4 инъекции данных препаратов, что обеспечивает длительную послеоперационную гипогормонемию, создающую условия для склеро— зирования сосудов узлов. Поэтому после отмены меди— каментозной менопаузы (а менструальная функция после 4–5 инъекций аГн-Рг возобновляется еще через 3–5 месяцев) восстановления внутриузлового кровотока в уже склерозированных сосудах не происходит, что под— тверждено результатами допплерографического исследования. При проведении вышеописанной комбиниро— ванной методики с применением ЭМА на фоне меди— каментозной менопаузы был выявлен более быстрый темп уменьшения размеров опухоли [28] и, соответ— ственно, клинической симптоматики, а также уменьше— ние длительности и интенсивности постэмболизацион— ного синдрома (субфебрилитета, болевого синдрома).
В некоторых случаях наличия гигантских миом при настоятельном желании женщины сохранить матку возможно комбинирование трех методов: применение ЭМА на фоне медикаментозной менопаузы с последующей консервативной миомэктомией.
И все же, какой метод выбрать при наличии интрамуральной миомы? При наличии фиброматозных узелков до 2,5 см в диаметре методом выбора, на наш взгляд, можно считать внитриматочную систему «Мирена», от 2 до 4,0 см в диаметре — комбинацию аГн-Рг и левоноргестрелвыделяющей системы, а при размерах опухоли более 4 см — ЭМА (рис.2).
При большом размере интрамурального узла возможно проведение пробы с агонистами Гн-Рг: при сдвиге узла после его уменьшения в полость матки (центрипетальный рост) выбор логично остановить на ЭМА, при центрифугальном росте — появляются выгодные условия для проведения миомэктомии (рис 3).
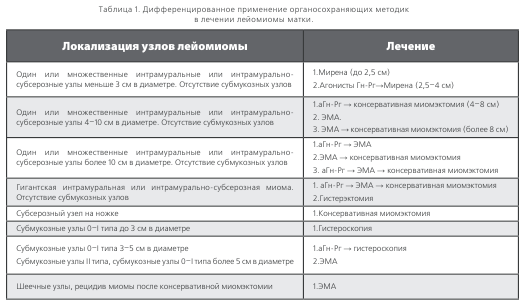
Обобщая приведенные сведения, хочется акцентировать внимание на том, что дифференцированное и зачастую комбинированное применение имеющихся на сегодня в арсенале врача разнообразных органосохраняющих методов лечения лейомиомы матки (табл.1) открывает новые возможности в ее лечении. Правильно подобранный метод или их комбинация позволит добиться эффективного купирования симптомов лейомиомы матки, значительно повысить «качество жизни» женщин с данным заболеванием, сохранив при этом желанную возможность реализации генеративной функции.
список использованной литературы
Майоров М.В. Миома матки: хирургический экстремизм или медикаментозный консерватизм? // Провизор — 2002 — №7 — С.36–38.
Дубініна В.Г., Кузєва Н.Г. Органозберігаючі ендовідеохірургічні операції в лікуванні міоми матки // Одеський медичний журнал — №4(78) — 2003 — С.33–37.
Коков Л.С., Самойлова Т.Е., Гус А.И. и др. Эмболизация маточных артерий — перспективный метод лечения больных лейомиомой матки // Акушерство и гинекология — 2005 — №4 — С.35–41.
Darai E., Fauconnier A., Davitian C., Poncelet C. Myomectomy //Uterine leiomiomata pathogenesis and management /ed by Ivo Brosens/ — Taylor and Francis: London and New York — 2006 — P.199–236.
Чайка А.В., Носенко Е.Н. Эндохирургическое лечение миомы матки у женщин репродуктивного возраста — В кн.: Основы репродуктивной медицины. Практическое руководство — Донецк.: Альматео., 2001 — С.394–397.
Donnez J., Schindler A.E., Wall weiner D., Audebert
A. Fibroids: management and treatment. In: Lunenfeld B., Insler V., editors. GnRH analogues: the state of the art 1996. Carnforth, UK: Parthenon Publishing, 1996 — P.71–82.
Плеханов А.Н. Лапароскопически ассистируемая влагалищная гистерэктомия у пациенток с миомой мат- ки больших размеров // Эндоскопическая хирургия — 2004 — Том 10, №3 — С.48–52.
Тихомиров А.Л., Лубнин Д.М. Миома матки. — М.: ООО «Медицинское информационное агенство», 2006. — 176с.
9 Donnez J., Gillerot S., Squifflet J., Nisolle M. Progestogens and antiprogestogens. In: Brosens I., Lunenfeld B., Donnez J., editors. Pathogenesis and medical management of uterine fibroids. Carnforth, UK: Parthenon Publishing, 1999 — P.121–128.
Rein M.S., Barbieri R.L., Freedmam A.J. Progesterone: a critical role in the pathogenesis of uterine myomas. // Am. J. Obstet. Gynecol — 1995 — Vol. 172 — № 1 — P. 14 — 18
Shozu M., Murakami K., Segawa T. et al. Decreased expression of early growth response-1 and its role in uterine
leiomyoma growth // Cancer Res — 2004 — N64(13) — P.4677–4684.
Wildemeersch D., Schacht E.Treatmentofmenorrhagia with a novel frameless intrauterine levonorgestrel-releasing drug delivery system: a pilot study // Eur. J. Contraception report Health Care — 2001 — Vol.6 — P.93–101
Lahteemaki P., Haukamaa M., Puolakka J. et al. Open randomized study of use of levonorgestrel-releasing intrauterine system as alternative to hysterectomy // Br Med J — 1998 — Vol.316 — P.1122–1226.
Татарчук Т.Ф. Пути оптимизации тактики органосохраняющей терапии лейомиомы матки // Лекарь № 1–2 — 2007. — С. 46–55.
Косей Н.В. Оптимизация органосохраняющего лечения лейомиомы матки с применением левоноргестрел выделяющей системы. // Здоровье женщины №3(31) — 2007 — С.91–97.
Fedel L., Bianchi S. et al. Conservative treatment of diffuse uterine leiomyomatosis // Fertil Steril — 2004 — N82(2) — P.450–453.
Вихляева Е.М. Руководство по диагностике и лечению лйеомиомы матки. — М.: МЕДпресс-информ, 2004. — 400с.
Vilos G.A., Vilos A.G., Abu-Rafea B., Pron G., Kozak R., Garvin G. Administration of goserelin acetate after uterine artery embolization does not change the reducation rate and volume of uterine myomas // Fertil Steril — 2006 May — Vol.85(5) — P.1478–14883.
Isaacs J.D., Gonadotropin-releasing hormone analogs — Clinical reproductive medicine / Ed Cowan B.D., Seifer D.B — Philadelphia — New York.: Lippincott-Raven Publishers., 1997 — 225–229.
Кулаков В.И., Адамян Л.В., Аскольская С.И., Фролова О Г. Здоровье и качество жизни женщин после тотальной и субтотальной гистерэктомии, проведенной по поводу миомы матки // Акушерство и гинекология.-1999 — №4 — С.31–34.
Самойлова Т.Е., Голубев В.А. Применение чрескожной артериальной эмболизации в акушерстве и гинеколо- гии // Акушерство и гинекология — 2005 — №4 — С.9–11.
Савельева Г.М., Бреусенко В.Г., Краснова И.А., Капра- нов С.А. Эмболизация маточных артерий при миоме мат- ки как альтернатива хирургическому лечению // Международный медицинский журнал — 2005 — №1 — С.74–78.
Ford S.M., Johnston C.J. et al. The management of uterine fibroids. A comparison of uterine fibroid embolization therapy versus myomectome — A retrospective review
// Cardivascular nad International Radiological Society of Europe — September 20–24 — 2003 — Antalya — P.157.
Niedercorn, Kos X., d’Archambeau O., Murgo S., Magotteaux P., Golzarian L. Uterine artery embolization for
symptomatic uterine bibroids: the Belgian experience // CIRSE. — Annual Meeting and Postgraduate Course of the Cardiovascular and Interventional Radiological Society of Europe — 2003 — P.56.
Ravina J.H., Aymard A., Ciraru-Vigneron N., Clerissi J., Merland J.J. Uterine fibroids embolization: results about 454 cases // gynecol Obstet Fertil — 2003 — Vol.31(7–8).p P.597– 605.
Vilos G.A., Daly L.J., Tse B.M. Pregnancy outcome after laparoscopic electromyolysis // J. Am. Assoc. Gynecol. Laparosc — 1998 — Vol.5 — P.289–292.
Альтман І.В. Ренгенендоваскулярна емболізація маткових артерій — новий етап у малоінвазивному лікуванні фіброміоми матки // Практична медицина — 2002 — Том 8, №2 — С.11–13.
Татарчук Т.Ф., Косей Н.В., Альтман И.В., Кондратюк В.А., Сухоребрая Е.И. Опыт применения эмболизации маточных артерий у женщин с лейомиомой матки // Репродуктивное здоровье женщины — №1(30) — 2007 — С.25–34.













Комментировать