Результаты исследования частоты гиперпролактинемии среди женщин репродуктивного возраста с недостаточностью лютеиновой фазы. Клиническая характеристика женщин с недостаточностью лютеиновой фазы на фоне гиперпролактинемии. Поэтапный алгоритм лечения недостаточностью лютеиновой фазы на фоне гиперпролактинемии с использованием комплекса негормональных препаратов.
Т.Ф. Татарчук, О.В. Булавенко, Т.Н. Тутченко, ГУ «Институт педиатрии, акушерства и гинекологии АМН Украины», г. Киев, Винницкий государственный медицинский университет им. Н.М.Пирогова
Резюме. Приведены результаты исследования частоты гиперпролактинемии среди женщин репродуктивного возраста с недостаточностью лютеиновой фазы (НЛФ), представлена клиническая характеристика женщин с НЛФ на фоне гиперпролактинемии, разработан поэтапный алгоритм лечения НЛФ на фоне гиперпролактинемии с использованием комплекса негормональных препаратов.
Введение
Недостаточность лютеиновой фазы (НЛФ) менструального цикла — состояние, проявляющееся дефицитом прогестерона, укорочением лютеиновой фазы (менее 11 дней) и отставанием созревания эндометрия от фазы цикла (более чем на 2 дня). НФЛ является одной из наиболее распространенных функциональных патологий яичника (A. Castelbaum, 2002).
Согласно данным различных авторов, НЛФ регистрируется у 25,5–46,6% женщин с бесплодием при регулярном менструальном цикле и у 85% — с привычным невынашиванием беременности [6]. НЛФ также является причиной развития гиперпластических процессов эндометрия, овуляторных маточных кровотечений, предменструального синдрома [1].
Несмотря на более чем полувековую историю изучения НЛФ, клиническое значение этой патологии не снижается, а, напротив, приобретает все большую актуальность в виду раскрытия новых патогенетических механизмов и подходов к лечению.
НЛФ является полиэтиологической патологией. В структуре ее этиологических факторов можно выделить три основные группы:
- нарушение рецепторного аппарата эндометрия;
- первичная или вторичная недостаточность гонад (сниженный овариальный резерв);
- нарушение фолликулогенеза вследствие дисбаланса гонадотропных гормонов на фоне гиперактивации гипоталамо-гипофизарно-надпочечниковой системы, гипотиреоза, гиперандрогении, гиперпролактинемии и т.д.
Последняя группа факторов является наиболее распространенной. Наименее изученным патогенетическим вариантом НЛФ является нарушение функции желтого тела на фоне избыточной секреции пролактина (Прл) — гиперпролактинемии (ГП) — одного из наиболее распространенных нейроэндокринных синдромов. Увеличение выработки Прл, которому ранее отводилась только скромная роль в регуляции лактации, является причиной нарушения менструальной и генеративной функции более чем в 25–30% случаев.
Накопленные клинические и экспериментальные данные показали, что нарушение секреции Прл и связанный с этим симптомокомплекс возникают как при первичном поражении Прл-секретирующих структур, так и при других эндокринных и неэндокринных заболеваниях, а также при приеме некоторых фармакологическихпрепаратов. В большом количестве случаев повышение уровней Прл является физиологическим процессом и отмечается при приеме пищи с высоким содержанием белка (особенно в полдень), стрессовых ситуациях, физических нагрузках, в периоды беременности (с 10тным увеличением к концу срока гестации) и лактации.
Патологическая ГП может быть органической и функциональной. Органическая ГП вызывается опухолями гипофиза (микро-и макропролактиномами). Однако, согласно современным классификациям, наиболее часто в гинекологической практике встречается функциональная ГП, которая подразделяется на симптоматическую (является проявлением гипотиреоза, хронической почечной недостаточности, цирроза печени, синдрома поликистозных яичников), смешанную и идиопатическую формы [2].
Часто повышение уровня пролактина характерно для состояния хронического стресса. Исследования последних лет в этой области позволяют утверждать, что считавшаяся ранее идиопатической ГП является следствием хронического психоэмоционального стресса, распространенность которого в современном обществе неуклонно растет [3,4].
Благодаря недавним исследованиям в сфере нейроэндокринологии слало известно, что повышенное содержание Прл подавляет репродуктивную функцию на различных уровнях. В гипоталамусе под влиянием высоких уровней Прл уменьшается синтез и высвобождение гонадотропин-рилизингового гормона, также снижается чувствительность гипоталамуса к эстрогенам. В исследовании R.A. Bauman и соавт. нормализация импульсной секреции гонадотропин-рилизингового гормона наблюдалась после лечения бромкриптином [5]. При ГП снижена чувствительность рецепторов гонадотропин-рилизингового гормона в гипофизе. В яичниках повышенные уровни Прл тормозят гонадотропинзависимый синтез стероидов, снижают чувствительность яичников к экзогенным гонадотропинам.
В условия повышенных уровней Прл нарушается функция стероидогенного острофазного регуляторного протеина (StAR), который осуществляет перенос холестерола с наружной на внутреннюю мембрану митохондрии, где и происходят начальные этапы синтеза прогестерона.
Таким образом, ГП непосредственно снижает секрецию прогестерона желтым телом и индуцирует ранний лютеолиз [3,5].
Благодаря достижениям молекулярной биологии стали известны дополнительные механизмы нарушения функции желтого тела. К ним относятся тканевая гипоксия, ацидоз, избыток свободных радикалов, в большинстве случаев обусловленные сниженным кровоснабжением, а также истощение энергетических ресурсов клеток [6,7].
Из вышеизложенного становится очевидной необходимость специального подхода к лечению НЛФ на фоне ГП с учетом как ведущего, так и сопутствующих патогенетических звеньев.
Первым этапом лечения является достижение нормопролактинемии с использованием эрголиновых производных. Однако для нормализации функции гипоталамогипофизарно-яичниковой системы в целом необходим комплексный подход, подразумевающий поэтапное физиологичное воздействие на вегетативные и метаболические составляющие патологии.
Нами был разработан двухэтапный алгоритм лечения НЛФ для женщин с ГП, дополненный комплексом негормональных препаратов.
Значительная роль стрессового фактора в механизме развития НЛФ указывает на необходимость проведения коррекции психологического состояния и состояния вегетативной нервной системы у данного контингента женщин, ввиду чего в комплекс лечения был введен препарат магния с витамином В6. Магний служит естественным антистрессовым фактором, тормозит развитие процессов возбуждения в центральной нервной системе и снижает чувствительность организма к внешним воздействиям. Кроме того, магний играет ведущую роль в энергетическом, пластическом и электролитном обмене, принимает участие в процессах окислительного фосфорилирования, мембранного транспорта.
Учитывая значение нарушения кровообращения для нормальной функции яичников в комплекс лечения был включен актовегин — препарат, стимулирующий ангиогенез, способствующий восстановлению капиллярной стенки, улучшающий микроциркуляцию за счет антитромботического действия.
Для поддержания нормопролактинемии оптимальным является назначение фитопрепарата циклодинон, обладающего мягким допаминергическим действием. Следующая составляющая лечебного комплекса представлена препаратом растительного происхождения — трибестан, активными компонентами которого являются стероидные гликозиды (сапонины) фуростанолового типа, извлеченные из растения Tribulus terrestris L (якорцов стелющихся).
Трибестан оказывает мягкий стимулирующий эффект на секрецию как гонадотропных, так и яичниковых гормонов. Доказано стимулирующее влияние трибестана на синтез ФСГ и эстрадиола, при этом его влияние на синтез тестостерона незначительно [8].
В исследованиях болгарских ученых П. Димова, иМ. Таскова (1981) по активирующему действию трибестана на ферментные системы, доказано, что препарат влияет на синтез аденилциклазы и циклического АМФ, который, в свою очередь, является одним из звеньев нормального образования стероидных гормонов, что и определяет целесообразность его использования при гипофункции желтого тела.
В исследовании терапевтического эффекта препарата на эндокринную функцию женщин доказана его высокая эффективность у больных с хронической ановуляцией и бесплодием [9]. Трибестан применялся как в виде монотерапии, так и в комплексе с гормональными препаратами. При этом комбинированное применение с гормональными препаратами приводит к потенцированию его положительного эффекта.
В контексте лечения НЛФ следует отметить влияние трибестана на психоэмоциональный статус, состояние вегетативной нервной системы: улучшение общего самочувствия, уменьшение утомляемости, раздражительности, увеличение физической и умственной работоспособности, улучшение памяти.
Целью исследования было определить роль функциональной ГП в патогенезе НЛФ у женщин активного репродуктивного возраста и разработать эффективный комплекс лечения НЛФ на фоне ГП для женщин репродуктивного возраста.
Материал и методы исследования
Обследовано 200 женщин репродуктивного возраста с НЛФ. В группу контроля вошли 45 практически здоровых женщин репродуктивного возраста без соматической и гинекологической патологии с двухфазным менструальным циклом и длительностью лютеиновой фазы больше 11 дней.
В исследование не включались женщины с трубно-перитонеальными формами бесплодия, опухолевыми процессами матки и яичников, хронической ановуляцией, патологическими изменениями эндометрия и пороками развития матки, патологией щитовидной железы, надпочечников.
Пациенткам было проведено исследование уровня Прл в сыворотке крови в первую и вторую фазы менструального цикла иммуноферментным методом, также определялась частота мастодинии, масталгии и галактореи. Пациенткам с повышенными уровнями Прл была проведена МРТ структур головного мозга с целью исключения опухолевых процессов гипофиза. Функциональное состояние матки и яичников оценивали с помощью сонографического исследования с доплеровским картированием на аппарате Voluson_730 pro с использованием абдоминального и вагинальгого трансдьюссеров. Кровоток в маточных и инатраовариальных артериях оценивали трижды: в пролиферативной фазе, накануне овуляции и в середине лютеиновой фазы путем измерения индексов резистентности (ИР) и пульсационных индексов (ИП) до и после лечения.
Для оценки состояния матки в середине лютеиновой фазы проводилось определение ее биофизического профиля с помощью бальной шкалы Аппельбаума (1995). Основой метода является оценка суммы показателей ультаразвукового и допплерометрического исследования. Определяются: 1) толщина эндометрия; 2) структура эндометрия; 3) сократимость миометрия; 4) эхогенность миометрия; 5) кровоток в маточных артериях; 6) кровоток в эндометрии и 7) кровоток в миометрии в В_режиме. При сумме балов 20 имплантация происходит в 100% случаев, при 17–19 баллах — в 77%, при 14–17 баллов — в 60%, при 13 и меньше — имплантация не происходит.
Для исследования состояния психосоциальной адаптации с помощью шкалы Спилберга-Ханина определяли уровни личностной и адаптивной тревожности. Состояние вегетативных функций оценивали с помощью вычисления вегетативного индекса Кердо (ВИК).
Материал для морфологического исследования получали путем аспирационной биопсии, биоптаты окрашивали гематоксилином и эозином, пикрофуксином по ванн Гизону.
Пациентки с ГП путем рандомизации с использованием таблицы случайных чисел были разделены на две группы: А (n=35) иВ (n=43), между которыми проводилось сравнение эффективности лечения. Группа А получала стандартную патогенетическую терапию: на первом этапе — каберголин в индивидуально подобранной дозировке и препарат магния с пиридоксином в течение 1 мес.; на втором этапе — дидрогестерон (по 1 таблетке 2 раза в день), с 16 по 25 дни цикла (в течение 3 мес.).
Группа В получала двухэтапную терапию с применением комплекса негормональных препаратов. На первом этапе использовался каберголин в индивидуально подобранной дозировке и препарат магния с пиридоксином в течение 1 мес. Для лечения на втором этапе в течение 3 мес. использовались препараты: дидрогестерон (по 1таблетке 2 раза в день), с 16 по 25 дни цикла, циклодинон (по 1 таблетке 1 раз в день), трибестан (по 1 таблетке 3 раза в день) ив течение 1 мес. актовегин (по 1 таблетке 3 раза в день).
Результаты исследований и их обсуждение
При анализе показателей уровня Прл обнаружено, что у 78 (39%) женщин репродуктивного возраста наблюдалось статистически достоверное его повышение (рис. 1) как вІ, так и во ІІ фазу менструального цикла (табл. 1). Эти результаты согласовываются с современными литературными данными о ГП в генезе НЛФ [1].

Исследование структур головного мозга у пациенток с ГП с помощью МРТ не выявило органической патологии. Исследование состояния центральной и вегетативной нервной систем показало, что для пациенток с НЛФ характерно снижение психологической адаптации, повышение уровня реактивной тревожности, а также десинхронизация вегетативных функций по типу симпатикотонии.
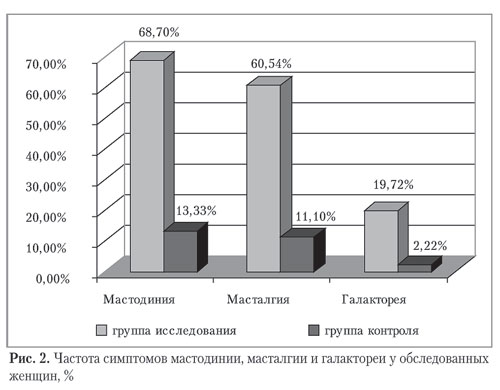
Симптомы мастодинии, масталгии и галактореи встречались достоверно чаще в группе женщин с ГП, при этом мастодиния являлась наиболее распространенным симптомом (рис. 2).
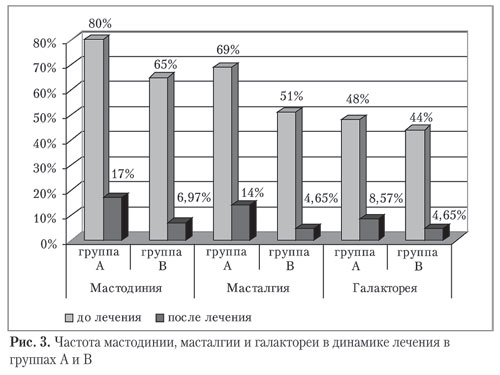
В результате проведенного лечения наблюдалось достоверное снижение всех упомянутых симптомов в обеих группах (рис. 3).
В результате проведенного двухэтапного лечения в группе А зарегистрировано восстановление секреторной фазы по данным биопсии у 54,2% (19 женщин) и достоверное улучшение васкуляризации яичников и матки (табл. 2).
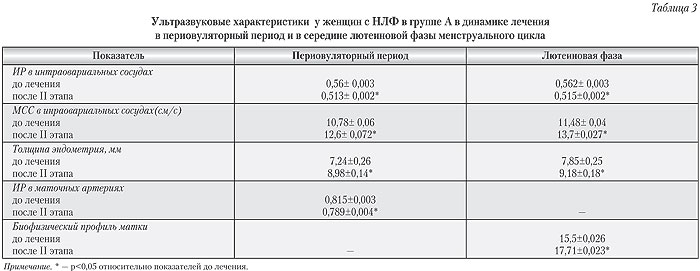
В то же время, несмотря на достоверное снижение показателей ИР в периовуляторный период и возрастание максимальной систолической скорости, эти показатели все же не соответствуют таковым у здоровых женщин (согласно данным литературы, в норме в периовуляторный период показатели ИР составляют 0,44±0,001, МСС — 17,47±0,027см/с) [10]. В середине лютеиновой фазы также наблюдалось достоверное улучшение показателей ИР, МСС перифолликулярного кровотока, а также улучшение показателей кровотока ветвей маточных артерий, однако средние показатели биофизического профиля матки не превышали 18 баллов, 15,5±0,026 до 17,71±0,023 (табл. 3).
Результаты обследования группы В показа-ли полное восстановление секреторной фазы цикла по данным биопсии у 37 (86,04%) женщин и достоверное улучшение васкуляризации яичников с нормализацией показателей у 35 (81,39%) и улучшением кровоснабжения матки у 36 (83,72%).

Как следует из данных, представленных в таблице 4, уже на 2–3 дни цикла наблюдалась нормализация кровоснабжения доминирующего фолликула, что проявлялось как достоверным снижением ИР в интраовариальных сосудах, так и повышением МСС.
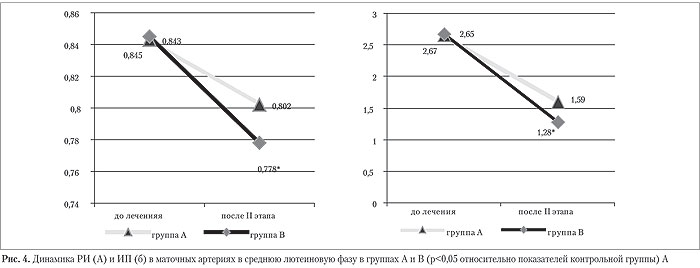
Снижение ИР в маточных сосудах (рис. 4) спо-верное увеличение толщины эндометрия, как в собствовало полноценному развитию эндомет-периовуляторный период, так и в середине люрия, в частности, в группе В наблюдалось досто-теиновой фазы (табл. 5).
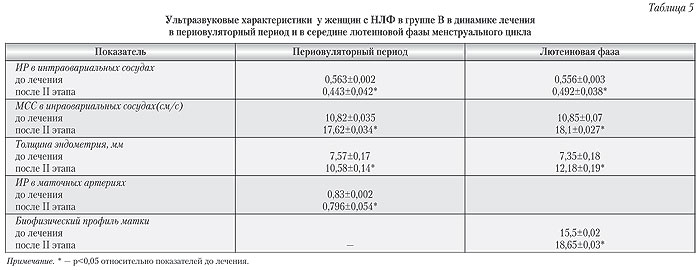
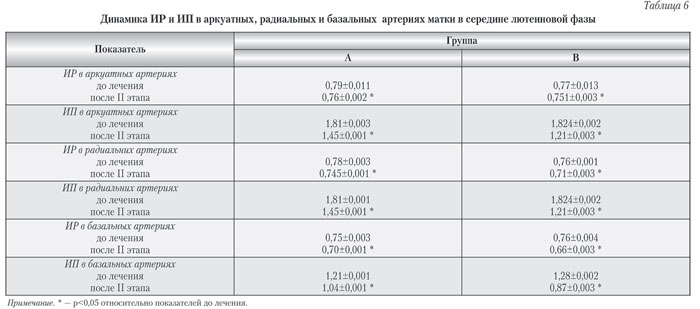
Состояние эндометрия по оценке биофизического профиля методом Аппельбаума, в среднем, превышал 18 баллов, что полностью соответствует показателям нормальной секреторной фазы цикла здоровых женщин. После второго этапа терапии в группе В показатели кровотока матки не только в ветвях маточных артерий, но и в ветвях аркуатных, радиальных, базальных и спиральных артерий были достоверно выше соответствующих показателей у пациенток, получавших лечение в группе А (табл. 6).
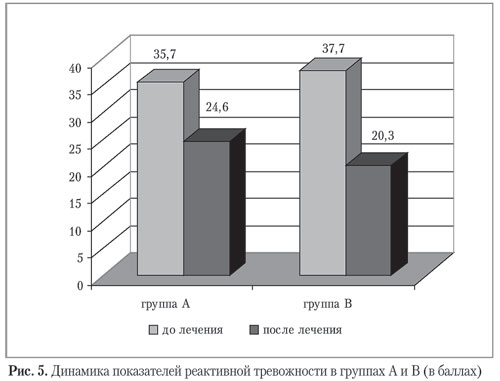
При определении динамики уровня реактивной тревожности зарегистрировано его достоверное снижение в обеих группах, однако приближение к среднестатистической норме присутствовало лишь в группе В (рис. 5). Определение ВИК после лечения показало стабилизацию вегетативных функций и увеличение доли женщин с эйтонией до 60% в группе А и до 74,4% — в группе В.
Выводы
Результаты проведенных исследований демонстрируют более высокую эффективность двухэтапного алгоритма лечения с использованием комплекса негормональных препаратов (группа В) для коррекции недостаточности лютеиновой фазы на фоне гиперпролактинемии.
Важным условием достижения стойкого клинического эффекта и профилактики связанной с НЛФ патологии является патогенетически обоснованная коррекция этиологических факторов в течение всего периода лечения. Подобранная таким образом комплексная коррекция характеризуется хорошей переносимостью,уменьшением количества и длительности применения экзогенных гормональных веществ, является высокоэффективной, не только в отношении восстановления функции репродуктивной системы, но и для нормального функционирования организма в целом.
Литература
- Демина Т.Н., Гошкодеря И.Ю. Недостаточность лютеиновой фазы: новые подходы к решению старых проблем // Здоровье женщины. — 2004. — № 4(20). — С. 63—69.
- Венцковская И.Б., Ефименко О.А.. Гиперпролактинемия в практике врача-гинеколога // Репрод. здоровье женщины. — 2003. — №3. — С. 71—76.
- Chrousos G.P., Torpy D.J., Gold P.W. Interactions between the hypothalamic-pituitary adrenal axis and the female reproductive system: clinical implication // Ann. Int. Med. — 1998. — №129. — P. 229—240.
- Татарчук Т.Ф. Стресс и репродуктивная функция женщины // Межд. эндокринол. ж. — 2006. — №3. — С. 2—9.
- Bauman R.A., Kant G.J.Chronic sustained stress increases levels of anterior pituitary prolactin mRNA // Pharmacol. Biochem. Behav. — 2000. — №67. —P. 423—431.
- Stocco C., Telleria C., Gibori G. The molecular control of corpus luteum formation, function, and regression // Endocrine reviews. — 2007. — № 4. — Р. 117—149.
- Niswander G.D. Molecular control of Lu-teal Secretion of Progesterone // Reproduction. — 2002. — №123. — P. 333—339.
- Vankov S. A propos of tribestan pharmacology / Scientific technical report, 1980.
- Tomova M., Guylemetova R. Steroid saponin and steroid sapogenine. Furastanol bisglykosid aus Tribulus terrestris L. // Planta medica. — 1978. — №34. — Р. 188—191.
- Comparison of transvaginal sonography, saline infusion sonography, and office hysteroscopy in reproductive_aged women with or without abnormal uterine bleeding / Kelekci S., Kaya E., Alan M., Alan Y., Bilge U., Mollamahmutoglu L. // Fertil. Steril. — 2005. — V. 84. — P. 682—686.












Комментировать