Рак молочної залози: Сучасні підходи в лікуванні. Програма профілактики і ранньої діагностики. Методи профілактики раку молочної залози. Рання діагностика. Самообстеження. Фактории риску.
Відділення пухлин грудної залози та її реконструктивної хірургії Національний інститут раку Автори: д.м.н., професор І.І. Смоланка
(завідувач відділенням пухлин грудної залози та її реконструктивної хірургії Національного інституту раку) д.м.н. С.Ю. Скляр
(провідний науковий співробітник відділення пухлин грудної залози та її реконструктивної хірургії Національного інституту раку) к.м.н. І.В. Досенко
(науковий співробітник відділення пухлин грудної залози та її реконструктивної хірургії Національного інституту раку)
Рак молочної залози (РМЗ) в останні роки викликає особливий інтерес, що пов’язано, в основному, зі значним зростанням захворюваності і смертності від даної патології у всьому світі. Щорічно у світі реєструється більше 1 млн. випадків РМЗ. Особливо високі показники захворюваності зафіксовано у США, Канаді, Франції, Ізраїлі, Швейцарії, країнах Прибалтики. У Країнах СНД щорічно реєструється 510 тис. випадків захворювання на РМЗ, смертність від цієї патології за останні 10 років зросла більше ніж у 2,5 рази та зайняла перше за частотою у жінок. За уточненими даними Національного канцер-реєстру України, у 2007 р. зареєстровано 15 469 нових випадків РМЗ, загальна кількість померлих від нього серед жіночого населення становила 7556, тобто 30,2 на 100 тис.
Рак молочної залози (РМЗ) займає перше місце серед онкопатології у жінок репродуктивного віку в Україні. По регіонах України найбільші показники захворюваності у 2007 році у м. Києві 74 на 100 тисяч жіночого населення та м. Севастополі 92,6 випадків на 100 тисяч жіночого населення.
Біля в 30% випадків РМЗ в Україні діагностується в занедбаних стадіях, що призводить до зростання витрат на лікування у 25-30 разів порівняно з тим, коли пухлина виявляється на ранній стадії. Саме тому великої актуальності набуває впровадження профілактики та ранньої діагностики, які покращують 5-річну виживаність хворих на РМЗ та зменшують витрати на лікування. Злоякісні новоутворення молочної залози займають провідне місце в захворюваності та смертності жіночого населення України, оскільки питома вага цієї патології в структурі захворюваності та смертності перевищує 18%. Абсолютне число захворілих на рак молочної залози щороку перевищує 15 тисяч Кількість померлих складає в межах 7500 8000 жінок. Вивчення динамічних моделей захворюваності на рак молочної залози показує, що рівень захворюваності зростає. Встановлено, що серед захворілих більше 37%, серед померлих більше 30% складають особи працездатного віку, це призводить до значних втрат життєвого потенціалу жіночої популяції України.
Найбільш об’єктивним інтегральним показником стану надання онкологічної допомоги хворим на рак молочної залози є показник 5-річної виживаності, який за даними Національного канцер-реєстру в Україні не перевищує 50%, між тим як в країнах Європи та США він складає 75-80%.
Нами розроблені централізовані заходи для закладів системи МОЗ України зі створення спеціалізованої служби допомоги жінкам з патологією молочних залоз. Слід відзначити, що основні проблеми при цьому полягають у організаційних вадах при наданні діагностичної та лікувальної допомоги таким пацієнткам на первинному та вторинному рівні медичної допомоги не дотримуються принципи онкологічної настороги та морфологічного підтвердження діагнозу. В зв’язку з цим нами запропоновано і зараз активно впроваджується трирівнева структура допомоги жінкам з чітким визначенням завдань та розподілом функцій для кожного етапа: мамологічний центр на базі Національного інституту раку, регіональних центрів на базі онкологічних диспансерів, а також кабінетів в лікувально-профілактичних установах неонкологічного профілю.
Програма профілактики і ранньої діагностики
РМЗ має два основних напрямки: первинна профілактика (етіопатогенетична) і вторинна профілактика, яка полягає в діагностиці і лікуванні передракових захворювань. Оскільки етіопатогенез РМЗ остаточно не з’ясовано, можливості первинної профілактики РМЗ обмежені. Основні зусилля дослідників у даний час спрямовані на удосконалення системи вторинної профілактики РМЗ.
Методи профілактики раку молочної залози
Первинна (загально-лікувальна мережа):
- проявляти особливу насторогу в критичні щодо РМЗ вікові періоди (після 50 років);
- регулювання маси тіла;
- зведення до мінімуму споживання алкоголю, відмова від паління;
- підтримка регулярного статевого життя, перші пологи не пізніше 28-30 років, природне вигодовування дитини не менше року; уникнення абортів;
- своєчасне лікування гінекологічної патології, контроль за прийомом гормональних контрацептивів;
- лікування цукрового діабету, захворювань печінки та щитоподібної залози;
- запобігання впливу несприятливих факторів зовнішнього середовища, уникнення стресів.
Вторинна:
- регулярне самообстеження молочних залоз;
- обстеження у мамолога-онколога один раз на рік;
- УЗД молочних залоз жінкам до 40 років один раз на рік (при відсутності патології);
- мамографія жінкам після 40 років 1 раз на 2 роки, після 50 років щорічно.
Пропальпуйте ліву підпахвинну та ліву надключичну ділянки.
Рання діагностика РМЗ можлива за умов виконання програм:
а) самообстеження;
б) лікарських профілактичних оглядів, спостережень і лікувань передпухлинної патології;
в) мамографічних досліджень.
Етапи організації масового скринінгу пухлин молочної залози включають в себе: 1) збирання повної інформації про наявність факторів, що сприяють виникненню РМЗ; 2) проведення огляду та пальпації молочних залоз у жінок з метою попереднього розподілу оглянутих на групи за ступенем ризику для подальшого поглибленого їх обстеження; 3) мамографія.
Самообстеження необхідно впроваджувати в практику як один з основних методів своєчасного виявлення пухлин молочної залози. Але проведення самообстеження також потребує відповідної організації, допомоги засобів масової інформації (радіо, телебачення та преси), відповідних пам’яток для населення тощо.
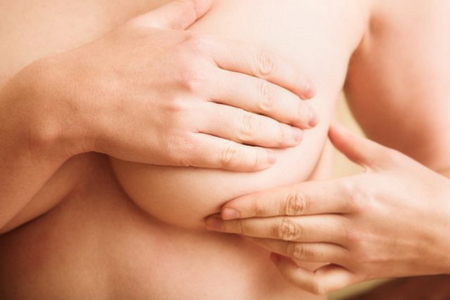
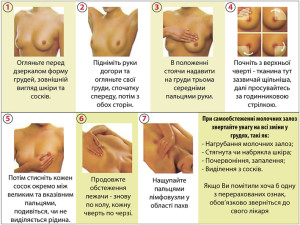
ПРОВЕДЕННЯ САМООБСТЕЖЕННЯ МОЛОЧНИХ ЗАЛОЗ
Огляд молочних залоз рекомендовано проводити кожен місяць в однаковий час, у жінок репродуктивного віку на 8-12 день менструального циклу.
- Станьте перед дзеркалом. Огляньте молочні залози. Зверніть увагу на наявність будь-яких змін форми грудей, зовнішній вигляд шкіри і сосків. Таку саму процедуру проведіть при поверненні в ліву і праву сторони.
- Підніміть руки за голову і огляньте обидві грудні залози.
- Правою долонею пропальпуйте ліву молочну залозу, кінчиками великого і вказівного пальців стисніть сосок, зверніть увагу на на наявність виділень та їх характер. Пропальпуйте ліву підпахвинну та ліву надключичну ділянки.
Таким самим чином обстежте праву молочну залозу.
При великому розмірі залози необхідно підтримувати її знизу: лівою рукою ліву, правою праву, а долонею протилежної руки по черзі пропальпувати молочні залози.
- Лежачи на спині, ліву руку покладіть за голову, а долонею правої руки обстежте ліву молочну залозу.
Таким чином обстежте і праву молочну залозу.
При виявленні будь-яких змін з боку молочних залоз необхідно звернутися до лікаря мамолога-онколога.
Лікарям, які займаються проблемами мамології необхідно оволодіти скринінговими програмами, а обстежені жінки повинні знати про фактори ризику, які на них впливають, враховувати їх під час оцінки свого стану здоров’я і вносити корективи у свій спосіб життя.
Акцентуючи увагу на реалізації програми «самообстеження», водночас необхідно розвивати і програму фахових профілактичних оглядів жінок з підвищеною ймовірністю виникнення злоякісних пухлин (так званих «груп ризику»).
ОСНОВНІ ФАКТОРИ РИЗИКУ РАКУ МОЛОЧНОЇ ЗАЛОЗИ
- Вік 50 років і більше.
- Рак молочної залози у найближчих родичів (мати, сестра, донька, бабуся по материнській лінії) чи інше захворювання на рак у пацієнтки.
- Дисгормональні гіперплазії молочної залози (мастопатії), травми молочних залоз.
- Порушення репродуктивної функції аборт після 35 років, перші пологи після 30 років, природне вигодовування дитини менше 5 місяців, безпліддя, ранній (до 12 років) чи пізній (після 16 років) початок місячних, ранній (до 45 років) чи пізній (після 53 років) клімакс.
- Ендокринні порушення (патологія щитоподібної залози, цукровий діабет, гіпоталамо-гіпофізарнонадниркові захворювання, ожиріння ІІ-го та ІІІ-го ступеню), супутня патологія (гіпертонічна хвороба, неврастенія, захворювання печінки).
- Захворювання репродуктивних органів пухлини матки та придатків, запальні хвороби, порушення менструальної функції, маткові кровотечі.
- •Паління та зловживання алкоголем.
- Вплив несприятливих факторів зовнішнього середовища
Після збору анамнестичних даних стосовно факторів ризику формуються групи пацієнток, які підлягають обов’язковому направленню на мамографію.
У випадках наявності трьох і більше факторів пацієнтку слід направити на мамографію.
Профілактичний огляд активне виявлення хвороби молочної залози з обов’язковою участю медпрацівника. Індивідуальний профогляд проводиться середнім медпрацівником долікарського кабінету, фельшерськоакушерського пункту. Мета виявлення візуальної форми раку. При підозрі на рак молочної залози хвора спрямовується до акушера-гінеколога, терапевта, хірурга, онколога, мамолога. Цільовий профогляд проводиться мамологом з метою виявлення захворювання молочної залози. Комплексний профогляд проводиться групою лікарів з метою виявлення різних нозологічних форм онкопатології, у тому числі РМЗ.
Диспансеризація періодичний огляд жінок, яких було взято на облік мамологом у зв’язку з високим ризиком розвитку РМЗ, а також тих, що пройшли лікування з приводу доброякісних та злоякісних новоутворень молочної залози.
Діагностика РМЗ
Індивідуальний профогляд проводиться середнім медпрацівником долікарського кабінету, фельшерськоакушерського пункту. Мета виявлення візуальної форми раку. У разі виникнення підозри на захворювання раком молочної залози хвора спрямовується до акушера-гінеколога, терапевта, хірурга, мамолога.
Цільовий профогляд проводиться мамологом з метою виявлення захворювання молочної залози.
Комплексний профогляд проводиться групою лікарів з метою виявлення різних нозологічних форм онкопатології, у тому числі РМЗ.
Диспансеризація періодичний огляд жінок, яких було взято на облік мамологом у зв’язку з високим ризиком розвитку РМЗ, а також тих жінок, які пройшли лікування з приводу доброякісних та злоякісних новоутворень молочної залози.
Профілактичний огляд активне виявлення хвороби молочної залози з обов’язковою участю медпрацівника.
Первинна діагностика клінічних форм РМЗ під час уважного та ретельного трактування виявлених змін дозволяє у більшості пацієнток з поширеними формами захворювання поставити правильний діагноз. Але, у разі початкових форм хвороби клінічна оцінка характеру патологічного процесу в молочній залозі буває складною. У цьому випадку на допомогу лікарю приходять інструментальні та лабораторні методи дослідження.
Після збору анамнестичних даних стосовно факторів ризику формуються групи пацієнток, які підлягають направленню на мамографію. У випадках наявності трьох і більше факторів пацієнтку слід обов’язково направити на мамографію.
Мамографія є одним з провідних та ефективних методів ранньої діагностики патології молочної залози, діагностики різних форм РМЗ. Цей метод дозволяє виявити вогнище пухлини розміром від 0,3 см., а також диференціювати злоякісні та доброякісні новоутворення. Особливої актуальності мамографія набуває за умови використання стереотаксичних приставок, що дозволяють виконувати пункційну біопсію у випадку пухлин in situ, коли всі інші методи не можуть виявити патології та уточнити природу змін у молочній залозі.
Кров’янисті та серозні виділення з соска є абсолютним показанням до дуктографії, можливості якої дозволяють виявити пристінкові розростання в протоках (рак чи папіломатоз), уточнити локалізацію вогнища, оцінити розповсюдженість процесу. Найбільш сучасне дослідження стану молочних проток ендоскопічне, дозволяє виявити вузли розміром до 0,1 мм.
Мета усіх мамографічних досліджень полягає у тому, щоб сприяти виявленню «прихованого» раку молочної залози, але на відміну від скринінгової мамографії, мамографічне дослідження молочної залози для вирішення особливих проблем (діагностична мамографія та допоміжні процедури) спрямованана на забезпечення спеціального аналітичного дослідження пацієнток з відхиленнями від норми, яких було виявлено клінічно або під час скринінгу. Діагностичне дослідження молочної залози повинно привести лікаря до кінцевого висновку про клінічні знахідки, до верифікації діагнозу, що дозволяє надати спеціальні рекомендації для її лікування.
Зазвичай, дослідження обмежуються кутовими проекціями краніокаудальної та медіолатеральної ділянки кожної молочної залози. Іноді для оптимальної візуалізації тканини молочної залози бувають необхідні додаткові проекції, але їх не потрібно виконувати рутинно. Там, де є підозра на патологію, можна пропонувати подальші візуалізаційні дослідження, діагностичну мамографію чи біопсію.
Середню дозу випромінення для мамографії слід вимірювати щорічно. Для дослідження зморщеної молочної залози, що складається на 50% із залозистої тканини, а на 50% з жирової, доза не буде перебільшувати 0,3 рад на експозицію при мамологічному дослідженні з отриманням знімку і не більше 0,4 рад на експозицію при ксерорадіографії.
Пропонується проводити щорічну скринінгову мамографію пацієнткам у віці 50 років і більше, а у віці 40-50 років 1 раз на 2 роки. Відомо, що періодичні проведення скринінгового мамологічного обстеження жінкам, котрі не мають скарг, знижують рівень смертності від РМЗ. Скринінгова мамографія є внеском радіологів до повного обсягу надання медичної допомоги пацієнтам.
Для якісної роботи рентгенологів необхідно складати графіки проведення контролю і сервісного обслуговування обладнання, стандартів якості зображення, проведення стандартних процедур для оцінки зображення, ретельне ведення документації та періодичний перегляд даних про результати роботи мамологічних кабінетів.
Результати наукових досліджень підтверджують доцільність щорічного проведення мамографії жінкам віком від 50 до 74 років. Проведення рутинного мамографічного обстеження жінок, які не досягли 40 років, не має високої результативності.
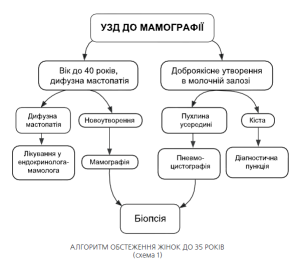
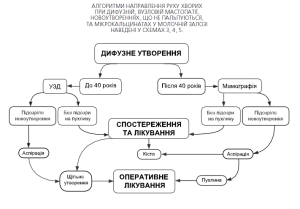
У жінок молодого віку (до 40 років) проведення мамографічних обстежень може бути замінено сонографічним дослідженням Якщо при УЗД молочних залоз лікар не бачить будь-яких вузлових новоутворень, пацієнтка направляється до лікаря ендокринолога-мамолога (при наявності дифузної мастопатії) або рекомендуються контрольні УЗД обстеження 1 раз на рік (за відсутності патології у молочних залозах. Алгоритм направлення хворих при цьому показано на схемі 1.
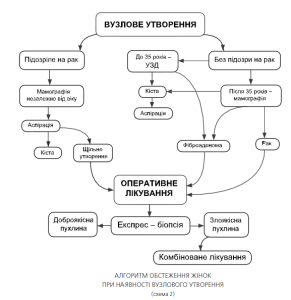
При виявленні вузлових новоутворень (фіброаденома, кіста і т.п.) пацієнтка повинна бути досліджена за допомогою мамографічного або пневмоцистографічного дослідження (схема 2). При виявленні фіброаденоми — рекомендоване хірургічне втручання з гістологічним дослідженням, при наявності кісти пункційна аспірація з цитологічним дослідженням ексудату, при підозрі на проліферативні або малігнізаційні процеси необхідне хірургічне втручання з гістологічним дослідженням.
Якщо кіста тільки пунктується, пацієнтку слід вторинно оглянути через 6 тижнів для того, щоб дізнатися чи немає рецидиву кісти. Якщо кіста після аспірації швидко рецидивує, пацієнтку слід направити на операцію.
При підозрі на малігнізацію новоутворення необхідна термінова секторальна резекція молочної залози з гістологічним дослідженням (операція повинна виконуватися в умовах онкологічного диспансеру або онкологічного інституту). У разі підтвердження діагнозу рак молочної залози одноразово необхідно провести радикальну операцію з наступним комбінованим лікуванням.
Якщо під час сонографічного (до 40 років) або мамографічноого (після 40 років) дослідження у хворої діагностовано дифузні новоутворення (схема 3) у молочній залозі, лікування та спостереження здійснюють за амбулаторних умов.
Пацієнтку з солідним дискретним пухлинним новоутворенням слід спрямовувати до хірурга навіть, якщо результат мамографії негативний. Хірургічна біопсія є обов’язковою при солідному, домінуючому та персистуючому пухлинному процесі.
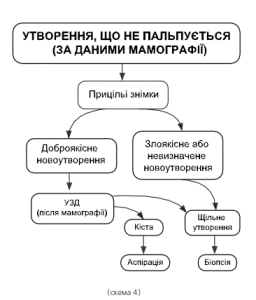
При новоутворенні, що не пальпується (дивись алгоритми в схемі 4, 5), але виявлене на мамографії, слід знову зробити прицільні знімки.
Якщо результат «вірогідно доброякісна» слід перевести хвору під амбулаторний нагляд та візуальні огляди 1 раз у 3 місяці. При необхідності слід провести пункційну біопсію під контролем УЗД. Рішення про те, який тип біопсії кращий для кожного патологічного утворення, що не пальпується, але виявлене при мамографії або УЗД, може бути прийнято інколи з урахуванням думки пацієнтки. Пропонується проведення або стереотаксичної біопсії під контролем УЗД, або стереотаксичної пункційної біопсії товстою голкою великого діаметру з видаленням стовбчика тканини (трепан-біопсія), або відкритої хірургічної біопсії під час секторальної резекції молочної залози.
При одержанні висновку після біопсії, яка підтверджує доброякісний процес, пацієнтка спостерігається і лікується амбулаторно, при відповіді «злоякісний процес» необхідно комбіноване лікування.
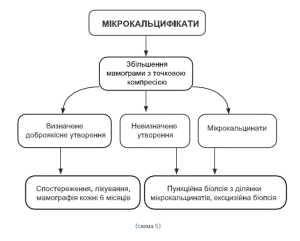
При виявленні на мамографічних знімках мікрокальцинатів або макрокальцинатів (див. алгоритм схеми 5), обов’язковим є проведення прицільної мамограми із збільшенням та компресією. Якщо при збільшенні процес розцінюється як доброякісний, необхідний рентгенконтроль через місяць для з’ясування тактики подальшого лікування. Якщо картина залишається суперечливою, слід обов’язково проводити секторальну резекцію з терміновим гістологічним дослідженням, а подальше лікування в залежності від гістологічного висновку. Усі вузлові форми дисгормональних гіперплазій підлягають хірургічному лікуванню з терміновим гістологічним дослідженням.
При виявленні онкопатології лікування повинно проводити у лікувально-діагностичних мамологічних центрах на базі онкодиспансерів або в Національному
інституті раку, оскільки лікування онкохворих у загальнолікувальній мережі погіршує прогноз у 3 рази.
У жінок, молодших за 35 років, під час скринінгу частіше застосовується УЗД молочних залоз. Комплексне УЗД в сучасній онкологічній практиці належить до основних методів скринінгової діагностики. Інформативність, нешкідливість, можливість багаторазового застосування визначають домінування даного методу в скринінговій променевій діагностиці. У мамології цей метод є незамінним за потреби дослідження рентгенологічно-щільних молочних залоз у молодих жінок, під час диференційної діагностики кістозних і солідних утворень, для вивчення структури та васкулярізації внутрішньопорожнинних вегетацій, виявлення ступеня розповсюдження процесу на лімфатичні вузли; при локалізації пухлинного вогнища в недоступних для рентгенівської мамографії ділянках молочної залози. Слід зазначити, що після операції в 6-9% випадків виникає рецидив захворювання, а більшість пухлинних вузлів при цьому локалізовані біля операційної зони, моніторинг якої також є пріоритетом комплексного УЗД.
На сучасному етапі перспективним і високоінформативним методом діагностики новоутворень в молочних залозах є магнітно-резонансна томографія.
Актуальним методом сучасної діагностики є виявлення та візуалізація сторожових (сигнальних) лімфатичних вузлів. Вважається, що перші реґіонарні лімфатичні вузли, що відводять лімфу від з первинної пухлини, є першими вузлами, які отримують обсіменіння лімфогенними метастатичними клітинами. Виявлення сторожових лімфатичніх вузлів характеризується високою точністю при РМЗ. Існують різноманітні прилади, за допомогою яких визначають сторожові лімфатичні вузли, чимало радіофармпрепаратів, барвників, що застосовуються для ін’єкцій. Перевагу надають радіоколоїдам із розміром часток між 50 і 200 нм.
Одне з важливих місць займає імуноферментна діагностика виявлення пухлинних маркерів, зміна концентрації яких залежить від виникнення росту злоякісної пухлини у хворої на РМЗ. До них належать білки групи СА (carbohydrate antigen): СА-15-3, раково-ембриональний антиген (РЕА), муциноподібний раково-асоційований антиген (МРА) та ін.
Завершальним етапом діагностики РМЗ є цитологічне та гістологічне (морфологічне) дослідження. Морфологічна верифікація необхідна за будь-якої підозри на злоякісний процес у молочній залозі. Найбільш інформативним на сьогодні є виконання трепан-біопсїї пухлинного утворення. Біологічні фактори мають важливе прогностичне значення та дозволяють прогнозувати відповідь на лікування. До біологічних факторів належать вік або стан репродуктивної функції, кількість уражених реґіонарних лімфатичних вузлів, стан рецепторів естрогенів (РЕ), та рецепторів прогестерону (РП), частка проліферуючих ракових клітин і експресія Her2/neu. На сучасному етапі велике значення має імуногістохімічна діагностика, в основі якої лежить визначення експресії низки генів, властивих тільки епітеліальним клітинам. При РМЗ практичне значення має визначення РЕ, РП, Нег2/пеи р53, BRCA-1, BRCA-2. Цей метод дозволяє прогнозувати перебіг захворювання й обґрунтувати доцільність застосування протипухлинного лікування. Наявність РЕ та РП у клітинах РМЗ важливе для ефективного застосування гормонотерапії, а онкобілка Нег2/пеи для прогнозування перебігу пухлинного процесу та адекватного призначення поліхіміота таргетної терапії. Онкобілок Нег2/пеи є глікопротеїном, за структурою подібним до рецепторів епідермального фактору росту, частота його виявлення за внутрішньопротокового гістотипу РМЗ становить 90%. Ген, що кодує онкобілок, локалізується в 17-хромосомі. Іноді його експресію виявляють у не пухлинній тканині молочної залози. У 20-30% усіх випадків РМЗ відзначають підвищену порівняно з пухлинною тканиною експресію білка Нег2/пеи у злоякісних клітинах.
Експресія Her2/neu має велике значення для вибору схеми хіміотерапії (ХТ). Встановлено, що за наявності в клітинах рецепторів стероїдниї гормонів та відсутності гіперекспресії Her2/neu, незалежно від розміру пухлини та стану лімфатичних вузлів перебіг РМЗ більш сприятливий, а за відсутності рецепторів стероїдних гормонів і наявності гіперекспресії Her2/neu більш агресивний (дивись схему стандартного обстеження хворих з підоз-рою на РМЗ).
Головним критерієм ефективності лікування хворих на РМЗ є вплив на показники виживання пацієнток. На сучасному етапі вибір методу лікування визначається стадією пухлинного процесу, клінічною формою РМЗ, віком і загальним станом хворих, гістологічною структурою пухлини, ступенем злоякісності, рівнем рецепторів стероїдних гормонів (РЕ і РП), експресії Her2/neu.
Найбільш перспективним у пацієнток на РМЗ вважається комплексний підхід, який включає оперативне втручання та консервативні методи протипухлинного спеціального лікування.
Діагноз РМЗ ґрунтується на пальпації грудних залоз, двобічній мамографії та УЗД. Морфологічна діагностика методом тонкоголкової аспірації або стовпчикової біопсії повинна проводитися до будь-яких хірургічних маніпуляцій.
Таким чином, діагностика РМЗ повинна базуватися на всесторонній і повній оцінці всіх клінічних, лабораторних, інструментальних і морфологічних даних, що дає змогу вибрати адекватну лікувальну тактику та максимально покращити безпосередні та віддалені результати терапії.
Нижче приведено класифікація РМЗ (останнє 6-те видання)
ТNM КЛІНІЧНА КЛАСИФІКАЦІЯ (UICC та AJCC, 2002 рік)
Т – Первинна пухлина
ТХ – Не досить даних для оцінки первинної пухлини
Т0 – Первинна пухлина не визначається
Тis – Carcinoma in situ
Тis (DCIS) – Carcinoma in situ в протоках
Тis (LCIS) – Carcinoma in situ або сателітними вузлами в шкірі тієї ж залози
Тis (Paget’s) – Хвороба Педжета соска без ознак пухлини
Примітка: Якщо при хворобі Педжета визначається пухлина, то вона класифікується згідно з її розмірами.
Т1 – Пухлина до 2 см. у найбільшому вимірі
Т1mic – Мікроінвазія не більше 0,1 см. у найбільшому вимірі
Т1а – Понад 0,1 см., але не більше 0,5 см. у найбільшому вимірі
Т1b – Понад 0,5 см., але не більше 1 см. у найбільшому вимірі
Т1с – Понад 1см., але не більше 2 см. у найбільшому вимірі
Т2 – Пухлина не більше 5 см. у найбільшому вимірі
Т3 – Пухлина понад 5 см. у найбільшому вимірі
Т4 – Пухлина будь-яких розмірів з прямим поширенням на грудну стінку або шкіру
Т4а – З поширенням на грудну стінку
Т4b – З набряком (включаюси симптом «лимонної шкірки») або виразкуванням шкіри грудної залози або сателітними вузлами в шкірі тієї ж залози
Т4с – Критерії 4а та 4b разом
Т4d – Запальна форма раку N-Регіонарні лімфатичні вузли
Регіонарними лімфовузлами є:
Пахвові (гомолатеральні): межпекторальні лімфатичні вузли (Роттера) та лімфатичні вузли, розміщені вздовж пахвової вени та її гілок. Вони поділяються на три рівні:
Рівень І лімфатичні вузли, розміщені латерально від зовнішнього краю малого грудного м’яза;
Рівень ІІ лімфатичні вузли між зовнішнім і внутрішніми краями малого грудного м’яза, а також межпекторальні лімфатичні вузли (Роттера);
Рівень ІІІ лімфатичні вузли, розміщені медіально від внутрішнього краю малого грудного м’яза, включно з підключичними і верхівковими (апікальними) лімфатичними вузлами.
Внутрішні грудні (гомолатеральні): лімфатичні вузли, розміщені в міжреберних проміжках вздовж краю грудини у внутрішньогрудній фасції.
Надключичні: лімфатичні вузли у надключичній ямці, яка є трикутником між лопатково-під’язиковим м’язом і сухожиллям (латеральна і верхня межа), внутрішньою яремною веною (медіальна межа) і ключицею з підключичиною веною (нижня межа). Лімфатичні вузли поза цим трикутником вважаються нижніми шийними вузлами (М1).
NХ – Недостатньо даних для оцінки стану реґіонарних лімфовузлів (наприклад, вони попередньо вже видалені)
N0 – Немає ознак метастатичного ураження регіонарних лімфатичних вузлів
N1 – Метастаз(и) у рухомих пахвових лімфатичних вузлах на стороні ураження
N2 – Метастази у пахвових лімфатичних вузлах з боку ураження, фіксовані поміж собою чи з навколишніми структурами, або в клінічно видимих* гомолатеральних внутрішньогрудних вузлах за відсутності клінічно доведених метастазів у пахвових лімфатичних вузлах
N2а – Метастази у пахвових лімфатичних вузлах з боку ураження, фіксовані поміж собою або з навколишніми структурами
N2b – Метастази в клінічно видимі* гомолатеральні внутрішні грудні вузли за відсутності клінічно доведених метастазів у пахвових лімфатичних вузлах
N3 – Метастаз(и) в гомолатеральний лімфатичний вузол (вузли) із ураженням пахвових лімфатичніх вузлів або без нього, або клінічно видимі* гомолатеральні внутрішні грудні вузли при клінічно доведених метастазах у пахвових лімфовузлах; або метастаз(и) із ураженням пахвових лімфатичних вузлів або без нього N3a Метастаз(и) в підключичний гомолатеральний лімфатичний вузол (вузли)
Nb – Метастаз(и) у гомолатеральний внутрішній грудний вузол (вузли)
N3c – Метастаз(и) у гомолатеральний надключичний вузол (вузли)
*Клінічна видимість передбачає визначення за допомогою методів візуалізації (за винятком лімфосцинтіграфії) або при клінічному огляді чи крупні утвори при гістологічному дослідженні.
М – Віддалені метастази
Мх – Не досить даних для визначення віддалених метастазів
М0 – Віддалені метастази не визначаються
М1 – Виявляються віддалені метастази
рТNM Патоморфологічна класифікація
рТ – Первинна пухлина
Патоморфологічна класифікація вимагає дослідження первинної пухлини, по межі проведеної резекції не повинно бути пухлинної тканини. Якщо по межі виявляється лише мікроскопічне поширення пухлинної тканини, то випадок може класифікуватися як рТ.
Категорії рТ відповідають категоріям Т.
Примітка: При класифікації рТ розмір пухлини оцінюється за інвазивним компонентом що є великий компонент in situ (наприклад 4 см.) і малий інвазивний компонент (наприклад, 0,5 см.), то пухлина кодується як рТ1а.
РN – Регіонарні лімфатичні вузли
Патоморфологічна класифікація вимагає резекції та дослідження принаймні нижних аксилярних лімфатичних вузлів (рівень І). В такому випадку резекційний матеріал включає звичайно не менше 6 лімфатичних вузлів.
PNX – Не досить даних для оцінки стану реґіонарних лімфовузлів (не видалені для дослідження або видалені раніше).
PNO – Відсутні метастази в реґіонарних лімфовузлах, додаткові обстеження на наявність окремих клітин пухлини* не проводилися.
Примітка: *Окремі клітини пухлини (ITC) це і поодинокі клітини пухлини, і малі групи розміром не більше 0,2 мм, які звичайно виявляються лише імуногістохімічними або молекулярними методами, хоча можуть виявлятися і при звичайному забарвленні. Окремі клітини пухлини зазвичай не характеризуються злоякісною активністю (наприклад, проліферативною чи стромальною реакцією).
pNO(i-) – Відстуні метастази в реґіонарних лімфовузлах при звичайному гістологічному дослідженні, негативні дані імуногістохімії
pNO(i+) – Відстуні метастази в реґіонарних лімфовузлах при звичайному гістологічному дослідженні, позитивні дані імуногістохімії відсутні регіонарні mts у л/в гістологічно, але позитивна 1НС, за відсутності групи, більша, ніж 0,2 мм.
PNO(mol-) – Відсутні регіонарні mts у л/в гістологічно, негативні і молекулярні дослідження (RT-PCR)b.
PNO(mol+) – Відсутні регіонарні mts у л/в гістологічно, але позитивні молекулярні дані (RT-PCR)b.
Примітка: (RT-PCR)b зворотна обратная транскриптазополімеразна ланцюгова реакція.
PN1 наявні mts в 1-3 підпахвові л/в та/або/ у внутрішні маммарні л/в під час мікроскопічного дослідження видаленого сентинельного л/в, але немає клінічно явних.**
** Визначаються як неустановлені на знімках (виключаючи лімфосцинтіграфію) або клінічним оглядом.
pN1mi – мікрометастази більше, ніж 0,2 мм,, але не більше, ніж 2 мм.
pN1a – наявність mts в 1-3 аксилярних л/в. pN1b mts у внутрішніх маммарних л/в, що визначаються під мікроскопом у віддаленому сторожовому л/в, але відсутні клінічно явні.**
pN1c – наявність mts в 1-3 аксилярних л/в та, одночасно, у внутрішніх маммарних л/в під час дослідження під мікроскопом віддаленого сентинельного л/в, але відсутні клінічно наявні.** (Якщо пов’язано з більш ніж 3-ма позитивними аксилярними л/в внутрішні маммарні класифікуються як pN3b, що відображають наростання пухлинного процесу).
pN2 – наявність mts у 4-9 аксилярних л/в; або за наявності клінічно виразних** внутрішніх маммарних л/в за відсутності mts в аксилярних л/в.
pN2a – наявність mts у 4-9 аксилярних л/в (не менше одного пухлинного вогнища більше 2,0 мм.).
pN2b – наявність mts, клінічно виразних,** у внутрішніх маммарних л/в за відсутності mts в аксилярних л/в.
pN3 – наявність mts в 10 та більше аксилярних л/в, або в підключичних л/в, або за клінічно виразних іпсілатеральних внутрішньомаммарних л/в за наявності 1 чи більше позитивних аксилярних л/в, або більш ніж у 3 аксилярних л/в з клінічно негативними, але такими, що визначаються під мікроскопом, mts у внутрішні маммарні л/в, або в іпсілатеральні надключичні л/в .
pN3a – наявність mts в 10 та більше аксилярних л/в (не менше одного пухлинного вогнища більше ніж 2 мм. в л/в ), або mts в подключичні л/в .
pN3b – наявність mts в клінічно виражених іпсілатеральних внутрішніх маммарних л/в за наявності 1 чи більше позитивних аксилярни л/в; або більш ніж у 3 аксилярних л/в та у внутрішніх маммарних л/в з видимим під мікроскопом mts у віддаленому сентинельному л/в, але за відсутності клінічно виражених.
pN3c – наявність mts в іпсілатеральних надключичних л/в.
G – Гістопатологічна градація
GХ – Ступінь диференціації не може бути визначений
G1 – Високій ступінь диференціації
G2 – Середній ступінь диференціації
G3 – Низький ступінь диференціації
G4 – Недиференційована пухлина
ГРУПУВАННЯ ЗА СТАДІЯМИ
СТАДІЯ О | TIS | NO | MO |
СТАДІЯ І | TI | NO | MO |
СТАДІЯ ІІА | T0 | N1 | MO |
T1 | N1 | MO | |
T2 | N0 | MO | |
СТАДИЯ ІІВ | T2 | N1 | MO |
T3 | N0 | MO | |
СТАДИЯ ІІІА | T0 | N2 | MO |
T1 | N2 | MO | |
T2 | N2 | MO | |
T3 | N1, N2 | MO | |
СТАДІЯ ІІІВ | T4 | N0, N1, N2 | MO |
СТАДІЯ ІІІС | Будь яке Т | N3 | MO |
СТАДІЯ IV | Будь яке Т | Будь яке N | M1 |
Для лікування РМЗ застосовують усі відомі в клінічній онкології методи, а саме: хірургічний, який досі залишається основним; хіміотерапію з різними режимами і шляхами введення хіміопрепаратів (внутрішньовенний, внутрішньопорожнинний, внутрішньолімфатичний, внутрішньоартеріальний та пероральний), променеву терапію із застосуванням різних режимів опромінення; гормонотерапію в неоад’ювантному та ад’ювантному режимах та імунотерапію.
Зміни, що відбулися в нашому розумінні проблеми
РМЗ на рубежі сторіч, були підсумовані в промові и. Veronesi (січень 2005 р.) на 9-й Міжнародній конференції в Сан-Галлені, а саме:
— розширені операції прогресивно поступаються місцем органозберігаючим;
— видалення регіонарних лімфатичних вузлів поступово обмежується кількістю уражених;
— скорочуються обсяг і тривалість ПТ;
— планування системного лікування рекомендується здійснювати з урахуванням факторів прогнозу й чутливості до ХТ та гормонотерапії;
— на перший план виходять індивідуалізація протипухлинного лікування та підвищення якості життя.
План комплексного лікування повинен визначати консиліум спеціалістів різного профілю, щоб об’єднати місцеве та системне лікування і визначити їх послідовність.
ХІРУРГІЧНЕ ЛІКУВАННЯ
Хірургічний метод є одним з основних методів, що застосовуються в лікуванні хворих на РМЗ. На початкових стадіях процесу хірургічне втручання залишається основним і найбільш ефективним. Відмінною рисою сучасних лікувальних заходів для пацієнток на РМЗ є більш широке використання органозберігаючих та відновлюючих операцій особливо у хворих з ранніми стадіями та репродуктивного віку. Протипоказами до органозберігаючих втручань є мультицентричність пухлини, великі її розміри (понад 3-4 см.), ураження пухлиною країв резекції.
Класична радикальна мастектомія не завжди виправдана через біологічні властивості пухлини, а видалення усієї залози з реґіонарними лімфатичними вузлами може порушити систему протипухлинного імунітету і навіть стимулювати метастазування. В останні роки у зв’язку з впровадженням органозберігаючих та відновлюючих операцій вимоги до хірургічного втручання ще більше підвищилися. Операції проводяться з мінімальною травматизацією тканин при дотриманні всіх принципів радикальності.
У більшості закордонних клінік застосування органозберігаючих методів названо «консервативним лікуванням», тому що основний акцент робиться на методи консервативної терапії в післяопераційному періоді. На початку запровадження методів «консервативного лікування» РМЗ обсяг операцій обмежувався тільки секторальною резекцією, потім збільшився до квадрант-ектомії молочної залози з видаленням реґіонарного лімфоколектора. Але термін «консервативне лікування» зберігся і навіть утвердився для всіх варіантів органозберігаючого лікування.
Сучасні дослідження в галузі хірургії РМЗ присвячені питанням зменшення обсягу оперативного втручання з дотриманням радикальності з метою мінімізації його інвалідизуючого впливу при досягненні локального контролю над захворюванням. Використання методів комбінованого лікування, спрямованих на збереження органу, забезпечує психологічну, косметичну та соціальну перевагу, скорочує кількість ліжкоднів, підвищує якість життя оперованих, знижує показники інвалідності та збільшує число працездатних осіб, яким виконали радикальну операцію. Все це має велике соціально-економічне значення для України.
ХІМІОТЕРАПІЯ
Нині нараховується більше 30 різних схем ХТ, які грунтуються на органотропності препаратів та індивідуальній чутливості пухлин до лікування. За неможливості визначення індивідуальної чутливості пухлин у схеми ХТ включають препарати, які діють на різні фази клітинного циклу. Головною причиною неефективності лікування (відсутність істотних змін у підвищенні виживання хворих) вважається резистентність новоутворення до протипухлинних препаратів. Отже, підвищення ефективності ХТ полягає як у подоланні множинної лікарської резистентності, так і в підвищенні чутливості клітин пухлини до протипухлинних препаратів.
При застосуванні хіміопрепаратів потрібно виключити можливість розвитку резистентності до цитостатиків, тому що таке лікування становить небезпеку з позицій ймовірності пригнічення протипухлинної резистентності організму, стимуляції росту стійких клонів і швидкого розвитку віддалених метастазів. Отже, можливість визначення чутливості до цитостатиків, вибору завдяки цьому оптимальної схеми ХТ є одним із головних шляхів підвищення ефективності протипухлинного лікування.
В Україні місцево поширені форми РМЗ діагностуються більш ніж у 30% вперше виявлених хворих. Тому на сучасному етапі велике значення мають неоад’ювантні методи лікування різні окремі або комбіновані терапевтичні впливи на пухлинний процес в передопераційному періоді.
Особливого поширення при лікуванні РМЗ в останні часи набула неоад’ювантна поліхіміотерапія, що дозволяє розширити показання до виконання органозберігаючих операцій. Беручи до уваги системний характер РМЗ, більшість онкологів вважають ХТ пріоритетною серед інших методів неоад’ювантного лікування. За умови її застосування можна досягти максимальної девіталізації пухлини, що дозволяє знизити проліферативний потенціал ракових клітин, підвищити абластику хірургічних втручань, знизити ризик розвитку рецидивів та метастазування. Потенційними перевагами неоад’ювантної поліхіміотерапії вважають зменшення біологічної активності пухлинних клітин як у пухлинному осередку, так і у віддалених мікрометастазах, створення сприятливих умов для проведення операції, зниження вірогідності генералізації РМЗ, можливість визначення чутливості пухлини. Сучасний стандарт лікування РМЗ полягає у застосуванні 3-6 курсів неоад’ювантної ХТ.
Оптимізація цитотоксичної терапії при РМЗ є одним із найперспективніших напрямів покращання результатів лікування. Розробки у цій галузі дають можливість потенціювати ефективність ХТ за рахунок, поперше, створення нових препаратів; по-друге, удосконалення методів транспорту ліків до пухлини; по-третє, застосування високодозових багатокомпонентних режимів; по-четверте, використання модифікаторів ХТ та, по-п’яте, призначення індивідуалізованих хіміотерапевтичних режимів.
Недостатній терапевтичний ефект при системному введенні хіміопрепаратів, ураження не тільки пухлинної, а й здорових тканин, висока токсичність ХТ при внутрішньовенному введенні зумовили необхідність використання методів регіонарної ХТ. Проведення внутрішньоартеріальної ХТ шляхом селективної катетеризації судин, які живлять новоутворення та його регіонарні метастази, часто має значні переваги перед системною ХТ. При застосуванні ангіографічних методів для підведення хіміопрепаратів безпосередньо до пухлини ефективність внутрішньоартеріального введення підвищується.
Актуальним на сьогодні є і метод ад’ювантної системної поліхіміотерапії. Вихід пухлинних клітин унаслідок хірургічного втручання у циркулюючу кров вважається одним із найважливіших факторів, здатних погіршити результати лікування РМЗ, та зумовлює застосування методів знищення гематогенних мікрометастазів. Теорія мінімальної післяопераційної залишкової хвороби передбачає збереження в організмі пацієнта після видалення основного новоутворення злоякісних клітин, які не визначаються клінічними й інструментальними методами і можуть бути причиною подальшого формування метастазів. Застосування ад’ювантної системної терапії найчастіше забезпечує відстрочку (іноді багаторічну) прогресування захворювання.
ГОРМОНОТЕРАПІЯ
Гормонотерапія також займає одне з центральних місць у комплексному лікуванні РМЗ. Захворюваність жінок на РМЗ зростає з 40-річного віку і знижується після 70 років. Указаний період збігається з гормональними змінами, які відбуваються в організмі жінки. У численних експериментальних та клінічних дослідженнях доведено, що порушення обміну та балансу естрогенів може призводити до розвитку РМЗ. Сьогодні естрогени вважають головними чинниками в онкогенезі пухлин молочної залози. Більшість злоякісних новоутворень для підтримки свого росту потребують естрогенів і за їх відсутності гинуть. Завданням гормонотерапії є зниження продукції естрогенів або нормалізація її балансу та блокування їх впливу на клітини пухлини. У менопаузі основним джерелом естрогенного синтезу стають жирова клітковина, м’язи, шкіра. Біосинтез естрогенів відбувається шляхом конверсії андрогенів в естрогени за допомогою ферменту ароматази. На сучасному етапі при лікуванні РМЗ чітко виділились два головні напрями гормонотерапії. Перший в репродуктивному віці застосування андрогенів або агоністів й антагоністів рилізинг-фактора лютеїнізуючого гормону, які знижують методом зворотного зв’язку синтез статевих гормонів та пролактину. Другий в менопаузі — застосування інгібіторів ароматази і таким чином зниження залишкових естрогенів.
Треба зазначити, що лікування гормонами ніколи не мало статусу монотерапії, при операбельних формах РМЗ воно отримало загальне визнання лише як складова комплексної терапії. Основним критерієм для призначення гормонального лікування хворим на РМЗ є експресія на поверхні пухлинних клітин рецепторів до естрогенів та прогестерону. Дослідження ефективності гормонотерапії засвідчило, що пухлини, клітини яких експресують гормональні рецептори, виявляють чутливість до неї в 65-70% випадків. Вважається, що якщо в новоутворенні виявлено більше ніж 10% клітин, що експресують рецептори гормонів, то його варто вважати гормоночутливим. Однак близько 20% пухлин молочної залози, незважаючи на наявність гормональних рецепторів, є нечутливими до дії гормонів, і, навпаки, у 15% випадків за відсутності гормональних рецепторів спостерігається позитивний ефект гормонотерапії.
ІМУНОТЕРАПІЯ
Важливою причиною незадовільних результатів лікування хворих на РМЗ є істотні порушення функціонального стану імунної системи, в основі яких лежать поширеність пухлинного процесу та застосування агресивних методів терапії. Вже досить тривалий час увагу дослідників привертає перспектива використання у хворих на РМЗ імунотерапії. Її метою є імунореабілітація хворих під час та після протипухлинного лікування, а також пригнічення росту чи знищення залишкових злоякісних клітин шляхом активації системи природного протипухлинного імунітету.
Останнім часом інтерес до протипухлинних вакцин у лікуванні онкологічних захворювань знову підвищився. В останніх експериментальних дослідженнях отримано позитивні результати застосування вакцинотерапії при деяких злоякісних новоутвореннях. Поряд із розробкою новітніх вакцин за допомогою сучасних методів генної та клітинної інженерії (пептидних протипухлинних вакцин та вакцин на основі амінокислотних послідовностей) важливим напрямом досліджень вважається створення гомота аутовакцин на основі пухлинних клітин, які теоретично містять увесь спектр антигенів, притаманних для конкретного новоутворення. За результатами клінічних випробувань висловлюється думка, що саме такі вакцини є найбільш адекватні для індивідуалізованої імунотерапії.
АНТИАНГІОГЕННА ТЕРАПІЯ
У проліферації та метастазуванні раку важливу роль відіграє ангіогенез. Це процес, який регулюється дією прота антиангіогенних факторів або сигналів. В умовах патології, таких як продукування пухлиною проангіогенних факторів росту, ангіогенез обумовлює формування судинної сітки, яка дозволяє новоутворенню збільшуватися. Отримавши доступ до життєво необхідного їм кисню та поживних речовин, пухлини отримають можливість рости за межі їх первинних розмірів та сприятливі умови до метастазування. За відсутності кровопостачання новоутворення отримує кисень та поживні речовини лише шляхом дифузії, при цьому його розміри не можуть перевищити 1-2 мм. в діаметрі. У безсудинних пухлинах темпи клітинного росту дорівнюють темпам їх загибелі, тому новоутворення залишається у «сплячому» стані, доки в ньому не почнеться ріст кровоносних судин із близько розташованих капілярів (ангіогенез). Початок ангіогенезу («ангіогенне переключення») веде до швидкого росту та метастазування пухлини.
Відповідно до теорії природної історії пухлинного росту формування метастазів починається з початком ангіогенезу, тобто після того, як кількість злоякісних клітин перевищить 103, а діаметр пухлини 0,5 см. Строки клінічного прояву метастазів індивідуальні, вони залежать, насамперед, від такого чинника, як час подвоєння об’єму пухлини. Визначено, що і через 10 років після лікування у хворих, які мали новоутворення до 0,5 см. у діаметрі, частота розвитку віддалених метастазів може ста-новити 9%. Встановлено, що регіонарні лімфатичні вузли не є механічним бар’єром для пухлинних клітин, як це вважалося раніше, а лімфогенна й гематогенна дисемінація відбуваються одночасно. На відміну від нормальних судин, кровоносні судини новоутворення мають структурні та функціональні аномалії. Вони не містять перицитів клітин, які функціонально пов’язані з судинним ендотелієм і наявність яких важлива для стабілізації та дозрівання судинних структур. Крім цього, судинна сітка пухлини звивиста та хаотична, а судини мають підвищену проникність, що сприяє росту пухлини.
На сучасному етапі розвитку науки відомо, що ангіогенез це комплекс процесів, які послідовно забезпечуютьвзаємодіюміжклітинамисудин,мітогенами та компонентами екстрацелюлярного матриксу. Незалежно від природи ангіогенезу (ембріональний, запальний, репаративний, пухлинний), неоваскуляризація проходить кілька послідовних стадій: розширення існуючих судин зі збільшенням їх проникності; розрив базальної мембрани; міграція ендотеліальних клітин у периваскулярну тканину строми в напрямку до джерела ангіогенного стимулу (у вигляді паростка, який складається з клітин з послабленими міжклітинними контактами); проліферація ендотеліальних клітин на верхівці паростка; формування судини з утворенням каналу всередині сформованого паростка, синтез нової базальної мембрани, злиття новоутворених судин та започаткування кровотоку.
Неоангіогенез і апоптоз пухлини розглядаються як два найвагоміші маркери прогнозу перебігу захворювання і чутливості до протипухлинної терапії. Неоваскуляризація часто корелює з біологічною агресивністю і злоякісністю новоутворення, вона залежить від кінетичних особливостей пухлини. Найбільша активність ангіогенезу спостерігається під час переход передраку в рак. Кількість судин у пухлині корелює з прогресуванням хвороби: наявністю регіонарних та віддалених метастазів, швидкістю генералізації — чим вища васкуляризація, тим гірший прогноз. Результати проведених досліджень дають підстави планувати протипухлинну терапію з урахуванням факторів васкуляризації злоякісного новоутворення, застосовувати антиангіогенну терапію. Проведені експериментальні та клінічні дослідження останніх років підтвердили значимість антиангіогенної терапії як важливої складової протипухлинного лікування.
Далі наведені схеми стандартного лікуванні РМЗ.
СХЕМИ СТАНДАРТНОГО ЛІКУВАННЯ ХВОРИХ
СПИСОК ЛІТЕРАТУРИ
- Стандарти діагностики і лікування онкологічних хворих .Київ, 2007.-199 с.
- Алгоритмы современной онкологии под ред. И.Б. Щепотина, Г.В. Бондаря, В.Л. Ганула. Киев: «Книга плюс», 2006. 304 с.
- Арсланов Х.С., Ткаченко Г.А. Влияние реконструктивно-пластических операцій на качество жизни больных раком молочной железы в отдаленном периоде //Современная онкология. 2006, Т8. №4. С.76-81.
- Семиглазов В.Ф., Семиглазов В.В., Клетсель А.Е. Неоадьювантное и адьювантное лечение рака молочной железы. Москва: МИА, 2008. 287 с.
- Смоланка І.І., Скляр С.Ю. Лікування первинного раку молочної залози. Сучасні аспекти (посібник). Київ. 2005. 20 с.
- Смоланка І.І., Скляр С.Ю. Шляхи підвищення ефективності комплексного лікування хворих на рак молочної залози. Київ: Сталь, 2007. -192 с.
- Шпарик Я.В. Рак грудної залози: класифікації TNM. Рекомендації ESMO. Режими медикаментозної терапії.— Львів: Галицька видавнича спілка, 2007. 172 с.
- Соколов В.М., Аніщенко Л.В. Рак молочної залози: проблеми діагностики та лікування //Одеський медичний журнал. 2006, Т.93, №1. -С. 95-99.
- Хмелевский Е.В., Харченко В.П. Особенности лучевой терапии гормонозависимого рака молочной железы //Вопросы онкологи. 2003. Т.49, №6. С. 711-715.
- Berg J. Adjuvant chemotherapy for breast cancer «one fits all?»//The Breast. 2005. Vol.14. P.564-569.
- Goldhirsch А., Glick J. H., Gelber R. D., Coates A. S., Thürlimann B., Senn H.-J. and Panel Members//Meeting Highlights: International Expert Consensus on the Primary Therapy of Early Breast Cancer 2005. Annals of Oncology 2005 16(10): 1569-1583.
- Diwanay S., Gautam M., Patwardham B. Cytoprotection and immunomodulation in cancer therapy //Curr. Med. Chem. Anticancer. 2004. Vol. 4, №6. P. 479-490.
- Mauri D., Pavlidis N., loannidis J.P. Neoadjuvant versus adjuvant treatment in breast cancer: metaanalysis //J/Natl.Cancer Inst. 2005. -№97. P. 188-194.
- Schirrmacher T V., Feuerer M., Beckhove P. et al. Cell Memory, Anergy and Immunotherapy in Breast Cancer / // Journal of Mammary Gland Biology and Neoplasia. 2002. Vol.7, № 2. P. 201-207.
- Zitvogel L., Tesniere A., Kroemer G. Cancer despite immunosurveillance: immunoselection and immunosubversion // Nature Rewies. Immunol. 2006. Vol.6. P.715-727.
- Matthew J. Challenges to the development of antigenspecific breast cancer vaccines //Breast Cancer Res. 2001. — Vol.3, №2. — P.95-98.
- Keith L. Immunization of Cancer Patients with a HER-2/neu, HLA-A2 Peptid, p369-377,Results in Shortlived Peptidspecific Immunity //Clinical Cancer Research. 2002. Vol.8.-P.1014-1018.
- Dillman R.O., Wiemann V., Nayak S.K. Interferongamma og granulocytemacrophage colony-stimulation factor administreted as adjuvants with a vaccine of irradiated autilogus tumor cells from short-term cell line culyures: a randomazed phase 2 trial of the cancer biotherapy reseach group //J.Immonother. 2003. Vol.26, №4. P.367-373.
- King S.E. Therapeutic cancer vaccines: an emerging treatment opinion //Clin. J. Oncol. Nurs. 2004. Vol.8, №3. P.271-278.













Комментировать