Ингаляционные антихолинергические лекарственные средства и кардиоваскулярный риск у пациентов с ХОЗЛ (ХОБЛ). Метанализ и его результаты. Обзор литературы.
А.Е. Березин
Запорожский государственный медицинский университет
Введение
Хроническое обструктивное заболевание легких (ХОЗЛ) является достаточно распространенным заболеванием, отличающимся экстенсивным характером роста частоты новых случаев в большинстве развитых странах мира и сопровождающимся достаточно высокой ожидаемой смертностью в популяции, далеко не всегда непосредственно связанной с респираторными причинами (Finkelstein J. et al.,2009; Malerba M., Romanelli G., 2009; Sin D.D., 2009). Так, многочисленные эпи-демиологические, популяционные и клинические исследования не только наглядно демонстрируют высокую ассоциацию ХОЗЛ с традиционными факторами риска манифестации сердечно-сосудистых заболеваний (сахарный диабет, гиперлипидемия, курение, ожирение), но свидетель-ствуют о благоприятном влиянии многих лекарственных средств (например статинов), широко применяемых для редукции кардиоваскулярного риска в угрожаемых популяциях, в отношении улучшения ближайшего и отдаленного прогноза у пациентов с документированным ХОЗЛ (Agabiti N. et al.,2009; Garda RodnguezL.A. et al., 2009; van Dijk W.D. et al., 2009; Wood-Baker R. et al., 2009). С другой стороны, ХОЗЛ способно оказывать негативное влияние на эволюцию коморбидных состояний, наиболее часто регистрируемых у этих пациентов (артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет, сердечная недостаточность, хроническая болезнь почек) (Agabiti N. et al.,2009; Sin D.D., 2009).
Необходимо отметить, что в большинстве стран мира (Украина не является исключением) лица с ХОЗЛ чаще становятся пациентами врачей общей практики, несмотря на достаточно хорошо развитую систему специализированной помощи. Это в какой-то мере является отражением факта преобладания в популяции пациентов лиц с мягкой и умеренной стадией заболевания, которая зачастую не требует серьезного профессионального участия узкопрофильного специалиста. Так изданное консенсуальное соглашение экспертов National Heart, Lung, andBloodInstitute(США) и Всемирной организации здравоохранения, посвященное профилактике и лечению ХОЗЛ, более известное как InitiativeGOLD (GlobalInitiativeforChronicObstructiveLungDisease), в большей мере адресовано решению общих вопросов, возникающих при первом контакте с пациентом, или трудностям, связанным с выбором оптимальной стратегии лечения и профилактике (GlobalInitiativeforChronicObstructiveLungDisease (GOLD), 2009). Подобный подход должен был оптимизировать усилия различных специалистов при верификации диагноза, оценке риска и идентификации ответа на иници-альное лечение. Эти представления повлекли за собой попытки ревизии и последующей модификации исходного документа InitiativeGOLDна основе новых данных доказательной медицины. В на-стоящее время ведущие мировые медицинские ассоциации, такие как AmericanThoracicSociety, EuropeanRespiratorySociety, CanadianThoracicSociety, NationalInstituteforClinicalExcellenceрекомендуют придерживаться общих принципов лечения и профилактики пациентов с ХОЗЛ в соответствии с требованиями InitiativeGOLD (O’DonnellD.E. et al., 2003; American Thoracic Society/European Respiratory Society Task Force, 2004; National CollaboratingCentre forChronic Conditions, 2004; Rabe K.F. et al., 2007).
Так, основными целями терапии больных с ХОЗЛ являются устранение симптомов и предотвращение прогрессирования заболевания, редукция частоты и тяжести обострений, улучшение качества жизни и толерантности к физической нагрузке пациентов, а также снижение вероятности наступления смертельного исхода (Joo M.J. et al.,2009). В идеале эти терапевтические цели должны быть реализованы при полном отсутствии или наличии минимальных негативных побочных эффектов, поскольку большинство пациентов с ХОЗЛ имеют различные коморбидные состояния, вклад которых в выживаемость в настоящее время достаточно четко определен, а их прогрессирование может быть опосредовано не только естественным течением патологического процесса, но и ятрогенным влиянием, в том числе и фармакологическим вмешательством (Christians-en C.F. et al.,2009).
В соответствии с действующим кон-сенсуальным соглашением бронходилататоры (преимущественно ингаляционные агонисты бета 2адренорецепторов (бета2агонисты) и антихолинергические лекарственные средства (АХЛС), а также в некоторой мере и метилксантины) являются основными компонентами терапии больных с документированным ХОЗЛ фактически любой стадии. Короткодействующие бронходилататоры рекомендованы для реверсии симптомов заболевания как дополнительный компонент длительно проводимой терапии пролонгированными средствами. Ингаляционные бронходилататоры (бета2агонисты и АХЛС) рассматриваются как более предпочтительный класс лекарственных средств по сравнению с препаратами, применяемыми внутрь, поскольку демонстрируют более оптимальный профиль эффективности, переносимости и безопасности. Необходимо обратить внимание на тот факт, что действующая в настоящее время последняя редакция Initiative GOLDдополнительно не акцентирует внимание врача на выборе конкретного бронходилататора при назначении инициальной терапии. С позиции сегодняшнего дня более выгодным, с точки зрения достижения адекватного контроля над эволюцией заболевания и реверсии его симптомов, является как можно более раннее применение комбинации бронходилататоров. Чаще всего таковой является использование бета2агонистов и АХЛС. Причем только в когорте больных с тяжелым ХОЗЛ рекомендовано дополнительное применение ингаляционных глюкокортикостероидов (ИГКС) на фоне настойчивой терапии бронходилататорами (Nazir S.A., Erbland M.L., 2009).
Таким образом, достаточно длительный период применения ингаляционных бронходилататоров и большой опыт их клинического использования не оставляли места для каких-либо сомнений в отноше-нии их безопасности применительно к сосуществующим коморбидным состояниям у пациентов с ХОЗЛ.
Тем не менее, интрига, связанная с так называемым неоптимальным профилем безопасности этого класса веществ, возникла в марте 2008 г., когда Управление по контролю за пищевыми продуктами и лекарственными средствами США (U.S. FoodandDrugAdministration/FDA) инициировало широкую дискуссию вокруг появившихся данных о возможном повышении риска возникновения мозгового ишемического инсульта у пациентов с ХОЗЛ, длительно получающих АХЛС. Так называемое раннее предупреждение (earlywarningcommunication)
о возможной опасности применения последних было фактически основано на результатах метаанализа 29 рандомизированных клинических исследований (РКИ), которые продемонстрировали повышение риска возникновения инсульта у пациентов, получавших тиотропия бромид (тиотропий) (8 случаев на 1000 больных) по сравнению с плацебо (6 случаев на 1000 больных) (U.S. FoodandDrugAdministration, 2008). В последующем, в сентябре 2008 г., в журнале Американской медицинской ассоциации JAMAпу-бликуется подробный отчет о доказательствах взаимосвязи между риском кардиоваскулярной смерти и использованием ингаляционных АХЛС (SinghS. et al.,2008). Именно результаты этого метаанализа и явились основанием для сдержанного беспокойства FDA относительно широкого рутинного использования ингаляционных АХЛС и инициировали широкую научную дискуссию вокруг этого вопроса (Hilleman D.E. et al., 2009).
Настоящий обзор посвящен обсужде-нию некоторых вопросов, касающихся доказательств безопасности АХЛС у пациентов с ХОЗЛ.
Длительное применение АХЛС и вероятность возникновения кардиоваскулярной смертности
Метаанализ S. Singhи соавторов (2008) — виновник вышеописанной дискуссии — основан на анализе влияния ингаляционных АХЛК (ипратропия бромида (ипратропия) и тиотропия)на частоту возникновения серьезных кардиоваскулярных событий (инфаркт миокарда, инсульт, кардиоваскулярная смерть) у паци-ентов с ХОЗЛ любой степени тяжести на протяжении более чем 30 сут после назначения. Необходимо отметить, что пациенты с документированной бронхиальной астмой не входили в число лиц, включенных в исследование. В качестве контрольной группы авторы метаанализа считали пациентов, получавших либо плацебо, либо ингаляционные бета2агонисты, в том числе и комбинации на их основе. Исследователи проанализировали результаты и дизайн 103 РКИ, из которых в метаанализ были включены (как соответствующие всем критериям отбора) только 17 испытаний (n=14 783) (12 с тиотропием и 5 — с ипратропием, n=7472). Группу плацебо (9 РКИ) или активного контроля (8 РКИ) составили 7311 пациентов (6 РКИ посвящены ингаляционному салметеролу, 1 РКИ — комбинации салметерол + флути-казон и 1 РКИ — сальбутамолу (albuterol), соответственно). В 5 РКИ продолжительность наблюдения составила от 6 мес до 5 лет, в 12 РКИ период использования ингаляционных АХЛС был более коротким и составлял от 6 нед до 6 мес. Среднее значение объема форсированного выдоха за 1 с (ОФВ1) <50% было зарегистрировано в 16 РКИ и только в 1 РКИ оно превышало 75 %>. Частота отказов от лечения во всех анализируемых испытаниях колебалась между 6 и 42 %>.
Анализ полученных данных показал, что ингаляционные АХЛС способствуют значительному повышению риска возникновения комбинированной конечной точки, включающей кардиоваскулярную смерть, инфаркт миокарда и инсульт (1,8 %> против 1,2 %> в контрольной группе; относительный риск (ОР)=1,58 [95 %> доверительный интервал (ДИ)=1,21-2,06];p<0,001). Кроме того, оказалось, что ингаляционные АХЛС приводят к повышению риска возникновения инфаркта миокарда (1,2 % против 0,8% в контрольной группе; ОР=1,53 [95 % ДИ=1,05-2,23];p=0,03) и кардиоваскулярной смерти (0,9 % против 0,5 % в контрольной группе; ОР=1,80 [95 % ДИ=1,17-2,77];p=0,008). При этом риск развития инсульта (0,5 % против 0,4 % в контрольной группе; ОР=1,46 [95 % ДИ=0,81-2,62];p=0,20) и показатель общей смертности (2,0% против 1,6% в контрольной группе; ОР=1,26 [95 % ДИ=0,99-1,61];p=0,06) существенным образом не изменялся. Необходимо отметить, что чувствительность анализа была ограничена результатами 5 РКИ, в которых отмечалась высокая частота отказов от лечения вследствие реализации побочных эффектов (ОР=1,73; p<0,001). При исключении из последующего анализа результатов указанных РКИ и обобщении данных оставшихся 12 РКИ авторами не было получено каких-либо подтверждений фактам, свидетельствующим о повы-шении риска возникновения кардиоваскулярных событий, инфаркта миокарда или инсульта в когорте больных, получавших ингаляционные АХЛС (ОР=1,16; p=0,60).
После опубликования метаанализ
S. Singhи соавторов (2008) достаточно часто подвергался весьма справедливой критике. Так, по мнению ряда исследователей в приведенном выше исследовании имеется большое количество методологических неточностей, способных существенным образом повлиять на валидность сделанных его авторами выводов (ObaYet al.,2008; HogarthD.K., JacobsonT.A., 2009; Salpeter S.R., 2009). Среди послед-них необходимо отметить тот факт, что S. Singhи соавторы (2008) свободно объединили в одном метаанализе плацебоконтролируемые и активноконтролируемые исследования. Кроме того, в 2 РКИ не было корректно указано общее количество включенных в анализ пациентов и по-бочных эффектов. Данные 1 РКИ были включены в метаанализ дважды, что повлекло за собой удвоение общего количества анализируемых случаев. Авторы пренебрегли существенными различиями в основных причинах прекращения участия пациентов в ряде РКИ. В частности, в некоторых испытаниях, таких как LungHealthStudy (LHS), посвященных ипратропию, большая часть больных прекратили прием АХЛС вследствие низкой комплаентности к исследуемому препарату, а не только в результате возникновения кардиоваскулярных событий. Вместе с тем, в более ранних публикациях, предшествующих вышеотмеченному метаанализу, уже обсуждались причины, явившиеся определяющими для некоторого повышения частоты регистрации большего числа кар-диоваскулярных событий в группе пациентов, отказавшихся от курения, на фоне приема ипратропия (Anthonisen N.R. et al.,2002). Особым нареканиям подвергались методы статистического анализа, не использовавшие логистические корригированные регрессии и не учитывавшие различные виды конечных точек, что повлекло за собой ограничения в выявлении взаимоотношений между дозой препарата и клинической результативностью, а также частотой регистрации побочных эффектов (Hilleman D.E. et al., 2009). Тем не менее, авторы метаанализа сочли возможным принять во внимание тот факт, что в этом исследовании все же был отмечен эффект повышения вероятности возникновения неблагоприятного клинического исхода, связанного с кардиоваску-лярной смертностью, в когорте пациентов, леченных АХЛС ипратропием.
Вместе с тем формально Lung Health Study явилось одним из первых исследований, в котором впервые выявлено повышение частоты неблагоприятных кардиоваскулярных событий на фоне приема АХЛС ипратропия (Hilleman D.E. et al., 2009). Примечательно, что в этом исследовании не было получено достоверных различий между группами больных, которые принимали в нем участие, в отношении показателя смертности и частоты госпита-лизации. Однако частота возникновения смертельных исходов вследствие кардио-васкулярных причин была достоверно выше в когорте пациентов, отказавшихся от курения и получавших АХЛС ипратропий (p=0,027). Кроме того, в этой группе лиц несколько чаще идентифицировались случаи смерти от ишемической болезни сердца, а также отмечалась более высокая частота возникновения комбинированного показателя фатальные + нефатальные случаи ишемической болезни сердца, однако различия между группами пациентов, получавших и не получавших АХЛС, не достигли статистической значимости (p=0,084 и p=0,156).
Отмечен тот факт, что большинство смертей, зарегистрированных в группе пациентов, формально получавших ипратропий, возникали именно у тех лиц, которые, вследствие низкой комплаентности, были вынуждены отказаться от его приема. Исследователи пришли к заключению о том, что, несмотря на верификацию более высокой частоты регистрации случаев ишемической болезни сердца и смерти, связанной с кардиоваскулярными причинами, в этой когорте пациентов, не пред-ставляется возможным подтвердить или опровергнуть существование непосредственной взаимосвязи между фактом приема исследуемого препарата и отмеченными выше твердыми конечными точками. Логичным является проведение специально спланированного исследования, обладающего достаточно высокой статистической мощностью для идентификации причин и механизмов возникновения обсуждаемого феномена.
Очевидно, что РКИ LHS не предоставляло исследователям такой возможности. Вместе с тем при его проведении отмечена более высокая частота госпитализации вследствие манифестации суправентрикулярной тахиаритмии именно в когорте пациентов, отказавшихся от курения и принимавших ипратропий, по сравнению с лицами, в лечении которых использовали плацебо. Представления о том, что повышение частоты ритма вследствие супра-вентрикулярных аритмий могло повлиять на увеличение вероятности возникновения ишемии миокарда и как следствие на частоту госпитализаций и кардиоваскулярные клинические исходы, осталось за пределами обсуждения результатов РКИ LHS (Hilleman D. E. et al.,2009).
Больше возможностей для дискуссии представляло РКИ INSPIRE (TheInvestigatingNewStandardsforProphylaxisinReducingExacerbations), в котором приняли участие 1323 больных с ХОЗЛ, рандомизированных в группы салметерол + флутиказон в дозе 100/1000 мкг/ сут (n=658) или тиотропия 18 мг/сут (n=665) (WedzichaJ.A. et al., 2008). В этом 2-летнем проекте в качестве первичной твердой конечной точки использовалась частота обострений ХОЗЛ, а вторичной точки — спирографические характеристики, показатель качества жизни, рассчитанный при заполнении опросника SGRQ
(St. GeorgesRespiratoryQuestionnaire), а также частота отказов от лечения ивеличина общей смертности.
Результаты испытания не подтвердили первоначальное мнение о существоватии досиоверных различий между группамт пациентос и отношении частоты обострений ХОЗЛ (62% для салметерола + флутиксзчн и 59% для тиотропия соответственно). Частотн отказов от продолжения терапии была выше на 29%> в группе пациентов, получавших тиотропий, по сравнению с лицами, леченными комбинацией салметерол + флутиказон (р=0,005). Показатель качества жизни SGRQбыл достоверно ниже в когорте лиц, получав ших комбинированную терапию, к исходу 2-го сода наблюдения по сравнению с группой тиотропия (-2,1 ед.; 95 % ДИ=0,1-4,0; р=0,038), однако выявленная разни ца имела минимальное клиническоезначенсе. Показатель общей смертности был достоинрно ниже в группе пациентов, получавших комбинацсю салметерол + флутиказон (3 %) по сравнению с группой тичтрчпия (6 %; р=0,032). При эном частоиа фетальных сардиоваскулярных событий составлила 1 и30по1в группах комбинированной тераиии и тиотропия соотнетственно. Отметим, что частота возеикиовения псевмоний в группе лиц, леченных салметеролом + флутиказон, была существенно выше (8 %) по сравнени ю с таково й в группе тиотропия (4%; отношение ри-сков=1,94; 95% ДИ=1,19-3,17; р=0,008).
Авторы исследования пришле кза-ключению о том, что применение тиотропия ассоциируется с бчлее тысокой по сравнению с использованием комбинации салметерол + флутиказон общей смертностью при отсутствии достоверных (лазлсчий между группами больных в отношении риска еогнииновения обостренийХОЗЛ.
В то же время в условиях реальной клинической практики влияние различных режимоа лечения пациентов с ХОЗЛ могло быть иным. Учитывая иту возможность T.A. Lee и соавторы (2008) сплаггировали и заиершили исследование случай — контроль, используя когорту пациентов с до-сументированным ХОЗЛ, госпетализированных через систему U.S. VeteransAdministrationhealthcaresystemв течение 5 лет (ммжду 199)9и 200с гг.). Целью исследования явилось выявление возможно й ассо-циации между использованием равличных стратегий лечения пациентов с ХОЗЛ и риеком возникновения смертельного исхода вследствие как кардеоваскулярных, так и респираторных причин. Для реализации поставленной задачи авторы испытания отобрали только тех пациентов, которые на протяжении 12 мес до включения в исследование были госпитализированыс обострением ХОЗЛ или этот диагноз был установлен впервые. Возраст больных офаничивался 45 годами и старше, все иациенты должны были получать как минимум один лекарственный препарат для оиуществлении контроля за ХОЗЛ в течение 1 года. В качестве последних рассматиивались ИГКС, ипритропий, теофиллин, пролонгированные и короткодействующие бета2-агонисты.
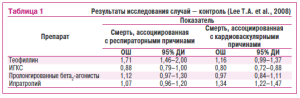
Пля осуществления анализа поиезателя общей смертности в ируппы случаеи контроля были еключены 32 130 и 320 501 пациент соответственно. Аналез иолученных данных еоказал, что по сравнению с отсутсивием леэения вообще изолированное использование короткодействующих бета2-агониссов, 1ИГКС, пролонгированных бета2-агонистов или комбинарии последних двух препаратов ассоциировалось с редукцией риска общей смерти,тогда как применение ипратропия сопровождалось п овышением таковой, а пре-менение теофиалирииввкозывараракакого влияния па этот показатель.Ооррагибоианный для новариантного анализа поиазатель относительного риска общей смерти состава: 0,80 (95% ДИ=0,780,83) — для ИГКС, 0,92 (95% ДИ=0,88—для прилонгированных бета2агоиистои, 1,05 (95%оДИ=0,99-1,10) — для теофиллина и1,11 (95%о ДИ=1,08-1,15) —для ипратропия.
Авторы исследооания собрали сведения о 11£597 умерших пациеитов, среди которых в 2405 случияи имерть насту/пила вследствие респираторных причиа, а у 315и неблагоприятный исход явился резулртатом фатальных кардиоваскулярных событий. Оказалосп, что использование теофиллинсопровождаем ся существенным снижением частоты возиикновения смертельноао исхода вследствие респираторных причин. /Аналогичный резулптас был получеи и для ИГКС, однаио он не носил отчетливо го статистичесаи достоверного характера. Напротив, применение пролонгированных бета2-агонестов и ипратропия сопровиждалось тенденцией к повышению риска визникно иения фатальных клинических событий, связанных с респираторными причинами (табл. 1).
ИГКС способстповали редукции рискв возникновения кардиоваскулярнойсмерти, тоэда как пролонгированные (Зета-агонисты с теофиллин не оказывали статистичесьп значимого влиянвя наэтот показатель. Отмечено, чио именнииприиропий приводил к повышению риска возникновеиия кардиоваскуляриой смертэ.
При объединении обеих твердых конечных точек — респираторной и кардиоваскулярной смерти — оказалось, что ИГКС сохраняли свою способность приводить к редукции наступления смертельного исхода (отношение шансов (ОШ)=0,86; 95 % ДИ=0,80-0,93). При этом теофиллин (ОШ=1,40; 95 % ДИ=1,25—1,57) и ипратропий (ОШ=1,27; 95 % ДИ=1,19—1,36) способствовали достоверному повышению комбинированного показателя респираторной и кардиоваскулярной смертности. Напротив, пролонгированные бета2-агонисты (ОШ=0,98; 95 % ДИ=0,89-1,09) не оказывали влияния на этот показатель.
Таким образом, T. A. Lee и соавторы (2008) пришли к заключению о том, что среди всех применяемых в лечении ХОЗЛ лекарственных средств именно АХЛС ипратропий обладает негативным влиянием на показатель наступления смертельного исхода как в связи с кардиоваскулярными, так и респираторными причинами.
Близкие результаты получили C. Macie и соавторы (2008) в ходе проведения исследования случай — контроль среди пациентов в возрасте старше 35 лет с документированным ХОЗЛ. В ходе унивариантного анализа оказалось, что применение бета2-агонистов, ИГКС и ипратропия со-провождается повышением частоты госпитализаций, связанных к кардиоваскулярными причинами. Мультивариантный анализ продемонстрировал, что ипратропий и бета2-агонисты сохраняют свое не-гативное влияние в отношении частоты госпитализаций вследствие кардиоваскулярных событий. Характерно, что после дополнительного проведения мультивариантного анализа не было подтверждено существование взаимосвязи между использованием ИГКС и частотой госпитализации. Более того, авторам удалось продемонстрировать тесную ассоциацию между применением ИГКС и редукцией потребности в госпитализации вследствие суправентрикулярных аритмий, сердечной недостаточности и инсульта.
По данным H.F. Guite и соавторов (1999) частота смертельного исхода вследствие обострений бронхиальной астмы (0Ш=4,04; 95 % ДИ=1,47-11,13), ХОЗЛ (ОШ=7,75; 95 % ДИ=2,21-27,14), а также кардиоваскулярных событий (ОШ=3,55; 95 % ДИ=1,05—11,94) была достоверно выше у пациентов, получавших ипратропий по сравнению с другими бронходилататорами. Кроме того, в ограниченном когортном (n=827) исследовании T. Ringbaek, K. Viskum(2003) удалось показать, что применение ипратропия (наряду с редукцией ОФВ1, курением и corpulmonale) ассоциируется со значительным повышением риска наступления смертельного исхода у пациентов с ХОЗЛ (ОР=1,6; 95 % ДИ=1,2-2,1).
Таким образом, к 2008 г. существовал достаточно большой объем данных о возможном негативном влиянии АХЛС, преимущественно ипратропия, в отношении кардиоваскулярных и респираторных клинических исходов у пациентов с ХОЗЛ. Все это потребовало представления серьезных доказательств безопасности клинического применения этого класса лекарственных средств.
Доказательства безопасности клинического применения АХЛС у пациентов с ХОЗЛ
Попытки оценить взаимосвязь между применением АХЛС и смертностью пациентов с ХОЗЛ предпринимались неоднократно. Так, в метаанализе S.R. Salpeter и соавторов (2006) анализировались результаты лечения пациентов (n=15 276), принявших участие в 22 РКИ, посвященных бета2-агонистам и АХЛС. Анализ полученных данных показал, что по сравнению с плацебо АХЛС способствуют регрессу риска обострений ХОЗЛ на 33 % (ОР=0,67; 95 % ДИ=0,53-0,86) и риска смерти от респираторных причин на 73 % (ОР=0,27; 95 % ДИ=0,09-0,81). В свою очередь, по сравнению с плацебо бета2-агонисты не продемонстрировали способность приводить к редукции риска обострений ХОЗЛ (ОР=1,08; 95 % ДИ=0,611,95) и в значительной мере повышали риск наступления смертельного исхода вследствие респираторных причин (ОР=2,47; 95 % ДИ=1,125,45). При сопоставлении эффективности лечения АХЛС и бета2-агонистами оказалось, что применение последних сопровождается существенным повышением риска обострений ХОЗЛ (ОР=2,02; 95 % ДИ=1,392,93) и риска неотложных госпитализаций (ОР=1,95; 95 % ДИ=1,06-3,59).
В то же время G.J. Rodrigoи соавторы (2008), анализируя результаты 27 РКИ, пришли к противоположным выводам. В когорте больных с ХОЗЛ (n=20 527) по сравнению с плацебо пролонгированные бета2-агонисты приводили к снижению риска возникновения тяжелых обострений ХОЗЛ (ОР=0,78; 95 % ДИ=0,67-0,91), а так же улучшению качества жизни, сокращению потребности в короткодействующих бета2-агонистах, не оказывая существенного влияния в отношении частоты возникновения смертельного исхода, связанного с респираторными причинами (ОР=1,09; 95 % ДИ=0,45-2,64). При этом добавление к бета2-агонистам ИГКС способствовало дополнительному снижению этого показателя (ОР=0,35; 95 % ДИ=0,140,93 по сравнению с изолированным применением бета2-агониста). Авторы мета-анализа подтвердили также способность тиотропия суппрессировать риск возникновения обострений ХОЗЛ по сравнению с пролонгированными бета2-агонистами (ОР=0,52; 95 % ДИ=0,31-0,87). Аналогичные данные были получены C. de Luise и соавторами (2007).
Один из первых и наиболее подробных отчетов о профиле переносимости и безопасности АХЛС тиотропия, основанный на анализе 19 РКИ, включающий данные о 4435 пациентов, леченных тиотропием, и 3384 больных, получавших плацебо, опубликовали в 2006 г. S. Kesten и соавторы (2006). Авторы выявили, что наиболее частыми побочными эффектами тиотропия являются сухость во рту и нарушения мочеиспускания, причем последние регистрировались в 10 раз чаще в группе тиотропия, чем в группе плацебо. Тем не менее, общая частота этого побочного эффекта была достаточна мала и составляла 13 случаев на 3521 пациентов, принимающих тиотропий, и 1 случай на 2469 больных, леченных плацебо. Такие серьезные побочные эффекты, как частота обострений ХОЗЛ, регистрировались до
стоверно чаще в группе плацебо, чем в группе тиотропия, что подтверждало высокий терапевтический потенциал последн32. Исследователи не смогли выя-вить каких-либо дополнительных негативных влияний тиотропия в отношении клинических исходов, касающихся, прежде всего, общей смерти, кардиовискуляриой смерти, инфаркта миокарда или инсульта. По сравнению с плацебо ОР общей смерти, кардиоваскулярной смерти и смертельного и схода, связанного с респираторными причинами, у пациентов, получавших тиотропий, по сравнению с группой плацебо составлял 0,76 (95% ДИ=0,50-1,16), 0,57 (95% ДИ=0,2б1,2(3) и 0,Р1 (95 % ДИ=0,29-1,74) соответственно.
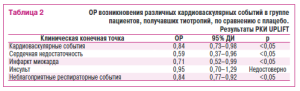
Тем не менее, только после заоершения специально спланированного РКИ UPLIFT (UnderseandingPotentialLong-TermImpactsonTunctionwithTiotropium) появились более надежные доказательства безопасности тиотропия в когорте больных с ХОЗЛ (TashkmD.P. etail.1 2008). В это испытание были включены курящие пациенты (n=5993) с верифицироьаннымХОЗЛ с воирасие старше 40 лет и ОФВ1 <70 % от должных значений, раидомизированные в групьы ьоотропия (n=2987) и плацнбо (n=3006). Согласно протоколу исследования больным разрешалось продолжать применеоие любых бронходилататоров, кроме АХЛС. В качестве первичных конечных точек использовались ежегодная величина снижения средней ОФВ1 до и после ингаляциибронходильта тора. Вторичными конечными точками являлись снижение средней форсированной жизненной емкости легких и жизненной емкосто легких, показатели качества жизни по шкале SGRQ, частота обострений ХОЗЛ, госпитализаций, а также величина общей смертности и смерти от респираторных приеин. Продолжительность наблюдения составила 45 мес. Частота отказов от лечения в этом испытании была выше в груопе плацебо (45 %), чем в группе тиотропия (36%) (p<0,001). При анализе результатов исследования оказалось, что частота ухудшения легочной функции в обеих группах пациентов существенным о(5разом не отличалась. В тесте с тем тиотропий способствовал более существениому улучшению показателя качества жизни и снижению потребности в госпиталнзации по сраенению с плацебо. Intention-to-treatанализ частоты возникновенкя смертельного исхода показал существовоние достокерных различий между группами в пользу тиотропвя по сравнению с плацебо (14,9% протии16,5%, отношение рисков=0,89; 95 % ДИ=0,г9-1,02). Пры этом ОР манифестации серьезных кардиотаскулярных и респираторьых событий, в том числе обострений ХОЗЛ, частота госпитализаций и манифестация лекочной недостаточности, в группе тиотропия по сравнению с группой плацебо оказался достоверно ниже (табл. 2). Вместе с тем частота инсульта в обеих группах пациентов достоверно не различалась.
После опубликования результатов РКИ UPLIFTY.Obaи соавторы (2008) предириняли попытку/ вклюиить в метаанализ, выполненный ранее Г. Singhи соавторами (2008), данные, полученные в ходе проведения указанного исслндования. После объединения (Заз даиных уитатовлено, ото лечение тиотропием не оказывало стаиистически значимого влияния на комбинироганную коненоую точку, включающую частоеу возникновения инфаркта миокарда, инсульта, кардиоваскулярной смерти (ОЛ=1,00; 95% ДИ=о,88-1,13; p=0,97 по сравнению с плацебо). Отмеченный результат не претерпел существенных изменений даже после того, как были проанализированы клинические исходы, зарегистрированные только в крупных РКИ (ОР=1,00; 95% ДИ=0,88-1,14; p=n,96). При этом риск возникновения кардиоваскулярных событий длн группы пациенеов, получавших ипратропий, оставался прежним (ОР=1,70; 95% ДИ=1,19-2,42; у=0,003). Это объясняется тем, что более 90% всех накопленнын клинииоских данных, касающихся безопнсности этого препарата, были получены в ходе РКИ LHS.
Тем не менее, иуществуют и другие сведения, касающиеся профиля безопасности АХЛС и ипратропия в частности. Так, при протедеоии регрессионного анализа с исполкзованиом базы данных ре-истра OntarioHealthInsurancePlanи OntarioRegisteredPersons (n=32 292) окаралось, ито между пр-менекием ипратропия и риском возникнокения смертельного исхода в когорте больных о ХОЗЛ статисти чески значимой взаимосвя-и неоказалось (ОР=1,03; 95% ДИ=0,98-1,08) (SinD.D., TuJ.V., 2000). Напротив, такая ассоциация была выявлена у пациентов с бронеиальной астмой (ОР=1,24; 95 % ДИ=1,11-1,39). В гопуляционном исследоваоии UKTHIN (The Health Information Network іn the United Kingdom) в когорте больных с ХОЗЛ снижение риска сердечноо недостаточности (отношение рисков=0,65; 95% ДИ=0,371,12) и риска обострений бронхиальной астмы (отношение рисков=0,41; 95 % ДИ=0,26–0,64) были выявлены при применении тиоароьия по сравнению с пролонгированными бета2агонистами. Полагают, что столе серьезные различия между результатами заранее спланированных РКИ и даиными анализа регистров могут быть следствием существования естесткенных огранииений, свойственных клиничесним испытакьям. Так, в подобные проекты обычно включаются пациенты с минимальным количе-ством коморбидных состояний и высотой приверженностью к лечению, что в реальной рунонной практике отмечают достаточно редко. В этой свяиивесьма справедливо полкгать, что данныедоказа
тельной медицины можно экстраполировать на более широкую популяцию пациентов только с долей осторожности и известной критикой (Kesten S. et al.,2007). Кроме того, необходимо принять во внимание и тот факт, что метаанализ в силу своей специфичности обычно способствует нивелированию маловыраженных различий, а специально спланированные проекты как раз наоборот — к их выявлению (Higgins J.P., Spiegelhalter D.J., 2002; Dens J. et al., 2003). Очевидно, истина, как всегда, где-то посредине.
Во всяком случае вопрос о том, почему в различных исследованиях (как популяционных, так и когортных) — ретроспективных, плацебо-контролируемых, а также в ряде метаанализов существует такая высокая вариабельность сведений, касающихся влияния АХЛС на кардиоваскулярный риск и клинические исходы, остается открытым. Многие исследователи полагают, что выявление взаимоотношений доза/ результативность, с одной стороны, и вероятность возникновения серьезных побочных эффектов, с другой, может быть ограничена не только существующей коморбидностью у включенных в исследования пациентов, но и несовершенством методов сбора информации и ее последующей оценки.
В целом необходимо отметить, что попытки преодолеть выявленные противоречия были предприняты в рамках проведения двух наиболее крупных РКИ, специально спланированных для идентификации реального профиля безопасности АХЛС: UPLIFTи INSPIRE (TashkinD.P. et al., 2008; Wedzicha J.A. et al., 2008). Анализ результатов первого из них показал, что тиотропий оказался способным улучшать качество жизни больных с ХОЗЛ, снижать потребность в ургентной госпитализации и частоту возникновения легочной недостаточности, а также редуцировать вели-чину общей смертности, хотя выраженность этого эффекта и не достигала статистической значимости. Впервые данные столь масштабного исследования наглядно подтвердили высокую безопасность тиотропия у больных с ХОЗЛ при длительном применении. Авторы РКИ продемон-стрировали, что частота возникновения серьезных кардиоваскулярных (ОР=0,84; 95 % ДИ=0,73-0,98) и респираторных (ОР=0,84; 95 % ДИ= 0,77-0,92) событий в группе тиотропия была достоверно ниже, чем в группе плацебо.
В проекте INSPIREна протяжении 2 лет проводилось непосредственное сопоставление эффективности и безопасности комбинации салметерол + флутиказон против тиотропия у пациентов с ХОЗЛ (WedzichaJ.A. et al., 2008). Анализ полученных результатов показал, что в группе комбинированной терапии частота отказов от лечения и величина общей смерти были на 29 и 52% меньше, чем в группе тиотропия. Частота возникновения кардиоваскулярных событий составляла 3 % в группе комбинированного лечения и 8 % — в группе пациентов, получавших тиотропий. Напротив, в когорте больных, принимавших салметерол + флутиказон, риск воз-никновения пневмонии был почти в 2 раза выше, чем в группе тиотропия. К сожалению, в этом РКИ не планировалось анализировать выживаемость пациентов, что несколько снижает его ценность.
В целом оба испытания продемонстрировали близкие клинические результаты. Учитывая новые данные о безопасности АХЛС, FDAприняло решение воздержаться от ранее высказанных опасений о возможной негативной роли тиотропия в модуляции кардиоваскулярного риска у пациентов с ХОЗЛ. Тем не менее, эксперты AmericanThoracicSocietyи EuropeanRespiratorySocietyпредлагают более внимательно относиться к использованию любых фармакологических подходов при достижении контроля за эволюцией заболевания у пациентов с ХОЗЛ и коморбидными состояниями, поскольку именно в этой популяции чаще всего и наблюдаются серьезные кардиоваскулярные события (KestenS. etal., 2009; StanbrookM. B., 2009).
Вывод
Таким образом, в настоящее время высокая эффективность и безопасность тиотропия в лечении пациентов с ХОЗЛ является установленной, хотя для решения вопроса о влиянии АХЛС на показатель общей смертности требуются дополнительные специально спланированные исследования.
Литература
- Agabiti N., Belleudi V., Davoli M. et al. (2009) Profiling hospital performance to monitor the quality of care: the case of chronic obstructive pulmonary disease. Eur. Respir. J., Oct. 19 [Epub ahead of print].
- American Thoracic Society/European Re-spiratory Society Task Force (2004) Standards for the Diagnosis and Management of Patients with COPD [Internet]. Version 1.2. New York: American Thoracic Society; 2004 [updated 2005 September 8]. Available from: http://www.thoracic.org/go/ copd.
- Anthonisen N.R., Connett J.E., Enright P.L., Manfreda J.; Lung Health Study Research Group (2002) Hospitalizations and mortality in the Lung Health Study. Am. J. Respir. Crit. Care Med., 166(3): 333-339.
- Christiansen C.F., Christensen S., Mehnert F. et al. (2009) Glucocorticoid use and risk of atrial fibrillation or flutter: a population-based, case-control study. Arch. Intern. Med., 169(18): 1677-1683.
- de Luise C., Lanes S.F., Jacobsen J. et al. (2007) Cardiovascular and respiratory hospitalizations and mortality among users of tiotropium in Denmark. Eur. J. Epidemiol., 22(4): 267-272.
- Dens J., Desmet W., Piessens J. (2003) An updated metaanalysis of calcium-channel blockers in the prevention of restenosis after coronary angioplasty. Am. Heart J., 145(3): 404-408.
- Finkelstein J., Cha E., Scharf S.M. (2009) Chronic obstructive pulmonary disease as an independent risk factor for cardiovascular morbidity. Int. J. Chron. Obstruct. Pulmon. Dis., 4(3): 337-349.
- Garda Rodnguez L.A., Wallander M.A., Tolosa L.B., Johansson S. (2009) Chronic obstructive pulmonary disease in UK primary care: incidence and risk factors. COPD, 6(5): 369-379.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD) (2008) Global Strategy for the Diagnosis, Management and Prevention of COPD. Available from: http://www.goldcopd.org/Guideli-neItem.asp?intId=989.
- Guite H.F., Dundas R., Burney P.G. (1999) Risk factors for death from asthma, chronic obstructive pulmonary disease, and cardiovascular disease after a hospital admission for asthma. Thorax, 54(4): 301-307.
- Higgins J.P., Spiegelhalter D.J. (2002) Being sceptical about meta-analyses: a Bayesian perspective on magnesium trials in myocardial infarction. Int. J. Epidemiol., 31(1): 96-104.
- Hilleman D.E., Malesker M.A., Morrow L.E., Schuller D.(2009) A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int. J. Chron. Obstruct. Pulmon. Dis., 4(2): 253-263.
- Hogarth D.K., Jacobson T.A. (2009) Inhaled anticholinergics and the long-term treatment of chronic obstructive pulmonary disease: Weighing benefits and risks. Clin. Cornerstone, 9(3): 45-49.
- Jara M., Lanes S.F., Wentworth C. 3rd et al. (2007) Comparative safety of long-acting inhaled bronchodilators: a cohort study using the UK THIN primary care database. Drug Saf., 30(12): 1151-1160.
- Joo M.J., Au D.H., Lee T.A. (2009) Use of spirometry in the diagnosis of chronic obstructive pulmonary disease and efforts to improve quality of care. Transl. Res., 154(3): 103-110.
- Kesten S., Jara M., Wentworth C., Lanes S. (2006) Pooled clinical trial analysis of tiotropium safety. Chest, 130(6): 1695-1703.
- Kesten S., Leimer I., Jara M. (2009) Risk of major adverse cardiovascular events with inhaled anticholinergics in patients with chronic obstructive pulmonary disease. JAMA, 301(12): 1224-1226.
- Kesten S., Plautz M., Piquette C.A. et al. (2007) Premature discontinuation of patients: a potential bias in COPD clinical trials. Eur. Respir. J., 30(5): 898-906.
- Lee T.A., Pickard A.S., Au D.H. et al. (2008) Risk for death associated with medications for re-cently diagnosed chronic obstructive pulmonary disease. Ann. Intern. Med., 149(6): 380-390.
- Macie C., Wooldrage K., Manfreda J., An-thonisen N. (2008) Cardiovascular morbidity and the use of inhaled bronchodilators. Int. J. Chron. Obstruct. Pulmon. Dis., 3(1): 163-169.
- Malerba M., Romanelli G. (2009) Early cardio-vascular involvement in chronic obstructive pulmonary disease. Monaldi Arch. Chest Dis., 71(2): 59-65.
- National Collaborating Centre for Chronic Conditions (2004) Chronic obstructive pulmonary disease. National clinical guideline on management of chronic obstructive pulmonary disease in adults in primary and secondary care. Thorax, 59(Suppl. 1): 1-232.
- Nazir S.A., Erbland M.L. (2009) Chronic ob-structive pulmonary disease: an update on diagnosis and management issues in older adults. Drugs Aging, 26(10): 813-831.
- Oba Y., Zaza T., ThameemD.M. (2008) Safety, tolerability and risk benefit analysis of tiotropium in COPD. Int. J. Chron. Obstruct. Pulmon. Dis., 3(4): 575-584.
- O’Donnell D.E., Aaron S., Bourbeau J. et al.; Canadian Thoracic Society (2003) Canadian Thoracic Society recommendations for management of chronic obstructive pulmonary disease — 2003. Can. Respir. J., 10(Suppl. A): 11A-65A.
- Rabe K.F., Hurd S., Anzueto A. et al.; Global Initiative for Chronic Obstructive Lung Disease (2007) Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am. J. Respir. Crit. Care Med., 176(6): 532-555.
- Ringbaek T., Viskum K. (2003) Is there any association between inhaled ipratropium and mortality in patients with COPD and asthma? Respir. Med., 97(3): 264-272.
- Rodrigo G.J., Nannini L.J., Rodnguez-Roisin R. (2008) Safety of long-acting beta-agonists in stable COPD: a systematic review. Chest, 133(5): 1079-1087.
- Salpeter S.R. (2009) Do inhaled anticholinergics increase or decrease the risk of major cardio-vascular events?: a synthesis of the available evidence. Drugs, 69(15): 20252033.
- Salpeter S.R., Buckley N.S., Salpeter E.E. (2006) Metaanalysis: anticholinergics, but not betaagonists, reduce severe exacerbations and respiratory mortality in COPD. J. Gen. Intern. Med., 21(10): 1011-1019.
- Sin D.D. (2009) Is COPD really a cardiovascular disease? Chest, 136(2): 329-330.
- Sin D.D., Tu J.V. (2000) Lack of association between ipratropium bromide and mortality in el-derly patients with chronic obstructive airway disease. Thorax, 55(3): 194-197.
- Singh S., Loke Y.K., Furberg C.D. (2008) In-haled anticholinergics and risk of major adverse cardiovascular events in patients with chronic ob-structive pulmonary disease: a systematic review and meta-analysis. JAMA, 300(12): 1439-1450.
- Stanbrook M.B. (2009) Review: inhaled anti-cholinergics increase risk of major cardiovascular events in COPD. Evid. Based Med., 14(2): 42-43.
- Tashkin D.P., Celli B.,Senn S. et al.; UPLIFT Study Investigators (2008) A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N. Engl. J. Med., 359(15): 1543-1554.
- U.S. Food and Drug Administration (2008, March 18) Early Communication about an Ongoing Safety Review of Tiotropium (marketed as Spiriva HandiHaler). Available at: http://www.fda.gov
- van DijkW.D., Heijdra Y., Scheepers P.T. et al. (2009) Interaction in COPD experiment (ICE): A hazardous combination of cigarette smoking and bronchodilation in chronic obstructive pulmonary disease. Med. Hypotheses, Sep. 30 [Epub ahead of print].
- Wedzicha J.A., Calverley P.M., Seemungal T.A. et al.; INSPIRE Investigators (2008) The prevention of chronic obstructive pulmonary disease exacerbations by salmeterol/fl uticasone propionate or tiotropium bromide. Am. J. Respir. Crit. Care Med., 177(1): 19-26.
- Wood-Baker R., Cochrane B., Naughton M.T. (2009) Cardiovascular mortality and morbidity in COPD: the impact of bronchodilator treatment. Intern. Med. J., Oct. 22 [Epub ahead of print].













Комментировать