М.В. Иванова, Н.В. Скрипченко, Н.В. Матюнина, А.А. Вильниц, В.Б. Войтенков, Научно-исследовательский институт детских инфекций ФМБА России, Санкт-Петербург, Россия
Введение
Серозные менингиты (СМ) являются распространенными формами поражения центральной нервной системы, частота которых в структуре нейроинфекций достигает 25 — 30% [1—4]. Среди заболевших СМ дети и подростки составляют 65 — 78%. В последние годы наблюдается рост заболеваемости СМ, в этиологии которых имеют значение как вирусы (энтеровирусы, герпес-вирусы, вирус лихорадки Западного Нила, ВИЧ и др.), так и бактерии (туберкулезные палочки, лептоспиры, грибы рода кандида, иерсинии, боррелии и эрлихии) [3]. Тенденции распространения заболевания по-прежнему указывают на возникновение спорадических случаев и вспышек [4]. Основу клинической картины СМ составляют общемозговые и менингеальные симптомы, выраженность которых отражает степень воспалительных и гемоликвородинамических нарушений. Несмотря на сравнительно благоприятное течение серозных менингитов, у реконвалесцентов в 40—60% случаев диагностируются неврологические нарушения, чаще всего в виде церебрастенического (32,2%) и невротического (12,3%) синдромов [4]. В патогенезе серозных менингитов имеет значение как синдром системного воспалительного ответа, воспаление мягких мозговых оболочек, нарушение гемо- и ликвородинамики, так и нейрометаболические изменения, степень выраженности которых зависит от тяжести менингита. В этой связи общепринятой терапевтической тактикой СМ является применение не только этиотропных препаратов, но и патогенетических средств, включающих дегидратационные, сосудистые и обязательно ноотропные препараты. В настоящее время появляются новые ноотропные препараты с комплексным механизмом действия, влияющие на различные патогенетические звенья патологического процесса. Одним из таких препаратов является нооклерин, обладающий церебропротективными свойствами с отчетливым ноотропным, психостимулирующим и психогармонизирующим действием при астенических состояниях, нарушениях памяти различного генеза [5—6].
Цель исследования — оценить терапевтическую эффективность препарата нооклерин при серозных менингитах у детей.
Материалы и методы
Проведено клинико-лабораторное обследование 50 больных с СМ в возрасте от 10 до 18 лет, проходивших лечение в Научно-исследовательском институте детских инфекций в 2012 — 2013 гг. Все дети поступали с подозрением на менингит на 1—2-й день заболевания. Достоверных гендерных различий выявлено не было — с одинаковой частотой болели как мальчики (52%), так и девочки (48%). У 32 (64%) пациентов была установлена энтеровирусная этиология заболевания, а 18 детей (36%) переносили серозный менингит неустановленной этиологии.
Диагноз серозного менингита выставлялся на основании данных анамнеза заболевания, клинической картины и лабораторных показателей (клинический анализ ЦСЖ и общий анализ крови). Все больные были разделены на 2 группы:
1 группа (основная группа — 35 детей) вместе с базовой терапией серозного менингита получала препарат нооклерин с 5-го дня госпитализации, доза препарата зависела от возраста пациента. Так, детям с 10 до 12 лет нооклерин назначался по 2,5 мл (0,5 г) 2 раза в день, старше 12 лет — 5,0 мл (1 г) 2 раза в день, длительность приема препарата составила 2 месяца.
2 группа (группа сравнения — 15 детей) получала только базовую терапию.
Базовая терапия серозного менингита включала противовирусные (амиксин), дегидратационные (диакарб), дезинтоксикационные препараты.
Обе группы были сопоставимы по возрасту, полу, тяжести заболевания и этиологии менингита.
Всем детям проводился мониторинг клинико-неврологических показателей в течение всего периода стационарного лечения и через 2 месяца после выписки из стационара. Оценивалась длительность основных симптомов заболевания — температуры, симптомов интоксикации, головной боли, рвоты, сохранения менингеальных симптомов, сроки санации ЦСЖ. Также проводилось этиологическое обследование для определения возбудителя, вызвавшего серозный менингит (энтеровирусы, герпес-вирусы, боррелии, вирус клещевого энцефалита) в крови и ЦСЖ методом полимеразно-цепной реакции (ПЦР), одновременно с этим в крови методом иммуноферментного анализа (ИФА) определялись иммуноглобулины (Ig) IgM и IgG к тем же возбудителям.
Оценка степени астении проводилось по «Шкале симптомов астении у детей» и «Шкале астении Шаца».
Качество жизни оценивали при помощи опросника PedsQL4.0. Опросник состоит из 23 вопросов и включает 4 шкалы: физическое функционирование (8 вопросов), эмоциональное функционирование (5 вопросов), социальное функционирование (5 вопросов) и жизнь в учебном заведении (5 вопросов). Общее количество баллов после процедуры перекодирования каждого из пяти вариантов ответа рассчитывается в итоге по 100-балльной шкале (от 0 до 100 баллов): чем выше итоговая величина, тем лучше качество жизни ребенка [7]. Оценка степени астении, когнитивных функций и качества жизни проводилась дважды: в день госпитализации и через 2 месяца после выписки при диспансерном осмотре. В эти же сроки проводилось ЭЭГ-обследование.
Результаты и обсуждение
Анализ течения острого периода серозного менингита в обеих группах не выявил достоверных отличий по длительности основных симптомов заболевания (рис. 1).
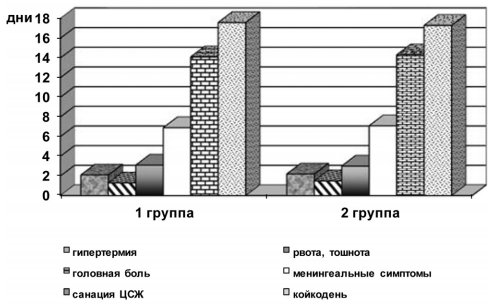
Рис. 1. Длительность основных клинических симптомов у больных с серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) (р>0,05)
Однако при осмотре детей, перенесших серозный менингит, в периоде реконвалесценции через 2 месяца после выписки из стационара больные из контрольной группы достоверно более часто жаловались на эмоциональную лабильность, неустойчивость настроения, повышенную утомляемость в вечерние часы и к концу учебной недели, головные боли, возникающие после эмоциональной или умственной нагрузки, уменьшение работоспособности, чем дети, получавшие нооклерин (табл. 1).
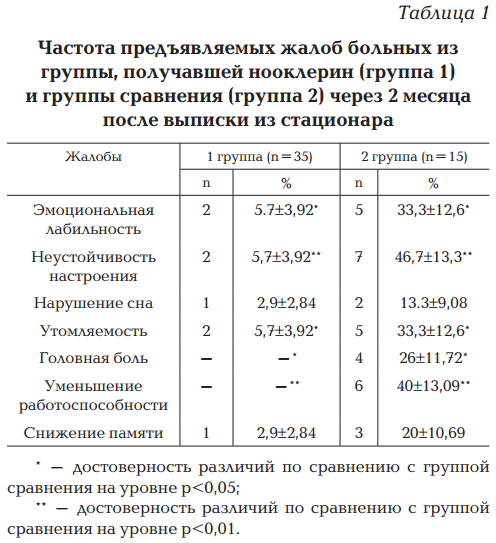
Таким образом, проявления церебрастенического синдрома в группе сравнения выявлялись значительно чаще, чем у детей, получавших нооклерин.
Для объективизации степени выраженности астенического синдрома у детей в обеих группах было проведено анкетирование пациентов по «Опроснику для выявления уровня астении И.К. Шаца» и «Шкале симптомов астении у детей». Оценка уровня астении по «Опроснику И.К. Шаца» проводилось дважды: в первые сутки поступления ребенка в стационар и через 2 месяца после выписки из стационара при диспансерном наблюдении (рис. 2).
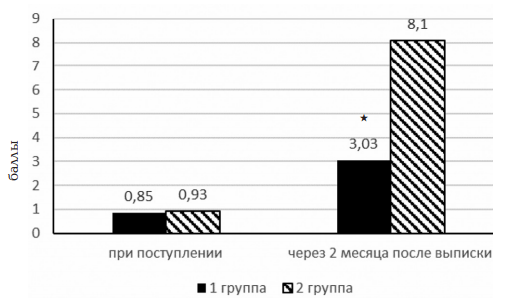
Рис. 2. Оценка уровня астении у больных серозными менингитами, получавших нооклерин (группа 1) и в группе сравнения (группа 2) до и после лечения по «Опроснику И.К. Шаца»; * – достоверность различий по сравнению с группой сравнения на уровне p<0,01
При проведении первого тестирования выявлялся уровень астении у ребенка до начала серозного менингита (исследователь просил отвечать на вопросы с учетом состояния до наступления заболевания). Анализ полученных результатов выявил, что «реакция утомления» (оценка по «Опроснику И.К. Шаца» 1—2 балла) была выявлена у 4 человек в группе 1 (11,4%) и 2 человек в группе 2 (13,3), у остальных пациентов она была меньше 1 (отсутствие астении). В целом, средний балл оценки уровня астении составил 0,86±0,5 (группа 1) и 0,93±0,9 (группа 2), что соответствует по «Опроснику И.К. Шаца» отсутствию астении.
При повторном тестировании детей, перенесших серозный менингит, через 2 месяца после выписки из стационара также получены достоверные различия по уровню астении в исследуемых группах. Так, у детей, получавших в течение 2 месяцев нооклерин, уровень астении расценивался как «реакция утомления» (средний балльный показатель в группе — 3,03±1,3), причем изменения чаще всего касались шкалы V (эмоциональная лабильность), у 9 пациентов он был равен 0, что соответствует отсутствию астении. В группе сравнения средний балльный показатель составил 8,1±0,87, что соответствует «умеренной астении» по «Опроснику И.К. Шаца», прочем изменения чаще всего касались шкалы III (изменение памяти), IV (нарушения внимания), V (эмоциональная лабильность).
Оценка уровня астении по «Шкале симптомов астении у детей» проводилось 3 раза: в первые сутки поступления ребенка в стационар, при выписке и через 2 месяца после выписки из стационара при диспансерном наблюдении (рис. 3).
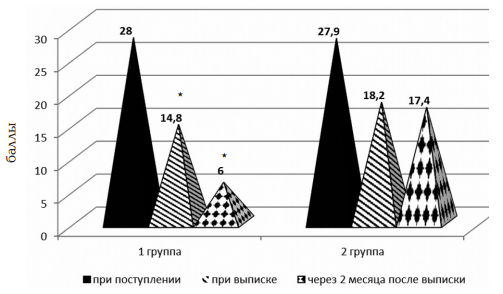
Рис. 3. Оценка уровня астении у больных серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) до и после лечения по «Шкале симптомов астении у детей»; * – достоверность различий по сравнению с группой сравнения на уровне p<0,01
При проведении первого тестирования достоверных отличий в обеих группах получено не было. Уровень астении учитывался на момент поступления больного в стационар и соответствовал умеренной астении (средний балл оценки уровня астении 28±2,9 (группа 1) и 27,9±1,9 (группа 2). При выписке из стационара отмечались существенные отличия этого показателя в исследуемых группах, которые значительно увеличивались при третьем тестировании пациентов. Так, в группе больных, получавших нооклерин, к моменту выписки из стационара — снижался в 2 раза (14,8±0,67) и соответствовал уровню «реакции утомления», а к моменту окончания приема нооклерина (через 2 месяца после выписки из стационара) уменьшался практически до нормальных значений (6±2,6).
В группе сравнения также отмечалось снижение средней балльной оценки уровня астении к моменту выписки из стационара (18,2±0,91), но она оставалась достоверно выше, чем в группе детей, получавших нооклерин, и соответствовала умеренной степени астении. В дальнейшем, при третьем обследовании через 2 месяца после выписки из стационара, она практически не изменилась и составила 17,4±2,4, что было достоверно выше, чем в основной группе.
Таким образом, проведенное тестирование больных серозными менингитами по двум шкалам для определения уровня астении в остром периоде заболевания и в катамнезе через 2 месяца после выписки в различных группах выявило достоверно более низкий уровень развития астенических проявлений у детей, получавших нооклерин, к моменту выписки из стационара, а также значительное уменьшение проявлений астении через 2 месяца приема препарата, по сравнению с группой сравнения. Полученные данные подтверждают тот факт, что нооклерин оказывает не только психостимулирующее, но и церебропротективное действие.
Наряду с оценкой уровня астении у детей, переносящих серозный менингит, нами проводилась оценка изменения качества жизни у этих пациентов (табл. 2).
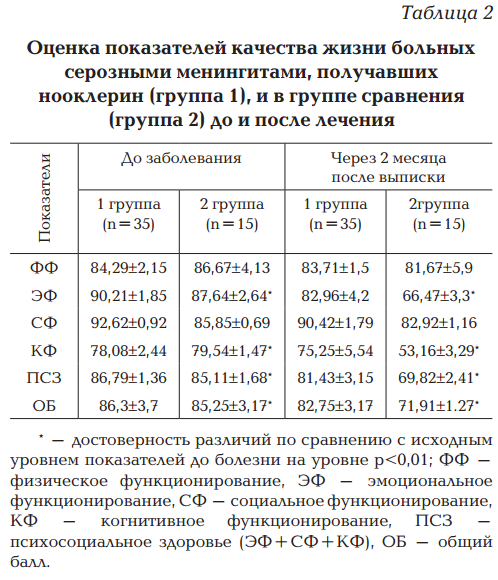
При проведении тестирования по опроснику для родителей PedsQL версия 4.0 в день поступления в стационар оценивался исходный уровень качества жизни ребенка до заболевания серозным менингитом. При анализе полученных данных достоверных отличий по всем шкалам качества жизни у обеих групп получено не было. Было отмечено, что в обеих группах имелось некоторое снижение качества жизни по шкале когнитивного функционирования до 78,08±2,44 баллов (группа 1) и 75,25±5,54 балла (группа 2).
При повторном тестировании детей, перенесших серозные менингиты, через 2 месяца после выписки из стационара в группе 1 отмечалось незначительное снижение балльной оценки по всем шкалам качества жизни, но оно было минимальным и статистически не достоверным. В то же время при анализе данных тестирования в группе 2, проведенного в эти же сроки, было получено достоверное снижение уровня качества жизни по сравнению с исходными показателями: общий балл снизился с 85,25±3,17 до 71,91±1,27, показатель «психосоциальное здоровье» — с 85,11 ±1,68 до 69,82±2,41 (p<0,01). Также можно отметить, что снижение уровня качества жизни происходило в основном за счет достоверного уменьшения показателей по шкале эмоционального функционирования (с 87,64±2,64 до 66,47±3,3, p<0,01) и шкале когнитивного функционирования (с 79,54±1,47 до 53,16±3,29, p<0,01), что коррелирует с показателями уровня астении в этой группе.
Таким образом, проведенное исследование выявило снижение уровня качества жизни через 2 месяца после перенесенного серозного менингита у детей, получавших только базовую терапию в остром периоде заболевания (группа 2), в то время как у детей, получавших вместе с базовой терапией серозного менингита в течение 2 месяцев нооклерин, качество жизни оставалось на первоначальном уровне.
Также нами проведен сравнительный анализ показателей ЭЭГ-обследования в группе детей, получавших нооклерин с 5-го дня лечения серозного менингита (группа 1) и в группе сравнения (группа 2). ЭЭГ-обследование проводилось дважды: в первые 2 суток поступления ребенка на лечение в стационар и через 2 месяца после выписки.
При ЭЭГ-исследовании в остром периоде серозного менингита достоверных отличий у больных основной группы и группы сравнения получено не было. В обеих группах наблюдалось общее понижение амплитуды альфа-ритма, в некоторых случаях альфа-ритм был представлен отдельными элементами на фоне полиморфной кривой; в обеих группах регистрировалась диффузная медленноволновая активность без четкого преобладания по отведениям. Спектр ЭЭГ в обеих группах был смещен в сторону тета-диапазона.
При повторном исследовании через 2 месяца после выписки из стационара в группе детей, получавших нооклерин (группа 1), в 37,2% случаев (n=13) наблюдалась картина ЭЭГ, соответствующая возрастной норме, в 40% (n=14) отмечались легкие признаки дезорганизации основной активности: умеренное понижение амплитуды альфа-ритма, периодическое проведение альфа-ритма в лобные отведения, отдельные медленные волны без четкого преобладания по отведениям. В 22,8% случаев (n = 8) регистрировались признаки средней степени выраженности дезорганизации основной активности (постоянное проведение альфа-ритма в лобные отведения, средней степени выраженности понижение его амплитуды, медленноволновая активность с формированием редких (1—2 за все время записи) билатерально-синхронных вспышек).
В группе сравнения (группа 2) в 80% случаев (n=12) регистрировались средней степени выраженности изменения биоэлектрической активности, умеренные в 20% (n=3). Возрастной нормы не зарегистрировано ни в одном случаев. Эпилептиформной активности ни в одной группе выявлено не было (рис. 4).
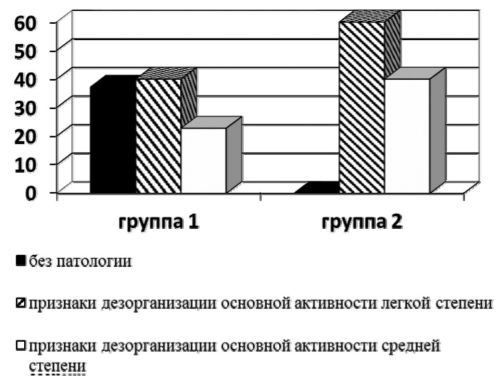
Рис. 4. Частота (%) изменения ЭЭГ-показателей у больных серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) при обследовании через 2 месяца после выписки из стационара
Таким образом, данные, полученные при ЭЭГ-обследовании в остром периоде заболевания и в катамнезе через 2 месяца после выписки из стационара полностью коррелируют с клиническими наблюдениями и данными, полученными при анкетировании больных. Не исключено, что нооклерин как препарат, по своей химической структуре близкий к естественным веществам, оптимизирующим деятельность мозга (гамма-аминомасляная и глутаминовая кислоты), при применении у детей, больных серозными менингитами, облегчая процесс передачи нервного импульса, улучшая фиксацию, консолидацию и воспроизведение памятных следов, стимулируя процессы тканевого обмена, способствует оптимизации нейрометаболических процессов, что предупреждает формирование органического дефицита. Применение нооклерина в комплексной терапии серозных менингитов сглаживает межполушарные различия в функционировании головного мозга, что также способствует протекции развития симптоматической эпилепсии в периоде поздней реконвалесценции.
Заключение
Полученные данные клинического наблюдения за больными с серозным менингитом, проведенное тестирование для определения уровня астении и качества жизни, ЭЭГ-обследование в остром периоде заболевания и в катамнезе в течение 2 месяцев у больных, получавших нооклерин и в группе сравнения, показали терапевтическую эффективность нооклерина, а также подтвердили его психостимулирующие, нейрометаболическое и церебропротективное действие. Переносимость препарата у детей хорошая. Побочных эффектов выявлено не было. В связи с этим препарат нооклерин может быть включен в стандарт оказания помощи детям, переносящим серозный менингит для профилактики и лечения постинфекционной астении для улучшения исходов заболевания.
Литература
- Лобзин, Ю.В. Энтеровирусные инфекции / Ю.В. Лобзин, Н.В. Скрипченко, Е.А. Мурина. — СПб., 2012. — 432 с.
- Михайлова, Е.В. Менингиты энтеровирусной этиологии у детей: современные подходы к диагностике и особенности клинического течения / Е.В. Михайлова, А.В. Штейнберг, И.Г. Еремеева // Инфекционные болезни. — 2008. — № 6 (1). — С. 31—34.
- Скрипченко, Н.В. Вирусные энцефалиты и менингиты у детей / Н.В. Скрипченко, М.Н. Сорокина. — М.: Медицина, 2004. — 415 с.
- Скрипченко, Н.В. Энтеровирусная (неполио) инфекция у детей : методические рекомендации / Н.В. Скрипченко [и др.]. — СПб.: — 2013. — 18 с.
- Аведисова, А.С. Новый отечественный препарат нооклерин в терапии астении и других заболеваний / А.С. Аведисова // Фармотека. — 2005. — № 6. — С. 51—54.
- Александровский, Ю.А. Применение препарата нооклерин в качестве антиастенического средства у больных с функциональной астенией / Ю.А. Александровский, А.С. Аведисова, Д.В. Ястребов // Психиатрия и психофармакотерапия. — 2003. — № 6. — С. 51—54.
- Лукьянова, Е.М. Оценка качества жизни в педиатрии /Е.М. Лукьянова // Качественная клиническая практика. — 2002. — № 4. — С. 34—42
References
- Lobzin Yu.V., Skripchenko, N.V., Murina E.A. Enterovlral infection, S-Pb., 2012/ — 432 p.
- Mixailova E.V., Shteinberg A.V., Eremeeva I.G. Infechionnie bolezni — 2008. — 6 (1). — P. 31 — 34.
- Skripchenko, N.V., Sorokina M.N. Viral encephalitis and meningitis inchildren. Moscow: Medicine, 2004. —415p.
- Shteinberg A.V., Ivanova G.P. et al Methodological guidelines — S-Pb.: — 2013. — 18 p.
- Avedisova A.S. Pharmoteka. — 2005. — №6. — P. 51-54
- Aleksandrovski Yu.A., Avedisova A.S., Yastrebov D.V. Psixiatriya i psixofarmakoterapiya. — 2003. — №6. —P . 51—54
- Lukianova E.M. Kachestvennaia klinicheskaia praktika. — 2002. — №4. — P. 34-42.







Комментировать