Аналіз результатів надання невідкладної допомоги 337 дітям з критичними ВВС за період з 01.09.2003 по 01.09.2007 у Центрі дитячої кардіології та кардіохірургії.
І.М. Ємець Науково-практичний медичний центр дитячої кардіології та кардіохірургії МОЗ України, м. Київ
Резюме. Критична вроджена вада серця (ВВС) — патологія розвитку серця, яка не дозволяє забезпечити адекватний серцевий викид з достатнім для підтримки життя тиском і насиченням киснем, що призводить до смерті в перші дні життя за відсутності екстреного кардіохірургічного втручання. В Україні щороку народжується більше тисячі дітей з критичними ВВС, при природному перебігу майже всі вони помирають протягом перших місяців життя. В статті проведено аналіз результатів надання невідкладної допомоги 337 дітям з критичними ВВС за період з 01.09.2003 по 01.09.2007.
Вступ
В Україні щороку народжується близько 400 000 дітей, 3 500 з них мають вроджену ваду серця (ВВС).
Серед немовлят з вадами серця 30– 40% знаходяться у критичному стані [1]. Одне з визначень критичної вади серця запропонував Олександр Надас в 1978 р. [2], згідно якого це патологія розвитку серця, яка не дозволяє забезпечити адекватний серцевий викид з достатнім для підтримки життя тиском і насиченням киснем, що призводить до смерті в перші дні життя за відсутності екстреного кардіохірургічного втручання.
До критичних ВВС належать [3,4]: транспозиція магістральних судин з інтактною міжшлуночковою перегородкою (ТМС); критичний аортальний стеноз (АС); критична коарктація аорти (КА); критичний стеноз легеневої артерії (СЛА); атрезія легеневої артерії з інтактною міжшлуночковою перегородкою (АЛА); тотальний аномальний дренаж легеневих вен з обструкцією відтоку (ТАДЛВ); гіпоплазія лівих відділів серця (ГЛВС).
Критичний стан пацієнтів при цих вадах зумовлений основними патологічними синдромами: гіпоксемією, серцевою недостатністю або їх поєднанням.
У формуванні артеріальної гіпоксемії при ВВС можуть відігравати роль три основні механізми:
1) право’ліве шунтування венозної крові (СЛА, АЛА, ТАДЛВ, ГЛВС);
2) знижений легеневий кровотік і зменшене повернення артеріальної крові до серця (СЛА, АЛА, ТАДЛВ);
3) роз’єднання великого і малого кіл кровообігу (ТМС).
Серцева недостатність виникає внаслідок різко збільшеного переднавантаження та постнавантаження на шлуночки серця (АС, КА, СЛА, АЛА, ТАДЛВ, ГЛВС).
При природному перебігу майже всі новонароджені з такими вадами вмирають протягом перших місяців життя. Сучасний рівень кардіохірургії дозволяє виконати хірургічну корекцію, однак хворі знаходяться в критичному стані, який значно підвищує ризик операції. Своєчасне виявлення таких пацієнтів, адекватне ведення на етапі транспортування та доопераційному етапі, вибір коректного методу втручання призводять до зменшення ризику хірургічних втручань та покращення результатів лікування.
Мета роботи: аналіз результатів надання невідкладної допомоги дітям з критичними ВВС для оптимізації ведення таких пацієнтів на доопераційномуетапі та покращення результатів інвазивних втручань.
Матеріал і методи дослідження
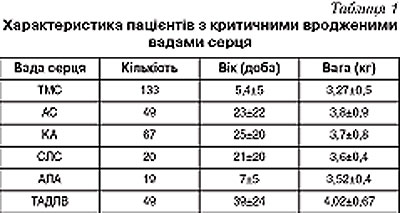
Кількість дітей, направлених до Центру дитячої кардіології та кардіохірургії, з кожним роком зростає і, відповідно, зростає кількість діагностованих вад серця та дітей, що потребують екстреного хірургічного втручання. За період з 01.09.03 по 01.09.07 до Центру було направлено 10 840 пацієнтів з підозрою на ВВС. Діагноз підтверджено у 44% (n=4854) пацієнтів, екстреного хірургічного втручання з приводу критичної ВВС потребували 337 (6,9%) пацієнтів (табл.1).
Загальноклінічні дослідження включали збір анамнезу, клінічний огляд, аускультацію, вимір артеріального тиску, електрокардіографічне, рентгенологічне дослідження, оцінку фізичного розвитку. Проводилися загальноклінічні аналізи крові і сечі, поглиблений біохімічний аналіз крові та інші клінічні і лабораторні дослідження за потреби.
Для діагностики ВВС, дослідження анатомії вад, визначення ступеня і оцінки функціонального стану серцяна дота післяопераційному етапі використовували метод комплексної ехокардіографії (ЕХОКГ). Дослідження виконували за стандартною методикою на апаратах «Philips’Sonos 5500», «Philips’Sonos 7500», «Siemens’Acuson Cypress». У випадках неуточнених супутніх вад серця, при складних формах ВВС, а також за необхідності проведення ендоваскулярних паліативних або радикальних втручань проводилася катетеризація серця і ангіокардіографія, які виконували з використанням комплексів рентгенівської електронно’оптичної апаратури фірми «Simens» — «Axiom Artis».
Після встановлення діагнозу критичної вади серця стан дитини стабілізували в умовах інтенсивної терапії за наступною схемою:
-припинення ентерального годування;
-інфузія вазопростану (простогландину Е) в дозі 0,003–0,01 мкг/кг/хв (окрім ТАДЛВ);
-за необхідності — допамін (добутамін), починаючи з 3 мкг/кг/хв;
-контроль і корекція порушень кислотно’лужного стану;
-забезпечення адекватного терморежиму дитини;
-енергетичний і водний баланс забезпечувався за рахунок інфузії розчину 5% глюкози з розрахунку 100 мл/кг на добу;
-водний баланс дотримували негативним (при АС,КА), близьким до нульового (при ТМС, СЛА, АЛА, ТАДЛВ);
-за необхідності — стимуляція діурезу: фуросемід в/в 1–2 мг/кг 4–6 разів на добу;
-при ознаках декомпенсації вади, нестабільній гемодинаміці — переведення на штучну вентиляцію легень (концентрація О2 в газовій суміші 21%, режим гіповентиляції при дуктусзалежних вадах).
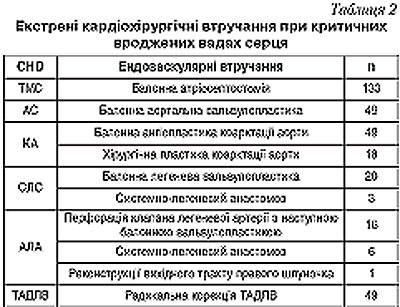
Після підготовки та стабілізації стану пацієнтів в умовах інтенсивної терапії (від 30 хвилин до 24 годин) дітям з критичними ВВС проводили наступні екстрені кардіохірургічні втручання (табл.2).
Результати досліджень та їх обговорення
При наданні невідкладної хірургічної допомоги дітям з критичними вадами серця перевага надавалась малоінвазивним рентгенендоваскулярним методам (табл.2). Це пов’язано з меншим ризиком та достатньою ефективністю таких втручань порівняно з відкритими хірургічними операціями.
При ТМС атріосептостомія (процедура Рашкінда) була проведена у 133 пацієнтів: у 128 — під контролем рентгеноскопії, у 5 — під контролем ехокардіографії.
Середній вік пацієнтів склав 5,4±5 діб, вага — 3,27±0,5кг, середнє насичення киснем артеріальної крові — 65±18%.
Найбільш тяжкими були пацієнти, у яких не функціонувала відкрита артеріальна протока, а змішування крові відбувалось на рівні нерозширеного овального вікна; сатурація у таких дітей коливалась від 20 до 50%. Важкий станцих немовлят пов’язаний з пізньою діагностикою вади та неадекватним веденням на догоспітальному етапі.
Процедура Рашкінда була ефективною у 100% випадків. Середній розмір овального вікна збільшився з 3,5±1,19 до 7,25±1,24 мм. Сатурація зросла з 65±18% до 75±9,37%.
Летальність склала 3% (n=4). Один пацієнт помер на 5 добу після втручання внаслідок перфорації стінки передсердя під час процедури, 3 пацієнти — внаслідок супутньої патології: сепсис з двобічною інфарктпневмонією, стеноз жовчовивідних шляхів, внутрішньоутробна інфекція з дистрофією печінки інтоксикацією та гіпербілірубінемією. Корекцію вади в подальшому провели в 112 випадках. Це були: операція артеріального переключення у 66 пацієнтів (середній вік — 10±3 доби) та у 5 дітей у віці 1–7 місяців (після звужування легеневої артерії з накладенням системно’легеневого анастомозу з метою тренування лівого шлуночка); операція атріального переключення — у 41 пацієнта, (середній вік 5,5±1,3 місяця).
За період роботи центру було проведено 49 дилатацій критичного стенозу аортального клапана. Середній вік пацієнтів склав 23±22 доби, середня вага — 3,8±0,9 кг. Операція була ефективною у всіх пацієнтів, в середньому градієнт зменшився з 94±34 до 20±13 мм рт. ст., фракція викиду збільшилась з 43±13% до 68±11%. У 90% пацієнтів відмічено збільшення аортальної недостатності після дилатації на 1 рівень. Летальність склала 4%, 2 пацієнти померли внаслідок вихідної поліорганної недостатності та ВУІ.
З приводу критичної коарктації аорти було проведено 49 балонних ангіопластик. Середній вік пацієнтів склав 25±20 діб, середня вага — 3,7±0,8 кг. Втручання було ефективним у всіх випадках, фракція викиду в середньому зросла з 42±15 до 64±9,7%, градієнт тиску знизився з 66±8 до 10±7 мм рт. ст. Летальність склала 4% (n=2). Причиною летальності у всіх випадках стала вихідна поліорганна недостатність внаслідок несвоєчасної діагностики та декомпенсації вади на догоспітальному етапі. Незважаючи на високу безпосередню ефективність втручання, 74% (n=35) пацієнтів потребували відкритої хірургічної корекції вади протягом наступних трьох місяців після втручання внаслідок наростання градієнту на рівні коарктації та появи ознак збільшеного постнавантаження на лівий шлуночок. Первинну хірургічну корекцію коарктації аорти за методом розширеного анастомозу «кінець в кінець» проводили у 18 хворих, середній вік яких становив 12±11 діб, вага — 3,3±0,6 кг. Два пацієнти потребували розширеної пластики дуги аорти внаслідок її значної гіпоплазії за методикою «subclavian flap». Летальних випадків в післяопераційному періоді не спостерігалось.
Операція була ефективною у всіх хворих, фракція викиду в середньому зросла з 50±12 до 65±8%, градієнт тиску знизився з 59±12 до 14±5 мм рт.ст., в подальшому 1 пацієнт потребував рентген’ендоваскулярної дилатації рекоарктації аорти через 6 місяців після операції.
При критичному стенозі легеневої артерії проведено 20 балонних вальвулопластик, у всіх пацієнтів відмічено підвищення сатурації з 75,4±15% до 93±5,5% та зниження систолічного тиску в правому шлуночку з 94±23,6 до 43±13,7 мм рт.ст. Внаслідок зниженого легеневого кровотоку 3 (15%) пацієнти потребували накладання анастомоза блеллока на 4–7 добу після втручання. Недостатність легеневого кровотоку була зумовлена гіпоплазію тристулкового клапана та правого шлуночка.
Для покращення стану у новонароджених з атрезією легеневої артерії з інтактною міжшлуночковою перегородкою виконували перфорацію мембрани клапана легеневої артерії з наступною балонною дилатацією. У 16 пацієнтів з 19 перфорація мембрани клапана легеневої артерії булла успішною. Середній вік пацієнтів склав 7±5 діб, вага 3,52±0,4 кг. У всіх пацієнтів відмічено появу антеградного кровотоку у легеневу артерію, підвищення сатурації з 61±15 до 84±7% та зниження систолічного тиску в правому шлуночку з 93±17 до 47±12 мм рт.ст. Незважаючи на високу безпосередню ефективність процедури 50% (n=9), пацієнти потребували додаткового втручання протягом першого року після дилатації. Шістьом хворим виконано накладання системно-легеневого анастомозу в ранньому післяопераційному періоді (1–9 день після втручання) після зупинки функції артеріальної протоки, 2 — повторну балонну вальвулопластику через 6 місяців та 2 пацієнтам проведена відкрита реконструкція вихідного тракту правого шлуночка через 1 тиждень і 7 місяців після втручання.
Трьом пацієнтам, у яких спроба перфорації була безуспішною, було проведено балонну атріосептостомію та накладення системно’легеневого анастомозу.
Радикальна корекція вади в умовах штучного кровообігу виконувалась лише у дітей з тотальним аномальним дренажем легеневих вен. Суть операції полягала в накладенні анастомозу між лівим передсердям та коллектором легеневих вен. Післяопераційна летальність в даній групі склала 16,4% (n=8). У віддаленому періоді 84,5% пацієнтів не мали скарг та не потребували медикаментозної терапії. Жоден з пацієнтів не потребував проведення повторних операцій.
Проблема ранньої діагностики критичних ВВС потребує всебічного дослідження. Маніфестація ознак вад серця у неонатальному періоді поєднується з незрілістю механізмів компенсації, що призводить до підвищення ризику хірургічного втручання. З огляду на прогресуюче погіршення геодинаміки, своєчасність постановки діагнозу, адекватне ведення хворого на догоспітальному етапі, коректне транспортування пацієнта, невідкладна кардіохірургічна допомога є головними передумовами успіху.
Зволікання створює реальну загрозу здоров’ю і життю хворого. Одним з основних способів вирішення проблеми надання своєчасної допомоги дітям з критичними ВВС є розвиток пренатальної діагностики в Україні.
Використання рентген’ендоваскулярних методів при критичних ВВС доцільне завдяки зменшенню ступеня ятрогенного впливу, пов’язаного з операційною травмою, тривалим наркозом і штучною вентиляцією легень, масивною інфузійною терапією. Все це зумовлює значні переваги ендоваскулярного втручання над хірургічним.
Застосування малоінвазивних рентген’ендоваскулярних процедур забезпечує значний виграш у часі при потребі у відстроченні оперативного втручання, пов’язаного з підвищеним ризиком. Водночас радикальність ендоваскулярних операцій при КА, АЛА є дискутабельним питанням, враховуючи високий процент потреби в реінтервенції.
Висновки
- Стратегічним напрямком порятунку хворих з критичними ВВС є своєчасна діагностика та транспортування у спеціалізовані заклади.
- Екстрені кардіохірургічні втручання усувають загрозу життю у 95% випадків.
- Рівень післяопераційної летальності залежить від термінів виявлення критичними ВВС у дитини, адекватності транспортування та надання допомоги на догоспітальному етапі.
Література
- Kirklin J.W., Barratt_Boyes S.G. eds Cardiac Surgery. 2nd edition. — New York: Clurchill Livingstone, 1993. — 1774р.
- Mavrodis C., Backer C.L. Pediatric cardiac surgery. 2nd edition. — St. Louis: Mosby, 1994. — 645р.
- Nadas A.S., Fyler D.C. Pediatric cardiology // Third ed. Philadelphia W.B. Saunders Co. — 1972. — Р.749.
- Stark J., de Leval M. Surgery for congenital heart defects. 2nd edition. Philadelphia WB Saunders Co. — 1994. — 712р.














Комментировать