Изучение вопросов взаимосвязи эндокринных расстройств и психических заболеваний. Обзор литературы.
Горобец Людмила Николаевна
Московский научно-исследовательский институт психиатрии, отделение психиатрической эндокриноло- гии (Москва)
Изучение вопросов взаимосвязи эндокринных расстройств и психических заболеваний имеет достаточно давние традиции как в отечественной, так и в зарубежной психиатрии (2, 4, 5, 6, 7, 11,16).
Первые сообщения о наличии патологии эндо- кринных желез у психически больных относятся к 80-90 годам XIX столетия. Основываясь лишь на клинических методах исследования, психиатры установили ряд положений, имеющих значение и в настоящее время. Так, В. Гризингером (16) было отмечено, что беременность, послеродовое со- стояние и кормление часто способствуют разви- тию «сумасшествия». Г. Шюле (2, 5) придавал большое значение исчезновению или скудности menses при меланхолиях. В.Ф. Чиж (2, 5) считал, что при психозах эндокринные расстройства встречаются чаще, чем у здоровых людей, и указывал на то, что у душевнобольных взаимозависимость между эндокринной и психическими сфе- рами проявляется в возникновении эндокринной патологии при ухудшении психического состояния пациентов и ее исчезновении с окончанием психоза. С.С. Корсаков (2, 16) указывал на связь «туч- ности» при душевных заболеваниях с неблагоприятным исходом психопатологических процессов.
Рядом авторов (М.С. Маслов, Н. Пенде и др.) (2, 5,16) была предпринята попытка на основе выявленной патологической активности со стороны той или иной эндокринной железы выделить определенные типы морфоконституции и темперамента и представить их в качестве конституциональной недостаточности, приводящей к развитию психических заболеваний.
Исторический интерес представляет мнение некоторых авторов, которые усматривали в нарушении функции отдельной эндокринной железы основную причину развития шизофрении. В формиро- вании «эндотоксической теории» важную роль сыграли работы Е.К. Краснушкина, В.П. Осипова, В.П. Протопопова и др. (2, 5, 13, 16).
В качестве аргумента исследователи приводили результаты реакции Абдельгардена, которая вы- являла нарушение метаболизма эндокринных желез у больных с dementia praecox.
На особую роль эндокринной системы при шизофрении указывали результаты исследования морфологи желез внутренней секреции. Так, в частности, И.В. Лысаковский (5,16) выявил макро- скопическую патологию щитовидной железы, надпочечников, гипофиза и половых желез, что выражалось в дегенеративных процессах парен химы и весовых отклонениях этих органов.
Оценка патологии желез внутренней секреции как пускового механизма развития психозов привела к ряду неоправданных терапевтических мероприятий: трансплантации тканей половых желез, тиреоидэктомии, адреналэктомии, кастрации, терапии гормонами (1, 2, 5, 16).
В ряде случаев при применении данных методик лечения отмечалось улучшение психического со- стояния, зависящее, по мнению ряда авторов (1,5, 16), от стимулирующего действия гормональных препаратов или его полного отсутствия. Од- нако, в целом эффект эндокринной терапии при психических заболеваниях был спорным, а благо- приятные результаты получали главным образом в тех случаях, когда имелась склонность к спонтанному выздоровлению или улучшению.
В ходе дальнейших исследований выяснилось следующее:
1. Шизофрения не так уж часто возникает в пу- бертатном возрасте и в связи с генератив- ными процессами.
2. У больных шизофренией не всегда удается обнаружить эндокринные сдвиги.
3. Выраженные эндокринные расстройства во- все не обязательно приводят к психическим расстройствам.
Более того, ряд изменений эндокринных желез
может быть связан с осложняющими заболеваниями и терминальными состояниями (1, 2, 5).
В работах О. Клинебергера, Н. Пенде (1, 2, 16) встречаются данные о многочисленных попытках найти характерные нарушения психики при опре- деленном эндокринном заболевании. В результате исследований было установлено, что при од- ной и той же эндокринной патологии встречаются различные по своей направленности психопато- логические синдромы. Так, например, гипофунк- ция щитовидной железы может сопровождаться не только вялостью и безразличием, но и взрыв- чатостью, гневливостью и импульсивностью. Таким образом, на том этапе развития психонейро- эндокринологии исследователи пришли к заключению о сложности взаимосвязи эндокринной, нервной и психической сфер, однако на многие возникшие в то время вопросы ответа найти не удавалось.
В 50-е – 60-е годы ХХ столетия в связи с успехами экспериментальной эндокринологии вновь появились гипотезы, рассматривающие эндокринные отклонения как важные патогенетические звенья в развитии нервно-психических расстройств. Рядом исследователей (1, 2, 5, 7, 8, 12, 13, 15) были предприняты попытки выделения тех форм пси- хических заболеваний, для которых характерны эндокринные отклонения, а также изучения влияния эндокринного фактора на клинику, течение и прогноз этих форм с целью разработки соответ- ствующих терапевтических рекомендаций. Р.А. Наджаров (5) обращал внимание на достаточно частое развитие выраженных эндокринных нару- шений, преимущественно в виде ожирения и гир- сутизма, при ядерных формах шизофрении. Он утверждал, что эти нарушения возникали в стадии стабилизации шизофренического процесса. При гебефренической форме данные нарушения по- являлись рано, чаще в манифестном периоде болезни. Автор связывал эндокринные сдвиги у больных с тяжестью и злокачественностью про- цесса. Д.Д. Орловская (12, 13) на основании ис- следования большой группы больных шизофре- нией, у которых в процессе заболевания возника- ли выраженные и стойкие эндокринные дисфунк- ции, установила, что последние являются, как правило, полигландулярными. Она же указывала на три наиболее частых эндокринных синдрома — гирсутизм, ожирение и инфантилизм, которые претерпевают своеобразную динамику у больных шизофренией. Подчеркивалась атипичность структуры эндокринных расстройств, выходящая за рамки известных эндокринных заболеваний и синдромов. Было высказано предположение об известном параллелизме течения шизофрении и динамики эндокринных расстройств: чем интен- сивнее темп эндогенного процесса, тем скорее возникают эндокринные сдвиги. Т.А. Невзорова и Г.Я. Авруцкий (1) полагали, что острые периоды шизофрении всегда сопровождаются сложными эндокринными и вегетативными сдвигами, сово- купность которых свидетельствует не только об участии в патологическом процессе гипоталамуса, но и всей диэнцефальной и мезодиэнцефальной областей. Касаясь патофизиологических механизмов развития ожирения и вирилизма у боль- ных шизофренией, М.С. Кахана (5, 16) полагал, что если в начальных стадиях психопатологического процесса функция коры надпочечников у многих больных снижена (что проявляется в поте- ре массы тела, мышечной астении, гипотонии), то в дефектных состояниях функция коры надпочеч- ников повышается, что приводит к ожирению и вирилизму (2, 5).
Особое место занимали попытки представить ши- зофрению на основе концепции о стрессе и общем адаптационном синдроме по Г. Селье. Одна- ко результаты исследования системы гипофиз- надпочечники, проведенные для обоснования этой гипотезы, равно как и попытки эндокринной терапии на основе гормонального анализа оказа- лись противоречивыми.
Наряду с изучением патогенетических механизмов эндокринных нарушений при шизофрении ученых интересовал важный научно-практический вопрос установления корреляций между гормональными показателями и клинической картиной заболевания. Первые исследования в этом направлении показали определенные зависимости между уровнем 17-кетостероидов (17-КС) и психическим состоянием больных (5, 8, 15, 16). Они проявлялись в положительной корреляции между высокими цифрами 17-КС и двигательным возбуждением и растерянностью. Нормализация гормональных показателей соответствовала ре- дукции психопатологической симптоматики. При изучении реактивности коры надпочечников и го- над на стимуляцию АКТГ была выявлена зависи- мость при непрерывнотекущей шизофрении меж- ду измененной реактивностью этих желез и дли- тельностью заболевания. Рядом авторов (2, 16) была выявлена разница гормональных уровней у больных параноидной и гебефренической фор- мами шизофрении. В обеих группах уровни гона- дотропинов, АКТГ и половых гормонов были сни- жены, а цифры гормонов надпочечников и щито- видной железы не отличались от нормы.
Относительно выраженности эндокринных рас- стройств при шизофрении у большинства иссле- дователей имелось определенное единство мне- ний (1, 2, 5, 8, 12, 13, 24). Так, например, было установлено, что тяжелая эндокринная патология в виде сахарного диабета, актромегалии, болезни Аддисона и Иценко-Кушинга является при психи- ческих заболеваниях редкостью, а преобладают транзиторные, рудиментарные и полиморфные расстройства, которые занимают как бы промежу- точное положение между нормой и патологией и выявляются с помощью определенных функцио- нальных проб и нагрузок. Было установлено положение, согласно которому в основе эндокрин- ных нарушений при шизофрении лежит дисрегуляция центральных механизмов и, в первую очередь, диэнцефальной области.
Необходимо указать на значительный вклад, который внесли работы отечественных ученых, таких как С.Г. Жислин, А.И. Белкин, Д.Д. Орловская и др. в исследование эндокринного фактора при шизофрении.
Большое значение в понимание взаимоотношений эндокринных и нервно-психических процессов внесли работы М. Bleuler (24). Он одним из первых отошел от принятых в психоэндокринологии схем, трафаретов и стандартов, отметив особое значение для клиники психических расстройств темпа нарастания эндокринной патологии, преморбидных особенностей личности, связь нарушения гормональной регуляции с различными по своей направленности расстройствами в сфере влечений, побуждений импульсов и элементарных эмоций.
Как указывает автор, при тяжелых и бурно развивающихся нарушениях функции желез внутренней секреции наблюдаются психозы типа острой экзо- генной реакции. При хронических эндокринных заболеваниях имеет место амнестический синдром. И, наконец, при длительных, но сравнительно легких эндокринных заболеваниях психо- патологическая симптоматика характеризуется расстройством единства влечений, нарушением инстинктов, побуждений и настроений. Указанные изменения психики, встречающиеся наиболее часто при эндокринных заболеваниях и не доходящие до степени психоза, М. Bleuler объединил в понятие «эндокринный психосиндром». Автор особо подчеркивал, что эндокринный психосиндром не специфичен для патологии какой-нибудь одной железы внутренней секреции, а встречается при любых эндокринных заболеваниях, даже с диаметрально противоположным типом расстройства обмена веществ (например, гипер- и гипоти- реоз). При этом нет строгого параллелизма между ухудшением соматического состояния и нараста- нием психопатологических симптомов. Выраженность эндокринного психосиндрома во многом за- висит, как отмечал М. Bleuler, от преморбидных и наследственных особенностей личности. Подчер- кивалась возможность появления соответствующих психопатологических картин и при различных неэндокринных заболеваниях. В то же время, автор отмечал, что внутри рамок эндокринного пси- хосиндрома патология той или иной железы имеет свои особенности. Однако, это не важно в ха- рактеристике эндокринного психосиндрома. Главное значение заключается в том, что все психопа- тологические картины можно объединить в рамки единого синдрома, характерного для всех эндокринных заболеваний.
Синтез и последующее изучение в 50-х годах хлорпромазина, а в дальнейшем и других нейролептических препаратов, ознаменовали открытие психофармакологической эры (ПФЭ) в психиатрии (10). Одним из признаков указанных препаратов является способность вызывать характерные по- бочные эффекты, связанные с их специфической дофаминблокирующей активностью в тубероин- фундибулярной области ЦНС. Это приводит как к увеличению выработки гормона пролактина, нарушениям секреции ряда тропных гормонов, так и к дисрегуляции диэнцефальной области ЦНС, обусловливающей по принципу «обратной связи» нарушения нормального функционирования пе- риферических желез внутренней секреции, след- ствием чего является развитие нейроэндокринных дисфункций. По классификации побочных эффек- тов и осложнений нейролептической терапии, предложенной Гуровичем И.Я. в 1971 г. (7), обменно-эндокринные нарушения относятся к побочным эффектам, обусловленным особенностя- ми прямого действия препаратов.
К наиболее характерным эндокринным побочным эффектам нейролептической терапии относят: нарушения менструального цикла, галакторею, гинекомастию, увеличение массы тела, гипергли- кемию, сексуальные дисфункции, явления дисти- реоза (1, 2, 7, 12, 15, 16).
С началом ПФЭ массовое, а зачастую довольно длительное применение нейролептических пре- паратов фактически привело к существенным сдвигам в клинической картине, течении и патоге- незе психозов, позволило сформулировать поня- тие лекарственного патоморфоза, что в полной мере относится и к нейроэндокринным дисфунк- циям при шизофрении.
В связи с этим, эндокринные расстройства при шизофрении, возникающие в процессе антипсихо- тической терапии, являются, по-видимому, отра- жением как дисбаланса функционального состоя- ния желез внутренней секреции, возникающего в результате патогенетических механизмов самого психического заболевания, факторов «почвы» — с одной стороны, так и побочного эффекта ПФТ – с другой (2 ,5, 16).
Применение в психиатрической практике тонких радиохимических и иммуноферментных методов определения гормонов в биологических жидко- стях, открытие гипоталамических рилизинг- и ин- гибирующих факторов и выделение их в чистом виде позволило провести ряд исследований с це- лью расширения знаний о нейроэндокринных вза- имодействиях. Это, в свою очередь, дало возмож- ность изучить не только клинические аспекты эн- докринных дисфункций, возникающих в процессе ПФТ у больных шзофренией, но и сопоставить их с развивающимся гормональным дисбалансом и выявить важные закономерности, лежащие в ос- нове воздействия нейролептиков на эндокринную систему (1, 2, 5, 7, 10, 16).
Особое внимание к эндокринологическим иссле- дованиям в психиатрии на современном этапе связано с двумя основными причинами.
Во-первых, с изменившейся ситуацией в клиниче- ской практике, когда перед психиатрами на дан- ном этапе были поставлены задачи не только ку- пирования психопатологической симптоматики, но и обеспечения высокого уровня социальной адап- тации и функционирования психически больных, улучшения качества их жизни.
И, во-вторых, – с появлением новой группы атипичных нейролептиков (антипсихотиков), в струк- туре побочных эффектов которых преобладают именно эндокринные нарушения.
Анализ современных литературных данных обна- руживает наибольшее количество публикаций, касающихся трех основных эндокринных симпто- мокомплексов: синдрома гиперпролактинемии (ГП) (галакторея, гинекомастия, нарушения мен- струального цикла, сексуальные расстройства); метаболического синдрома (МС) (прибавка веса, гипергликемия, сахарный диабет, кетоацидоз) и дистиреоза (гипер- и гипотиреоз) (4, 6, 10, 11, 23,43).
Фармако-эпидемиологические аспекты
Следует отметить, что, анализируя вопросы вли- яния ПФТ на частоту и выраженность эндокрин- ных расстройств у психических больных, M.Bleuler (24) справедливо отмечал, что разрешение его затруднено в связи с отсутствием достоверных данных относительно распространения эндокрин- ной патологии при шизофрении в «допсихофар- макологическую» эру. По данным Полищука И.А., распространенность эндокринных нарушений у стационарных больных в 60-е годы составляла до 1,1%, тогда как в амбулаторной практике (по дан- ным Сканави Е.Е.) подобные нарушения встречались практически у 50% больных шизофренией (2,16).
Гипепролактинемия
Несмотря на то, что о многих клинических признаках ГП известно давно, к настоящему моменту от- сутствуют масштабные эпидемиологические ис- следования данной проблемы. Имеются лишь единичные данные, в которых частота встречае- мости симптомов ГП при терапии нейролептиками колеблется в пределах от 3% до 90%.
По данным Kinross-Whright V., Ayd F. (7), частота встречаемости аменореи, длительностью от не- скольких месяцев до нескольких лет, на фоне приема типичных нейролептиков составляет от 5% до 85%. Santoni J.P., Saubadu S. (4) приводят данные о распространенности аменореи у 33% пациентов, получавших нейролептики. Частота встречаемости галактореи колеблется от 7% до 26%, по данным Robinson B. (7), и от 10% до 90%, по данным Pommeet B. et al. (7). Kotin J. и Buvant J. (4) среди обследованных больных с повышенным уровнем пролактина выявил у мужчин импотенцию в 60% случаев, отмечая при этом задержку эякуляции, болезненность и отсутствие оргазма.
Анализ результатов фармако-эпидемиологических исследований ГП при терапии АА показал, что прием эглонила вызывает развитие ГП в 80-100%; рисперидона — в 35-94%; оланзапина –3-52%; клозапина – 4-12,5% случаев, а терапия кветиапином не сопровождается изменениями уровня пролактина крови (4, 21, 34, 42, 45, 46).
Ожирение
Изменения веса у больных шизофренией были хорошо известны еще до внедрения нейролептиков в клиническую практику (6, 11). Однако с по- явлением этих препаратов прибавка в весе приобрела статус серьезной проблемы психиатриче- ской практики (6, 7, 17, 18, 28). В соответствии с данными, опубликованными, в приложении к Национальному анкетированию по вопросам (National Health Interview Survey, NHIS) в 1989 г. (53), показатели индекса массы тела (ИМТ) у больных шизофренией сопоставимы или превос- ходят аналогичные значения в населении (6, 11,53).
Доля лиц с избыточным весом среди больных шизофренией, находящихся на терапии типичными нейролептиками, варьирует от 6,7% до 62%, при- чем наиболее высокие пропорции установлены у женщин (6, 11). Amdisen A. (7) отмечал, что тера- пия хлорпромазином приводит к увеличению веса в 15,9% случаев, клопентиксолом – в 6,7% случаев, перфеназином – в 8% в течение первых пяти лет их применения, тогда как Johnson D.A. опи- сывал прибавку веса на терапии пролонгами (флюпентиксола деканоатом и флюфеназина де- каноатом) в 55% случаев (6).
Данные исследований, проведенных в течение последнего десятилетия, показали, что увеличе- ние массы тела более чем на 20% у больных ши- зофренией на фоне приема атипичных антипсихотиков (АА) наблюдается в 40-80% случаев (6, 11,22, 23, 31, 39).
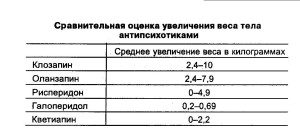
Проведенные Allison D.B. и соавт. (18) исследова- ния по оценке влияния классических (хлорпрома- зин, галоперидол, флуфеназин, трифлуоперазин, перфеназин, тиоридазин) и атипичных антипсихо- тиков (клозапин, оланзапин, сертиндол, зипрози- дон, кветиапин) на массу тела выявили, что сред- нее увеличение веса при применении атипичных антипсихотиков было выше, чем у классических нейролептиков. Атипичные антипсихотики в зна- чительной степени различаются между собой по возможности вызывать повышение массы тела.
Таблица № 1.
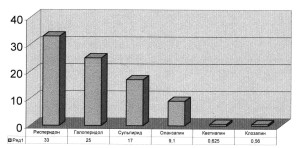
На основе литературных данных, по частоте встречаемости и степени выраженности этого по- бочного эффекта АА их можно распределить в следующем порядке: клозапин, оланзапин, риспе- ридон, кветиапин, сульпирид (6, 11, 17, 18, 47, 48).
Большинство авторов также указывает на то, что АА в большей степени вызывают увеличение ве- са, чем препараты прошлого поколения. Однако следует подчеркнуть, что сравнение АА проводилось в основном с типичным нейролептиком гало- перидолом, который, как известно, вызывает меньшую прибавку веса по сравнению с фенотиа- зиновыми производными (6, 11, 31). Таким образом, для более взвешенных выводов требуется дальнейшие сравнительные исследования по этой проблеме.
Нарушения в регуляции глюкозы
Более высокий риск развития сахарного диабета II типа при шизофрении, по сравнению с данными в общей популяции, отмечался в научной литературе с 1926 года (6, 21), в том числе отмечались нарушения теста толерантности к глюкозе (29).Общеизвестно, что в отличие от диабета I ти- па, который обусловлен деструкцией β-клеток и приводит к абсолютной инсулиновой недостаточ- ности, при диабете II типа отмечается относи- тельный дефицит инсулина, который может варь- ировать в широких пределах – от инсулинорези- стентности до разнообразных дефектов секреции инсулина. Сахарный диабет II типа чаще встреча- ется у пациентов в возрастной группе старше 40 лет (6, 11).
Сведения о возникновении гипергликемии, спровоцированной нейролептиками, впервые были представлены в сообщениях по изучению фенотиазиновых производных в 1964 г. (6, 11, 26, 43, 51). В дальнейшем было показано, что типичные нейролептики могут вносить изменения в глюкозоинсулиновый гомеостаз (6, 11, 26, 29). Так хлорпромазин прежде использовали для предотвра- щения гипоглекимии у пациентов со злокачественной инсулиномой (30). Он также вызывал гипергликемию у лабораторных животных (6, 11,19). Кроме того, публиковались сообщения о том, что хлорпромазин может индуцировать гипергликемию у здоровых добровольцев и у пациентов со скрытым диабетом (6, 11, 26, 29).
В последние десятилетия спектр публикаций, связанных с вышеуказанными побочными эффекта- ми, значительно расширился. Наряду с описанием отдельных случаев ГГ и ИНСД на терапии АА, по- явились публикации, касающиеся в основном эпидемиологических аспектов данной проблемы.
После введения фенотиазинов в клиническую практику частота развития сахарного диабета II типа у больных шизофренией возросла с 4,2% в 1956 г. до 17,2% в 1968 г. (6, 11). Многие авторы приводят цифры распространенности сахарного диабета у больных шизофренией от 11% до 18%.
Недавно опубликованное исследование выявило частоту данного расстройства у больных шизофренией в США, равную 14,9%. Исследование, проведенное в Японии, содержит данные о распространенности сахарного диабета среди больных шизофренией 8,8%. Распространенность сахарного диабета II типа зависит от возраста больных: если в группе 50-59 лет сахарный диабет был диагностирован у 12,9%, то в возрастной группе 60-69 лет – у 18,9% больных (6, 11).
Следует подчеркнуть, что наибольшее количество научно-исследовательских работ по данной проблеме, касается таких АА, как оланзапин и клозапин.
В обзоре литературы с 1970 по июнь 2000 г.г. бы- ло описано 10 случаев гипергликемии и 5 случаев кетоацидоза в связи с оланзапином. Об этом же свидетельствуют и другие авторы (6, 11, 37, 38).
Так Hagg S. и соавт. (32) показали, что у 12% больных, длительно принимавших клозапин, раз- вивался сахарный диабет, при этом у 10% отме- чались нарушения толерантности к глюкозе. По отдельным сообщениям других авторов (6, 11, 20,22, 25, 27, 36, 54, 55), описаны единичные случаи развития кетоацидоза, сахарного диабета, нарушения толерантности к глюкозе при терапии оланзапином, клозапином, рисперидоном.
Следует отметить, что в настоящее время не существует убедительных фармако-эпидемио- логических данных о том, что антипсихотические препараты различаются между собой по способ- ности вызывать нарушения регуляции уровня глюкозы (41). Так ретроспективный анализ более 30 000 случаев назначения антипсихотической терапии в США и Великобритании не показал статистически достоверных различий между классическими и атипичными антипсихотиками по частоте развития эндокринных побочных эффектов, связанных с нарушением уровня глюкозы (6, 11).
Дистиреоз
Установлено, что уровень нарушений тиреоидного метаболизма у больных с психической патологией выше, чем в общей популяции, где он встречается с частотой до 6%. MacSweeney et al. (44) отмечали, что уровень встречаемости дистериоза у больных шизофренией с наследственной отяго- щенностью по заболеваниям щитовидной железы значительно выше, чем у пациентов без таковой. Преобладание одной или более тиреоидных дис- функций у пациентов с психической патологией, по данным других авторов (44), ранжируется от 6 до 49%. Авторы отмечают, что наиболее распро- страненными являются транзиторная гипертирок- синемия и так называемый «эутиреоидный синдром», для которого характерны нарушения процесса дейодирования тироксина в трийодтиронин.
По данным Reiser L.W. (44), явления дистиреоза на фоне проведения терапии нейролептиками у женщин встречаются в 7 раз чаще, чем у мужчин, причем, если у женщин дисфункция щитовидной железы чаще предшествует психическому заболеванию, то у мужчин в большинстве случаев возникает после манифестации шизофренического процесса.
По данным Таллера М.Б. (16), проявления дисти- реоза отмечались в 9,1% случаев у больных шизофренией. Анализ полученных им данных пока- зал, что явления дистиреоза чаще встречались у женщин в возрастном периоде от 30 до 60 лет.
Было отмечено, что при рекуррентном течении шизофрении симптомы дистиреоза встречались в 22,6%, при приступообразно-прогредиентном – в 29%, а при непрерывнотекущей – в 48,4% случаев.
Исследования последних лет, касающиеся изуче- ния гормонального профиля тиреоидной оси при психических заболеваниях, выявили разнона- правленность колебаний уровней как ТТГ, так и периферических гормонов щитовидной железы (Т3 и Т4), которые встречаются в 20-49% случаев у больных шизофренией (44).
Механизмы развития ГП, МС и дистиреоза при антипсихотической терапии
Общим биохимическим свойством для всех нейролептиков является их способность блокировать постсинаптические дофаминэргические рецепторы с компенсаторным усилением синтеза и метаболизма дофамина. Нейролептики, вызыва- ющие выраженные нейроэндокринные побочные эффекты, связанные, в частности, с увеличением выработки гормона пролактина, снижением со- держания гормона роста, функциональные нарушения в гипоталамо-гипофизарно-тиреоидной (ГГТ) системе оказывают сильное блокирующее действие на D2 рецепторы в тубероинфундибулярной системе (гипоталамус, гипофиз) головного мозга (2, 4, 10, 11).
В результате нейрохимических исследований к настоящему времени установлено, что нейролеп- тики имеют смешанный профиль рецепторной активности, который представлен на таблице № 2.
Таблица № 2. Профиль рецепторной активности антипсихотиков
| Рисперидон | Оланзапин | Сульпирид | Кветиапин | Клозапин | Галоперидол |
| D1,D2,D3 – до- фамин.5НТ2А, 5НТ2С –серотонин.Н1 – гистамин. |
1 и 2 –
адренерг.D1,D2,D3,D4 –дофамин.5НТ2А,5НТ2С –серотонин.Н1 – гистамин
2 – адренерг. М1 – мускарин.
D2,D3,D4 –дофамин.D1,D2,D3–дофамин.5НТ1А,5НТ2А –серотонин.Н1 – гистамин.
1 и 2 –
адренерг.
D1,D2,D3,D4 –дофамин.5НТ1А,5НТ2А –серотонин.М1 – мускарин. Н1 – гистамин.
2 – адренерг.
D1,D2,D3 – до- фамин.5НТ2А, – серо- тонинН1 – гистамин.
1 и 2 –
адренерг.
Как видно из таблицы, помимо блокады D2-рецепторов они блокируют и другие подтипы дофаминовых рецепторов, а именно – D1, D3, D4, а также серотониновые, гистаминовые, мускариновые, адренэргические и холинэргические.
Когда стало известно, что секреция гормонов передней доли гипофиза, к которым относится пролактин, также регулируется аминэргическими нейронами (исследования Fuxe K., Hokfelt T.; Kleinberg D.L. с соавт.) (4, 21) и начались фарма- коэндокринологические исследования особенно- стей воздействия психотропных препаратов на секрецию пролактина. По данным различных исследователей (Лаакман Г., Ерентраут З.) (4), при- менение нейролептиков ведет к значительному увеличению уровня пролактина. Причем, препараты с высоким сродством к D2 рецепторам вызывают особенно сильную секрецию пролактина, тогда как антипсихотики с низким сродством – вызывают меньший выброс пролактина, а если и вызывают, то только в больших дозах.
Эти предположения подтверждены данными Richelson E. (4), полученными in vitro (рис. 1).
Рис. 1 Блокада нейролептиками D2 рецепторов
Из данных, представленных на рис. 1, следует, что различная степень способности нейролептиков блокировать дофаминовые D2-рецепторы позволяет в определенной мере предсказать развитие гиперпролактинемии. Так рисперидон, галоперидол, сульпирид и оланзапин, обладая большей способностью к блокаде дофаминовых ре- цепторов, вызывают развитие гиперпролактине- мии, тогда как кветиапин и клозапин ее не вызывают.
В последние годы особое внимание исследователей привлечено к изучению вопросов функционирования серотонинэргических систем мозга, в связи с тем, что новое поколение антипсихотических препаратов в большей степени блокирует 5НТ2, чем D2 рецепторы. Известно, что серото- нинэргическая система оказывает модулирующее влияние на дофаминэргические структуры. Пред- полагают, что серотонин угнетает высвобождение дофамина, тогда как блокада постсинаптических серотониновых рецепторов ведет к увеличению содержания дофамина. По-видимому, подобный механизм взаимодействия серотонина и дофамина в тубероинфундибулярной области приводит к уменьшению выраженности явлений ГП. Кроме того, блокада 5НТ2А рецепторов может приводить к нарушению эякуляции у мужчин, а влияние нейролептиков на 5НТ2С рецепторы связывают с усилением аппетита и повышением массы тела. Имеются данные о том, что блокада 5НТ1А рецепторов снижает уровень инсулина и вызывает гипергликемию, а также опосредованно способствует развитию резистентности к инсулину. Нарушения пищевого поведения, приводящие к увеличению веса тела, могут быть связаны и с блокирующим действием нейролептиков на Н1 гистаминовые рецепторы.
Результаты многочисленных экспериментальных исследований, проведенных с целью установле- ния силы аффинитета нейролептиков с различ- ными видами нейрорецепторов суммированы и в сравнительном аспекте представлены в таблице № 3, составленной Мосоловым С.Н (10).
Таблица № 3.
Сравнительная сила блокирующего действия нейролептиков на рецепторы мозга.
| РецепторыПрепарат | D1 | D2 | D3 | 5HT1 A | 5HT2 A | 5HT2 C | α1 | α2 | M1 | H1 |
| Сульпирид | — | ++ | ++ | — | — | ? | — | — | — | — |
| Галоперидол | + | ++++ | +++ | — | ++ | — | ++ | +/- | — | +/- |
| Рисперидон | + | ++++ | ++ | + | +++ | + | +++ | +++ | — | +(+) |
| Клозапин | +/- | + | +/- | +/- | +++ | ++ | +++ | ++ | +++ | ++ |
| Оланзапин | ++ | +++ | ++ | — | +++ | +(+) | ++ | +(+) | +++ | +++ |
| Кветиапин | +/- | + | + | + | ++ | +/- | ++ | +(+) | — | ++ |
«?» – нет данных; «+» — слабая активность; «-» — отсутствие связывающей активности; «+/-» — связывающая активность сомнительна; «+(+)» – слабая или умеренная активность; «++» — умеренная активность; «+++» — выраженная активность; «++++» — максимальная активность (лидирующий по этому действию препарат).
Исходя из данных таблицы № 3 и рисунка № 1, следует ожидать, что сульпирид и галоперидол вызывают выраженную гиперпролактинемию и фактически не вызывают прибавку веса в связи с мощной блокадой D2 рецепторов и отсутствием влияния на 5НТ2С рецепторы. Применение рисперидона отличается слабой или умеренной ГП и незначительной прибавкой веса в связи с блокадой как D2, так и 5НТ2 рецепторов. Клозапин, оланзапин и кветиапин – не вызывают развиия ГП, однако обладают способностью повышать вес и аппетит (бóльшая блокада 5НТ2, чем D2 и D3 рецепторов, а также блокада Н1 рецепторов).
Однако простая экстраполяция данных о рецеп- торной предпочтительности и силе аффинитета того или иного антипсихотика, полученная in vitro, на клинические условия не всегда правомерна, в связи с наличием других факторов, участвующих в развитии нейроэндокринных дисфункций (4, 10).
И если взгляды на механизмы развития ГП у большинства исследователей совпадают и не вызывают больших разногласий, то относительно причин возникновения метаболических эндокринных нарушений и дисфункций со стороны ГГТ-оси, сопутствующих нейролептической терапии, к еди- ному мнению на настоящий момент ученые не пришли.
Высказывается целый ряд гипотез /включая увеличение потребления пищи, малоподвижный об- раз жизни (6, 11)/, объясняющих связанное с нейролептиками увеличение массы тела у больных шизофренией (6, 11, 49). Roger S. et al/цитируется по Sussmun N. (50)/ в своих исследованиях проверили возможные механизмы увеличения веса у этого контингента больных, а также возможные причины, увеличивающие их подверженность развитию указанного побочного эффекта, такие как инертность, негативные симптомы, малая возможность к обучению, социально- экономический статус, госпитализм. Они подтверждают, что увеличение веса, связанное с приемом некоторых новейших антипсихотиков, превосходит этот результат при применении типичных нейролептиков.
Ряд исследователей указывает на возможную связь прибавки в весе с нейрогормональными и нейропептидными изменениями (6, 11, 35, 40). Так, например, по данным Koro C.E. et al (36) увеличение массы тела при терапии оланзапином может происходить при повышении секреции лептина.
Ожирение может быть связано с повышением уровня андрогенов у женщин и снижением их уровня у мужчин. Данные изменения гормонального статуса снижают чувствительность нейронов насыщения в гипоталамусе. Кроме того, повышение уровня пролактина может прямо способствовать увеличению веса тела за счет снижения чувствительности к инсулину или же опосредованно за счет дальнейшего нарушения уровня перифе- рических половых гормонов (6, 11).
Интересно отметить, что по данным ряда исследований, наиболее выраженное увеличение массы тела отмечается у пациентов с исходно низким весом. Однако, по данным других сообщений, подобной связи обнаружено не было. Отмечается также, что прибавка веса, связанная с нейролеп- тиками, может быть серьезной проблемой для пациентов детского и подросткового возраста, в связи с возрастными нейроэндокринными особенностями (6, 11, 49).
Basile V.S et al /цитируется по Sussmun N. (50)/,подтвердили значение генетических факторов, оказывающих влияние на развитие побочных эффектов, таких как ожирение, у больных шизофренией. Например, у больных, склонных к увеличе- нию веса при лечении клозапином, генетический анализ показал различие по гену серотониновых рецепторов HTR2C, адренэргических рецепторов ADRB3, ADRA1A и фактора некроза опухоли TNF- α по сравнению с больными, вес которых при при- еме клозапина не изменялся (11).
Относительно предполагаемых механизмов развития нарушений регуляции глюкозы, возникающих в результате приема нейролептиков, мнения многих ученых неоднозначны. Тем не менее, практически все исследователи сходятся на том, что влияние антипсихотических препаратов на ко- лебания уровня глюкозы не вполне ясны. По- видимому, причинно-следственные отношения, касающиеся нарушения метаболизма глюкозы имеют мультифакторный характер. С одной стороны, определенную роль играют наследственная и половая предиспозиции; с другой – различные метаболические нарушения: прибавка веса; антагонизм антипсихотиков к гистамину, серотонину и дофамину вследствие особенностей воздействия нейролептиков на соответствующие рецепторы ЦНС; влияние на секрецию лептина, С-пептида, инсулина, а также других нейропептидов и гормо- нов (кортизола, СТГ и др.); нарушения липидного обмена (6, 11, 55).
Одним из наиболее сложных и малоизученных вопросов нейроэндокринных дисфункций являются механизмы развития дистиреоза у больных шизофренией в процессе нейролептической терапии. Исторический интерес представляет гипотеза, выдвинутая в 1932 г. Gjessing (44), который предполагал, что наличие взаимосвязей между нарушениями основного обмена и азотистого баланса у больных шизофренией связано с изменениями функции щитовидной железы. В 50-е годы ХХ столетия Reiss M. et al (2), сопоставляя ре- зультаты функциональной активности щитовидной железы, полученные с помощью радиоактивного йода, с данными основного обмена, выявили разнонаправленность этих процессов. Так, повышение показателей функции щитовидной железы соответствовали нормальным или пониженным цифрам основного обмена и наоборот. На основании проведенных исследований авторы пришли к выводу о том, что у больных шизофренией зна- чительно снижается чувствительность тканей и органов (особенно головного мозга) к воздей- ствию гормонов щитовидной железы, а ткани са- мой щитовидной железы обнаруживают понижен- ную чувствительность к тиреотропным гормонам гипофиза значительно чаще, чем у здоровых пробандов (2).
Результаты исследований, касающихся влияний нейролептических препаратов на состояние ГГТ- системы (как гормональные, так и клинические показатели) неоднозначны и противоречивы. Вы- явленные в исследованиях Таллера М.Б. (16) диссоциации между клиническими проявлениями дистиреоза и лабораторными данными позволили высказать предположение о лежащей в основе этой нейроэндокринной дисфункции диэнцефальной патологии. Тиреоидные гормоны оказывают множественные эффекты на ЦНС, в частности, на его лимбические структуры, выработку серотони- на и норэпинефрина, тем самым вовлекаясь в па- тогенез психических расстройств. Однако, до настоящего времени нет единого мнения о регуляторном каскаде, посредством которого гормоны ТТГ-системы вовлечены в эти процессы (44).
Тем не менее, одной из возможных причин разви- тия дистиреоза при терапии нейролептиками мо- жет являться повышение чувствительности β- адренергических нейронов катехоламинергиче- ской системы, приводящей к повышению уровня ТТГ, а затем и периферических гормонов (Т3 и Т4). Ramschak-Schwarzer S. et al. (44) отмечают, что антипсихотики влияют на синтез и метабо- лизм тиреоидных гормонов на разных уровнях, в том числе и на гипоталамическом, поскольку ан- типсихотики оказывают свое действие в основном посредством моноаминоергической и серотонинергической систем, а TТГ контролируется теми же системами. Существует мнение, что различный фармакологический профиль препаратов, в частности, дофаминергическое действие, альфа- адренергическое и серотонинергическое по- разному отражаются на метаболизме тиреоидных гормонов. Так, при исследовании состояния ГГТ- оси на терапии атипичным нейролептиком клозапином отмечалось снижение Т4-свободного, ти- роксинового индекса, а также сниженный ТТГ- ответ на введение тиролиберина. При терапии кветиапином отмечались схожие тенденции в изменениях гормонального профиля тиреоидной оси, которые самостоятельно купировались после отмены препарата (44).
Клинические аспекты
Гиперпролактинемия
Клиническая картина ГП различается в зависимо- сти от пола. В первую очередь ГП приводит к нарушениям половой функции. У женщин наблю- даются нарушения менструального цикла, которые могут проявлятся аменореей (отсутствие менструации 6 мес. и более), олигоменореей (скудные менструации 1 раз в 2-3 мес.), ановуля- торными циклами (менструальные циклы без ову- ляции и образования жѐлтого тела), менометрор- рагией (обильными менструациями), укорочением лютеиновой фазы и бесплодием. У мужчин снижается половое влечение и потенция, развиваются олигозооспермия и бесплодие. Иногда един- ственным симптомом ГП является галакторея. В этом случае также имеются половые различия. У женщин галакторея, не связанная с беременностью и кормлением, встречается, по мнению разных авторов, от 30 до 80 % случаев и связана с нормальным или повышенным содержанием эстрогенов. Истечение жидкости из сосков, напоми- нающее галакторею, может наблюдаться и в отсутствии ГП – при паппиломатозе и раке молочной железы. Поэтому важно исключить указанные заболевания молочных желѐз.
Как у мужчин, так и у женщин степень выраженности галактореи различна – от выделения нескольких капель лишь при надавливании на молочную железу, до спонтанной галактореи. В зависимости от этого галакторея подразделяется на несколько вариантов: интермиттирующую (непостоянную), а также, когда наблюдаются: одиночные капли при сильном надавливании на молочные железы, обильные выделения при несильном надавливании на молочные железы, спонтанные выделения из молочной железы.
Следует подчеркнуть, что недостаточность эстрогенов при ГП у женщин является также причиной повышения массы тела, задержки жидкости и остеопороза.
У больных с ГП может иметь место «нечистота кожных покровов» в виде акне, а также может развиваться гирсутизм.
У мужчин ГП может сопровождаться гинекомастией (увеличением молочных желез), размягчением яичек, реже встречаются остеопороз и акне.
Метаболический синдром (ожирение, гипергликемия, ИНСД, кетоацидоз)
Термин «ожирение» означает избыточное накопление жира в организме, приводящее к увеличе- нию массы тела на 20% и более от средних нормальных величин («идеальная масса тела») (3, 9).
В большинстве стран избыточный вес определяют исходя из индекса массы тела (ИМТ) или индекса Кетле – отношение массы тела, выраженной в килограммах к квадрату роста в метрах. Значение индекса Кетле 25,0 – 27,0, как соответствующее максимально допустимой массе тела, подтвер- ждается большим числом эпидемиологических исследований (3, 6, 11).
По данным ВОЗ, избыточным вес считается при ИМТ > 25, а при ИМТ > 30 диагностируется ожирение. Под фармакогенным увеличением веса принято понимать побочный эффект препарата в виде повышения массы тела более 5-7% в период его применения (11).
Большое клиническое значение имеет не только степень нарастания массы тела, но и специфика распределения жировой ткани. Действительно, в тех случаях, когда основная масса жира располо- жена на туловище и в брюшной полости, возрас- тает вероятность развития заболеваний, связан- ных с ожирением (артериальная гипертония, са- харный диабет 2 типа и др.) как у психически здоровых лиц, так и у больных шизофренией, полу- чающих нейролептики (3, 6, 11).
Не менее серьезным побочным эффектом терапии антипсихотическими препаратами, нередко связанным с увеличением массы тела, является нарушение уровня глюкозы в крови. Нарушение толерантности к глюкозе может проходить не- сколько стадий и клинически проявляться в трех состояниях: гипергликемия (ГГ), сахарный диабет 2 типа или инсулиннезависимый (ИНСД) и кето- ацидоз (9).
Если существующая гипергликемия длительное время может не сопровождаться клиническими признаками, то ИНСД сопровождается рядом симптомов, к которым относятся повышенное мочеотделение, неестественные жажда или голод, быстрая утомляемость, сонливость, зуд кожных покровов, расстройства зрения и др. (9). Одним из осложнений ИНСД является диабетический кето- ацидоз, возникающий из-за абсолютного или относительного дефицита инсулина за несколько дней и часов, который при отсутствии адекватных терапевтических мероприятий может привести к развитию коматозного состояния. Клиническая картина кетоацидоза характеризуется абсолют- ным или относительным дефицитом инсулина; развитием болезненного состояния в течение нескольких дней или часов; полной потерей созна- ния; шумным дыханием (типа Куссмауля); резким запахом ацетона изо рта; сухостью и цианотично- стью кожных покровов; сужением зрачков; нитевидным пульсом.
Дистиреоз
Под термином дистиреоз, предложенного в 1973 г. Белкиным А.И. (2), следует понимать мозаичность представленности клинической картины симпто- мов как гипертиреоза, так и гипотиреоза.
К явлениям гипертиреоза относятся: повышенная раздражительность, нервозность, потливость, плохая переносимость повышенной температуры окружающей среды, сердцебиение, повышенный аппетит и, несмотря на это, похудание, диарея и боли в области сердца колющего или сжимающего характера. К явлениям гипотиреоза относятся: слабость, повышенная утомляемость, брадикардия, снижение памяти, сонливость, боли в мышцах, зябкость, запоры, кровоточивость десен, снижение аппетита и разрушение зубной эмали.
Характерна сухость кожи с гиперкератозом в об- ласти локтевых и коленных суставов, ломкость волос. Пальпация щитовидной железы в ряде случаев обнаруживает ее увеличение до 1-2 степени при сохранении подвижности и эластичности (2, 9, 16).
Основные факторы риска возникновения эндокринных побочных эффектов антипсихотиков
В доступной нам литературе были обнаружены сведения о факторах риска возникновения ожирения, нарушения толерантности к глюкозе и дистиреоза, тогда как исследований, касающихся факторов риска развития ГП, выявить не удалось.
В таблицах № 4 и № 5 приводятся обобщенные данные о факторах риска метаболических эндо- кринных расстройств.
Табл. № 4
Основные факторы риска увеличения веса при антипсихотической терапии
Биологические и генетические:
— особенности метаболических процессов;
— предрасположенность к диабету;
— нейрогормональные и нейропептидные изменения.
— малая возможность к обучению.
Табл. № 5
Факторы риска возникновения гипергликемии при антипсихотической терапии
— диагноз шизофрении;
— избыточный вес до начала лечения;
— увеличение веса более чем на 10% во время приема препарата;
— нарушение регуляции глюкозы;
— артериальная гипертензия > 140/90 мм рт. ст.;
— наличие сахарного диабета у родственников;
— возраст > 45 лет.
К факторам риска развития дистиреоза относят наследственную отягощенность больных шизофренией по заболеваниям щитовидной железы, кататоническую симптоматику, а также лиц с условно пропорциональным типом МФК. Не следует также забывать о том, что у больных с явлениями гипертиреоза повышается риск токсичности нейролептиков с возникновением тяжелых дистонических реакций, психомоторного возбуждения и нарушений ритма сердечной деятельности.
Принципы коррекции и профилактики
Клинико-демографические:
— женский пол;
— молодой возраст;
— низкий вес до начала терапии;
— инертность, негативные симптомы;
— снижение физической активности.
Социальные и поведенческие:
— изменение социального и экономического статуса;
— изменение пищевого поведения;
Имеющиеся на настоящий момент литературные данные о проведении коррекционных мероприятий нейроэндокринных дисфункций у больных шизофренией, носят единичный характер (4, 6, 11).
Учитывая механизм развития патологической ГП , примером которой является нейролептическая ГП, имеется возможность воздействия с помощью корректоров на различные звенья этой патологи- ческой цепи (Табл. № 6).
С этой целью используют различные фармакологические препараты, которые по механизмам до- фаминостимулирующего эффекта разделяются на ряд групп (9).
К первой группе относятся предшественники до- фамина — леводопа, а также комбинированные препараты типа накома и мадопара. Однако в связи с побочным действием, которое обусловле- но периферическим дофамином, предпочтение в терапии гиперпролактинемии отдаѐтся препара- там второй группы — стимуляторам центральных и периферических дофаминовых рецепторов: бро- мокриптин, лизурид, перголид, амантадин, лер- готрил и др. Из перечисленных лекарственных средств наибольшее распространение получил бромокриптин. В последние годы разработаны препараты длительного действия, такие как пар- лодел LAR, а также препарат достинекс. Длитель- ный опыт применения препаратов второй группы показал, что часть больных с ГП остаются резистентными к терапии и для снижения уровня пролактина требуются высокие дозы корректоров, что, естественно, связано с возможными ослож- нениями. В связи с этим был разработан новый D2-агонист норпролак, не относящийся к произ- водным спорыньи, который нормализует содержание пролактина у больных, резистентных к бромокриптину (9).
Диета и поведенческая терапия являются основ- ными способами борьбы с увеличением веса, вызванным нейролептиками. В предварительных исследованиях эффективности поведенческой терапии связанного с этим расстройством доказана возможность значительного кратковременного снижения веса. Появились работы о возможности фармакологической коррекции нейролептического ожирения. Например, возможно применение из- бирательных антагонистов гистаминовых рецепторов 2 типа. В частности, низатидин показал спо- собность уменьшать вызванное оланзапином увеличение веса. Агонисты дофамина (амантадин и др.) также способны противодействовать ожире- нию, вызванному оланзапином (6, 11). При выявлении ГГ и ИНСД применяются, как правило, оральные гипогликемические препараты и инсулинотерапия, а в отдельных случаях требуется отмена АА (6, 11).
Активное лечение легких форм дистиреоза, по мнению ряда авторов (2, 16, 44), у больных шизофренией считается нецелесообразным, по- скольку оно может оказывать неблагоприятное влияние как на клиническую картину шизофренического процесса, так и на повышение чувствительности к нейролептикам, что может приводить к развитию сердечной дизритмии.
Не вызывает сомнений тот факт, что появление любых, в том числе вышеперечисленных эндо- кринных побочных эффектов при терапии анти- психотическими препаратами, в значительной мере ухудшает комплайенс между врачом и пациен- том. Повышается риск нарушений режима приѐма препаратов, а иногда и полного отказа пациентов принимать их, вне зависимости от необходимости продолжения лечения по основным показаниям. Следует подчеркнуть, что в подобных ситуациях тактика врача может быть двоякой.
1. С одной стороны, в случае клинической выраженности и значимости для пациента по- бочных эндокринных эффектов, возможно, более оправданным является перевод боль- ного на прием препарата иной химической группы, обладающего иным спектром побочных эффектов.
2. С другой стороны, если применяемый антипсихотический препарат является предпочтительным в данном конкретном случае, а эндокринные нарушения минимальны, то целесообразна следующая терапевтическая тактика: медленная титрация или снижение дозы препарата; мониторинг уровня глюкозы, пролактина и тиреоидных гормонов (осо- бенно в первые 3-4 месяца терапии); ЭКГ- исследования, УЗИ щитовидной железы; учет факторов риска: больные с уровнем глюкозы натощак > 6,1 ммоль/л; отягощенная наследственность по диабету и заболеваниям щитовидной железы; ожирение; ар- териальная гипертензия; высокий уровень триглицеридов; наличие диабета во время беременности; поликистоз яичников; назна- чения коррекционных мероприятий. Необходима также консультация психоэндокринолога.
Анализ данных представленных в литературе исследований свидетельствует о том, что терапия нейролептиками нередко сопровождается такими побочными эффектами, как гиперпролактинемия, прибавка веса, гипергликемия, сахарный диабет II типа (инсулиннезависимый), кетоацидоз и дистиреоз. Следует отметить, что на настоящий момент нет единого мнения как о механизмах, частоте и предикторах возникновения этих расстройств, так и о способах их профилактики и коррекции. Это связано в первую очередь со следующими причинами: малыми выборками обследуемых больных, различными временными рамками терапии, отсутствием возможности учета смены препарата, выборочностью исследуемых данных, разнородностью клинических групп.
Такое состояние проблемы с очевидностью подтверждает актуальность дальнейших, более детальных исследований в этой области с целью оптимизации терапевтической помощи больным шизофренией.
Литература
1. Авруцкий Г.Я., Гурович И.Я., Громова В.В. Фармакотерапия психических заболеваний. – М.: Медицина, 1974. – 471 с.
2. Белкин А.И., Лакуста В.Н. Биологическая те- рапия психических заболеваний (Под ред. д.м.н., проф. В.В. Ковалева). – Кишинев. – «Штиница». – 1983. – 216 с.
3. Гинзбург М.М., Крюков Н.Н. Ожирение. – М. – Медпрактика – 2002. – 128 с.
4. Горобец Л.Н., Буланов В.С., Комиссаров П.С. и др. Проблема гиперпролактинемии при те- рапии антипсихотическими препаратами //Ж. «Социальная и клиническая психиатрия»– т. 13. – Выпуск 1. — М. – 2003. — с. 164-169.
5. Горобец Л.Н., Литвинов А.В. Исторические аспекты и современный этап развития пси- хонейроэндокринологии // В сб. научных трудов «Современные проблемы психиатри- ческой эндокринологии». – М. – 2004. – с. 6-22.
6. Горобец Л.Н., Ермолаева Л.Г., Жмурина М.В. Проблема увеличения веса и развития са- харного диабета при нейролептической терапии шизофрении // В сб. п/ред. проф. И.Я.Гуровича и д.м.н. А.Б. Шмуклера «Метаболические побочные эффекты и осложнения при психофармакотерапии» (Приложение к журналу «Социальная и клиническая психи- атрия»). – М. – 2003. – с. 22-28.
7. Гурович И.Я. Побочные эффекты и ослож- нения при нейролептической терапии больных шизофренией // Диссертация… доктора медицинских наук. – М. – 1971. – 443 с.
8. Жислин С.Г. К вопросу о роли эндокринного фактора в клинике шизофрении и психозов позднего возраста // В сб. «Проблемы пси- хиатрии». – Т. 2. – М. – 1962. – с. 3-19.
9. Лавин Н. Эндокринология. – М. — «Практика».– 1999. – 803 с.
10. Мосолов С.Н. Полвека нейролептической терапии: основные итоги и новые рубежи // В сб. «Новые достижения в терапии психических заболеваний». — М. — 2002. – с. 47-82.
11. Мосолов С.Н., Кабанов С.О. Метаболиче- ские нарушения при антипсихотической те- рапии // Ж. «Социальная и клиническая пси- хиатрия». – М. – 2003. – Т. 13. – Выпуск 2. – с. 162-171.
12. Орловская Д.Д. Нейроэндокринные факторы при шизофрении и их связь с типом течения заболевания. Дис. … докт. мед. наук. – М., 1966. – 425 с.
13. Орловская Д.Д. Роль эндокринных факторов в патогенезе шизофрении // Актуальные проблемы невропатологии и психиатрии. –М.: Медицина, 1974. — С. 212-222.
14. Свет-Молдавская Е.Д. Гинекологические за- болевания у психически больных женщин. –М., — 1958. – 87 с.
15. Свет-Молдавская Е.Д. Изучение эндокрин- ных нарушений у психически больных женщин // Гормональные нарушения при некоторых нервно-психических заболеваниях. – М., 1957. – с. 92-119.
16. Таллер М.Б. Психофармакотерапия и морфоконституциональная предиспозиция в генезе эндокринных расстройств больных ши- зофренией: Дисс. … канд. мед. наук. – М. –1986. – 168 с.
17. Allison D.B., Fontaine K.R., Heo M., Mentor J.L., Cappelleri J.C., Chandler L.P., Weiden P.J., Cheskin L.J. The distribution of body mass index among individuals with and without schiz- ophrenia // J. Clin. Psychiatry. — 1999. – 60. – p.p. 215-220.
18. Allison D.B., Mentor J.M., Heo M., Chandler L., Cappeller J.C., Infant M., Weiden P. Antipsy-chotic-induced weight gain: a comprehensive research synthesis // Am. J. Psychiatry. — 1999. –156 (11). – p.p. 1686-96.
19. Ammon H.P., Orci L., Steinle J. Effect of chlor- promazin (CPZ) on insulin release in vivo and in vitro in the rat // J. Pharmacol. Exp. Ther. — 1973. – 187. – p.p. 423-429.
20. Anand P., Popli А.Р., Konicki Р.Е., Georg Jurjus G.J. et al. Clozapine and associated dia- betes millitus // J. Clin. Psychiatry. – 1997. – March. — 58. – p. 3.
21. Arneson G.A. Phenothiazine derivatives and glucose metabolism // J. Neuropsychiatry. -1964. – 5. – p. 181.
22. Beasley C.M. Safety of olanzapine // J. Clin.Psychiatry. – Monograph. — 1997a. – 15 (2). –p.p. 19-21.
23. Bernstein J.G. Induction of obesity by psycho- tropic drugs // Ann. NY Acad. Sci. — 1987. –499. – p.p. 203-215.
24. Bleuler M. Endokrinologische Psychiatrie. –Schtuttgart. – Thieme. – 1954. — 498 s.
25. Bonanno D.G., Davydov L, Botts S.R. Olanzap- ine-induced diabetes mellitus // Ann. Pharma-cother. — 2001. – May. – 35 (5). – p.p. 563-5.
26. Dagli A.J. Severe hyperglycaemia following in- gestion of chlorpromazine // J. Assoc. Physi-cians India. – 1984. – 32. – p.p. 762-763.
27. Dawn A.I., Roper T.A., Riley J.A. Diabetic ke- toacidosis and clozapine // Am. J. Psychiatry. –1997. – 10. – p.p. 493-495.
28. Doss F.W. The effect of antipsychotic drugs on body weight: a retrospective review // J. Clin. Psychiatry. – 1979. – 40. – p.p. 528-530.
29. Erle G., Basso M., Federspil G. et al. Effect of chlorpromazine on blood glucose and plasma insulin in man // Eur. J. Clin. Pharmacol. –1977. – 11. – p.p. 15-18.
30. Federspil G., Casar D, Stautffacher W. Chlor- promazine in the treatment of endogenous or- ganic hyperinsulinism // Diabetologia. – 1974. –10. – p.p. 189-191.
31. Green J.K., Goisman R.M. et al. Weight Gain From Novel Antipsychotic Drugs: Need For Ac- tion. // General Hospital Psychiatry. – 2000. – Vol. 22. – p.p. 224-235.
32. Hägg S., Joelsson L., Mjordal T. et al. Preva- lence of Diabetes and Impaired Glucose Toler-ance in Patients Treated with Clozapine Com- posed with Patients Treated with Conventional Depot Neuroleptic Medications// J. Clin. Psy- chiatry. – 1998. — 59:6. – June. — p.p. 294-299.
33. Kamath V., Jones C.N., Yip J.C. et al. Effects of a quick – release form of bromocriptine (Er- goset) on fasting and postrandial plasma glu- cose insulin lipid and lipoprotein concentration in obese nondiabetic hyperinsulinemic women // Diabetes Care. – 1997. – 20. – p.p. 1697-1701.
34. Kleinberg D.L., Davis J.M., De Coster R. Pro- lactin levels and adversе events in patients treated with rusperidone//Clin.Psychopharmacology. 1999. 19, 57-61.
35. Klein S., Coppack S., Mohamed-Ali V., Landt M. Adipose tissue leptin production and plasma leptin kinetics in humans // Diabetes. – 1996. — Jul. – 45 (7). – p.p. 984-7.
36. Koro C.E., Fedder D.O., L’Italien G.J. et al.Shizophrenia and Disoders with Psychotic Fea- tures Diabetes // British Medical Journal. –2002. — August. – 3. — p.p. 325-243.
37. Liebziet K.A., Markowitz J.S., Caley C.F. New onset diabetes and atypical antipsychotics //Eur. Neuropsychopharmacology. – 2001. –Feb. — 11(1). – p.p. 25-32.
38. Lindermayer J.P., Nathan A.M., Smith R.C. Hy- perglycaemia associated with the use of atypical antipsychotics // J. Clin. Psychiatry. – 2001.- 62. — Suppl. 23. – p.p. 30-38.
39. Masand P.S., Blackburn C.L., Ganguli R., Goldman L.S., Gorman J., Greenberg I., Kawa- chi I., Perkins D.O., Sachs C.S. Weight gain associated with the use of antipsychotic medi- cations // J. Clin. Psychiatry. — 1999. — Audio- graph Series. – p. 2.
40. Melkerson K.I., Halting A.L., Brismar K.E. Ele- vated levels of insulin, leptin, and blood lipids in olanzapine-treated patients with schizophrenia or related psychoses // J. Clin. Psychiatry. – 2000. – Oct. — 61(10). — p. p. 742-749.
41. Mir S., Taylor D. Atypical antipsychotics and hyperglycaemia // International Clinical Psychopharmacology. – 2001. – 16. – p.p. 63-74.
42. Peuskens J. Prolactin in schizophrenia a litera- ture review // Ciear perspectives.- 1997. – Vol. 1, Issue 3. – Management issues in schizophrenia. – 42 p.
43. Proakis A.G., Mennear J.H., Miya T.S. et al. Phenothiazines – induced hyperglycemia: rela- tion to CNS and adrenal effects // Proc. Soc. Exp. Biol. Med. – 1971. – 137. – p.p. 1385-1388.
44. Psychoneuroendocrinology: the scientific basis of clinical practice (Edited by Wolkowitz O.M., Rothschild A.J.). – American Psychiatric Pub- lishing. – Washington, London. – 2003. – 588 p.
45. Schriber S., Segman R.H. Risperidone-induced galactorrea//Psychopharmacology 1997.130:300-301.
46. Shiwach R.S., Carmody T.J. Prolactogenic ef- fect of risperidone in male patients a preliminary study //Acta.Psychiatrica. Scandinavica.1998.98.81-83.
47. Silverstone T., Smith G., Coodall E. Prevalence of obesity in patients receiving depot antipsy- chotics // Br. J. Psychol. — 1988. –153. – p.p.214-217.
48. Stanton J.M. Weight gain associated with neu- roleptic medication: a review // Schizoph. Bull. –1995. – 21. – p.p. 463-472.
49. Stern J., Hirsch J., Blair S., Foreyt J., Frank A., Kumanyika S., Madans J.,Marlatt G., St Jeor S.,Stunkard A. Weighing the options: criteria for evaluating weight-management programs // The Committee to Develop Criteria for Evaluating the Outcomes of Approaches to Prevent and Treat Obesity. — Obes. Res. – 1995. – Nov. – 3 (6). – p.p. 591-604.
50. Sussmun N. Weight gain and glucose regula- tion during antipsychotic drug treatment // J. Clin. Psychiatry. – 2001. – 62. — (Suppl. 23). – p.p. 3-4.
51. Tonnard – Neumann E. Phenothiazines and di- abetes in hospitalized women. // Am. J. Psychiatry. – 1968. – 124. – p.p. 978-982.
52. Tran P., Lu Y., Sanqlez T. et al. Olanzapine in the treatment of schizoaffective disorder // Pre- sented at the 36th annual NCDEU meeting, Bo- ca Raton, EL. – 1996.
53. U.S. Department of Health and Human Ser- vices: 1989 National Health Interview Survey. -CD-ROM Series. – 1993. — 10(3).
54. Wirshing D.A., Spelberg B.J., Erhart S.M., Marder S.R., Wirshing W.C. Novel antipsychotics and new onset diabetes // Biol. Psychiatry. -1998. – 44. – p.p. 778-783.
55. Yazici K.M., Erbas T., Yazici A.H. The effect of clozapine on glucose metabolism // Exp. Clin.Endocrinol. Diabetes. – 1998. – 106. – p.p. 475-477.









Комментировать