Фиброэзофагогастроскопия. Капсульная эндоскопия. Транзиентная эластометрия. Мультиспиральная компьютерная томография. Портальная сцинтиграфия.
Д.В. Гарбузенко, доктор медицинских наук, доцент, профессор кафедры факультетской хирургии
ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Минздрава РФ,
Челябинск, член-корреспондент Российской Академии Естествознания,
действительный член Российского общества хирургов
Портальная гипертензия (ПГ) является ведущим синдромом, характерным для цирроза печени (ЦП), тяжесть основных клинических проявлений которого, как правило, определяет прогноз и тактику лечения.
Своевременная диагностика ПГ с оценкой характерных для неё гемодинамических расстройств, представляет собой актуальную проблему современной гепатологии. Наиболее опасным осложнением ПГ остаются кровотечения из варикозно расширенных вен пищевода.
Следует отметить, что примерно у 50% пациентов с ЦП они отсутствуют, у 5–12% ежегодно наблюдается их формирование, а в течение двух лет у 6–70% – увеличение размера. Поэтому все больные ЦП каждые 1–3 года должны подвергаться скринингу как на наличие пищеводных варикозов, так и для исследования динамики их роста [20].
Считается, что непосредственной причиной разрыва варикозных узлов является комбинация повышения давления внутри изменённого сосуда и слабости его стенки. Очевидно, что, чем крупнее варикоз, тем риск кровотечения выше. Международная классификация варикозно расширенных вен пищевода, предложенная Японским обществом по изучению ПГ (Japanese Research Society for Portal Hypertension), разделяет их следующим образом:
- F0 – варикоз отсутствует;
- F1 – небольшой, прямой варикоз (1 ст.);
- F2 – извитой варикоз, занимающий менее 1/3 просвета пищевода (2 ст.);
- F3 – большой, чёткообразный варикоз, занимающий более 1/3 просвета пищевода (3 ст.) [45].
Кроме того, развитию кровотечений способствует поверхностное расположение варикозно расширенных вен, их связь с наполненными кровью внутриэпителиальными канальцами, что соответствует эндоскопическим понятиям «вишнёво-красные пятна» или «варикоз на варикозе» [англ.– cherry red spots, varices on top of the varices], а также воспалительные изменения слизистой оболочки пищевода и желудка [22].
Традиционно для определения выраженности этих патологических нарушений применяется фиброэзофагогастроскопия. Она может быть дополнена измерением давления в варикозно расширенных венах, что имеет важное практическое значение при оценке риска кровотечения и мониторинге эффективности консервативной терапии. Последнее осуществляется либо посредством пункции варикозного узла (как правило, во время проведения склеротерапии), либо, что более целесообразно, использованием эндоскопической баллонной манометрии [37].
Вместе с тем, фиброэзофагогастроскопия не лишена определённых недостатков. В частности, инвазивность, а также дискомфорт, который испытывают больные при выполнении данной процедуры, приводят к тому, что в ряде случаев они отказываются от её проведения и фактически выпадают из наблюдения. Кроме того, фиброэзофагогастроскопию нельзя осуществить при тяжёлом состоянии пациента. Поэтому в настоящее время изучается чувствительность и специфичность некоторых более толерантных технологий как для выявления пищеводных варикозов, так и оценки риска предполагаемого кровотечения.
Капсульная эндоскопия была внедрена в медицинскую практику в 2001 году для диагностики заболеваний тонкой кишки. Суть метода заключается в том, что после попадания миниатюрной капсулы в пищеварительный тракт, помещённая в неё видеокамера с частотой 2 изображения в секунду, углом поля зрения 140° и восьмикратным увеличением, регистрирует все, что фиксирует ее объектив. Через датчик, установленный на животе пациента, видеосигнал передаётся на записывающее устройство, размещённое у него на поясе. Емкости источника питания капсулы хватает на 8 часов бесперебойной работы. Далее зображения загружаются на компьютер и в течение 40–60 мин изучаются специалистом [41].
Мета-анализ 7 исследований по применению капсульной эндоскопии у больных с ПГ показал её приемлемую чувствительность и специфичность (85,8% и 80,5%, соответственно) в идентификации пищеводных варикозов. Но она оказалась хуже фиброэзофагогастроскопии при дифференцировке их по степеням, что важно для выработки лечебной тактики [51].
Учитывая, что большинство осложнений ЦП являются следствием повышения портального давления, его оценка имеет важное практическое значение.
Наиболее точно величине портального давления соответствует градиент печёночного венозного давления (ГПВД). Для его определения через кубитальную, внутреннюю ярёмную либо бедренную вену в одну из ветвей печёночной вены вводят до упора катетер, раздувают расположенный на его конце баллон, препятствуя оттоку крови, и измеряют заклиненное печёночное венозное давление. После этого баллон распускают и устанавливают уровень свободного печёночного венозного давления. Разница между заклиненным и свободным печёночным венозным давлением представляет собой ГПВД [13].
На его величину влияют два фактора: печёночное сосудистое сопротивление портальному кровотоку и резистентность в коллатеральной сети. Установлено, что если нормальные показатели ГПВД находятся в пределах 1–5 мм рт. ст., то уровень, превышающий эти границы до значений 10 мм рт. ст, свидетельствует о наличии ПГ, не взирая на клинические проявления.
При 10–12 мм рт. ст. формируются пищеводные варикозы, а дальнейшее увеличение ГПВД существенно усугубляет риск кровотечений из них [12]. К сожалению, в большинстве случаев ГПВД не может быть исследован в обычной клинической практике. В связи с этим, в настоящее время изучаются альтернативные способы, позволяющие на основании современных представлений о патогенезе ПГ оценить тяжесть её течения и прогнозировать риск вероятных осложнений (см. рисунок). Одними из них являются активно разрабатываемые в последние годы неинвазивные методы диагностики фиброза печени, к которым относятся определение его сывороточных маркёров, применение фибротеста и транзиентная эластометрия печени.
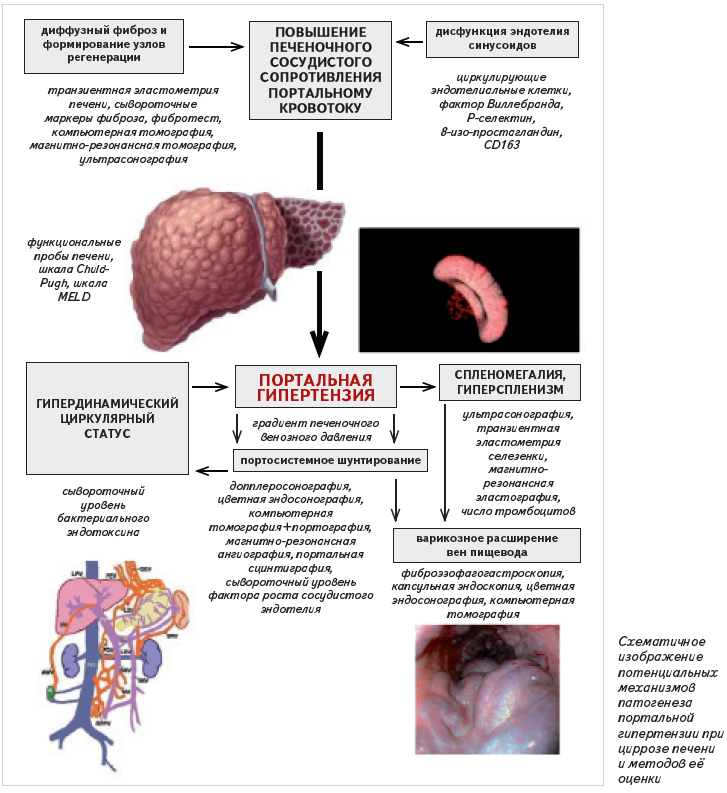
Было показано, что хотя сывороточные уровни ламинина и гиалуроновой кислоты, также как и биохимические показатели фибротеста, включающие α-2-макроглобулин, гаптоглобин, аполипопротеин А1, γ-лутамилтранспептидазу и общий билирубин, соотносились со значениями ГПВД, они оказались несостоятельными как прогностический критерий риска кровотечений из варикозно расширенных вен пищевода [39; 59].
Транзиентная эластометрия даёт возможность при помощи аппарата «Фиброскан» за счёт колебаний средней амплитуды и низкой частоты получить количественную оценку эластичности печени для определения стадии фиброза (по системе Metavir), выраженную в килопаскалях (кПа). Корреляция её значений с ГПВД изучалась в пяти исследованиях, включающих пациентов с бессимптомным или компенсированным ЦП. Несмотря на то, что при величине ГПВД от 5 до 10–12 мм рт. ст. имела место хорошая взаимосвязь между изучаемыми показателями, при более высоких его значениях она была несущественной.
Тем не менее, полученные результаты предполагают, что тяжёлая ПГ может быть диагностирована при значениях эластичности печени от 13,6 кПа до 34,9 кПа. В то же время, если они превышают 40 кПа, существует большая вероятность развития варикозно расширенных вен пищевода и кровотечений из них [15].
- Stefanescu и соавт. [54] в качестве предиктора крупных пищеводных варикозов предложили алгоритм, основанный на последовательной транзиентной эластометрии печени и селезёнки. Если показатели эластичности печени превышают 19 кПа, авторы рекомендуют выполнять эластометрию селезёнки. При этом значения эластичности последней, превышающие 55 кПа, с высокой вероятностью свидетельствуют о наличии пищеводного варикоза высокого риска.
Одна из причин недостаточной ценности транзиентной эластометрии печени в диагностике тяжёлой ПГ заключается в том, что она отражает печёночное сосудистое сопротивление портальному кровотоку, вызванное исключительно анатомическими факторами, а именно накоплением волокон внеклеточного матрикса. При этом функциональные изменения в эндотелии синусоидов, играющие важную роль в патогенезе ПГ, не учитываются [1].
В настоящее время в качестве суррогатных маркеров эндотелиальной дисфункции исследовались циркулирующие эндотелиальные клетки, фактор Виллебранда, P-селектин и 8-изо-простагландин F2a [5; 40]. Было показано, что у больных ЦП их уровень повышался, причём значения фактора Виллебранда достоверно коррелировали с величиной ГПВД, шкалами Child-Pugh и MELD [25].
Выстилающие синусоиды эндотелиальные клетки при ЦП активируются и приобретают сосудосуживающий фенотип. Их чувствительность к продуцируемым клетками Купфера эндогенным вазоконстрикторам повышается [55]. Недавние исследования показали, что сывороточная концентрация CD163, маркера активированных макрофагов М2, у больных с ПГ была повышена и соответствовала величине ГПВД. В мультивариантном анализе она превосходила эндоскопическую классификацию варикозного расширения вен пищевода по прогнозированию кровотечений. Причём риск этого осложнения резко возрастал при значениях CD163 более 4100 нг/л [60].
Допплеросонография широко применяется для изучения характера гемодинамических нарушений, свойственных больным ЦП, а также выраженности ПГ. В частности, она позволяет визуализировать диаметр сосудов системы воротной вены, скорость кровотока по ним, естественные портосисемные шунты. Однако из-за индивидуальных особенностей данных параметров у каждого пациента, её значения не могут быть унифицированы и в ряде случаев неправильно интерпретируются [9].
В связи с этим, для более точной характеристики ПГ предлагается использование различных допплеросонографических индексов, которые рассчитываются исходя из показателей портального, печёночного и селезёночного артериального кровотока. Отмечалось, что индекс резистентности в печёночной артерии (отношение разности максимальной систолической и конечной диастолической скорости кровотока к максимальной систолической скорости кровотока) и пульсационный индекс в печёночной артерии (отношение разности максимальной систолической скорости кровотока и минимальной систолической скорости кровотока к средней скорости в течение сердечного цикла), а также печёночный сосудистый индекс (отношение средней линейной скорости кровотока в воротной вене к пульсационному индексу в печёночной артерии) коррелируют с величиной портального давления, измеренного во время операции [62]. Помимо этого, индекс ПГ (отношение произведения индекса резистентности в печеночной артерии × 0,69 и индекса резистентности в селезёночной артерии × 0,87 к средней линейной скорости кровотока в воротной вене) [58] и спленопортальный индекс (отношение объёмной скорости кровотока в селезёночной вене к объёмной скорости кровотока в воротной вене) [43] позволяют достаточно точно идентифицировать больных компенсированным ЦП, имеющих варикозно расширенные вены пищевода.
Анализ изменений печёночного венозного кровотока по данным допплеросонографии также представляет интерес при оценке тяжести ПГ. В норме он носит трёх- (четырёх-, пяти-) фазный характер, что является следствием различий в центральном венозном давлении, обусловленных сердечным циклом. У больных ЦП печёночный венозный кровоток становится бифазным, а по мере роста ГПВД – монофазным, коррелируя со степенью варикозного расширения вен пищевода [31].
Кроме того перспективным в диагностике ПГ у больных ЦП может быть определение внутрипечёночного циркуляторного времени. После введения в локтевую вену воздушных микропузырьков (контрастно-диагностического средства для улучшения изображения при ультразвуковом исследовании) подсчитывается разница между временем их поступления в печёночную вену и печёночную артерию (при ЦП уменьшается), а также между временем их поступления в воротную вену и печёночную артерию (при ЦП увеличивается) [61].
Характер гепатофугальной циркуляции по портосистемным коллатералям у больных ЦП является определяющим в развитии кровотечений из варикозно расширенных вен пищевода. Наиболее важным здесь является гастроэзофагеальный путь шунтирования, главная роль в формировании которого принадлежит левой желудочной вене. Она, дренируя обе желудочные поверхности, восходит по малой кривизне влево в малый сальник к пищеводному отверстию диафрагмы, где сообщается с венами пищевода. Затем, изгибаясь обратно вниз и вправо позади сальниковой сумки, впадает в воротную вену. Анастомозы между левой и правой желудочными венами и левой и короткими желудочными венами, обозначенные терминами соответственно «коронарная вена» и «задняя желудочная вена», имеют клиническое значение лишь при ПГ, поскольку участвуют в формировании пищеводных и связанных с ними околопищеводных варикозов [18]. Отмечалось, что диаметр левой желудочной вены, превышающий 6 мм, и увеличение средней линейной скорости кровотока в ней по данным цветного допплеровского картирования могут свидетельствовать о наличии варикозно расширенных вен пищевода высокого риска [8].
Одним из методов исследования гепатофугального кровотока в области гастроэзофагеального соединения служит цветная эндосонография. Посредством её было выявлено, что у больных ЦП значительно увеличенный кровоток в варикозно расширенных венах пищевода, непарной и межрёберных венах уменьшался при назначении пропранолола и нитроглицерина [56], также как и терлипрессина и соматостатина [42].
Помимо оценки эффективности фармакотерапии эндосонография за счёт хорошей визуализации перфорантных, левой желудочной и параэзофагеальных коллатеральных вен может быть применена для мониторинга эндоскопических методов лечения пищеводных варикозов [50].
Мультиспиральная компьютерная томография с трёхмерной реконструкцией изображения обычно выполняется больным ЦП для скрининга на наличие гепатоцеллюлярной карциномы. Она также позволяет выявить изменения, характерные для ПГ: параэзофагеальные коллатеральные вены, спленомегалию, асцит, варикозно расширенные вены пищевода, которые визуализируются как выпячивания, выступающие в просвет пищевода, имеющего при этом неравномерно утолщённые стенки. Учитывая, что указанные признаки не являются специфичными и могут быть вызваны разными причинами, а именно, перистальтикой или избыточными складками слизистой оболочки, для более чёткой визуализации варикоза необходимо раздуть пищевод воздухом или заполнить его просвет контрастным веществом, например, бариевой взвесью.
Данный метод для диагностики варикозно расширенных вен пищевода был применён в трёх исследованиях и показал хорошие результаты [34; 35; 48]. Его чувствительность и специфичность составила, соответственно, от 63% до 93% и от 76% до 97%, в том числе при обнаружении больших варикозов – соответственно, от 56% до 92% и от 84% до 92%. В сравнении с фиброэзофагогастроскопией недостатком мультиспиральной компьютерной томографии является невозможность дифференцировки варикоза по степеням и оценки состояния слизистой оболочки пищевода и желудка, а также повышенный риск облучения пациента. К достоинствам метода, особенно при использовании мультипланарных реконструкций изображения, можно отнести хорошую визуализацию естественных портосистемных шунтов [36].
Кроме того, мультиспиральная компьютерная томография, дополненная портографией [6], также как магнитно-резонансная ангиография [23], позволяют определить локализацию, природу и тип коллатеральной циркуляции по параэзофагеальным венам. При этом не было выявлено корреляции между их диаметром и степенью варикозного расширения вен пищевода, что можно объяснить патофизиологической ролью этого пути окольного кровообращения, заключающегося не в развитии и сохранении пищеводного варикоза при ПГ, а в стабилизации портального давления у больных ЦП [30].
Портальная сцинтиграфия с применением 99mTc, выполненная через прямую кишку, является неинвазивным методом для изучения портального шунтирующего индекса. Полученные в результате исследования значения, которые рассчитывались из кривых радиоактивности печени и сердца, хорошо коррелировали с величиной портального давления. Отмечалось, что если его показатели выше 20 % у больных ЦП развиваются варикозно расширенные вены пищевода, а при значениях более 60% — резко увеличивается риск кровотечения из них [19]. Аналогичная трансселезёночная методика, несмотря на большую травматичность, имеет практически одинаковую эффективность, а также позволяет уточнить характер гепатофугального кровотока по портосистемным коллатералям [28].
В последние годы важная роль в развитии естественных портосистемных шунтов и, в частности, формировании пищеводных варикозов придаётся ангиогенезу – сложному физиологическому процессу образования новых кровеносных сосудов [4]. Он происходит посредством активации эндотелиальных клеток, экспрессии в них протеаз, разрушения внеклеточного матрикса, пролиферации, миграции и образования эндотелиальными клетками первичных высокопроницаемых сосудистых структур, которые после стабилизации и «взросления» за счет привлечения перицитов и гладкомышечных клеток трансформируются в трехмерную сосудистую сеть [26].
В связи с чем, определение сывороточных маркёров ангиогенеза может быть важным при оценке тяжести ПГ и выраженности портосистемного коллатерального кровообращения. Например, одно исследование показало прямую корреляционную связь между сывороточным уровнем наиболее изученного ангиогенного белка фактора роста сосудистого эндотелия и величиной ГПВД [53].
Развитие гипердинамического циркуляторного статуса у больных ЦП усугубляет течение ПГ и сопровождается усилением сердечного выброса, уменьшением периферического сосудистого сопротивления и раскрытием артериовенозных коммуникаций. Одной из причин его развития является поступление через сеть портосистемных шунтов сосудорасширяющих веществ, одним из которых может быть бактериальный эндотоксин [2]. Мы изучили целесообразность его оценки в крови больных ЦП, как метода прогнозирования риска кровотечений из варикозно расширенных вен пищевода. Было установлено, что наиболее высокий уровень бактериального эндотоксина наблюдался при наличии острого кровотечения. У пациентов, перенёсших его в анамнезе, значения эндотоксемии превышали величины, зафиксированные у больных, не имевших этого осложнения. Кроме того, в то время как уровень бактериального эндотоксина в крови от 0 до 4,0 нг/мл определял низкую вероятность возникновения кровотечения из варикозно расширенных вен пищевода, то значения, превышающие 4,1 нг/мл, говорили о его высоком риске. В связи с этим диагностический критерий 4,0 нг/мл был нами определён как оптимальный. Также оказалось, что выраженность эндотоксемии достоверно коррелировала со степенью варикозного расширения вен пищевода [3].
Хорошо известно, что морфологические изменения в селезёнке при ЦП включают в себя полнокровие красной пульпы, гиперплазию гистиоцитов, удлинение и утолщение стенок артериол. Кроме того, имеет место увеличение количества ретикулярных волокон и субкапсулярных миофибробластов, сопровождающееся диффузным фиброзом паренхимы селезёнки. Роль этих структурных нарушений в формировании варикозного расширения вен пищевода остаётся неясной [11]. Однако спленомегалия [24], а также повышение плотности селезёнки, выявленное посредством магнитно-резонансной эластографии или транзиентной эластометрии, могут быть предикторами их развития [46; 52]. Следует добавить, что в педиатрической практике рекомендуется размер селезенки, оцененный по данным ультрасонографии, рассчитывать с учётом Z оценки стандартного отклонения относительно нормальных значений для данного возраста [44].
Известно, что тромбоцитопения является типичным осложнением ЦП и обусловлена гиперспленизмом. Сама по себе она имеет плохую чувствительность и специфичность как прогностический фактор варикозного расширения вен пищевода и риска кровотечения из них [49]. Тем не менее хорошими критериями могут быть сочетание снижения числа тромбоцитов менее 90×109/л с тяжёлыми нарушениями функции печени (Child В, С) [14], также как комбинация этих параметров с длинником селезёнки превышающим 160 мм [17].
Кроме того, наличие пищеводного варикоза высокого риска предлагается рассчитывать исходя из отношения произведения значений эластичности печени и диаметра селезёнки (мм) к числу тромбоцитов, а также отношения квадрата числа тромбоцитов к произведению фракций моноцитов и сегментоядерных нейтрофилов (%). При этом в первом случае определяющей является величина превышающая 5,5, во втором – менее 11 [32; 33]. E.G. Giannini и соавт. [29] считают целесообразным проведение профилактических мероприятий по предотвращению кровотечений из варикозно расширенных вен пищевода при значениях отношения числа тромбоцитов в периферической крови к диаметру селезенки ((N/мм3)/мм) менее 909. Однако, по мнению S. Chawla и соавт. [16] чувствительность и специфичность данного метода достаточно низкая, чтобы им заменить фибро-эзофагогастроскопию.
J.C. Gana и соавт. [27] предложили критерий неинвазивной диагностики пищеводных варикозов у детей, который рассчитывается по формуле: [(0,75 × число тромбоцитов (109/л))/(Z оценка размера селезенки + 5)] + (2,5 × уровень альбумина (г/дл)). В то же время S.H. Park и соавт. [47] описали неинвазивную прогностическую модель клинически значимой ПГ у пациентов с выраженным фиброзом, включающую следующие параметры: 14.2 – 7.1 × log10 (число тромбоцитов (109/л)) + 4.2 × log10 (уровень билирубина (мг/дл)).
Дальнейшие исследования показали очевидную прогностическую ценность данных алгоритмов. При этом, если результаты первого из них ниже 114, а второго – более – 1,2, то больной с большой долей вероятности имеет варикозно расширенные вены пищевода и нуждается в эндоскопическом обследовании [7].
Нарушения функции печени могут быть важным фактором риска кровотечений из пищеводных варикозов. Отмечалось, что сочетание высоких величин международного нормализованного отношения со снижением значений альбумина и аланинтрансаминазы у больных компенсированным ЦП (Child A) косвенно свидетельствует о формировании варикозного расширения вен пищевода [10], а совокупность уровня холинэстеразы менее 2250 Е/л и международного нормализованного отношения более 1,2 – о высокой вероятности развития кровотечения из них [57]. Уровень общего билирубина, превышающий 51 ммоль/л, в сочетании с трансфузией более 6 единиц крови при остром варикозном кровотечении у больных ЦП считаются факторами риска его рецидива [38].
Таким образом, несмотря на то, что фиброэзофагогастроскопия и исследование ГПВД в настоящее время являются общепризнанными инструментами скрининга больных ЦП с ПГ [21], они имеют ряд недостатков, снижающих их прогностическую значимость. Отсюда следует, что оптимизация других известных методов, а также разработка новых, основанных на патофизиологических механизмах развития ПГ, позволит повысить эффективность лечебных мероприятий, направленных на профилактику связанных с ней тяжёлых осложнений.
Источник: Журнал «Поликлиника», спецвыпуск № 2, 2015 «ГАСТРОЭНТЕРОЛОГИЯ»













Комментировать