Коллектив авторов: Джулия Мозураитен (Julija Mozūraitienė), Кристина Биелскин (Kristina Bielskienė), Видмантас Аткосиус (Vydmantas Atkočius), Дануте Лабеикейт (Danutė Labeikytė).
- Аннотация к данной научной статье.
Несмотря на современные достижения в терапии злокачественных меланом, новые стратегии лечения только приветствуются в клиниках для выживания больных пациентов с таким неутешительным диагнозом.
Теперь предполагается, что персонализированные молекулярные методы лечения для каждого пациента необходимы, относительно специфичности молекулярных изменений в опухолях этих пациентов. В человеческих меланомах «Notch»-сигнализации взаимодействуют с другими путями («pathway»), включая, например, «MAPK», «PI3K-акт», «NF-kB» и «p53»-белка. В данной статье обсуждаются мутировавшие гены и ведущие аберрантные сигнальные пути траектории («pathway») в меланомах человека, которые представляют интерес в отношении их перспективы использования для персонализированных стратегий лечения меланомы у больных пациентов.
Мы можем предположить, что E3-убиквитин лигазы (Е3) «MDM2» и «MDM4» может быть привлекательнее терапевтического назначения «p53»-белка и «Нотч» («Notch»), сигнальных путей траектории («pathway») при злокачественных меланомах, с помощью низкомолекулярных ингибиторов. Вполне возможно, что восстановление «p53»-«MDM2» -«NUMB» комплексов в меланомах позволит также восстановить функции «p53»-белка «дикого» типа и положительно модулировать «Нотч» («Notch»)-путь траектории («pathway»). В данном научном обзоре, мы, группа авторов-исследователей, суммируем последние данные о новых для нас продовольственных и лекарственных препаратах Соединенных Штатов Америки (США). Эти продукты питания и медикаменты являются вполне утвержденными целевыми препаратами для лечения метастатической меланомы и являются предположительной моделью лечения для стратегии по ориентации «Нотч» («Notch»).
Убиквитин-лигаза — это участие убиквитин-лигазы (Е3) в полиубиквитинизации белка мишени. Убиквитин лигаза (на английском – «E3 ubiquitin ligase») фермент лигаза, ковалентно присоединящий убиквитин к белку «мишени» изопептидной связью.
2. Введение к данной научной статье.Меланома кожи является наиболее агрессивной формой рака кожи среди всех ее провлений. Появление меланомы часто бывает связано с химиорезистентностью, для больного пациента услышать диагноз «меланома кожи» — является худшим приговором! Согласно докладу Всемирной организации здравоохранения, около 48000 случаев смерти, связанных с меланомой кожи, происходят во всем мире в течение одного года [1]. Заболеваемость человека меланомой кожи в Литве за последнее десятилетие увеличилась в два раза, и на сегодня статистика составляет — около 300 новых случаев в год, то есть, очевидно, что наблюдается существенный «прирост» случаев данного онкологического заболевания [2]. Метастатические меланомы имеют плохой прогноз для больного пациента, с медианой выживаемости для пациентов с четвертой стадией меланомы кожи, начиная от 8 до 18 месяцев после постановки диагноза, в зависимости от «степени» меланомы [3]. Несмотря на неоднократные попытки современной медицины в лечении злокачественной меланомы кожи, хирургическое решение данного вопроса остается, на сегодняшний день, стандартной и единственно эффективной формой лечения. Иссечение первичной опухоли с прогнозом адаптированной маржи рекомендуется во всем мире, в качестве основного терапевтического подхода в лечении меланомы кожи у больного пациента. Теперь, спустя четыре десятилетия после первоначального одобрения этого способа лечения в «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств)[1] в 1975 году, дакарбазин (или «DTIC» — этот противоопухолевый препарат часто используется для лечения различных видов рака) продолжает оставаться стандартным препаратом в онколечении для большинства больных пациентов с этим заболеванием [4]. Высокие дозы «интерлейкина-2» («ИЛ-HD-2»), утвержденные «FDA» в 1998 году для метастатической меланомы, льготы, небольшое подмножество пациентов [4].
Хорошей новостью является то, что в настоящее время существуют и эффективные методы лечения препаратами метастатической меланомы кожи. В 2011-2014 годах несколько лекарственных препаратов, таких, как «Ipilimumab» [5] и [6], «Vemurafenib» [7], «dabrafenib» [8] и [9], «trametinib» [9] и [10] и «ПЭГ-интерферон» («PEG-interferon α-2b («PEG-IFN»)) α-2b («ПЭГ-ИФН») [11], [12] [13] утвержденные «FDA», для этих целей стли использоваться. Тем не менее, как и все новые лекарства от рака, эти препараты стоят сегодня очень дорого [14]. Лекарственный препарат «Vemurafenib», который ориентирован на мутантный онкоген «BRAF» («БРАФ»), присутствующий в 50 процентах случаев меланом ыкожи человека, вызывает «критические» регрессии опухоли в большинстве случаев. Тем не менее, средняя продолжительность ответной реакции находится всего в течение шести месяцев, со средним расширением общей выживаемости менее четырех месяцев. Комбинированное лечение с помощью лекарственного препарата «dabrafenib» (этот лекарственный препарат предназначен для лечения рака, связанного с мутантной версией гена «BRAF» («БРАФ»)) и «trametinib» (митоген-активированных протеинкиназ [«МЭК»] — ([«MEK»]) — ингибитор препарата с противоопухолевой активностью) значительно увеличивал выживаемость в случаях заболеваний меланомы кожи без прогрессирования, по сравнению с монотерапией лекарственным препаратом «dabrafenib» (медиана 9,4 против 5,8 месяцев, а соотношение рисков («HR») составляет 0,39, 95 процента, доверительный интервал (ДИ) — 0.25-0.62. И снижением токсичности дерматологического, проявляющего, плоскоклеточного рака (в том числе, Кератоакантома), хотя заболеваемость лихорадкой была увеличена (71 процент по сравнению с 26 процентами) [15] и [16]. Лекарственный препарат «Ipilimumab», оказывает очень мощное действие, но по неспецифическим, иммуностимулирующим данным, он редко вызывает опухолевые регрессии, хотя болезнь и стабилизируется в течение трех и более лет в подгруппе около 10 процентов больных пациентов. Использование препарата «интерферона α-2b» остается, на сегодня, достаточно спорным вариантом лечебной терапии при меланоме кожи. Токсичность данного лекарственного препарата является существенным противопоказанием с психоневрологического, конституционного и печеночного характера токсичности – в этом кроются основные проблемы подобной терапии [17]. Хотя, это и улучшает безрецидивную выживаемость, — и нельзя об этом не сказать, — но адъювантное (послеоперационное) лечение лекарственным препаратом «ПЭГ-интерферон» («PEG-interferon α-2b («PEG-IFN»)) α-2b («ПЭГ-ИФН») отрицательно влияет на качество жизни у больных пациентов с третьей стадией меланомы кожи [13].
Теперь же предполагается, что персонализированные молекулярные методы лечения для каждого больного пациента необходимо изменять, относительно специфики молекулярных изменений и мутации отцовства в опухолях больных пациентов. Одной из таких процедур может быть восстановление функции «p53»-белка «дикого» типа с помощью малого молекулярного ингибитора E3-убиквитин-лигазы (Е3) [18], [19] и [20]. Несколько научных медицинских докладов продемонстрировали определенную роль для аберрантных «Нотч» («Notch») сигнализации путей траектории («pathway») в меланомагнезисах («melanomagenesis») и прогрессии [21]. Таким образом, еще одной возможной стратегией для лечения меланомы может стать ориентацией на путь траектории («pathway») «Нотч» («Notch») с помощью различных ингибиторов, например, «γ-secretase» ингибиторов [22] и [23], или же с помощью сочетания нескольких целевых терапий, согласно молекулярным изменениям в меланомах опухоли больного пациента.
Рассмотрим «Рисунок первый», который, буквально, обобщает знания о мутировавших генах и аномальных путях в меланомах кожи. Это выглядит так, что меланома прогрессирует в больных органах. А это, по сути, является результатом различных сочетаний нарушений всевозможных эффекторов, действующих различными молекулярными «траекториями пути» («pathways»). Мы полагаем, что для понимания молекулярных изменений в патогенезе меланомы кожи следует предложить цели для персональной лекарственной терапии больных пациентов.
«Рисунок первый».
«Молекулярные аберрации в прогрессии меланомы».
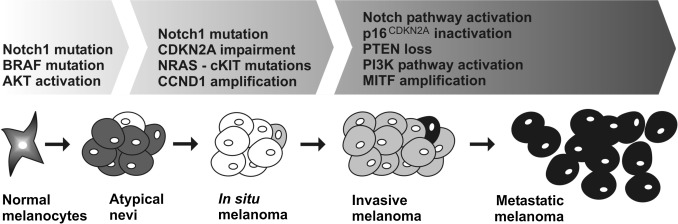
«Нотч» («Notch»)1; Вырезка рецепторов; «BRAF» («БРАФ»), человеческого гена, который делает белок под названием «B-Raf» (серин /или треонин киназы белка); «AKT»; конкретного серина/ треонина-протеинкиназы конкретных; «CDKN2A», «2A-ингибитор-циклин», зависимой киназы, или — циклинзависимой ингибитор-киназы-2А; «НКО» («NRAS»); нейробластома «РАН» («RAS») вирусная («v-РАН») — («v-Ras») онкогена гомолога; «cKIT», рецептор тирозинкиназы (прото-онкогенов); «CCND1», «G1/S»-конкретного циклин-«D1» («G1/S-specific cyclin-D1»); «P16CDKN2A», опухоль супрессирующего гена (ген-супрессор опухолей), участвующий в пути траектории («pathway») гена «p16» / или циклин-зависимых киназы / или ретинобластомы путей траектории («pathway») клеточного цикла управления (пути контроля клеточного цикла); «PTEN» («ПТЕН»), фосфатазы и натяжение гомолога ангиотензина; «MITF», микрофтальмия связанного транскрипционного фактора; нормальные меланоциты, меланин кожи продуцирующих клеток (меланин-продуцирующие клетки), расположенных в нижних слоях (слой образование, базальный слой) кожи эпидермиса; атипичные невусы, необычные доброкачественные родинки, которые внешне могут напоминать меланому кожу; в «situ»-меланомы кожи (на месте меланомы кожи), ранняя стадия меланомы кожи. Раковые клетки находятся в верхнем слое кожи (в эпидермисе); инвазивные меланомы кожи, проникающие глубже в кожу, и которые могут распространяться на другие части человеческого тела; метастатические меланомы кожи, когда меланомы кожи распространяются в другие места человечного теле и по всему организму, — тогда они называются метастатическими, или расширенными, меланомами кожи.
- Мутировавшие гены (мутации генов) и аномальные пути в меланому кожи.
Прогрессирование меланомы кожи связано не только с определенными генетическими изменениями (мутациями, делециями, амплификациями, транслокациями или же генами), но также оно связано с эпигенетическими изменениями, которые модулируют модуляции деятельности транскрипции метилирования («methylations») и реорганизации хроматина. Эти изменения, как следствие, вызывают и приводят к аберрантным сигнальным путям траектории в меланомах кожи человека. Затем будет «обсуждаться» мутирование генов и ведущих аберрантных путей траектории («pathway») в человеческой меланоме кожи, которая представляет интерес в отношении их точек зрения, новых персонализированных стратегий лечения меланомы кожи (более детально прописано в «Таблице первой»).
«Таблица первая».
«Мутировавшие гены (мутации генов) и аномальные пути, связанные с прогрессированием меланомы кожи человека».
| Траектория пути («Pathway») | Название гена | Мутация | Частота (в процентах,%) | Стадии прогрессии | ||
Последствия
Ссылки
«РАН» («RAS») /или «РАФ» («RAF») /или «МЕК» («MEK») /или «ЕРК» («ERK»).
«Н-РАН» («N-RAS»).Получить из функции (Gain-of-function)
«RASQ61K»/ или «R».81
15–30.Врождённые меланоцитарные невусы,
Меланома.
Триггеры старения, фенотипы невусов и преобразование увековеченных меланоцитов (запускание процесса старения фенотипов в невусах и превращение увековечивания меланоцитов).
Постоянно и конститутивно активный «МАРК»-путь траектории («pathway»). Увеличение выживания и рост. [24] и [25]. «БРАФ» («BRAF»).Получить из функции (Gain-of-function) — «БРАФ-В 600 Е» («BRAFV600E).82
50.Доброкачественные невусы.
Меланома кожи человека.Триггерыстарения, фенотипы невусов и преобразование увековеченных меланоцитов (запускание процесса старения фенотипов в невусах и превращение увековечивания меланоцитов).
Постоянно и конститутивно активный «МАРК»-путь траектории («pathway»). Увеличение выживания и рост. [26], [27], [28], [29] и [30]. «МЕК» («MEK»).Получить из функции (Gain-of-function) «МЕК1/2» («MEK1/2»). Меланома кожи человека.Учредительный и конститутивный «ЕРК» («ERK») фосфорилирования и более высокая устойчивость к ингибиторам «МЕК» («MEK»). [31], [32] и [33]. «MAPK» («МАРК»).Получить из функции (Gain-of-function) «MAP3K5» и «MAP3K9.
Получить из функции (Gain-of-function) «MAP2K1» и «MAP2K2».67–85.
8.Метастатическая(«Metastatic) меланома кожи человека.
Меланома кожи человека.Потеря функций киназы «МАРК»; снижение активности путей «MAP3K», которое, возможно, может привести к химической устойчивости меланомы кожи человека.
Учредительный и конститутивный «ЕРК» («ERK») фосфорилирования и более высокаяустойчивость к ингибиторам «МЕК» («MEK»).
Потеря функции (Loss-of-function) Потеря функции (Loss-of-function) «CDKN2A» («CNV»).
- 8.2.
56.
Меланома кожи человека (семейная).
Меланома кожи человека.
Меланома кожи человека.Мутации влияют на «p16INK4a, «p14ARF», /или обоих белков путем удаления, мутации или промоутера глушителе. Неконтролируемые клеточные пролиферации [36]. «p16INK4a».Потеря функции (Loss-of-function) «p16INK4a».50.Меланома кожи человека.«CDKN2A». Потеря функции (Loss-of-function). «CDK4» и «CDK6». Активация и содействие пролиферации клеток.[36]. «p14ARF».Потеря функции (Loss-of-function) «p14ARF».90–95.Меланома кожи человека.Потеря функции (Loss-of-function) «p53»-белка. Продвижение деградации «р53»-белка. Неконтролируемый рост клеток и пролиферации. [36] «CDK4».«CDK» («R24C»).
Получить из функции (Gain-of-function)
«CDK4» («CNV»).37Меланома кожи человека (семейная)
Меланома кожи человека.Сделать «p16INK4a» -не в состоянии препятствовать комплексу «D1» /или «CDK4»-комплексу. Прогрессирование клеточного цикла. [36]. «PI3K» /или «AKT».«AKT3».Усилители «AKT3».35.Меланома кожи человека.Отрицательное регулирование «PI3K» /или «AKT» траектории пути («pathway»). Неконтролируемая клеточная пролиферация. [37], [38] и [39]. «ПТЕН» («PTEN»).Потеря функции (Loss-of-function)
«ПТЕН» («PTEN»).40–60.Меланома кожи человека.Отрицательное регулирование «PI3K» /или «AKT» траектории пути («pathway»). Учредительные и конситуитивные активации «AKT». Неконтролируемая клеточная пролиферация. [37], [38] и [39]. «PI3K».«PI3K».5.Меланома кожи человека.Негативные правила «PI3K»/ или «AKT» путей траекторий («pathway»). Учредительный акт активации. Неконтролируемые пролиферации.
«Dickkopf-1, 2, 3». Меланома кожи человека.Неконтролируемый клеточный рост и распространение.[42] и [43]. «WIF-1».Снижение или потеря выражения
«WIF-1». Меланома кожи человека.Неконтролируемый клеточный рост и распространение.
[44]. «Нотч» («Notch»)траектории пути («pathway»).«Нотч1» («Notch1»).«Haplo»-недостаточность или получить из функция «Нотч1» («Notch1»).Меланома кожи человека.Высокий уровень экспрессии «Notch1» («Нотч1»), усиливается активация «Нотч» («Notch»)траектории пути («pathway»). Активируется уровень β — катенина («β-catenin»). Неконтролируемый рост клеток. [45], [46], [47], [48], [49], [50], [51], [52], [53], [54], [55], [56], [57] и [58]. Белковая «p53»-траектория пути («pathway»).«П53» («P53»).Мутации или удаления
«TP53».1–5.
11–25.Метастатическая(«Metastatic) основная меланома. Меланома кожи человека.«G1» /или «S» клеточного цикла, инактивированный, белковый «р53»-путь траектории («pathway»); неконтролируемая клеточная пролиферация. [59] и [60]. «МДМ2»(«MDM2»).Усилители
Сильно выраженные.
- 50.
Меланома кожи человека.«G1» /или «S» клеточного цикла, инактивированный «р53»-путь траектории («pathway»); неконтролируемая клеточная пролиферация. [59] и [60]. «МДМ4»(«MDM4»).Сильно выраженные.
65. Прямоеподавление белковой «p53»- трансактивацией; неконтролируемой клеточной пролиферацией. [59] и [60].
3.1. «РАН» («RAS») /или «РАФ» («RAF») /или «МЕК» («MEK») /или «ЕРК» («ERK») траектории пути («pathway»).
Сообщается, что «РАН» («RAS») /или «РАФ» («RAF») /или «МЕК» («MEK») /или «ЕРК» («ERK») траектории пути («pathway») активируются в более, чем в 80 процентах случаев всех кожных меланом. Этот сигнальный путь передачи траектории («pathway») регулируется рецепторами тирозина киназы, цитокинами и гетеротримерными «G»-белками-рецепторами. Небольшие белковые «G»-белок «РАН» («RAS») – («HRAS», «KRAS» и «НРО» в организме человека) с течением времени активируют «РАФ» («RAF») — («Araf» («АРАФ»), «БРАФ» («BRAF») и «КРАФ» («CRAF») в организме человека), что следует последовательной активации «МЕК» («МЕК») и «ERK» («ЭРК»), и этот сигнал, наконец, является преобразованным (трансдуцированным) к правилам транскрипции (регулирования) в ядре [24].
Этот путь траектории («pathway») конститутивно активируется факторами роста (эпидермальный фактор роста [«ЕГФ» («EGF»)], тромбоцитарный фактор роста [«ГРП» («PDG»)], сосудистый эндотелиальный фактор роста [овощной («VEG»)], стволовых клеток фактор [«СКФ» («SCF»)], фактор роста фибробластов [«ФБП» («FGF»)], фактор роста гепатоцитов [«ХГФ» («HGF»)] и глиальных клеток-нейротрофический фактор [«ГДНФ» («GDNF»]) [24] и [25]. Когда активируется «РАН» («RAS»), то могут образовываться комплексы с «РАФ» («RAF»). Этот активированный комплекс «приводит» к фосфорилированию митоген-активируемой протеинкиназы путей траектории («pathway») в «MAPK» («МАРК»), Он также известен, как «ЭРК» («ЕРК»), который прохдит через активацию «MEK» («MEK»). Путь траектории («pathway») «MAPK» («МАРК»), когда фосфорилируется, может, непосредственно, проникать и вводить в ядро и, таким образом, происходит эффект экспрессии генов. Все это, в конечном итоге, приводит к изменениям контроля клеточной пролиферации [25].
Активирующие мутации в «БРАФ» («BRAF») видны в 50 – 60 процентах случаев всех меланом [26]. Среди мутации «БРАФ» («BRAF»), наблюдается в меланомах свыше 90 процентов на кодон 600, и среди них — более 90 процентов являются единичными нуклеотидными мутациями (мутациями нуклеотида), что приводит к замене валина глутаминовой кислотой «БРАФ-В 600 Е» («BRAFV600E»). Менее распространенные мутации — это «БРАФ-В 600 К» («BRAFV600К»), например, замена валина лизином, которая представляет 5 процентов – 6 процентов. Тем не менее, о распространенности «БРАФ-В 600 К» («BRAFV600К») было сообщено выше в некоторых проводимых группах исследования [27]. Мутация «БРАФ» («BRAF») активирует «БРАФ-В 600 К» («BRAFV600К») и индуцирует учредительные сигналы «МЕК»-«ЕРК» («МЕК»-«ERK») в клетках. Активированный «БРАФ» («BRAF») также участвует в контролировании клеточного цикла данной прогрессии [28]. Все это приводит к постоянному активному участию «МАРК» («МАРК») пути траектории («pathway»). Он, в свою очередь, способствует «продвижению», буквально, «поощрению» распространения, выживания, вторжения и ангиогенеза меланомы кожи человека. Это представляет большой научный интерес для ученых, ведь «БРАФ» («BRAF»)-мутации происходят также при высоких частотах (> (больше) 80 процентов) в меланоцитных невусов. Мы только предполагаем, что эти соматические изменения происходят в начале меланомагнезиса («melanomagenesis») [29]. Тем не менее, большинство невусов не переходят в злокачественную форму меланомы кожи человека. Это означает, что мутация гена «БРАФ» («BRAF») может быть необходимой, но не достаточной, чтобы вызывать такую злокачественную трансформацию в человеческом организме. Предполагается, что индуцированные механизмы «контрольно-пропускного пункта» у «БРАФ-В 600 Е» («BRAFV600E») могут производить процесс «старения» организма, как особого состояния, при отсутствии дополнительных генетических и молекулярных «событий», которые способствуют туморогенезису («tumorigenesis») [29] и [30]. Предполагается, что другие мутации вместе с «БРАФ-В 600 Е» («BRAFV600E») могут быть необходимы для «инициации» и прогрессии опухолей, особенно в меланомах кожи человека, возникающие, в связи с уже существующими у человека невусами [31].
В меланомах кожи человека, мутации в «НКО» («NRAS») являются наиболее распространенными и включают примерно 15 процентов – 30 процентов всех изученых случаев заболевания человеком меланомой кожи. Среди всех мутаций «НКО» («NRAS») наиболее частыми случаями и проявлениями меланомы кожи человека являются «RASQ61K» /или «R»-замена глутамина в положении 61 — по этой позиции лизин или аргинин глютамина [32]. 81 процент всех врожденных и меланоцитарных невусов и пигментные пятнышек мутации – это мутации «RASQ61K» /или «R». Усиленная экспрессия и принудительное выражение онкогенных мутаций «RASQ61K» /или «R» в нормальных меланоцитах вызывает старение фенотипа через задержку роста и, следовательно, вызвают уже, условно говоря, «рост задержки». Точно известно, что невусы могут оставаться «задеражанными» в росте на протяжении целых десятилетий [29]. Онкогенное выражение «НКО» («NRAS») и «БРАФ» («BRAF») вызывает «продвижение» пролиферации, поощрение распространения, выживания, «вторжения» и ангиогенез меланомы через активацию путей траектории («pathway») «MAPK» («МАРК») [25]. Кроме того, «НКО» («NRAS») и/ или «БРАФ»-(«BRAF»)-активации опосредуют переход («EMT») переключателя эпителиальных к мезенхимальных — на поздней стадии меланомы кожи человека (коммутатор переходного эпителия в мезенхимы («EMT») на поздней стадии меланомы кожи человека). «ЕМТ» является независимым фактором неблагоприятного прогноза у больных пациентов с меланомой кожи человека [29]. «НКО» («NRAS») и/ или «БРАФ» («BRAF») сигнальный путь траектории («pathway») является потенциальной «мишенью» для всейпротивоопухолевой терапии, соблюдая и, буквально, «уважая» ее высокую частоту мутаций и ее важную роли в развитии и прогрессировании заболеваемости меланомы кожи человека [29].
Тем не менее, в дополнении к «НКО» («NRAS») и/ или «БРАФ» («BRAF») — (а также помимо них) некоторые другие компоненты проводящих путей траектории («pathway») «MAPK» («МАРК») часто также мутируют в клеточных линиях меланомы кожи человека и пробах меланомы кожи человека. «Старк» и другие («Stark et al») [33] установили мутации в «MAP3K5» и «MAP3K9». Недавно были обнаружены и идентифицированы неканонические мутации «БРАФ» («BRAF»), в результате конститутивные и учредительные «ЭРК» («ERK») обладали фосфорилированием и высокой устойчивостью к ингибиторам «MEK» («МЕК»). Скрининг и детальный анализ больший группы исследуемых больных пациентов с меланомой кожи человека показал наличие повторяющихся соматических проявлений «MAP2K1» и «MAP2K2»-мутаций, которые происходили при общей частототности в 8 процентов [34] . Хотя вполне возможно, что «MEK1» /или «MEK2»-мутации активируют в «ЭРК» («ERK») присутствие этих изменений в онкогенных условиях. «БРАФ-В 600 Е»-(«BRAFV600E»)-поражения предполагают, что другие сигнальные эффекты могут происходить. И, по крайней мере, некоторые «MEK1» /или «MEK2»-мутации могут также придавать устойчивость этим процессам и предусматривать сопротивление к «РАФ»-(«RAF»)-ингибированию [35] .
3.2. «СДКН2» («CDKN2») / или «CDK4» («CДK4») опухоли подавляющих путей траектории («pathway»).
Циклин-зависимой киназы ингибитор «2А» («СДКН2А» («CDKN2A»)) является основным геном, участвующим в патогенезе меланомы кожи человека и предрасположенности этому заболеванию. Он располагается на хромосоме «9p21» и кодирует два белка, а именно: «p16INK4a» (ингибитор киназы а) и «p14ARF» (перевод в рамке альтернативных чтения и считывания), — известных, как опухолевые «супрессоры» [29]. Потеря функции мутации в локусе («СДКН2А» («CDKN2A»)) являются наиболее частым генетическим аномалием при семейной кожной меланоме человека (это оставляет около 40 процентов всех случаев семейной кожной меланомы человека). Эти мутации у больных пациентов без каких-либо историй, все же, сравнительно редко встречаемые (около 8,2 процентов всех случаев) [26] и [28]. Инактивация («СДКН2А» («CDKN2A»)) обусловлена, главным образом, удалением, мутацией или же рспространением «глушителей» (через гиперметилирование («hypermethylation»)) [28]. Эти мутации могут повлиять на «p16INK4a»-белок и «p14ARF»-белок или на оба белка сразу. «p16INK4a»-белок взаимодействует, непосредственно, с «CDK4» («CДK4») и делением клеток киназы 6 «CDK6» («CДK6»), и блокирует их ассоциации с «D»-типом комплексов. Таким образом, потеря первичной функции белка «p16INK4a» была обнаружена в 50 процентах всех известных случаев меланомы кожи человека. Она способствуют активации «CDK4» («CДK4») и «CDK6» («CДK6»), что приводит к гиперметилированию («hypermethylation») белка ретинобластомы («pRB») и активации транскрипционных факторов содействия «E2F1by», который уже способствует пролиферации клеток. Также было установлено, что потеря функции белка «p16INK4a» способствует меланоцитному «увековечению» [28] и [29]. Белок «p14ARF» известен, главным образом, своим функционированием на предотвращение деградации «p53»-белка «усмирителя» и «подавителя» тумора опухоли убиквитин-лигазы (Е3) белка «МДМ2» («MDM2») и также часто инактивируется при меланоме кожи человека [29]. «МДМ2» («MDM2») негативно регулирует «p53»-белком, и функциями «МДМ2» («MDM2»), регулируя белок «p14ARF». Хотя, прямые мутации «p53»-белка все же редки и встречаются нечасто при кожных меланомах человека (около 5 процентов – 10 процентов всех людей, заболевших кожной меланомой), инактивирование путей траектории («pathway») «p53»-белка больше происходит и встречается через («СДКН2А» («CDKN2A»)) и чеерз утрату функции своего продукта белка «p14ARF». Таким образом, потеря функции белка «p14ARF» также приводит к увеличению роста, пролиферации и распространению мелномы кожи человека [18] и [26].
Циклин-зависимые киназы 4 («СДКН2А» («CDKN2A»)) расположены в «12q13.6» и кодируют белок, взаимодействующий с продуктом гена продукта белка «p16INK4a». Были выявленыгерминальные мутации в этом гене в очень небольшом проценте случаев забоелваемостмм семейной меланомой кожи человека (а именно — зародышевые линии мутации в этом гене были идентифицированы в очень небольшой проценте семейной кожной меланомы человека). Мутация аргинина в позиции 24 в цистеине или гистидине («СДК4Р24С/Ч» («CDK4R24C/С»)) оказывает влияние на этот белок: он ставноится «нечувствительным» к правилам и регулированию по белку «p16INK4a», но сохраняет взаимодействия между «CDK4» («CДK4») и циклином «Д1» («D1»), ведущими к учредительным и конститутивным активациям белкового комплекса и ненормальному (аномальному, буквльно) распространению, через инактивации белка ретинобластомы и «Е2Ф»-(«E2F»)- активации [28] [29].
Недавно, у молодого больного пациента из исследуемой группы в 143 человека с первичными инвазивными меланоми мы обнаружили вариации числа копий гена («ВКК» «CNVs»)) в «CDK4» («CДK4»), «ССНД1» («CCND1») и («СДКН2А» («CDKN2A»)). Было показано, что вариации числа копий гена («ВКК» «CNVs»)) были распространены в меланомах кожи человека, с усилением «CDK4» («CДK4») /или «ССНД1» («CCND1») в 37 процентах и 18 процентах всех случаев, соответственно, и при гемизиготных, или при гомозиготных («hemizygous») потерях («СДКН2А» («CDKN2A»)) в 56 процентов [36] .
3.3. «PI3K» /или «AKT» пути траектории («pathway»).
«PI3K» /или «AKT» пути траектории («pathway») являются одними из самых важных сигнальных путей при раковом заболевании. Многочисленные исследования показали, что активация этого пути траектории («pathway») играет крайне важную роль в меланомах кожи человека, часто в условиях одновременной активации «РАФ» («RAF»), «ЭРК» («ERK»), «МЕК» («МЕК») и «РАН» («RAS») сигнальных путей [37«PI3K» /или «AKT» пути траектории («pathway»), которые активируются факторами роста или митогенными стимулами, такими как, инсулин-подобный фактор роста 1 («IGF1») и / или «РАН» («RAS»)]. «PI3K» катализирует фосфорилирование фосфатидилинозитола («PI») в фосфатидилинозитоле-3 фосфата («PIP3»), который, в свою очередь, активирует серин /или треонин киназы «AKT» [25]. Фосфатазы и гомологи ангиотензина фосфатидилинозита фосфата фосфатаза («ПТЕН» — «PTEN») негативно регулируют пути траектории («pathway») «PI3K» по «dephosphorylating» и инактивации «PI3K». «ПТЕН» («PTEN») часто бывет, буквально, «выведен из эксплуатации» при раковых заболеваниях у больного человека. Инактивированные «ПТЕН» («PTEN») не могут «препятствовать» «PI3K»; в результате, митогенные белки активируются при движении вверх «по течению» их регулятора «AKT3» [25], [29] и [31]. «AKT3» является формой серина /или треонина киназы, что преимущественно и преференциально экспрессируется и выражено в человеческих меланомах кожи. И их активация амплификации гена находится приблизительно в 60 процентах спорадических человеческих кожных меланах (это примерно 35 процентов всех случаев) или путем траектории («pathway») инактивации «ПТЕН» («PTEN») (это примерно 40 процентов – 60 процентов всех случаев). Эти мутации негативно и крайне отрицательно регулируют «PI3K» /или «AKT» пути траектории («pathway»). Мутации «PI3K» были определены только в 5 процентах случаев [25] и [38]. Примерно 30 процентов всех человеческих, метастатических меланом кожи человека с моноаллельной («monoallelic») потерей и явным убытком «ПТЕН» («PTEN») показали аномально низкие уровни транскрипторов и белковых уровней. Мы предполагаем, что эпигенетические правила регулирования могут быть «вовлечены в развитие» данных видов опухолей. Последние исследования показали корреляцию между эпигенетическими глушителями «ПТЕН» («PTEN») и летальным конечным, исходом заболевания – смертью больного пациента [25], [28], [29] и [31].
Функциональные эксперименты продемонстрировали и показали важную роль «PI3K» /или «AKT» путей траектории («pathway») в меланомах кожи человека – «посвящения» и терапевтического сопротивления (терапевтической резистентности). Наличие многих ингибиторов против «PI3K» /или «AKT» путей траектории («pathway») быстро приводит к развитию научного исследования и процессов, которые, в конечном итоге, будут определять его клиническое значение этого заболевания, в этой болезни [37]. Кроме того, ученый Ши и с коллегами («Chi et al.») смогли недавно установить, что инсулин ослабляет и уменьшает терапевтическую эффективность «ДТИК» («DTIC») и «ПЛХ4720» («PLX4720» в клетках меланомы кожи человека, которая опосредована активацией «PI3K» /или «AKT» путей траектории («pathway»), и может быть преодолена путем траектории («pathway») «PI3K»-ингибиторов [39].
3.4 . «WNT» («ВНТ») /или траектория пути («pathway») белка β–катенина («β-catenin»).
В изменения в «WNT» («ВНТ») /или траекторию сигнального пути («pathway») β–катенина («β-catenin») вовлечены и многочисленные аномалии развития, роста и гомеостаза [40]. «WNT» («ВНТ») белков включают в себя различные секреции секреторных гликопротеинов, которые соединяют и «присоединяются» к «Frizzled»-рецепторам и рецепторам, связанных с белком липопротеинов низкой плотности, с тем, чтобы стабилизировать критический уровень белка β-катенина («β-catenin»). Белок β-катенин («β-catenin») является многофункциональным белком, который «связывается» с E-кадгерином («E-cadherin») и альфа-катенином («α-catenin») в плазматической мембране, чтобы помочь им в межклеточных ячейках спаек. Белок β-катенин («β-catenin») также был обнаружен в цитоплазме или же в ядре, где он действует, как транскрипционный кофактор с белками «ФТС» («TCF») и «ДК»-(«LEF»)-белками. При отсутствии «WNT»-(«ВНТ»)-«Frizzled» сигнализации свободных белков β-катенина («β-catenin») они являются связанными с ингибитором сигнального пути траектории («pathway») — «WNT» («ВНТ») — («Axin»), гликоген-синтазы-киназы-3-бета («GSK3b») и «APC», в комплексе с прямыми фосфорилированными белками β-катенина («β-catenin»), ведущими к полному деградированию протеасов [ 29] и [40].
Белок β-катенин («β-catenin») активируется, когда «WNT» («ВНТ»)-лиганды связываются с рецепторами клеточной поверхности «Frizzled». Эта «привязка» и это связывание имеет важное значение для формирования меланомы кожи человека через течение, оказываемое ими тормозящее действие и тормозящие эффекты на рилин («Gsk3b»). Мутации гена белков β-катенин («β-catenin») в экзоне-3 (примерно 1,5 процента всех случаев заболеваемости меланомой кожи человека) препятствовали его фосфорилированию рилина («Gsk3b»), что приводило, в результате, к его накоплению в цитоплазме и транслокации в ядре, где он связывает и активирует транскрипционный («transcriptional») фактор «партнеров» с белками «ФТС» («TCF») и «ДК»-(«LEF»)-белками. Все это приводит к усилению активности («upregulation») митогенных белков, таких, как «Myc» и циклин «Д1» («D1») [29] и [31]. Также было установлено, что экспрессия и выражение негативных регуляторов канонических «WNT» («ВНТ») и β-катенина («β-catenin») сигнальных путей траектории («pathway»), таких, как «Dickkopf-1, 2, 3» («Dkk-1, 2, 3») и «WNT» («ВНТ»)-фактора, ингибирующего-1 («WNT» («ВНТ»)-1), сильно снижается или же, вообще, бывает полностью утеряна, и в клеточных линиях человеческой кожной меланомы и опухолевых образцах [29]. Недавние наши исследования смогли показать и продемонстрировать, что с активацией «WNT» («ВНТ») /или траекторией сигнального пути («pathway») β–катенина («β-catenin») автоматически уменьшается рост опухолей, а также взаимное «сотрудничество» с «ЕРК» («ERK») / или ингибиторами путей траектории («pathway») «MAPK» («МАРК») для «продвижения» и содействия апоптоза в меланомах кожи человека [41]. Недавно Конрад и другие ученые («Conrad et al.»), посредством скрининга и анализа данных миРНК (малые интерферирующие РНК, «siRNA», — это одноцепочечные РНК длиной около 22 нуклеотидов, которые комплементарно (или частично комплементарно) связываются с мРНК, что приводит к ее разрушению или к ингибирова- нию трансляции с нее) идентифицировали белок, «ФАМ129Б» («FAM129B»), в качестве потенциального регулятора «WNT» («ВНТ») и β-катенина («β-catenin») сигнальных путей траектории («pathway»). Нами было также показано и продемонстрировано, что малые интерферирующие миРНК («siRNA») опосредованного нокдауна «ФАМ129Б» («FAM129B») в «А375» и «А2058» клеточных линий меланомы кожи человечка ингибируют опосредованную «ВНТ3а» («Wnt3a»)-активацию β–катенина («β-catenin») сигнальным путей траектории («pathway»), реагирующих «отзывчивые» люциферазы и ингибирующих выражение, и препятствующих проявления «экспрессии» эндогенного целевого гена-мишени «WNT» («ВНТ») и β-катенина («β-catenin») сигнальных путей траектории («pathway») «Axin2».
Было также показано и продемонстрировано то, что «ФАМ129Б» («FAM129B»)-нокдаун «угнетает» и ингибирует апоптоз («apoptosis») в клетках кожной меланомы человека, получившего лечение с «ВНТ3А» («WNT3A»). Эти эксперименты во многом поддерживают роль «ofFAM129B» в увязке «WNT» («ВНТ») и β-катенина («β-catenin») сигнальных путей траектории («pathway») сигнализации к апоптозу («apoptosis») в меланомах кожи человека [42].
Было установлено, что «МЦПК» («ICAT»), другой ингибитор β-катенина («β-catenin») сигнальных путей траектории («pathway»), и белки «ФТС» («TCF») ингибируют β-катенин («β-catenin») транскрипции, «соревнуясь» с Т-клетками, факторами лимфоидных /или усилителей энхансер-факторов [43]. Клетки человека меланомы кожи с высоким уровнем «МЦПК» («ICAT») часто характеризуются дерегулированной β-катенина («β-catenin»)-сигнализацией. Высокие уровни «МЦПК» («ICAT») коррелировали с образование метастазов у подопытных мышей. Эктопическое и внематочное выражение «МЦПК» («ICAT») в клетках меланомы кожи человека не влияет на их распространение и пролиферацию, но зато происходит увеличение клеточной подвижности и «вторжение» в метастатические клетки кожи человека [43].
Недавно было показано, что повышенный уровень атомного и ядерного белка β-катенина («β-catenin») связан с улучшением и повышением процента выживаемости у больных пациентов меланомой кожи. Больные пациенты с более высоким уровнем атомного и ядерного белка β-катенина («β-catenin») в их опухолях не демонстрируют преимущество выживания, наблюдавшееся ранее у больных пациентов с молекулярно-невыбранной меланомой кожи, которые не получали «БРАФи» («BRAFi»). Кроме того, активация «WNT» («ВНТ») и β-катенина («β-catenin») сигнализации заметно «тормозится» и ингибируется в клетках, «культивировавших» в меланомах кожи у больных пациентов, получивших лечение с долгосрочным применением «БРАФи» («BRAFi»). Основываясь на наши наблдения, мы предполагаем, что продолжительное лечение меланомы кожи человека именно «БРАФи» («BRAFi») сможет повлиять на взаимодействие между «WNT» («ВНТ») /или путем траектории («pathway») «MAPK» («МАРК»), и «WNT» («ВНТ») и β-катенина («β-catenin») сигнальных путей траектории («pathway»), что прямо повлияет благоприятные или же неблагоприятные исходы для больных меланомой кожи пациентов [44]. Таким образом, понимание взаимодействия путей траектории («pathway») в «WNT» («ВНТ») и в β-катенине («β-catenin») сигнальных путей траектории («pathway») будет крайне необходимым для больных пациентов меланомой кожей, поскольку это будет способствовать облегчению индивидуального лечения, и, поэтому, обеспечит продолжительное выживание больных меланомой кожи пациентов.
2.5. «Нотч» («Notch») пути траектории («pathway»).
Известно, что аберрантная сигнализация «Нотч» («Notch») путей траектории («pathway») приводит к раку кожи, но регулирование участников системы «Нотч» («Notch») путей траектории («pathway») в патогенезе опухолей кожи человека еще не полностью изучена до конца, а потому – этот механизм остается непонятным. «Нотч» («Notch») пути траектории («pathway») являются рецепторами клеточной поверхности, которая преобразовывает и передает сигналы малой дальности, взаимодействуя с трансмембранными лигандами, такими как «Дельта» («Delta») (называемая дельта-образной в организме человека – «termed Delta-like in humans») и «Serrate» («Серрате» — называемая, зазубренной у человека – «termed Jagged in humans») на соседних ячейках клеток. Связывание лиганды приводит к расщеплению «Нотч» («Notch») путей траектории («pathway»)-рецептора и выпуска «Нотч» («Notch») пути траектории («pathway») внутриклеточного «домена» («NiCd»). Выход внутриклеточного «домена» («NiCd») «путешествует» к ядру и регулирует транскрипцию ДНК-комплексов, содержащих белок (и связывающих его), связывающий «CBF1» /или «RBPjk», /или «SU» («H»), /или «Lag1» («CSL»). Компоненты аппарата транскрипции («MAML1», «HAс»), «набираются» в комплексе «NICD-CSL», что приводит к транскрипционной («transcriptional») активации генов-мишеней «Нотч» («Notch») пути траектории («pathway») — (Более детально смотреть на «Рисунке втором») [45]. Лиганды и рецепторы «Нотч» («Notch») пути траектории («pathway») модифицированы различными пост-трансляционными, «столб-поступательными», событиями, которые регулируют их количество, качество, или же — активации процессов. Эти пост-трансляционные, «столб-поступательные», правила включают протеолиз (Фурин-обработку рецептора в транс-Гольджи сети ((«the trans-Golgi network» («TGN»)), или последовательные «расколы», «разобщенности» «Адамов» («ADAM») и гамма-секретазы («gamma-secretase») в «Нотч» («Notch») путей траектории («pathway») рецепторов при их активации)), необычное гликозилирование рецепторов во время своего созревания и процесса убиквитинирования («ubiquitination»)[46] и [47]. По последним полученным нами данным, убиквитинирование («ubiquitination») «Нотч» («Notch») путей траектории («pathway») играет важную роль в регуляции его деятельности и аберрантного убиквитинирования («ubiquitination») ферментов, часто связанных с развитием рака, включая такое онкологическое заболевание, как кожная меланома у человека [46] и [48].
«Делтекс» («Deltex») и «НеддЕ3» («Nedd4E3») убиквитин-лигаза (Е3) и белки «NUMB» и альфа-адаптин («α-adaptin») регулируют, в общем, уровень установившегося (стационарного) рецептора «Нотч» («Notch») путей траектории («pathway») на клеточной поверхности. «Неюр» («Neur») и «МИБ» («MIB») E3-убиквитин-лигазы (Е3) регулируют лигандом активации, «ubiquitylating» его внутриклеточного «домена» [46]. «НИИБ» («NICD») «деградирует» и разлагается в «SCF Fbw7 E3» убиквитин-лигазе (Е3)-комплекса через систему убиквитин-протеасомы. «Скелетрофин» («Skeletrophin») является, буквально, главным связующим звеном для убиквитин-лигазы (E3) для «Нотч» («Notch») путей траектории («pathway») лигандов, «Jagged2» и дельты («Delta»). «Скелетрофин» («Skeletrophin») добавляет поли-убиквитин цепочку к дельте («Delta»), ведущей к эндоцитозу, но никак не к деградации. Эта модификация, «Скелетрофин» («Skeletrophin»), положительно регулирует «Нотч» («Notch») сигнальные пути траектории («pathway»). Выражение «Скелетрофин» («Skeletrophin») в кожной меланоме человека подавляется гиперметилированием («hypermethylation») «раскрутки» [46] и [48]. В последнее время, были созданы взаимодействия между «Нумб» («NUMB»), «Нотч» («Notch») путями траектории («pathway»), и «р53»-белком. Как упоминалось уже выше, выпущенные «НИИБ» («NICD») входят в ядра, где они уже связываются с ядерными факторами транскрипции «КСЛ» («CSL») и стимулируют транскрипцию «Нотч» («Notch») путей траектории («pathway») основных генов-мишеней. «Нумб» («NUMB»), во многом, действуют, как док-белки («docking protein») для «НИИБ» («NICD»), предотвращая «НИИБ»-(«NICD»)-транслокации к ядру, и, тем самым, ингибируя и «препятствуя» во многом внутриклеточной «передаче» сигнала («сигнализации», иными словами) «Нотч» («Notch») по путям траектории («pathway»). В то же время, «Нумб» («NUMB») взаимодействует с «р53»-белком регулирующего белка «МДМ2» («MDM2») — (мышиной двойной минуте — два). «МДМ2» («MDM2») ингибирует и, буквально, — «угнетает», — функцию «р53»-белка, блокируя его транскрипционную активность и способствуя его ядерному экспорту, а также, стимулируя его «деградации» через «polyubiquitination». Недавно нами было доказано, что «Нумб» («NUMB») образует тримерный («trimeric») комплекс с «р53»-белком и «МДМ2» («MDM2»), тем самым, регулируя и «выравнивая» стабильность «р53»-белка [49] и [50]. Интересно, что «МДМ2» («MDM2») амплификации генов или же выражение повышенной экспрессии генов являются общепринятыми при случаях заболеваний кожной меланомой человека [18]. Выражение активированного «МДМ2» («MDM2») должно быть одним из самых важных факторов в меланоме кожи человека, потому что это напрямую связано с регулированием, по меньшей мере, двух сигнальных путей траектории («pathway») клетки («Нотч» («Notch») путей траектории («pathway») и «р53»-белка. Все это представляет интерес к тому, что большинство Е3-убиквитин-лигазы, участвующих в регуляции «Нотч» («Notch») путей траектории («pathway»), являются прямо причастными к образованию меланомы кожи человека и «Нотч» («Notch») путей траектории («pathway»). Данные результаты показывают, что «МДМ2» («MDM2») может быть привлекательной «мишенью» для меланомной терапии при лечении данного онкологического заболевания.
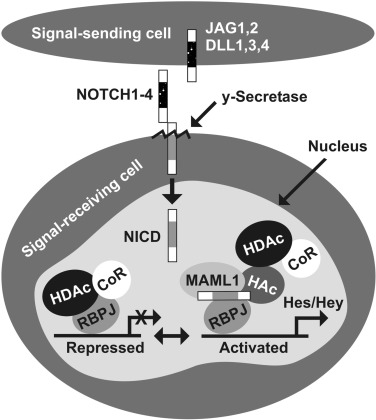
«Рисунок второй».
«Нотч» («Notch») сигнальный путь траектории («pathway»). «Jagged 1» и «Jagged2» (на рсиунке – это «Jag1», «Jag2»), «Нотч» («Notch») путь траектории («pathway») лиганды; «Dll1, 3, 4», «Нотч» («Notch») лиганды ; «Нотч1» («Notch1») путь траектории («pathway»), «Нотч2» («Notch2») путь траектории («pathway»), «Нотч3» («Notch3») путь траектории («pathway»), «Нотч4» («Notch4») путь траектории («pathway»), «Нотч» («Notch») пути траектории («pathway») рецепторы; γ-секретазы, мульти-субъединица (субблок) протеазные комплексы («multi-subunit protease complex»); «НИИБ» («NICD»), «Нотч» («Notch») пути траектории («pathway») внутриклеточного «домена»; «ГДАЦ» («HDAc»), гистондезацетилаз (гистонов комплексы); «ГДАЦ» («HDAc»), гистонов ацетилтрансферазы; КР, КР-корепрессоры («КОР» и «КОР-корепрессоры» («CoR», «CoR corepressors»)); «RBPJ», рекомбиногенные связывания комбинирующего белка, малые и «обнаженные» подавители; «МАМЛ1» («MAML1»), вдохновитель, как белок-1; «ГЭС» /или «Хей» («Hes» /или «Hey»), факторы транскрипции «ГЭС» /или «Хей» («Hes» /или «Hey») (волосяные усилители «Сплит-1»).
За последние несколько лет наблюдаются огромные интересы к роли «Нотч» («Notch»), сигнального пути траектории («pathway»,) в коже здорового и больного человека. Недавние исследования показали, «Нотч» («Notch») пути траектории сигнализации («pathway») играют важную роль в развитии эпидермиса. Однако, необходимо уточнить основные молекулярные механизмы. «Нотч» («Notch») пути траектории («pathway») рецепторов и лигандами дифференциально выражаются в различных клеточных слоях ячеек жизнеспособного эпидермиса [51]. В здоровой коже уже выражаются все четыре рецепторы «Нотч» («Notch») сигнального пути траектории («pathway»). «Нотч» («Notch») сигнального пути траектории («pathway»), кажется, что также влияет на регулирование меланоцитных линий развития. «Нотч» («Notch») сигнальный путь траектории («pathway») в состоянии определить ячейки локализации и урегулировать терминал дифференцировки клеток. Кроме того, «Нотч» («Notch») сигнальный путь траектории («pathway») уменьшается в условиях «hyperproliferating» кожи, включа, «вульгарные» псориазы [51].
Дерегулированные «Нотч» («Notch») сигнальный путь траектории («pathway») (гапло («haplo») недостаточно. Или же эти функции «Нотч» («Notch») сигнального пути траектории («pathway») или генов «Нотч» («Notch») сигнального пути траектории («pathway»), связанных генов) часто наблюдаются в различных злокачественных опухолях человека. И связано это, как правило, с негативными и крайне не оптимистичными исходами для больных пациентов. «Нотч» («Notch») сигнальный путь траектории («pathway») может действовать: либо как онкоген, либо как — опухолевый супрессор, в зависимости от обоих клеточных и тканевых контекстов [52] .
Недавние исследования показали, что отсутствие «Нотч1» («Notch1») сигнальных путей траектории («pathway»), дельта («Delta1») и «Jagged1», «пропавших без вести», или же уменьшившиеся «Нотч» («Notch») сигнальные пути траектории («pathway»), приводят к «беспорядкам» в эпидермальной дифференциации и пролиферации, и способствуют формированию базальной карциномы («ЦДИ» — «(BCCS)») [51]. «Нотч» («Notch») сигнальные пути траектории («pathway»), как уже ранее сообщлось, также «способен содействовать» развитию кожного плоскоклеточного рака («SCC») [53].
Можно предположить, что «Нотч» («Notch») сигнальные пути траектории («pathway»)-видимые, они функционируют в коже, как опухолевые супрессоры. Активация «Нотч» («Notch») сигнальных путей траектории («pathway») показывает расширенный, усиленный, первичный рост клеток меланомы кожи человека в пробирке и в естественных условиях («vitro» и «in vivo»), который включает первичные клетки меланомы кожи человека, чтобы получить возможность метастатической меланомы кожи человека. Кроме того, было показано, что онкогенные эффекты и воздействие «Нотч» («Notch») сигнальных путей траектории («pathway») на клетки меланомы кожи человека были опосредованы через прямое «посредниество» β-катенина («β-catenin»), который активирует («upregulated») следующие эффекты «Нотч1» («Notch1») сигнальных путей траектории («pathway») активации. Кроме того, ингибирование экспрессии и выражения β-катенина («β-catenin») может выдержать «Нотч1» («Notch1») сигнальных путей траектории («pathway») повышенный рост опухоли и метастазирование (метастазы) [54].
Было установлено, что происходит выражение белков «Нотч1» («Notch1») пути траектории («pathway»), «Нотч2» («Notch2») путь траектории («pathway»), «Jagged1», «Jagged2», «Дельта-1» («Delta1») — «upregulated» («Delta-like 1») в диспластических невусах и меланоме кожи человека, по сравнению с общими меланоцитарными невусами. Эти результаты прямо показывают, что активация «Нотч» («Notch») пути траектории («pathway») может представлять развитие ранней меланоцитарной опухоли и вызывать усиление активности («upregulation») «Нотч» («Notch») сигнального пути траектории («pathway»), «поддерживающего» прогрессии опухоли [55]. Pinnix et al. [56]
Только у «Нотч1» («Notch1») пути траектории («pathway») «shownt»-«шляпа» является достаточной для трансформации человеческих меланоцитов. Кроме того, «Нотч1» («Notch1») пути траектории («pathway») еще и усиливает фазу вертикального роста, активации «MAPK» («МАРК») и «AKT» пути траектории («pathway»); ингибирование «MAPK» («МАРК») или «PI3K-AKT» пути траектории («pathway») меняет рост опухолевых клеток, индуцированных «Нотч1» («Notch1») сигнального пути траектории («pathway») [57]. Также было установлено, что «Нотч4» («Notch4») пути траектории («pathway») специально для выражения «Нодал» («Nodal») в агрессивных клетках требует этого, и отыгрывает жизненно важную роль в росте клеток и в поддержании максимально агрессивного фенотипа [58].
Последние проводимые нами исследования свидетельствуют о том, что активная передача сигналов «Нотч» («Notch») путей траектории («pathway») способна как бы «поддерживать» рак объединенных стволовых клеток, индуцируровать эпителиально-мезенхимальный переход и способствовать химической устойчивости рганизма. На основе проводимых нами исследований мы предполагаем и подразумевают то, что фармакологическое ингибирование «Нотч»(«Notch») путей траектории («pathway») сигнализации может, буквально, «уточнить» назначение терапии при раке больному пациенту и улучшить вероятность выживания больного пациента. Гамма-секретазы ингибиторы («ССГС», английское – «GSIs») являются препаратами, которые ингибируют «Нотч» («Notch») путей траектории («pathway») сигнализации и могут быть вполне себе успешными в управлении роста раковых клеток в сочетании со стандартной химиотерапией, но существенные побочные эффекты препятствовали их широкому применению в медицине. Последние усилия ученых-исследователей были направлены уже на развитие и выработку антител против конкретных, специфических рецепторов «Нотч» («Notch») путей траектории («pathway») и лигандов, с надеждой ограничить побочные эффекты, тем самым, обеспечивая тот же результат, что и гамма-секретазы ингибиторов («ССГС», английское – «GSIs»). Вместе с другими проводимыми нашими коллегами исследованиями, характеризующими «Нотч» («Notch») пути траектории («pathway») сигнализации и модуляции, мы очень надеемся, что «изысканные» методы таргетинга «Нотч» («Notch») путей траектории («pathway») были все же уточнены, и теперь они могут стать мощными инструментами в целой системе противоопухолевой терапии [52].
Будущие исследования, уже будут направлены на выявление новых целей сигнализации «Нотч» («Notch») путей траектории («pathway»), что, в свою очередь, уже позволит провести оценку механизмов, лежащих в основе «перекрестных помех» между «Нотч1» («Notch1») пути траектории («pathway»), «МАРК» («МАРК»), «PI3K-AKT, «NF-кВ» и «p53»-белка-путей траектории («pathway»).
3.6. «p53»-пути траектории («pathway»).
Белок «р53»-пути траектории («pathway») положительно или отрицательно регулирует множество генов, участвующих в регуляции клеточного цикла («CDKN1A»), в индукции аутофагии («autophagy»), в процессах старения и апоптоза («NOXA», «PUMA» и «BAX»), а также регулирует гены, участвующие в репарации ДНК или же в клеточном метаболизме ДНК [29] и [59]. Белок «p53» активируется через тетрамеризации («tetramerization»), которые позволяют распознавать «p53»-белок в последовательности конкретной привязки «сайтов» связывания на целевых генах и стимулируют их активацию [59]. Хотя «перегласовки» и мутации «p53»-белка находятся примерно в 50 процентах случаев раковых заболеваний человека, но только в одном-пяти процентах случаев первичных меланом и ы 11-25 процентах случаев метастатической меланомы больные пациенты имеют мутировавший «р53»-белок [18] и [29]. «Перегласовки» и мутации в самом «p53»-белке – это, по-прежнему, менее частые случаи заболеваний при меланомах, поэтому мы можем предложить, что функциональные свойства противоопухолевого «p53»-белка могут быть как бы «репрессированы» многими другими механизмами в организме. Установлено, что «MDM2» функционирует, как негативный регулятор «p53»-белка. Способность «MDM2» ингибировать «p53»-белок регулируется отрицательной «обратной связью», в которой активация «p53»-белка приводит к транскрипции и трансляции «MDM2», что, в свою очередь, прямо вызвает ингибирование «р53»-белка [20]. «MDM2» взаимодействует с трансактивационным («transactivation») «доменом» «p53»-белка через белковый «p53»-взаимодействующий «домен» на «N»-конце при «MDM2». Связывание «MDM2» с «p53»-белком предотвращает от «связывания» у «p53»-белка с его транскрипционным анализом его коактиваторов и, впоследствии, все это приводит к тому, что предотвращается «p53»-белковая активация генов-«мишеней» [20].
Несмотря на то, что нами было обнаружено, что «MDM2» способны хорошо выражаться в половине случаев инвазивных первичных и инвазивных метастатических меланом человека, амплификация и усиление локуса «MDM2» является все же крайне редким явлением [18] и [19]. У больных пациентов, как мы увидели по результатам последующих исследований, было зафиксировано снижение экспрессии и выражения «MDM2». Этот показатель был напрямую связан с более высокими показателями по выживанию больных меланомой кожи пациентов [18]. Это можно объяснять авторегуляторной и авто-нормативной «петлей» между «p53»-белком и «MDM2». Увеличение выражения и экспрессии «MDM2» также возможно, вследствие потери своих репрессоров «p14ARF» и общей мутации. Без своих репрессоров, «MDM2» остается в постоянно активном состоянии. Все эти «события» можно определить, как апоптозу («apoptotic») сопротивления при меланоме кожи человека, несмотря на статус, в значительной степени, «дикого» типа «р53»-белка [18]. Предполагается, что нацеливание «р53»белка на «MDM2»-регулирования «петли обратной связи» с небольшими молекулярными ингибиторами может стать, в последствие, подходящей стратегией лечения пациентов с «р53»-белком «дикого» типа при метастатической меланоме кожи человека [20]. В дополнение, как правило, мутировавшим генам «БРАФ» («BRAF»), «НКО» («NRAS»), «ПТЕН» («PTEN»), «p53»-белка и «p16»-белка, новые гены-«кандидаты» во время проводимого исследования были идентифицированы и определены. В том числе, были установлены гены «GRIN2A», «ERBB4» и «ММР8» (мутировавшие в 30 процентах случаев, в 19 процентах случаев и в 7 процентах случаев меланомы кожи человека, соответственно). Совсем недавно были установлены новые гены-«драйвера» для меланомы кои человека, такие как, «PREX2», «PPP6C» и «RAC1» [29] и [60].
- Современные принципы лечения агрессивной меланомы кожи человека.
Хирургическое иссечение является стандартным методом лечения для локализованных меланом человека. У больных пациентов с такими опасными факторами риска, как толщина опухоли (глубина опухоли больше, чем четыре миллиметра), язвы, высокие митотические показатели или региональные узлы, риск развития метастазов может быть очень высоким (в 30-80 процентах всех случаев) [61]. В настоящее время системная и внутрирастительная терапия являются основной формой лечения для большинства больных пациентов с меланомой кожи четвертой стадии. Она включает в себя: химиотерапию, цитотоксическую иммунотерапию или же комбинацию подходов, например, элементы биохимиотерапии [4]. Ранее, для больных пациентов с хирургической резекцией первичной меланомы (меньше или равной двум миллиметрам) с или без региональных лимфатических узлов, единственным эффективным вариантом адъювантной терапии был назначение «Интерферона-α» («IFN-α» — «ИФН-α») [4]. Тем не менее, из-за его ограниченной пользы при безрецидивной выживаемости и минимально возможном улучшении общей выживаемости, показания для лечения препаратом «Интерфероном-α» («IFN-α» — «ИФН-α») все же остаются достаточно спорными [17]. Системные подходы, которые были оценены, на сегодняшний день, для метастатического заболевания, включают в себя цитотоксическую химиотерапию в виде отдельных «агентов» и множественных лекарственных комбинаций, включая «DTIC», «Темозоламид» и платиновых «агентов» («карбоплатин», «паклитаксел» и белок «паклитаксел»), и иммунотерапии, которые включают в себя цитокинов «Интерферон-α» («IFN-α» — «ИФН-α») и «Интерлейкин-2» («ИЛ-2», «IL-2») [62]. В течение более 30 лет, стандартно рекомендуемой терапией для больных пациентов с четвертой стадией метастазов, в соответствии с системой Американского объединенного комитета по онкологическим заболеваниям («AJCC»), была только одна единственная терапия – «DTIC» [63]. Но монолечение только «DTIC»-терапией или же лечение в сочетании с «DTIC»-терапией привело к низкому уровню реагирования, редким продолжительным ответным реакциям организма, и оно не оказывало никакого влияния на выживаемость больных пациентов [64]. Хотя, уровень ответных реакций на лечение с применением терапии препаратом «Интерлейкин-2» («ИЛ-2», «IL-2») и был низким, но само лечение данным препаратом привлекло ученых-исследователей, о чем свидетельствуют многочисленные научные доклады и сообщения о долгосрочных ответных реакциях в целом комплексе респондентов-ответчиков [64]. Их интересовали, в первую очередь, продолжительные и долгосрочные ответные реакции организма на действие этого препарата [64]. Сочетание химиотерапии с иммунотерапией (биохимиотерапией) привело к увеличению ответных реакций организма, как отмечается в многочисленных исследованиях третьей стадии меланомы кожи человека [65] и [66]. Тем не менее, преимущества в выживаемости больных пациентов не были продемонстрированы, а продолжительность действия уровня токсичности заметно возросла и увеличилась [66].
Расширение знаний о молекулярном патогенезе меланомы кожи человека открывает дверь к персонализированным подходам в лечении данного заболевания. Несколько ведущих групп «агентов», которые меняют классические терапии меланомы, являются высокоселективными мутирующими онкогенами «БРАФ» («BRAF»)-ингибиторами («Вермурафениб» («Vemurafenib»), «Дабрафениб» («dabrafenib»), весьма специфическими ингибиторами «MEK1» /или «MEK2» («trametinib») и моноклональными антителами анти-цитотоксических Т-лимфоцитов антигенов-4, «CTLA-4» («Ипилимумаб» («Ipilimumab»)).
«Вермурафениб» («Vemurafenib») является «устным» ингибитором «тирозинкиназы» в онкогенах киназы «БРАФ-В 600 Е» («BRAFV600E») протеинкиназы. «Вермурафениб» («Vemurafenib») рекомендуется для лечения взрослых больных пациентов с нерезектабельными или метастатическими меланомами кожи. Его назначают также и при положительных мутациях «БРАФ-В 600 Е» («BRAFV600E») [7]. На третьей стадии исследования мы изучали заболевания 675 больных пациентов с неоперабельной стадией IIIC /или четвертой стадией меланомы кожи с мутациями «БРАФ-В 600 Е» («BRAFV600E») у больных пациентов. Согласно результатам проведенного нами исследования, с «Вермурафенибом» («Vemurafenib») были связаны статистически важные показатели. Так, согласно полученной статистики, значительно улучшилась общая выживаемость («ОС») больных пациентов и выживаемости без прогрессирования зболевания («ВБП» — «PFS») по сравнению с лечением «DTIC»-терапией [7].
Результаты проведения декабрьского исследований в 2010 году с «отсечкой краев» показали следующее. Три проведенных исследования показали, что лечение с использованием препарата «Вермурафениб» («Vemurafenib») привело к статистически значимому снижению смертности больных пациентов («HR» = 0.37; 95 процентов — «CI», 0.26–0.55; P < 0.001). За шесть месяцев, общая выживаемость больных пациентов составила 84 процента (95 процентов «CI», 78–89 процентов) в группе больных пациентов, которых лечили с помощью препарата «Вермурафениб» («Vemurafenib»). Аналогичный показатель за этот же период составил 64 процента (95 процентов «CI», 56–73 процента) среди больных пациентов, которых лечили с помощью препарата «Дакарбазин» («dacarbazine»). Также у больных пациентов, которые получали препарат «Вермурафениб» («Vemurafenib»), статистически было отмечено значительное снижение прогрессирования опухолей («HR» = 0.26; 95 процентов «CI», от 0.20 до 0.33; P < 0.001). По средним оценкам и показателям, медиана выживаемости больных пациентов (она оценивалась в 549 пациентов) составила 5,32 месяца (95 процентов «CI», 4.86-6.57) в группе больных пациентов, которые получали препарат «Вермурафениб» («Vemurafenib»), и еще 1,61 месяца (95 процентов «CI», 1,58-1,74) в альтернативной группе больных пациентов, которых лечили с помощью препарата «Дакарбазин» («dacarbazine») [7].
Результаты проведения февральского исследований в 2012 году («среза исследования») показали следующее. Как показывает практика, больные пациенты, которые во время своего лечения перешли от «DTIC»-терапии на лечение препаратом «Вермурафениб» («Vemurafenib») и другими ингибиторами «БРАФ-В 600 Е» («BRAFV600E»), показали, что лечение с использованием препарата «Вермурафениб» («Vemurafenib») привело к статистически значимому результату, без прогрессирования выживаемости («HR» = 0,38; 95 процентов «CI», 0,32 -0.46 , P < 0,001) по сравнению с использованием «DTIC»-терапии. Медиана общей выживаемости составила 13,6 месяцев в группе больных пациентов, которые получали препарат «Вермурафениб» («Vemurafenib»), и 10.3 месяца в альтернативной группе больных пациентов, которых лечили с помощью препарата «Дакарбазин» («dacarbazine») — («HR» = 0,76; 95 процентов, «CI» 0.63-0.93; P <0,01) [7].
Наиболее частые побочные эффекты (класс второй или более), связанными с применением препарата «Вермурафениб» («Vemurafenib») за время проведения исследовании «BRIM3», касались реакции кожи, артралгии и усталости (в декабре 2010 в группу исследования вошло 618 пациентов). В общей сложности 61 человек (10 процентов исследуемых), которые получали препарат «Вермурафениб»(«Vemurafenib»), прошли через три степени кожного плоскоклеточного рака, кератоакантомы кожи («keratoacanthoma»). Или же у них одновременно прошли кератоакантома кожи («keratoacanthoma») и три степени кожного плоскоклеточного рака. В этой группе пациентов лечение проходило, посредством простых хирургических манипуляций [67]. Молекулярные исследования показали, что развитие плоскоклеточного рака и кератоакантомы клеток кожи при лечении ингибиторами «БРАФ» («BRAF») было напрямую связано с парадоксальными активацями митоген-активированного протеина киназы «MAPK» пути траектории («pathway»), которые обходят ингибирование «БРАФ-В 600 Е» («BRAFV600E») [68].
Препарат «Дабрафениб» («Dabrafenib») является другим ингибитораом киназы «БРАФ» («BRAF»), который продемонстрировал значительную активность у больных пациентов с прогрессирующими меланомами кожи, по сравнению с «DTIC»-терапией и химиотерапией. Препарат «Дабрафениб» («Dabrafenib») был одобрен в США в «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) в мае 2013 года. Препарат «Дабрафениб» («Dabrafenib») был также одобрен для лечения больных пациентов с прогрессирующими меланомами, содержащими мутации «БРАФ-В 600 Е» («BRAFV600E») [8]. Результаты ключевой третьей стадии проводимого исследования (было исследовано 250 пациентов с меланомой кожи на неоперабельной третьи стадией или четвертой стадии меланомы с наличием «БРАФ-В 600 Е» («BRAFV600E»)) говорят о том, что проводимое лечение с использованием препарата «Дабрафениба» («Dabrafenib») способно значительно увеличить «ВБП» («PFS»), по сравнению с применением терапии «DTIC» (медиана 5.1 месяца против 2,7 месяца; «HR» = 0,33, 95 процентов «CI», 0,20 – 0,54) [69]. Основываясь на независимый обзор данных, «ПФС» («PFS») был аналогичным образом увеличен (6,7 против 2,9 месяцев; «HR» = 0,35; 95 процентов «CI», 0,20 – 0,61). Объективные ответы, по оценке независимого комитета по рассмотрению полученных данных исследования, были замечены у 93 187 больных пациентов, которых лечили с применением препарата «Дабрафениб» («Dabrafenib») — (50 процентов), включая шесть случаев (3 процента) с полным ответом организма. Среди тех больных пациентов, кто лечится с помощью терапии «DTIC», было зафиксировано четыре частичных ответы в 63 случаях, общий показатель ответов составил всего 6 процентов. В целом, общий уровень выживания был обновлен на собрании Американского общества клинической онкологии («ASCO») в 2013 году [70]. При средней медиане наблюдения последующие 15 и 13 месяцев в двух группах общая выживаемость была лучшей при использовании препарата «Дабрафениб» («Dabrafenib») («HR» = 0,76; 95 процентов «CI», 0,48 – 1,21), но она не была статистически значимее [70].
Лечение больных пациентов с применением препарата «Дабрафениб» («Dabrafenib»), как правило, хорошо переносится последними. Как и «Вермурафениб»(«Vemurafenib»), наиболее частым вторым или более классом токсичности, «Дабрафениб» («Dabrafenib») является дерматологическим препаратом. В других классах токсичности – от второго и выше — наблюдались между 5 процентами и 15 процентами случаев у пациентов боль в суставах, включая еще и усталость, головную боль, артралгию, астению и лихорадку [69].
Примерно у 50 процентов больных пациентов, которых лечили препаратами «Дабрафениб» («Dabrafenib») или «Вермурафениб» («Vemurafenib»), болезнь начинала развиваться, спустя шесть-семь месяцев после начала лечения [70]. Было описано несколько механизмов приобретенных сопротивлений, включая повышенное выражение киназы «КРАФ» («CRAF»), «СОТ1» («COT1») или мутации «БРАФ» («BRAF») [71] [72] и [73], активации мутации в НКО («NRAS»), «MEK1» или «AKT1» [35] и [74], аберрантных сплайсингах мутации «БРАФ» («BRAF») [75], активации киназы фосфатидилинозитола-3-OH («PI3K») через потерю «ПТЕН» («PTEN») [76] и стойких активационных рецепторов тирозинкиназы, включая «ПДЖФРß» («PDGFRß»), «ИЖФ-1Р» («IGF-1R») и «ЕЖФР» («EGFR») [74] , [77] и [78].
Механизм относительной частоты сопротивления и корреляции этих механизмов с клинических исходов мутации «БРАФ» («BRAF») ингибиторов терапии плохо еще понимается. Без одного исследования, были проанализированы все ранее известные механизмы сопротивления в когорте одного больного пациента, но это не дало нам, увы, понять их корреляцию с клинико-морфологическими особенностями или результатами.
Препарат «Траметиниб» («Trametinib») является очень мощным, высоко специфическим ингибитором «MEK1» /или «MEK2». Препарат «Траметиниб» («Trametinib») был первоначально одобрен для лечения больных пациентов с меланомой, которые ранее лечились «БРАФ» («BRAF») ингибитором, который содержит мутирующий «БРАФ-В 600 Е» («BRAFV600E») [10]. Это утверждение было основано на продление общей выживаемости больных меланомой кожи больных пациентов с использованием препарата «Траметиниба» («Trametinib») в качестве монотерапии у больных пациентов, которые не получили результатов от предшествующего лечения мутировавшим ингибитором «БРАФ» («BRAF»). Впоследствии, препарат «Траметиниб» («Trametinib») был одобрен в «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) для использования в лечении меланомы кожи в сочетании с использованием препарата «Дабрафениб» («Dabrafenib»), в качестве исходного препарата при таргетной терапии для больных пациентов, у которых меланома кожи содержит мутации ингибиторов «БРАФ-В 600 Е» («BRAFV600E») или «БРАФ-В 600 К» («BRAFV600K» [15]. В «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) это было одобрено на основании продления общей выживаемости больных меланомой кожи пациентов, в лечении которых использовался препарат «Траметиниб» («Trametinib»), в качестве одного из «агентов» в организме больного пациента, который не получал предварительную терапию с использованием «БРАФ»-(«BRAF»)-ингибиторов. Это утверждение было основано на демонстрации улучшения состояния больных людей по продолжительности выживаемости (без прогрессирования статистики) от пяти-шести месяцев до девяти месяцев (связанные с более высоким показателем реагирования) [79]. Тем не менее, улучшение симптомов, связанных с заболеванием или общим уровнем выживаемости больных меланомой пациентов по сравнению с уровнем выживаемости больных пациентов, которые прошли только терапию препаратом «Дабрафениб» («Dabrafenib») или же «Вермурафениб» («Vemurafenib»), еще не было продемонстрировано для комбинации препаратов «Дабрафениб» («Dabrafenib») и «Траметиниб» («Trametinib») [79].
Эффективность препарата «Траметиниб» («Trametinib»), как одного из «агентов», было продемонстрировано в третьей фазе метрики на примере 322 больных пациентов с прогрессирующей меланомой кожи [15]. Все больные пациенты имели, либо «БРАФ-В 600 Е» («BRAFV600E»), либо мутации в их «БРАФ-В 600 К» («BRAFV600K») меланомах (87 процентов и 13 процентов, соответственно). Треть больных пациентов получали химиотерапию и еще 30 процентов больных пациентов ранее уже проходили иммунотерапию, но предварительная терапия ингибиторами «БРАФ» («BRAF») не допускается. Кроссовер в препарате «Траметиниб» («Trametinib») было разрешено заменить для больных пациентов, у которых болезнь прогрессировала, на химиотерапию. По результатам проведенного исследования, выживаемость больных пациентов была значительно увеличена при лечении препаратом «Траметиниб» («Trametinib») по сравнению с лечением химиотерапией (медиана — 4,8 против 1,5 месяца; «HR»=0,47; 95 процентов «CI», 0.34-0.65). Общая выживаемость пациентов, больных меланомой, была существенно лучше при лечении препаратом «Траметиниб» («Trametinib») (выживаемость — шесть месяцев, 81 процент против 67 процента; «HR» = 0,54; 95 процентов «CI», 0.32-0.92), хотя 47 процентов больных пациентов с прогрессированием меланомы на химиотерапии получил средний показатель эффективности применения препарата «Траметиниб» («Trametinib»). Улучшения в «ВБП» («PFS») и общая выживаемость больных меланомой пациентов были представлены во всех группах исследуемых, в том числе, в подгруппе больных пациентов, у которых уже начались метастазы в головном мозге или в других внутренних органах [15].
Чтобы отсрочить развитие резистентности к лечению и свести к минимуму токсичность, связанную с ингибированием «БРАФ» («BRAF»), было проведено исследование, в котором лечение препаратом «Траметиниб» («Trametinib») было объединено с лечением препаратом «Дабрафениб» («Dabrafenib») [15]. А первый /или второй этапы исследования показали значительно-продолжительную выживаемость без прогрессирования заболевания, по сравнению с только применением препарата «Дабрафениб» («Dabrafenib») — (медиана 9,4 против 5,8 месяцев; «HR» = 0,39; 95 процентов, «CI» 0,25-0,62). И значительно увеличилось количество больных пациентов, которые остались живы – они смогли прожить еще один год (41 процент против 9 процентов). Дерматологическая токсичность, проявленный плоскоклеточный рак (включая кератоакантому кожи), — все это уменьшилось на обоих уровнях комбинированной дозы (5 процентов против 19 процентов), хотя заболеваемость пирексией и лихорадкой только возросла (71 процент против 26 процентов) [15].
Препарат «Ипилимумаб» («Ipilimumab») является моноклональным антителом, которое специфическим образом блокирует тормозящий и ингибирующий сигнал цитотоксических Т-лимфоцитов антигена-4 («CTLA-4»), что приводит к активации Т-клеток, к распространению и инфильтрацию лимфоцитов в опухоли. Следовательно, все это способствует гибели клеток меланомы [5]. Препарат «Ипилимумаб» («Ipilimumab») был одобрен в марте 2011 года в «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) для лечения больных пациентов, у которых развились неоперабельные метастазы при метастатической меланоме.
На двух крупных стадиях третьего исследования мы смогли установить, что использование препарата «Ипилимумаб» («Ipilimumab») способствовало существенному увеличению выживаемости у больных пациентов с прогрессирующими меланомами. В плацебо- контролируемых фазах третьего исследования мы смогли установить, что 676 больных пациентов были рандомизированы в соотношении 3:1:1. Они получали:
— препарат «Ипилимумаб» («Ipilimumab»), плюс, еще вакцину гликопротеина 100 (gp100);
— только препарат «Ипилимумаб» («Ipilimumab»);
— только вакцину гликопротеина 100 (gp100) [5].
Все пациенты были «HLA — A * 0201» позитивными и имели неоперабельные, метастатические меланомы кожи человека. Все больные пациенты предварительно прошли системное лечение заболеваний, посредством цитотоксической химиотерапии или применения «Интерлейкин-2» («ИЛ-2» — «IL-2»). Результаты этого исследования показали, что общая выживаемость значительно увеличилась у пациентов, учитывая препарат «Ипилимумаб» («Ipilimumab»), плюс, еще вакцину гликопротеина 100 (gp100). Медиана равна 10,0 месяцам по сравнению с 6,4 месяцам, «HR» для смерти 0,68. Значение сравнений препарата «Ипилимумаб» («Ipilimumab») против вакцины гликопротеина 100 (gp100) равняется 10.1 месяцам, по сравнению с 6,4 месяцам, «HR» — 0,66). Общая выживаемость при использовании препарата «Ипилимумаб» («Ipilimumab»), плюс, еще вакцина гликопротеина 100 (gp100), использование только препарата «Ипилимумаб» («Ipilimumab») и использование только вакцины гликопротеина 100 (gp100) равнялось: 44 процентам, 46 процентам и 25 процентам на 12 месяцев и 22 процентам, 24 процентам и 14 процентам на 24 месяцев, соответственно. Частота объективного ответа была значительно улучшена в обеих группах больных пациентов, получавших препарат «Ипилимумаб» («Ipilimumab» по сравнению с группой больных пациентов, проходивших лечение только посредством введения вакцины гликопротеина 100 (gp100) – а это: 5,7 процентов и 10,9 процентов по сравнению с 1,5 процентами, соответственно). Ответные реакции организма на введение препарата «Ипилимумаб» («Ipilimumab») как монотерапии, либо же в сочетании с вакциной гликопротеина 100 (gp100), продолжали улучшаться: этот показатель составил более, чем 24 недели после начала терапии.
На второй стадии третьего исследования 502 больных пациента с метастатической меланомой были рандомизированы на препараты «Ипилимумаб» («Ipilimumab») и «DTIC»-терапией или на плацебо с терапией «DTIC» [6]. Примерно одна четверная часть больных пациентов — ранее уже проходила адъювантную терапию, но это лечение не было связано с лечением метастатической болезни. Наше исследование показало, что общая выживаемость была значительно увеличена у пациентов, которым врачи назначали препарат «Ипилимумаб» («Ipilimumab») и «DTIC»-терапию или же переводили на плацебо с терапией«DTIC» (средний показатель — 11,2 месяца против 9,1 месяцев). Выживаемость в этом случае достигала одного, двух и трех лет, то есть, этому способствовало применение препарата «Ипилимумаб» («Ipilimumab»). Это 47 процентов против 36 процентов, 29 процентов против 18 процентов и 21 процент против 12 процентов, соответственно). Общая частота третьего и четвертого класса токсичности была значительно выше при лечении препаратом «Ипилимумаб» («Ipilimumab») вместе с «DTIC»-терапией по сравнению с монолечением только терапией «DTIC» (56 процентов против 28 процентов). В целом, третий и четвертый класс иммунно-опосредованных побочных реакций был значительно выше в комбинации с препаратом «Ипилимумаб» («Ipilimumab») (38 процентов против 4 процентов). Печеночная токсичность была значительна больше общей токсичности в комбинации с препаратом «Ипилимумаб» («Ipilimumab») , чем только с терапией «DTIC» (общий показатель повышения трансаминаза составил 29-33 процента против 6 процентов). Кроме того, распространенность печеночной токсичности была значительно выше по сравнению с наблюдаемой нами на второй стадии третьего испытания, когда препарат «Ипилимумаб» («Ipilimumab») давали больным пациентам без назначения терапии-«DTIC». Такой же показатель был отмечен и во время второго испытания, когда препарат «Ипилимумаб» («Ipilimumab») вводился больным пациентам строго по расписанию и в конкретно установленных дозах. Увеличение гепатотоксичности может быть связано с «побочной» комбинацией препарата «Ипилимумаба» («Ipilimumab») с «DTIC»-терапией, который также известен в фармакологии, как гепатотоксическое средство.
Распространенность других иммунных заболеваний, связанных с токсичностью (колитов, сыпи и гипофизита) была намного меньшей, чем мы наблюдали в предыдущих исследованиях при реакциях организма на проводимую монотерапию только препаратом «Ипилимумаб» («Ipilimumab»), предполагая, что «DTIC»-терапия, возможно,
оказывает «притупляющее» действие на токсичности, и /или заболеваемость больных пациентох гепатотоксичностью может иметь упреждающий характер. Возможно, это также приводит и к изменению профиля иммунной токсичности [6].
Другие данные свидетельствуют о потенциально синергической пользе комбинированного лечения препаратами «Ипилимумабом» («Ipilimumab») и «Вермурафенибом» («Vemurafenib») [80] . Было замечено, что неспецифические ингибиторы «МАРК»-путей траектории («pathway»), такие, как ингибиторы «МЕК», могут снижать функцию Т-клеток. Было отмечено, что лечение препаратом «Вермурафенибом» («Vemurafenib») способствовало увеличению дифференциации меланомы, экспрессии и выражения антигена и улучшению антиген-специфического Т-клеточного распознавания [80]. Потому, для этих целей показано назначать препарат «Вермурафениб» («Vemurafenib»).
Как уже упоминалось выше, ряд других молекулярных «целей» был идентифицирован у больных пациентов с меланомой. Он включают в себя: С-комплект белка («C-KIT»), «БРАФ» («BRAF»), «MEK», «ХПО» («НРО»), «PI3K», «AKT», «МТОР» («MTOR») и «ГНАС» («GNAC»). Несколько фармакологические ингибиторы, направленные на мутирование молекулы передачи сигналов, сегодня изучаются в клинических испытаниях.
Тем не менее, несмотря на успешное использование ингибиторов «БРАФ» («BRAF») во время начальной стадии лечения пациентов, больных меланомой, также наблюдается высокая токсичность этих препаратов и оказываемое организмом сопротивление, правда, минуя этап мутации в «RAS» («РАН»)/или «RAF» («РФС»)/или «Мек» /или «ERK» путей траектории («pathway»). Кроме того, препарат «Ипилимумаб» («Ipilimumab») оказывает очень мощное действие, но является также неспецифическим иммуностимулирующим препаратом, который редко вызывает опухолевые регрессии. Хотя, после лечения препаратом «Ипилимумабом» («Ipilimumab») заболевание стабилизировалось в течение трех и более лет в подгруппе у 10 процентов больных пациентов, но эта подгруппа может не иметь предположительно идентифицированных био-маркеров или же других тестеров, поэтому, большинство прошедших такую терапию больных ее сейчас не получают.
Проанализировав эти два факта и сравнив полученный результат, можно подытожить следующее. Если ориентироваться в лечении меланомы только на один вариант терапии, то, чаще всего, этого оказывается недостаточно для лечения пациентов только монотерапией – это, скорее всего, исключение из правил. Она подойдет далеко не во всех клинических случаях заболеваемости меланомы. Чтобы в каждом индивидуальном случае было большее количество успешных выздоровлений от меланомы больных пациентов, необходимо разработать разные варианты и стратегии лечения меланомы. Именно тогда будет возможным успешное персонализированное лечение пациентов с меланомой. Конечно же, потенциальной целью лечения является «Нотч» («Notch»), сигнальные пути траектории («pathway»). Очень важна их роль в меланомагенезисе («melanomagenesis») «Нотч» («Notch») сигнальные пути траектории («pathway») и их связи с другими аберрантными путями траектории в меланоме.
- Нацеливание «Нотч» («Notch») сигнальных путей траектории («pathway») в меланоме.
Вырезка сигнализации представляет собой сложный возможный способ урегулировать различные аспекты биологии меланомы кожи человека и многих других виды рака. Вырезки сигнализации в клетках меланомы взаимодействуют с дополнительными путями, которые принимают участие в онкогенезе («tumorigenesis»), включая «MAPK», «PI3K»-«АКТ», «NF»-«kB» и «p53»-белок [81]. Поэтому, мы можем предположить, что нацеливание нескольких вышеперечисленных может стать лучшим подходом в отношении прогрессирования заболеваемости меланомой.
Таким образом, учитывая ключевую роль вырезки сигнализации в росте меланомы и в ее прогрессировании, кацеливание «Нотч» («Notch») сигнальных путей траектории («pathway») представляет собой ценный подход в терапии и в лечении меланомы кожи человека. По последним данным [48], убиквитин-лигаза (Е3) может быть потенциальным спосбом терапии для лечения рака и возможным прогностическим био-маркеров. «MDM2» известен также, как основной регулятор «p53»-белка-супрессора опухоли. «р53»-белок и «MDM2» взаимодействуют между собой, при этом, образуется автоматическое регулирование цикла, в котором увеличение показателя «р53»-белка транскрипционно активирующего «MDM2». Последний, в свою очередь, уже понижает уровень «р53»-белка [20]. «р53»-онкобелок избыточно экспрессируется во многих человеческих опухолях, которые сохраняют «р53»-белок «дикого» типа, включая меланому кожи человека[19]. Наиболее распространенные подходы, используемые для целевой проверки, были направлены на «срыв» любого рода взаимодействия между «MDM2» и «p53»-белком. Согласно данным проведенного исследования, «nutlins» являются сильнодействующими и селективными ингибиторами взаимодействия между «p53»-белком и «MDM2» и эффективными противоопухолевыми препаратами, как «в пробирке», так и в естественных условиях («vitro» и «in vivo») [82] .
Несмотря на то, «р53»-белок часто структурно сохраняется, он остается функционально парализованным, по «CDKN2A» /или «АРФ» происходит потеря в меланоме. «MDM2» может стать привлекательной «целью» для «р53-белка» и «выемки» — «Нотч» («Notch») сигнальных путей траектории («pathway») в злокачественной меланоме, посредством восстановления функции «р53»-белка «дикого» типа. «MDM2» сверхэкспрессируется в злокачественных меланомах [18]. В недавних нашихисследованиях было продемонстрировано то, что существует очевидная взаимосвязь между выражением «MDM2» и толщиной опухоли, и «инвазией» в первичную меланому [83].
«MDM2» играет определенную роль в передаче сигналов «Нотч» («Notch»): сначала происходит положительная регуляция убиквитинирования «НУМБ» («Numb»), которая приводит к деградации «НУМБ» («NUMB»), таким образом, косвенно увеличиваня передачу сигналов «Нотч» («Notch»). Потом происходит процесс против «выемки» «Нотч1» («Notch 1»), что, в свою очередь, приводит к одновременной стабилизации и активации «НИСД» («NICD»). Таким образом, вполне возможно, что белковый «p53»-«MDM2»-«НУМБ»-(«NUMB»)-комплексы координируют регулирование «p53»-белка и «выемку» «Нотч» («Notch») путей траектории («pathway») [49], [50] и [84].
Еще одним негативным регулятором «р53»-белка является «MDM4».
«MDM4» образует гетерокомплекс с «MDM2», что, в свою очередь, усиливает убиквитинирование и деградацию «р53»-белка. В отличие от «MDM2», «MDM4» не является объектом транскрипционного анализа «p53»-белка. Усиление «MDM4» наблюдается во многих клинических случаях опухоли, включая меланому, и, что интересно, усиление «MDM4», по-видимому, коррелирует с обеими «p53»-белковыми статусами «WT» и отсутствием амплификации «MDM2». «MDM4» активируется в значительной части (примерно в 65 процентах) на первой-четвертой стадии меланомы кожи человека [19]. Недавно были разработаны скобки «SAH» («САК») – «p53»-пептидов, которые ингибируют «MDM4». Ингибирование «р53» – «MDM4» взаимодействия восстанавливает функции «р53»-белка в клетках меланомы кожи человека, что, в свою очередь, приводит к увеличению чувствительности больного к химиотерапии и ингибиторам онкогена «БРАФВ600Е» («BRAFV600E»). «MDM4» является ключевым фактором, определяющим нарушение функции «р53»-белка в человеческой меланоме. Вот почему назначение «MDM4» является перспективным решением в комбинированной терапии, направленный на лечение меланомы кожи человека [19 ] .
Таким образом, «MDM2» и «MDM4» могут быть «привлекательными целями» для «р53»-белка и «выемки» «Нотч» («Notch») путей траектории («pathway») в злокачественной меланоме, посредством восстановления взаимодействий, в том числе, «р53»-белка – «MDM2» («nutlins»), «MDM2» – «НУМБ» («Numb») (вопрос «сшивания» пептидов находится сейчас в стадии разработки ), «р53»-белка – «MDM4» (скобки «САК» («SAH») – «р53»-белка) в соответствии с неоднородностью опухолей меланомы и указанными молекулярными аберрациямий. Кроме того, разграничения точных взаимодействий между «выемкой» «Нотч» («Notch») и другими сигнальными каскадами в каждой из опухоли может значительно улучшить ответные реакции на «GSI»-терапию или лечение меланомы ингибиторами «BRAF» («БРАФ»).
- Заключение и результаты.
Знание различных молекулярных изменений в сигнальных путях меланомы представляет потенциальные задания для разработки новых лекартсвенных препаратов для персонализированной терапии пациентов, больных меланомой кожи человека. В последние годы «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) одобрило ряд новых лекарственных препаратов для пациентов с нерезектабельной, метастатической меланомой кожи.
В данной статье были кратко представлены основные сведения о молекулярных механизмах сигнальных путей меланомы (включая, «Нотч» («Notch») пути траектории («pathway»)) и одобрено медикаментозное лечение меланомы в молекулярных целях.
Мы полагаем, что перспективные стратегии для персонального лечения пациентов, больных меланомой, можно связать с нацеливанием на «Нотч» («Notch») сигнальных путей траектории («pathway»).
- Конфликт интересов.
Авторы отмечают отсутствие какого-либо конфликта интересов.
Экспертная оценка данной научной статьи была проведена под руководством Литовского университета наук о здоровье.
[1] Комментарий переводчика: «FDA» («Food and Drug Administration» — Управление по контролю качества пищевых продуктов и лекарственных средств) — это агентство Министерства здравоохранения и социальных служб США, один из федеральных исполнительных департаментов. Дата создания организации – 1906 год. «FDA» занимается сертификацией товаров и технологий, имеющих отношение к здоровью человека. «FDA» отвечает за сохранение здоровья населения путем регулирования и надзора в области безопасности пищевых продуктов, табачных изделий, пищевых добавок, лекарств (как рецептурных, так и безрецептурных), вакцин, медицинских устройств и ветеринарных препаратов. Также «FDA» контролирует исполнение некоторых законов, например, раздела №361 «Public Health Service Act» Закона об общественном здравоохранении и связанных с ними подзаконных актов. В задачи агентства входит контроль за соблюдением законодательных норм в области поддержания качества продуктов питания, лекарственных препаратов и косметических средств. «FDA» — это одна из самых влиятельных организаций в мире и самая жесткая медицинская сертификационная система в мире, которая пользуется самыми строгими критериями, максимально защищая здоровье человека. Сертификаты «FDA» — это знак качества любого товара и технологии. «FDA» — это единственная организация в мире, проводящая свой клинический контроль независимо от производителя.







Комментировать