В настоящее время молекулярное моделирование стало важнейшим методом при дизайне новых лекарственных веществ на начальном этапе их разработки. Эта бурно развивающаяся область компьютерной химии пришла на помощь фармакологам, физиологам, биохимикам и другим специалистам занимающимся разработкой и изучением механизма действия новых лекарств.

В данной статье кратко рассказывается о работе проведенной нашей исследовательской группой по поиску потенциальных противотуберкулезных препаратов методами молекулярного моделирования и виртуального скрининга.
В качестве объектов для исследования нами были выбраны системы с 1,3,4-оксадиазольным кольцом среди которых известны вещества с противотуберкулезной активностью[1-5].
В своих исследованиях мы опирались на работу B. Mathew и его коллег[6], которые показали что соединения (1)
(Рис. 1а) ингибируют фермент еноил-ACP редуктазу (InhA) Mycobacterium tuberculosis и тем самым проявляют противотуберкулезную активность.
В качестве потенциальных ингибиторов этого фермента нами были предложены амидины (2) (Рис. 1б)[7,8].
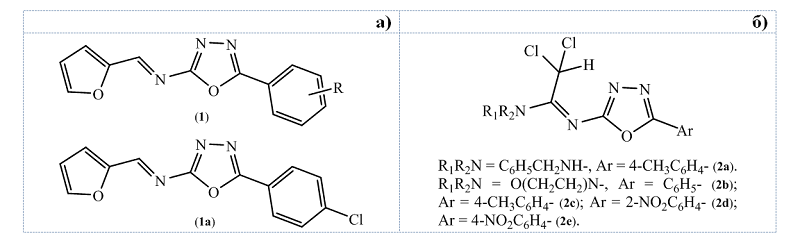
Рис. 1: Структуры соединений (1) и (2)
Перед молекулярным докингом мы провели оптимизацию геометрии (полуэмпирический метод PM3) изучаемых структур (Рис. 2) и их сопоставление (Рис. 3).
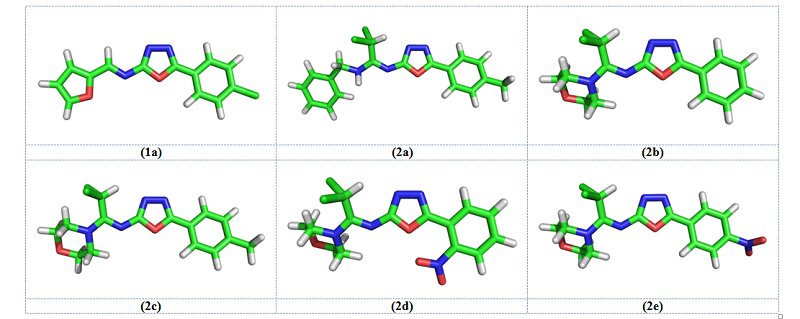
Рис. 2: Молекулярные структуры соединений (1а) и (2а-е).
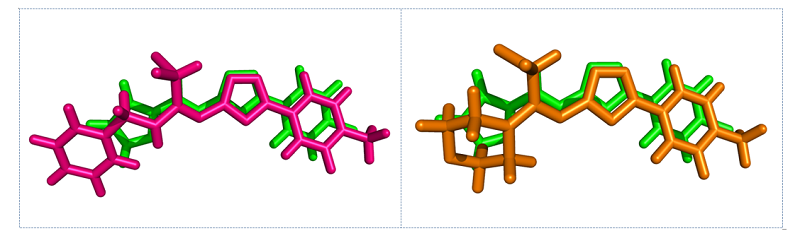
Рис. 3: Сопоставление пространственных структур соединения (1а) (зеленый), соединения (2а) (розовый) и (3с) (оранжевый).
Расчетная энергия связывания ингибитора (1a) с активным центром фермента составляет -9.08205 ккал/моль, время расчета составило 3 с. Полученные результаты очень близки с результатами работы[6], согласно которой энергия комплекса InhA-(1a) составляет -9.7426 ккал/моль. Молекула соединения (1a) дополнительно фиксируется в активном центре InhA фермента за счет сложной системы межмолекулярных водородных связей с участием молекул кристаллической воды – H2O 818, H2O 737 и H2O 743 (Рис. 4).
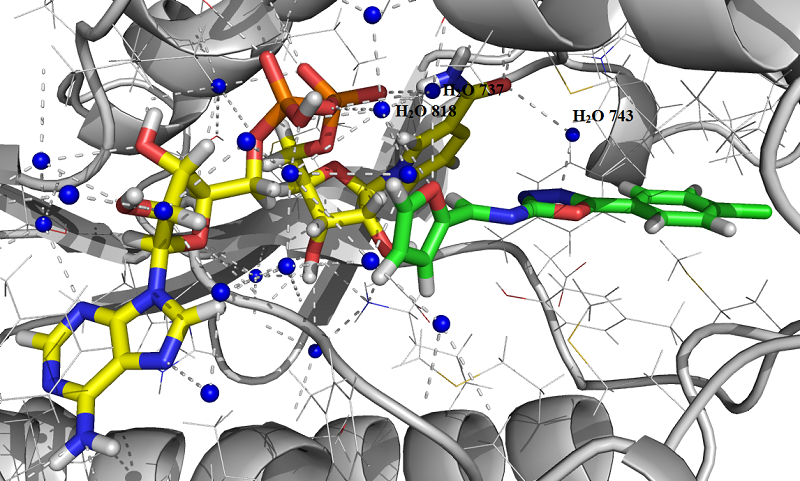
Рис. 4: Положение молекулы (1a) в активном центре InhA фермента согласно данным молекулярного докинга, энергия комплекса -9.08205 ккал/моль.
Согласно результатам молекулярного докинга наиболее стабильный комплекс с InhA ферментом образует соединение (2a), которое по этому показателю превосходит (1a). Энергия комплексов со структурами (2b) и (2c) несколько выше. Эти соединения немного превосходят ингибитор (1a) по прочности образующегося комплекса с ферментом (Табл. 3). Соединения (2d) и (2e) уступают эталону.
Таблица 3: Результаты молекулярного докинга N-5-арил-1,3,4-оксодиазоло-2,2-дихлорацетамидинов.
 Соединения (2a) эффективно связывается с ферментом InhA за счет образования двух межмолекулярных водородных связей (Рис. 5). В образовании одной водородной связи принимает участие атом Водорода молекулы кристаллической воды (H2O 743) и атом Азота N(3) 1,3,4-оксадиазольного кольца, длина связи H…N – 2.873637 Å. Вторую водородную связь образует атом Водорода амидинового фрагмента (BnNH) и атом Кислорода пептидной связи Pro156–Ala157, длина связи NH…O156=С′156 (Pro 156) – 2.834225 Å.
Соединения (2a) эффективно связывается с ферментом InhA за счет образования двух межмолекулярных водородных связей (Рис. 5). В образовании одной водородной связи принимает участие атом Водорода молекулы кристаллической воды (H2O 743) и атом Азота N(3) 1,3,4-оксадиазольного кольца, длина связи H…N – 2.873637 Å. Вторую водородную связь образует атом Водорода амидинового фрагмента (BnNH) и атом Кислорода пептидной связи Pro156–Ala157, длина связи NH…O156=С′156 (Pro 156) – 2.834225 Å.
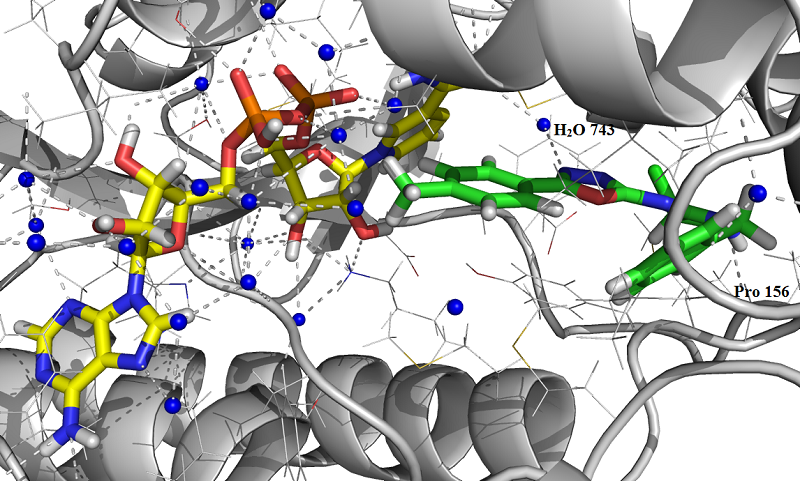
Рис. 5: Положение молекулы (2a) в активном центре InhA фермента согласно результатам молекулярного докинга.
Соединение (2b) при связывании с активным центром фермента образует сложную систему межмолекулярных водородных связей с участием трех молекул кристаллической воды и атома Кислорода морфолинового цикла (Рис. 6).
Водородные связи образуют:
- 1) атом Водорода молекулы воды (H2O 819) и атом Кислорода морфолинового цикла, длина связи H…O – 3.400024 Å;
- 2) атом Водорода молекулы воды (H2O 818) и атом Кислорода морфолинового цикла, длина связи H…O – 2.364742 Å;
- 3) атом Водорода молекулы воды (H2O 737) и атом Кислорода морфолинового цикла, длина связи H…O – 2.521765 Å.
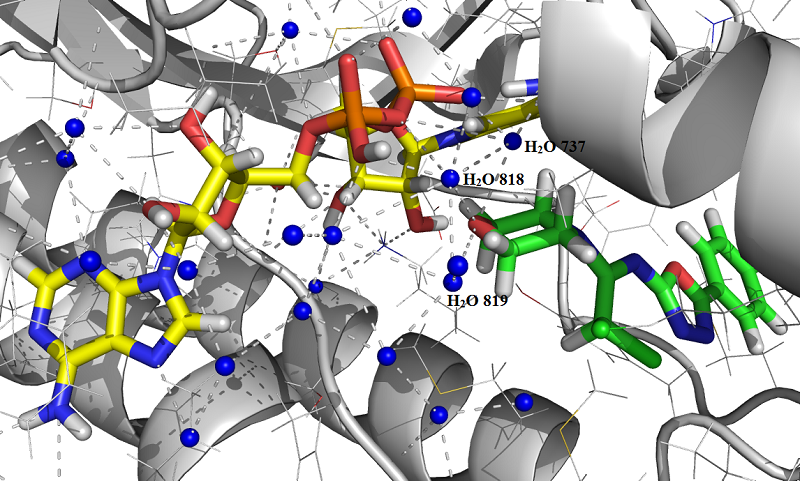
Рис. 6: Положение соединения (2b) в активном центре InhA фермента согласно результатам молекулярного докинга.
Соединение (2с) при связывании с активным центром фермента образует одну водородную связь с участием атом Водорода молекулы кристаллической воды (H2O 743) и атома Азота N(2) 1,3,4-оксадиазинового цикла, длина связи H…N 2.896771 Å (Рис. 7).
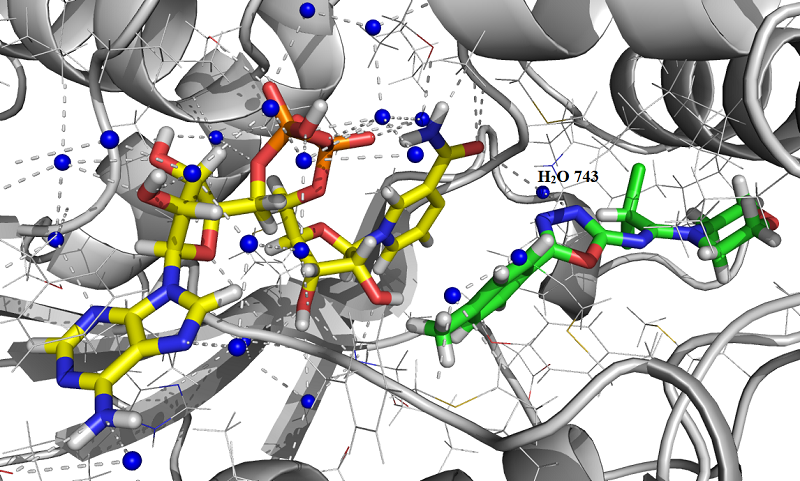
Рис. 7: Положение молекулы (2с) в активном центре InhA фермента согласно результатам молекулярного докинга.
Павел В. Задорожний
Кандидат химических наук,
доцент кафедры технологии органических веществ и фармацевтических препаратов.
ГВУЗ: «Украинский государственный химико-технологический университет»
Детально с работой можно ознакомиться:
Pavlo V. Zadorozhnii, Vadym V. Kiselev, Anastasia E. Titova, Aleksandr V. Kharchenko, Ihor O. Pokotylo, Oxana V. Okhtina Molecular Docking Studies of N-5-Aryl-1,3,4-oxadiazolo-2,2-dichloroacetamidines as Inhibitors of Enoyl-ACP Reductase Mycobacterium tuberculosis. Res. J. Pharm. Technol. 2017. – 10(4): 1091-1097. DOI: 10.5958/0974-360X.2017.00198.6
Литература:
- Joshi ShD, More UA, Kulkarni MSh, Nelaguddad K, Kulkarni VH. Combined Pharmacophore and Molecular Docking-based In silico Study of Some Pyrrolyl 1,3,4-oxadiazole benzothioate Derivatives. RGUHS J. Pharm. Sci. 2015; 5(2): 69-80. doi:10.5530/rjps.2015.2.6
- Asif M. A review on potent antitubercular agent isoniazid and its analogues. Int. J. Pharm. Chem. 2012; 2(4): 110-120. doi:10.7439/ijpc.v2i4.755
- Pattan ShR, Rabara PA, Pattan JS, Bukitagar AA, Wakale VS, Musmade DS. Synthesis and evaluation of some novel substituted 1,3,4-oxadiazole and pyrazole derivatives or antitubercular activity. Indian J. Chem. Sec. B. 2009; 48(10): 1453-1456.
- Das R, Asthana GSh, Suri KA, Mehta DK, Asthana A. Synthesis and Assessment of Antitubercular and Antimicrobial Activity of Some Novel Triazolo and Tetrazolo-Fused 1,3,4-Oxadiazole Molecules Containing Pyrazine Moiety. J. Pharm. Sci. Res. 2015; 7(10): 806-811.
- Kerur Sh, Alagavadi K, Zhu H, Manvi F. Synthesis, characterization and molecular docking simulation of disubstituted 1,3,4-oxadiazole derivatives for antibacterial studies. World J. Pharm. Pharm. Sci. 2014; 3(10): 573-585.
- Mathew B, Suresh J, Mathew GE, Sonia G, Krishnan GK. Design, Synthesis, Toxicity Estimation and Molecular Docking Studies of N-(furan-2-yl)-1-(5-substituted)phenyl-1,3,4-oxadiazol-2-yl)methanimine as Antitubercular Agents. Indian J. Pharm. Sci. 2014; 76(5): 401-406.
- Zadorozhnii PV, Kiselev VV, Kharchenko AV. N-Hetaryl-2,2-dichloroacet-amidines. Visn. Dnipropetr. Univ. Khim. 2014; 22(2): 31-38. doi:10.15421/081412
- Zadorozhnii PV, Pokotylo IO, Kiselev VV, Kharchenko AV. New 2,2-Dichloroacetamidines with Heterocyclic Fragments. Chem. Sci. Trans. 2016; 5(4): 1056-1062. doi:10.7598/cst2016.1310














Комментировать