Нестероидные противовоспалительные препараты. Фиксированная комбинация напроксена и эзомепразола. Тенденции.
Д.м.н. А.Е. Каратеев, ФГБНУ «НИИ ревматологии им. В.А. Насоновой» РАН, Москва
Нестероидные противовоспалительные препараты (НПВП) — надежный, но несовершенный инструмент противоболевой терапии [1-3]. НПВП появились на фармакологическом рынке в конце XIX в.: первым представителем этой группы следует считать феназон, «дебют» которого состоялся в 1884 г, за 14 лет до начала продаж ацетилсалициловой кислоты (АСК) [4, 5]. С тех пор НПВП уверенно держат лидирующую позицию среди анальгетиков, и нет такой области медицины, в которой необходимость контроля боли не предполагала бы использование этих препаратов. Однако, несмотря на длительную эволюцию, НПВП так и не избавились от своего важнейшего недостатка, который обнаружился в первые же годы их клинического применения, — негативного влияния на желудочно-кишечный тракт (ЖКТ) [1, 4-6]. И сегодня, как и 100 лет назад, назначающий НПВП доктор всегда балансирует между их эффективностью и риском развития серьезных осложнений. Причем, к сожалению, проблемы безопасности НПВП не ограничиваются только патологией ЖКТ; не меньшее значение имеют неблагоприятные реакции (НР) со стороны сердечно-сосудистой системы (ССС) и почек [1, 7].
Разумеется, все годы использования НПВП фармакологи предпринимали попытки улучшить эти препараты, снизив частоту побочных эффектов без ущерба для их обезболивающего и противовоспалительного потенциала: создать, образно говоря, «безопасный аспирин». Это стремление привело к нынешнему разнообразию НПВП. Так, за относительно короткий промежуток — с конца 1960-х до начала 1970-х гг в клиническую практику вошли индометацин, ибупрофен, кетопрофен, напроксен, пироксикам и ряд других, менее известных российским врачам препаратов; наконец, появился «золотой стандарт» этого класса — диклофенак. К середине 1990-х гг. в арсенале врачей находилось уже более 20 различных НПВП. Однако ни один них не удовлетворял в полной мере ожидания практикующих врачей, и если по удобству применения новые представители этой лекарственной группы однозначно превосходили АСК, то их преимущества в плане безопасности оказались очень сомнительными. Достаточно сказать, что проблема осложнений со стороны ЖКТ, ассоциированных с использованием НПВП, приобрела свое глобальное значение именно в годы расцвета производства этих лекарств [8].
Ситуация изменилась после открытия изомеров циклооксигеназы (ЦОГ) и создания нового класса НПВП — селективных ингибиторов ЦОГ-2 (селективные НПВП) [8-10]. Вероятно, первым препаратом этого типа следует считать нимесулид, обладающий преимущественной селективностью в отношении ЦОГ-2 и появившийся на фармакологическом рынке еще в 1985 г. [11]. Тем не менее официально эру новых лекарств открыл мелоксикам, который был представлен своими создателями именно в качестве препарата, избирательно блокирующего ЦОГ-2 [5, 12]. Правда, как оказалось в дальнейшем, мелоксикам далек от совершенства: его селективность достаточно умеренна, и осложнения со стороны ЖКТ на фоне приема этого препарата могут возникать, хотя суммарно реже, чем при использовании традиционных НПВП [13, 14].
Следом за мелоксикамом на рынок вышли истинно селективные НПВП — коксибы (рофекоксиб, целекоксиб, вальдекоксиб, лумирококсиб и эторикоксиб); с их появлением, казалось, проблема безопасного применения НПВП близка к своему решению [9, 10]. К сожалению, этого не случилось: печальной памяти «кризис коксибов», разразившийся после выявления негативного действия новых препаратов на ССС [15, 16], а затем феномен эторикоксиба (который, как показали данные крупнейшего исследования MEDAL, не отличался по частоте развития ЖКТ-кровотечений от диклофенака) [17], заставили расстаться с мечтой о создании «безопасного аспирина».
Другой путь улучшения НПВП — сочетание этих препаратов со средством, способным снизить риск развития НР. Эта идея легла в основу создания целой серии препаратов, представляющих собой комбинацию НПВП и гастропротектора — препарата, снижающего вероятность повреждения слизистой оболочки (СО) верхних отделов ЖКТ. В конце 1980-х гг. в клиническую практику вошел мизопростол, представляющий собой синтетический аналог простагландина (ПГ) Е2. Мизопростол предотвращает негативное воздействие НПВП на слизистую (которое, как известно, определяется подавлением ЦОГ-1 опосредованного синтеза цитопротективных ПГ) и весьма эффективно снижает риск развития язв желудка и ЖКТ-кровотечения, связанный с приемом этих лекарств [18]. На его основе был создан комбинированный препарат, содержащий 50 мг диклофенака и 200 мкг мизопростола [19]. Клинические испытания подтвердили, что новое средство гораздо безопаснее, чем диклофенак; препарат получил широкое распространение и с середины 1990-х гг. начал использоваться и в нашей стране. К сожалению, мизопростол имеет ряд неприятных НР — прежде всего появление гастралгий и диареи. Эти побочные эффекты достались и комбинированному препарату, что существенно ограничило его популярность. Поэтому после внедрения в клиническую практику селективных НПВП и ингибиторов протонной помпы (ИПП) он потерял свое значение и в настоящее время практически не используется.
Сегодня основным средством для профилактики поражения верхних отделов ЖКТ при использовании НПВП стали ИПП [6, 7]. Они эффективны, удобны в использовании и хорошо переносятся. Использование ИПП позволило создать серию «защищенных» НПВП — как раздельную, так и фиксированную (в виде 1 таблетки) комбинацию этих препаратов. К ним относятся напроксен + лансопразол, диклофенак + омепразол + пантопразол, а также кетопрофен + омепразол [20-23].
После серии масштабных и весьма удачных клинических исследований [24, 25] на мировой фармакологический рынок (в т. ч. российский) вышла фиксированная комбинация напроксена и эзомепразола (табл. 1).
Кроме этого, в США зарегистрировано лекарство, содержащее 800 мг ибупрофена и Н2-блокатор фамотидин 26,5 мг. Идея использовать Н2-блокатор в качестве гастропротективного агента связана со стремлением избежать ряда побочных эффектов, свойственных ИПП, — прежде всего негативного взаимодействия с рядом антитромботических средств, таких как клопидогрел. Хотя гастропротективный эффект Н2-блокаторов слабее, чем у ИПП, этот недостаток должно компенсировать использование последнего в высокой дозе: так, при условии приема по 1 таблетке 3 р./сут суточная доза фамотидина будет составлять 80 мг [26].
Не вызывает сомнений, что сочетание с ИПП способно существенно повысить безопасность НПВП — это несомненное преимущество комбинированных препаратов. С другой стороны, они имеют и очевидные недостатки. Так, ИПП и Н2-блокаторы защищают лишь верхние отделы ЖКТ, но не предохраняют от повреждения нижележащие отделы; при этом хорошо известно, что НПВП могут вызывать осложнения со стороны тонкой кишки (так называемая НПВП-энтеропатия), клиническое значение которых очень существенно [27]. Кроме того, антисекреторные средства сами могут вызывать серьезные НР — например, продолжительное использование ИПП ассоциируется с повышением риска развития кишечных инфекций, в т. ч. псевдомембранозного колита (вызванного Clostridium difficile), прогрессированием остеопороза, негативным фармакологическим взаимодействием с рядом важных лекарств и др. [28].
Другой путь улучшения НПВП заключается в изменении их собственной химической структуры с формированием у новой молекулы определенных гастропротективных свойств. Эта идея была реализована при создании ликофелона. Этот оригинальный представитель группы НПВП обладает способностью блокировать не только ЦОГ-2, но и 5-липооксигеназу (ЛОГ) — фермент, отвечающий за синтез лейкотриенов, играющих важную роль в развитии воспаления и повреждения слизистой ЖКТ. Некоторые эксперты считают, что ликофелон обладает заметным преимуществом по переносимости в сравнении с традиционными НПВП — прежде всего в отношении ЖКТ [29]. Кроме того, блокада 5-ЛОГ способна влиять на развитие «цитокинового каскада», лежащего в основе прогрессирования ревматических заболеваний [30]. Так, в крупном 2-летнем (!) исследовании, в котором ликофелон сравнивался с напроксеном у 355 больных остеоартрозом (ОА), новый препарат демонстрировал отчетливое замедление разрушения суставного хряща, т. е. значимое хондропротективное действие [31]. К сожалению, этот интересный препарат пока не вышел за границы клинических испытаний, поэтому оценка его клинического потенциала остается делом будущего.
Другим направлением модификации структуры НПВП является создание молекул действующих веществ, содержащих NO-группу, — так называемые ингибирующие ЦОГ донаторы окиси азота (NO) (CINOD-cyclooxygenase-inhibiting nitric oxide donator) [10, 32, 33].
NO относится к числу наиболее важных передатчиков биологических сигналов, который принимает участие в регуляции многих физиологических процессов. С его действием связывают замедление агрегации тромбоцитов и миграции нейтрофилов через сосудистую стенку, расслабление гладкомышечных клеток интимы сосудов, неоангиогенез, неонейрогенез и др. В области воспаления и повреждения NO (как и ПГ) способен выступать в негативной роли медиатора боли, вызывающего сенситизацию и прямую стимуляцию периферических болевых рецепторов. Синтез этой маленькой молекулы происходит при помощи фермента NO-синтетазы (NOS), которая отщепляет NO от аминокислоты L-аргинина с образованием L-цитруллина. Определены несколько изоформ NOS, одни из которых являются конститутивными (эндотелиальная — e-NOS и нейрональная — n-NOS); при этом синтез NO в области патологического процесса связывается с «работой» i-NOS — индуцируемой формой данного фермента [32, 33].
Для СО желудка NO является важным фактором: усиливает кровоток, репарацию эпителиоцитов, препятствует развитию воспаления (во многом благодаря подавлению хемотаксиса нейтрофилов) и блокирует свободнорадикальные процессы. Любопытно отметить, что основное количество этого вещества образуется при участии «провоспалительной» i-NOS, экспрессируемой в ответ на повреждение эпителиальных клеток такими факторами агрессии, как Helicobacter pylori, НПВП и соляная кислота [32, 33].
Таким образом, экзогенное повышение концентрации NO в СО может быть эффективным методом гастропротекции. Этот факт подтверждают данные, полученные в ходе одного масштабного популяционного исследования. Испанские исследователи A. Lanas et al. провели анализ влияния НПВП и различных гастропротективных препаратов на риск развития ЖКТ-кровотечений; исследуемой группой стали 2777 больных, у которых возникло данное осложнение, а 5532 лиц, не имевших подобных проблем, составили соответствующий контроль. Прием НПВП сам по себе резко повышал опасность кровотечения — отношение шансов (ОШ) составило 5,6. В то же время сопутствующий прием ИПП и Н2-блокаторов снижал данный риск: ОШ 0,33 и 0,65 соответственно. Такое же уменьшение риска осложнений со стороны ЖКТ отмечалось, если больные регулярно использовали нитропрепараты для лечения заболеваний ССС — ОШ составило 0,48 [34].
Развитием идеи CINOD как нового класса «защищенных» НПВП стал напроксинод, представлявший собой модифицированный напроксен с донатором NO-группы. Его создатели надеялись добиться существенного повышения безопасности препарата, причем в отношении не только ЖКТ, но и ССС. К сожалению, эти надежды в полной мере не оправдались. В 2005 г были представлены результаты 6-месячного рандомизированного контролируемого исследования (РКИ), в котором проводилось сравнение напроксинода 1500 мг/сут и обычного напроксена 1000 мг/сут у 970 больных ОА. Число язв верхних отделов ЖКТ, возникших на фоне приема напроксинода, было несколько меньшим, чем в контрольной группе, — 9,7 и 13,7%, однако различие это оказалось статистически незначимым [35]. Поскольку результаты клинических испытаний не подтвердили явного преимущества напроксинода, эта перспективная разработка так и не вошла в широкую клиническую практику [36].
К счастью, создание классических CINOD — не единственный подход к использованию гастропротективных свойств NO для снижения риска осложнений НПВП. Новым представителем «защищенных» НПВП, защитные свойства которого (помимо ряда других фармакологических свойств, указанных ниже) связаны со способностью индуцировать образование NO в слизистой ЖКТ, стал амтолметил гуацил (АМГ). Этот препарат представляет собой модификацию молекулы хорошо известного на Западе «традиционного» НПВП толметина. Толметин используется в клинической практике более 40 лет, это надежный анальгетик с выраженными противовоспалительными свойствами, доказавший хороший терапевтический потенциал и при купировании острой боли, и при лечении хронических ревматических заболеваний. Весьма показательно, что в США толметин зарегистрирован для использования в педиатрической практике у детей с 2-летнего возраста [37, 38].
Модификация толметина проводилась путем введения в его состав аминокислоты ванилина, что позволило существенно изменить его фармакологические свойства. АМГ в отличие от своего предшественника приобрел отчетливые гастропротективные свойства. Это в первую очередь определяется подавлением активности ингибиторов i-NOS, что обеспечивает значительное повышение концентрации NO в СО ЖКТ [39, 40]. Это подтверждает, в частности, работа G. Coruzzi et al., которые показали многократное нарастание активности i-NOS в СО лабораторных животных на фоне введения АМГ; ни плацебо, ни толметин такого эффекта не давали [39].
АМГ также стимулирует рецепторы капсаицина, усиливает синтез кальцитонин ген-связанного пептида, подавляет перекисное окисление липидов, что приводит к снижению секреции соляной кислоты и ускорению репарации эпителиоцитов [39, 40].
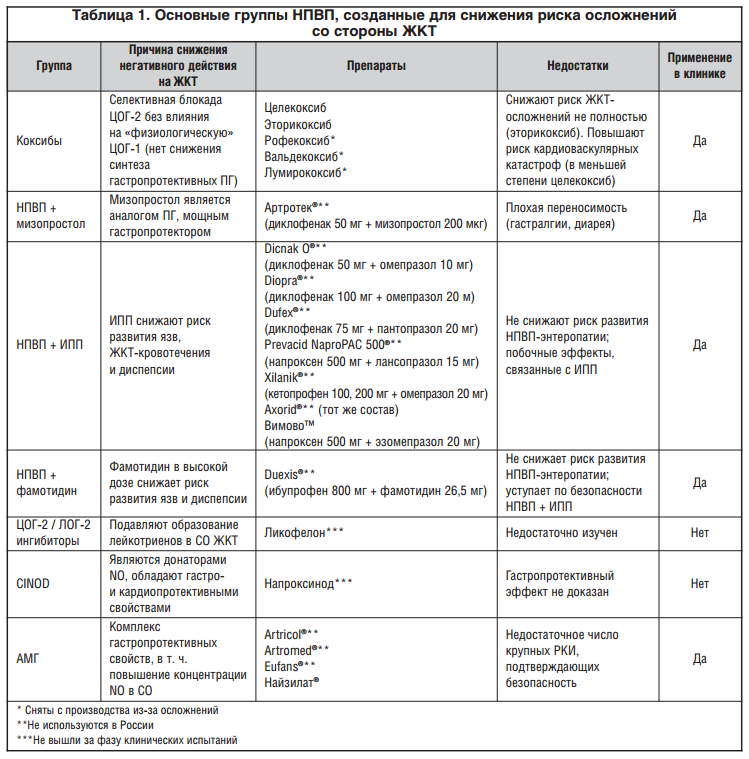
Гастропротективный потенциал нового средства был подтвержден серией лабораторных исследований. Так, в работе E. Tubaro et al. для этого препарата было показано дозозависимое подавление стимулированной желудочной секреции, т. е., по сути, он оказался достаточно эффективным антисекреторным средством (рис. 1). Кроме того, АМГ отчетливо усиливал секрецию бикарбоната, являющегося основой щелочного «буфера» СО желудка. Самое интересное, что АМГ, будучи НПВП, уменьшал повреждающее действие других НПВП. Так, в сравнении с плацебо или толметином на фоне введения АМГ у лабораторных животных было выявлено достоверное дозозависимое уменьшение выраженности ульцерации, вызванной приемом индометацина [40].
Важные результаты были получены G. Morini et al., изучавшими морфологическую картину СО желудка крыс, получавших АМГ, толметин и целекоксиб. Оказалось, что в группе животных, получавших АМГ, не было отмечено повреждения эндотелиальных клеток и провоспалительных изменений в стенке желудка, в отличие от животных, получавших препараты сравнения. Любопытно, что признаки воспаления возникали даже при использовании целекоксиба, который считается одним из наиболее безопасных для ЖКТ представителей группы НПВП [41].
АМГ эффективно устранял нарушения моторики верхних отделов ЖКТ у здоровых добровольцев, получивших в качестве раздражающего средства 40-80 мг чистого этилового спирта. Его эффект практически не отличался от действия мизопростола, который, как было указано выше, является мощным гастропротектором с доказанным лечебным потенциалом. При этом прием диклофенака и плацебо однозначно усиливал расстройства функции ЖКТ, вызванные приемом этилового спирта [42].
Конечно, лабораторные исследования представляют большой интерес. Тем не менее наибольшее значение для оценки перспектив применения АМГ имеет опыт клинических испытаний, проведенных с участием реальных пациентов. Таких работ было выполнено достаточно много.
В 2001 г. были представлены данные крупного 30-дневного исследования, в котором АМГ в дозе 1200-600 мг/сут назначался 388 больным с острой болью, связанной с ОА крупных суставов, или неспецифической болью в области спины. По всем параметрам оценки боли и нарушения функции использование АМГ приводило к достоверно значимому улучшению [43].
В РКИ было проведено сравнение АМГ и диклофенака у 50 больных с выраженной мышечно-скелетной болью. Выраженность боли оценивалась по 5-балльной шкале (от 0 до 4). Оказалось, что АМГ не уступал, а по ряду параметров даже превосходил препарат контроля. Так, боль в покое, при движении и выраженность нарушения функции через 4 нед. терапии составили в исследуемых группах 0,5 и 1,2, 0,7 и 0,8, 0,4 и 1,1 балла соответственно [44].
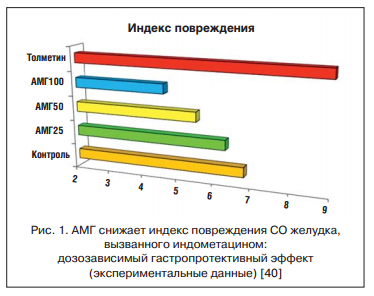
Эффективность и безопасность АМГ подтверждает метаанализ 18 РКИ (n=780) продолжительностью от 4 нед. до 6 мес., в которых сравнивались лечебное действие и частота НР при использовании АМГ и «традиционных» НПВП, таких как диклофенак, толметин, пироксикам и индометацин. Какие-либо осложнения на фоне приема нового препарата возникали гораздо реже, чем в контрольных группах: ОШ для их развития составило 0,2 (0,1-0,3); риск появления осложнений со стороны ЖКТ был меньше более чем в 3 раза: ОШ 0,3 (0,1-0,7). В 3-х РКИ (суммарно 92 больных) безопасность АМГ оценивалась по результатам оценки эндоскопической картины верхних отделов ЖКТ. Препаратами сравнения здесь были индометацин, толметин и диклофенак (рис. 2). Как видно, лишь у нескольких больных, получавших АМГ, развились небольшие изменения СО — единичные геморрагии или эрозии, в то время как прием обычных НПВП вызвал появление эрозий и язв почти у половины участников исследований [45].
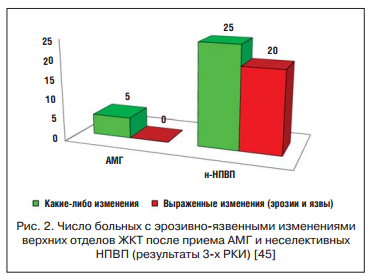
Принципиальное значение для оценки потенциала АМГ имеет его сравнение с целекоксибом, который среди всех НПВП по праву считается наиболее безопасным для ЖКТ. Такое сравнение было проведено группой хорватских ученых, продолжительность терапевтического периода составила 6 мес., в исследуемой группе было 180 больных ревматоидным артритом. Пациенты получали АМГ в дозе 1200 мг или целекоксиб в дозе 400 мг, причем всем до и после курса лечения проводилось эндоскопическое исследование ЖКТ. Результаты работы показаны на рисунке 3. Как видно, у подавляющего большинства пациентов не было отмечено развития каких-либо изменений СО, и АМГ по уровню ЖКТ-переносимости нисколько не уступал целекоксибу [46].
Еще одним подтверждением достоинств АМГ стала работа A. Belisari и L. Mantovani, сравнивших финансовые затраты при лечении этим препаратом и популярными «традиционными» НПВП. Как известно, реальная стоимость лекарственной терапии определяется не только номинальной ценой препарата, но и затратами на диагностические и лечебные мероприятия, связанные с необходимостью профилактики и терапии возможных НР. Исходя из этого, суммарные экономические потери, связанные с применением определенного представителя НПВП, могут в десятки раз превышать номинальную стоимость этого препарата. Как показали проведенные расчеты, АМГ суммарно обходился значительно дешевле, чем «традиционные» НПВП, которые гораздо чаще вызывали те или иные осложнения. Применение пироксикама (на 100 человек/лет) обходилось дороже на 150-1077 евро, диклофенака — на 380-1705, толметина — на 410-2190, а индометацина — на 1046-3132 [47].
В России АМГ появился под названием Найзилат® («Др. Редди’с»). Представляется, что это лекарство расширит возможности российских врачей в борьбе с острой и хронической болью. Новый препарат, согласно имеющимся литературным данным, обладает серьезными преимуществами в сравнении со многими «традиционными» НПВП. Толметин, ставший основой для создания нового препарата, хорошо известен западным врачам как действенное анальгетическое и противовоспалительное средство. Согласно данным серии клинических испытаний, АМГ нисколько не уступает по терапевтическому потенциалу своему предшественнику. Найзилат® обладает собственным гастропротективным эффектом, повышая концентрацию NO в СО ЖКТ, увеличивая ее репаративный потенциал и снижая секрецию соляной кислоты. Имеются доказательства большей безопасности АМГ для ЖКТ в сравнении со многими неселективными НПВП, в частности, диклофенаком. Согласно результатам достаточно крупного исследования, АМГ не уступает целекоксибу по своей переносимости и низкой частоте развития язв и эрозий ЖКТ. Необходимо отметить, что объем работ, подтверждающих преимущества АМГ, относительно невелик; не все параметры его безопасности, в частности, влияние на ССС, изучены достаточно полно. Это определяет необходимость проведения российских исследований преимуществ нового лекарства. Тем не менее имеющаяся на сегодняшний день информация дает возможность рекомендовать Найзилат® в качестве хорошей альтернативы «традиционным» НПВП при лечении острой и хронической боли.
Литература
- Brune K., Patrignani P. New insights into the use of currently available non-steroidal anti-inflammatory drugs // J Pain Res. 2015 Feb 20. Vol. 8. Р. 105-118.
- Blondell R.D., Azadfard M., Wsniewski A.M. Pharmacologic therapy for acute pain //Am Fam Physician. 2013 Jun 1. Vol. 87 (11). Р. 766-772.
- Kroenke K., Krebs E.E, Bair M.J. Pharmacotherapy of chronic pain: a synthesis of recommendations from systematic reviews // Gen Hosp Psychiatry. 2009 May-Jun. Vol. 31 (3). Р. 206-219.
- Brune K. The early history of non-opioid analgesics // Acute Pain. 1997. Vol. 1. Р. 33-40.
- Vane J. The fight aganst rheumatism: from willow bark to COX-1 sparing drugs // J Physiol Pharmacol. 2000. Vol. 51 (4 Pt 1). Р. 573-586.
- Goldstein J.L, Cryer B. Gastrointestinal injury associated with NSAID use: a case study and review of risk factors and preventative strategies// Drug Healthc Patent Saf. 2015 Jan 22. Vol. 7. Р. 31-41.
- Harirforoosh S., Asghar W., Jamali F. Adverse Effects of Nonsteroidal Antiinflammatory Drugs: An Update of Gastrointestinal, Cardiovascular and Renal Complications // J Pharm Pharm !S;i. 2013. Vol. 16 (5). Р. 821-847.
- Каратеев А.Е., Успенский Ю.П., Пахомова И.Г., Насонов Е.Л. Краткий курс истории НПВП// Научно-практическая ревматология. 2012. № 3. С. 101-111.
- Patrignani P., Patrono C. Cyclooxygenase inhibitors: From pharmacology to clinical read-outs // Biochim Biophys Acta. 2015 Apr. Vol. 1851 (4). Р. 422-432.
- Fiorucci S., Distrutti E. COXBs, CINODs and H S-releasing NSAIDs: current perspectives in the development of safer non steroida anti-inflammatory drugs// Curr Med Chem. 2011. Vol. 18 (23). Р. 3494-3505.
- Rainsford K. Profile and mechanisms of gastrointestinal and other side effects of nonsterodal anti-inflammatory drugs (NSAIDs) //Am. J. Med. 1999. Vol. 107. Р. 27-36.
- Furst D. Meloxicam: selective COX-2 inhibition in clinical practice// Semin Arthritis Rheum. 1997. Vol. 26 (6 Suppl). Р. 21-27.
- Van Hecken A., Schwartz J., Depr M. et al. Comparative inhibitory activity of rofecoxib, meloxicam, diclofenac, ibuprofen, and naproxen on COX-2 versus COX-1 in healthy volunteers // J Clin Pharmacol. 2000. Vol. 40 (10). Р. 1109-1120.
- Castellsague J., Riera-Guardia N., Calingaert B. et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project) // Drug Saf. 2012 Dec 1. Vol. 35 (12). Р. 1127-1146.
- Horton R. Vioxx, the implosion of Merck, and aftershocks at the FDA // Lancet. 2004. Vol. 364 (9450). Р. 1995-1996.
- Lenzer J. Crisis deepens at the US Food and Drug Administration // BMJ. 2004 Dec 4. Vol. 329 (7478). Р. 1308.
- Laine L., Curtis S.P., Cryer B. et al. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison // Lancet. 2007. Vol. 369. Р. 465-473.
- Silverstein F. New strategies for the prevention of serious upper GI complication from NSAIDs: lessons from the MUCOSA trial. New stand // Arth. Care. 1996. Vol. 5. Р. 2-6.
- Acevedo E., Castaneda O., Ugaz M. et al. Tolerability profiles of rofecoxib (Vioxx) and Arthrotec. A comparison of six weeks treatment in patients with osteoarthritis // Scand. J. Rheumatol. 2001. Vol. 30. Р. 19-24.
- http://www.drugs.com.
- http://www.medindia.net/drug-price/pantoprazole-combination/dufex.htm.
- http://www.has-sante.fr/portail/upload/docs/application/pdf/2011-08/xlanik_ct_7738.pdf.
- Gigante A., Tagarro I. Non-steroidal anti-inflammatory drugs and gastroprotection with proton pump inhibitors: a focus on ketoprofen/omeprazole // Clin Drug Investig. 2012. Vol. 32 (4). Р. 221-233.
- Roberts D., Miner P. Safety aspects and rational use of a naproxen + esomeprazole combination in the treatment of rheumatoid disease // Drug Healthc Patient Saf. 2011. Vol. 3. Р. 1-8.
- Cryer B.L., SSostek M.B., Fort J.G. et al. A fixed-dose combination of naproxen and esomeprazole magnesium has comparable upper gastrointestinal tolerability to celecoxib in patients with osteoarthritis of the knee: results from two randomized, parallel-group, placebo-controlled trias//Ann Med. 2011 Dec. Vol. 43 (8). Р. 594-605.
- Bello A. DUEXIS® (ibuprofen 800 mg, famotidine 26.6 mg): a new approach to gastroprotection for patients with chronic pain and inflammation who require treatment with a nonsteroidal anti-inflammatory drug // Ther Adv Musculoskelet as. 2012. Vol. 4 (5). Р. 327-339.
- Каратеев А.Е. Селективные ингибиторы циклооксигеназы-2 и «защищенные» нестероидные противовоспалительные препараты: два метода профилактики лекарственных осложнений // Клин. медицина. 2014. № 8. С. 54-62.
- Каратеев А Е. Шесть ножей в спину ингибиторам протонной помпы// Научно-практическая ревматология. 20013. № 51 (3). С. 332-340.
- Kulkarni S.K., Singh V.P. Licofelone: the answer to unmet needs in osteoarthritis therapy?// Curr Rheumatol Rep. 2008 Jan. Vol. 10 (1). Р. 43-48.
- BertoliniA., OttaniA., Sandrini M. Dual acting anti-inflammatory drugs: a reappraisal // Pharmacol Res. 2001 Dec. Vol. 44 (6). Р. 437-450.
- Raynaud J.P., Martel-Pelletier J., Bias P. et al. Protective effects of licofelone, a 5-lipoxygenase and cyclooxygenase inhibitor, versus naproxen on cartilage loss in knee osteoarthritis: a first multicentre clinical trial using quantitative MRI//Ann Rheum Dis. 2009 Jun. Vol. 68 (6). Р. 938-947.
- Lanas A Role of nitric oxide in the gastrointestinal tract // Arthritis Research & Therapy. 2008. Vol. 10 (Suppl 2). Р. 4.
- Wallace J.L., Viappiani S., Bolla M. Cyclooxygenase-inhibiting nitric oxide donators for osteoarthritis // Trends Pharmacol Sci. 2009 Mar. Vol. 30 (3). Р. 112-117.
- Lanas A., Garca-Rodrguez L.A., Arroyo M.T. et al. Effect of antisecretory drugs and nitrates on the risk of ulcer bleeding associated with nonsteroidal anti-inflammatory drugs, antiplatelet agents, and anticoagulants //Am J Gastroenterol. 20007. Vol. 102 (3). Р. 507-515.
- Lohmander L.S., McKeith D., Svensson O. et al. A randomised, placebo controlled, comparative trial of the gastrointestinal safety and efficacy of AZD3582 versus naproxen in osteoarthritis // Ann Rheum Dis. 2005. Vol. 64. Р. 449-456.
- Geusens P. Naproxcinod, a new cyclooxygenase-inhibiting nitric oxide donator (CINOD) // Expert Opin Biol Ther. 2009 May. Vol. 9 (5). Р. 649-657.
- Cordrey L.J. Tolmetin sodium, a new anti-arthritis drug: double-blind and long-term studies // Journal of the American Geriatrics Society. 1976. Vol. 24 (10). Р. 440-446.
- AHFS Drug Information 2007. McEvoy G.K., ed. Tolmetin. Bethesda, MD: American Society of Health-System Pharmacists, 2007. Р. 2118-2122.
- Coruzzi G., Coppelli G., Spaggiari S. et al. Gastroprotective effects of amtolmetin guacyl: a new non-steroidal anti-inflammatory drug that activates inducible aastric nitric oxide svnthase // Dig Liver Dis. 2002. Vol. 34 (6). Р. 403-410.
- Tubaro E., Belogi L., Mezzadri CM. The mechanism of action of amtolmetin guacyl, a new gastroprotective nonsteroidal anti-inflammatory drug // European Journal of Pharmacology. 2000. Vol. 387. Р. 233-244.
- Morini G., Guaita E., Lazzaretti M. et al. Morphological features of rat gastric mucosa after acute and chronic treatment with amtolmetin guacyl: comparison with non-selective and COX-2-selective NSAIDs // Digestion. 2003. Vol. 68 (2-3). Р. 124-132.
- Riezzo G., Chiloiro M., Montanaro S. Protective effect of amtolmetin guacyl versus placebo diclofenac and misoprostol in healthy volunteers evaluated as gastric electrical activity in alcohol-induced stomach damage // Dig Dis Sci. 2001. Vol. 46 (8). Р. 1797-1804.
- Biasi G., Marcolongo R. Efficacy and safety of amtolmetin guacyl in the treatment of acute osteoarthritis // Minerva Med. 2001 Oct. Vol. 92 (5). Р. 315-324.
- Tavella A, Ursini G. A clinical study on the anti-inflammatory activity and gastrointestinal tolerability of amtolmetin guacyl, a new NSAID, compared with diclofenac in aged patients with osteoarticular diseases // Clin Ter. 1997 Nov. Vol. 148 (11). Р. 543-548.
- Marcolongo R., Frediani B., Biasi G. et al. A Meta-Analysis of the Tolerability of Amtolmetin Guacil, a Novel, Effective Nonsteroidal Anti-Inflammatory Drug, Compared with Established Agents // Clin Drug Invest. 1999. Vol. 17 (2). Р. 89-96.
- Jaji Z., Malaise M., Nekam K. et al. Gastrointestinal safety of amtolmetin guacyl in comparison with celecoxib in patients with rheumatoid arthritis // Clin Exp Rheumatol. 2005. Vol. 23 (6). Р. 809-818.
- Belisari A., Mantovani L Cost-Benefit Analysis of Amtolmetin-GuacilClin//Drug Invest. 2001. Vol. 21 (1). Р. 47-58.








Комментировать