Миомэктомия во время беременности: описание и тенденции. Сроки проведения и показания к миомэктомии во время беременности. Описание клинического случая из практики.
Буянова С.Н., Гукасян С.А., Юдина Н.В.
Сообщение о первой миомэктомии во время беременности было опубликовано Granvill в 1827 г. Позднее Ammussat (1840) и A.L. Atlee (1845) сообщили об удалении узла миомы во время беременности. Первые шаги по внедрению реконструктивных операций при миоме матки предприняли за рубежом Rukronlein (1890) и W. Muller (1885), а в России – Д.А. Абуладзе. Они рекомендовали миомэктомию как операцию, сохраняющую, а у многих женщин – восстанавливающую их детородную функцию, т. к. 30% пациенток с миомами матки были бесплодными.
Миома матки обнаруживается приблизительно у каждой 4–5-й женщины после 30 лет [6]. Сочетание беременности и миомы в 70-е гг. XX века, по данным различных авторов, колебалось от 0,3% до 5%, а в настоящее время этот процент гораздо выше, что объясняется как увеличением частоты развития миомы, так и расширением возможностей ее обнаружения при УЗИ.
Беременность предполагает возникновение дополнительной нагрузки для матки, выполнение которой может быть осложнено наличием миоматозных узлов, рост которых чаще всего происходит во время беременности.
Поскольку число женщин, имеющих сочетание миомы матки и беременности, возрастает, акушерам-гинекологам все чаще приходится решать вопрос об уточнении тактики ведения больных с миомой матки во время беременности [4, 9, 10].
Нередко само наступление беременности у женщин с миомой матки – единственный ее шанс стать матерью. Течение беременности, акушерская тактика, а также методы родоразрешения при этом имеют свои особенности. Зачастую течение беременности у таких пациенток осложняется угрозой прерывания в различные сроки (частота этого осложнения колеблется от 14 до 25%) [Персианинов Л.С., 1972; Аксенов Т.А., 1978; Буянова С.Н. и др., 1998], фетоплацентарной недостаточностью (ФПН) и синдромом задержки роста плода, быстрым ростом опухоли, нарушением питания и некрозом миоматозного узла, отслойкой плаценты, в особенности в тех случаях, когда она полностью или частично расположена в области миоматозного узла, а также неправильным положением и предлежанием плода. Роды у беременных с миомой матки также протекают с осложнениями: несвоевременное излитие вод, аномалии сократительной деятельности матки, дистресс-синдром плода, плотное прикрепление плаценты, гипотонические кровотечения, субинволюция матки в послеродовом периоде и др.
Осложненное течение беременности и родов определяет высокую частоту оперативных вмешательств и акушерских пособий у беременных с опухолями матки. Кесарево сечение при наличии миомы матки, как правило, заканчивается расширением объема оперативного вмешательства (миомэктомия, удаление матки). Осложненное течение беременности и родов требует строго дифференцированного подхода к ведению беременных с миомой матки и определяет индивидуальную акушерскую тактику в каждом конкретном случае. Прежде всего, это касается решения вопросов о необходимости, возможности и условиях миомэктомии во время гестации [1, 2]. Важный принцип, который следует подчеркнуть особо: показанием к миомэктомии является не сам факт наличия миомы у беременной, а высокий риск осложнений, который она представляет в каждом конкретном случае для состояния здоровья, в первую очередь будущей матери, а также и плода.
Сроки проведения и показания к миомэктомии во время беременности. По нашему мнению, оптимальным для проведения плановой миомэктомии является срок беременности 14–16 нед., который характеризуется началом полноценного функционирования плаценты и возрастанием уровня прогестерона в периферической крови в 2 раза. Прогестерон препятствует развитию регулярных сокращений миометрия, усиливает запирательную функцию внутреннего маточного зева. По нашему мнению, основными показаниями к миомэктомии во время беременности являются следующие:
– большие и гигантские размеры узлов, препятствующие пролонгированию беременности и занимающие всю брюшную полость;
– нарушение кровообращения, некроз узлов, подтвержденные при УЗИ (почти во всех случаях);
– атипичное расположение узлов миомы (шеечные, перешеечные, интралигаментарные), приводящее к нарушению функции тазовых органов (дизурические явления, стойкие боли);
– невозможность прерывания беременности с использованием вагинального доступа из-за больших шеечно-перешеечных узлов при стойкой клинической картине угрозы прерывания беременности.
По нашим данным, риск потери плода при миомэктомии в обозначенной ситуации минимален, если толщина миометрия между нижним полюсом узла и полостью матки превышает 0,5–0,7 см.
Наиболее часто встречающимся осложнением беременности при наличии опухоли матки является угроза ее прерывания. По данным И.С. Сидоровой (1985), это осложнение у беременных с миомой наблюдается в 30–75% случаев. По данным Н.П. Василенко и Г.Л. Дорониной (1988), у 15% женщин миома явилась причиной прерывания беременности. Угроза прерывания беременности в первые 12 нед. является наиболее значимой, поскольку в это время происходит эмбриогенез и формирование плаценты. Угрожающее прерывание беременности в первом триместре часто осложняет нормальное течение этих процессов, что может привести к развитию плацентарной недостаточности, страданию плода. В число методов обследования беременной перед миомэктомией входит контроль за содержанием гормонов фетоплацентарного комплекса в плазме крови. Учитывая, что чаще всего основным патогенетическим механизмом невынашивания беременности является абсолютная или относительная прогестероновая недостаточность, лечение угрожающего аборта в первом триместре должно быть в первую очередь направлено на восполнение недостаточности прогестерона [5, 6, 10]. Беременным с миомой матки следует назначать микронизированный прогестерон в дозе 400–600 мг или дидрогестерон в дозе 20–30 мг/сут с момента констатации беременности.
Принимая во внимание высокий риск прерывания беременности после оперативного вмешательства, интенсивную профилактику данного осложнения мы начинали еще в предоперационном периоде (за 5–7 дней до операции). Она включала в себя внутривенное введение адреномиметиков (гексопреналин 5 мг в изотоническом растворе хлорида натрия), сернокислой магнезии 30,0 на 200 мл изотонического раствора хлорида натрия. Препараты вводились внутривенно капельно медленно. Для профилактики побочного действия b-адреномиметиков со стороны сердечно-сосудистой системы (тахикардия) препараты вводили вместе с антагонистами кальция (верапамил). Инфузионная терапия продолжалась 7–10 сут после операции с постепенным переходом на таблетированные формы. Доза подбиралась индивидуально в зависимости от выраженности симптомов угрозы прерывания беременности. В конце внутривенного введения препаратов при выраженной угрозе прерывания беременности вводилось 5,0 мл метамизола натрия внутривенно струйно, т. к. комбинированные препараты метамизола натрия обладают антипростагландиновым эффектом. Они были включены в комплекс терапии, направленной на пролонгирование беременности. Учитывая, что миома матки отрицательно влияет на фетоплацентарный кровоток, особенно в тех случаях, когда плацента локализована в области миоматозного узла, мы также проводили терапию, направленную на улучшение состояния кровотока. Для этого пациенткам назначался дипиридамол по 0,025 г 3 р./сут, а также препараты для профилактики внутриутробной гипоксии плода (пирацетам, кокарбоксилаза, аскорбиновая кислота, 40% раствор глюкозы).
Выбор метода анестезии при операциях, проводимых у беременных пациенток, определяется многими факторами, в т. ч. опытом и квалификацией анестезиологической бригады. Во время оперативного вмешательства при беременности нами соблюдаются следующие условия: обеспечение безопасности состояния матери во время операции, поддержание нормального маточно-плацентарного кровотока, максимальная защита плода и избегание факторов, приводящих к повышению тонуса миометрия. Операции проводились на сроке беременности от 14–16 нед., т. к. именно в этот период уменьшается риск тератогенного действия многих средств, используемых для анестезии, как во время операции, так и в послеоперационном периоде. Среди всех прочих методов анестезии мы использовали эпидуральную блокаду, которая позволяет получить продолжительное и эффективное обезболивание во время операции и продолжить его в послеоперационном периоде. Во время операции и в послеоперационном периоде в палате интенсивной терапии проводился тщательный мониторинг. Нами использовался раствор ропивакаина как наиболее безопасный в настоящее время локальный анестетик.
Для обеспечения большей безопасности миомэктомии во время беременности, снижения послеоперационных осложнений нами была разработана хирургическая технология миомэктомии при беременности. Миомэктомия во время беременности имеет свои особенности по сравнению с миомэктомией вне беременности, что связано с наличием расширенной сосудистой сети, высоким риском повышенной кровопотери. Основные принципы миомэктомии во время беременности – это создание условий для исключения травматизации плода, минимальной кровопотери, снижения риска гнойно-септических осложнений и выбор рационального разреза на матке с учетом последующего абдоминального родоразрешения. Мы применяем нижнесрединную лапаротомию для создания наиболее щадящих условий для беременной и плода, а также оптимального доступа к атипично расположенным узлам. Тело матки с расположенным в нем плодом выводится в рану и удерживается ассистентом, что позволяет уменьшать кровопотерю. Разрез целесообразно производить по верхнему полюсу узла во избежание травмы магистральных сосудистых пучков. Важная роль в исходе операции отводится шовному материалу и методике наложения швов на матке. Основным шовным материалом, который мы используем при хирургических вмешательствах, является викрил. Зашивание ложа узла мы производим викрилом №00, отдельными узловыми швами. Необходимо прокалывать всю толщину миометрия во избежание образования гематом в ране. Считаем важным наложение достаточно редких швов: через 7–10 мм друг от друга. Второй ряд швов – между узлами первого ряда. Таким образом, ткани удерживаются в состоянии репозиции без риска ишемии в прошитых и прилежащих участках. Особое внимание уделяется тщательности гемостаза, учитывая выраженность кровоснабжения матки во время беременности. Во время беременности удаляются только доминантные, т. е. большие узлы, составляющие проблему для пролонгирования гестации. Удаление всех узлов приводит к увеличению кровопотери, создает неблагоприятные условия для кровоснабжения миометрия, что повышает риск потери плода.
Послеоперационное ведение беременных, перенесших миомэктомию, имеет свои особенности, обусловленные необходимостью создания благоприятных условий для репарации тканей, профилактики гнойно-септических осложнений, адекватного функционирования кишечника, ликвидации угрозы прерывания беременности и улучшения маточно-плацентарного кровотока. После хирургического вмешательства в течение 2–3 дней проводилась интенсивная инфузионная терапия, включающая белковые, кристаллоидные препараты и средства, улучшающие микроциркуляцию и регенерацию тканей. Вопрос о длительности инфузионной терапии решается индивидуально в каждом конкретном случае и зависит от объема оперативного вмешательства и кровопотери. С целью профилактики гнойно-септических осложнений необходимо проводить антибактериальную профилактику (цефалоспорины). В зависимости от выраженности клинических признаков угрозы прерывания беременности с первых часов после операции продолжается терапия, направленная на сохранение беременности (токолитики, спазмолитики, сульфат магния по общепринятым схемам). В дальнейшем, при необходимости, пероральный прием препаратов назначается до 36 нед. гестации с постепенным снижением дозы [10].
На базе МОНИИАГ проводилось обследование и лечение 90 пациенток репродуктивного возраста (от 21 до 43 лет), которым была произведена миомэктомия лапаротомическим доступом во время беременности. Прослежены ближайшие и отдаленные результаты за 5-летний период. Показаниями к миомэктомии во время беременности во всех случаях явились ситуации, представляющие высокий риск нарушения состояния здоровья матери и плода. Так, у четверти беременных были симптомы нарушения функции мочевой системы при шеечно-перешеечных и интерлигаментарных узлах (задержка мочи, требующая катетеризации мочевого пузыря, уретерогидронефроз); у 53% имелись клинические и УЗ-признаки нарушения кровообращения узла (боли, мягкая консистенция, отек, деструкция); у 34,7% – большие и гигантские размеры узлов, заполняющие брюшную полость при сроке беременности до 16 нед. Во всех случаях нами были произведены органосохраняющие операции. Беременность у пациенток протекала удовлетворительно и закончилась родами в 37–39 нед. У 69 (76,7%) пациенток беременность завершилась оперативными родами (кесарево сечение в доношенном сроке беременности), а у 21 (23,3%) пациентки произошли самопроизвольные роды. У 6 женщин при кесаревом сечении обнаружен незначительный спаечный процесс. Также надо отметить, что в большинстве случаев рубцы на матке не визуализировались, миометрий не был истончен.
Значение рекоструктивно-пластических операций при миоме матке во время беременности определяется возможностью создания благоприятных условий для дальнейшего вынашивания беременности и благополучного родоразрешения.
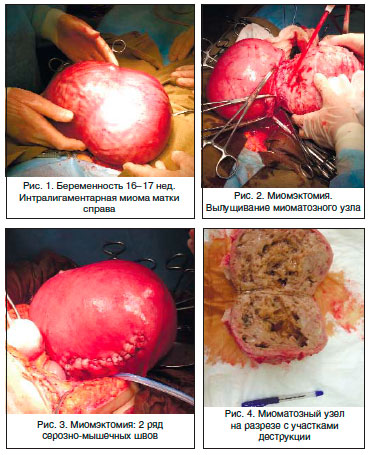
Пациентка Р., 40 лет. Поступила в гинекологическое отделение МОНИИАГ с диагнозом: интерстициальная миома матки больших размеров с центростремительным ростом и перешеечным расположением узлов, с симптомом быстрого роста. Беременность 16–17 нед. Угроза прерывания беременности. Анемия легкой степени. Пациентка страдала первичным невынашиванием беременности (5 самопроизвольных выкидышей в анамнезе в сроке от 8 до 12 нед.). Толщина миометрия от нижнего полюса узла до полости матки – 3 мм.
С учетом заинтересованности пациентки в сохранении беременности в клинике начато лечение, направленное на ее пролонгирование, профилактику ФПН, назначена противоанемическая терапия (дидрогестерон, сернокислая магнезия, гексопреналин в/в капельно и таблетированная форма, вазоактивные препараты – ксантинола никотинат в/в капельно, дипиридамол, эссенциальные фосфолипиды в/в струйно, спазмолитические и седативные препараты, препараты железа). Под эпидуральной анестезией произведены нижнесрединная лапаротомия, миомэктомия (без вскрытия полости матки), санация и активное трансабдоминальное дренирование полости малого таза. При вскрытии обнаружено: матка синюшной окраски, ротирована влево, увеличена до 28 нед. беременности за счет множественной миомы и беременности 16–17 нед.
С большими техническими сложностями матка выведена в рану. Наибольший миоматозный узел с интерстициальным расположением исходит из задней стенке матки с переходом на ее дно, ближе к правому маточному ребру, нижний полюс которого доходит до перешейка, размерами 15х10х8 см, с центростремительным ростом. Узлы плотной консистенции, с кальцинозом (рис.1).
Над узлами, исходящими из задней стенки, произведено два продольных разреза, острым путем узел вылущен (рис. 2).
Ложе узла зашито отдельными викриловыми швами в два ряда: 1 ряд – мышечно-мышечные, 2 ряд – серозно-мышечные. Кровопотеря 600 мл. Интраоперационно проводилась трансфузионная терапия (2 дозы одногруппной свежезамороженной плазмы и 2 дозы одногруппной эритроцитарной массы) (рис. 3).
В послеоперационном периоде проводилось лечение, направленное на пролонгирование беременности, профилактику ФПН, а также противоанемическая и симптоматическая терапия (утрожестан, сернокислая магнезия, гексопреналин в/в капельно и таблетированная форма, вазоактивные препараты – ксантинола никотинат в/в капельно, дипиридамол, эссенциальные фосфолипиды в/в струйно, спазмолитические и седативные препараты, препараты железа – тотема).
Результат гистологического исследования: узел имеет строение лейомиомы с выраженным сосудистым компонентом, отеком, дистрофическим полиморфизмом и участками некроза (рис. 4).
Пациентка всю беременность наблюдалась в НКО МОНИИАГ. Беременность завершилась оперативными родами в плановом порядке. Послеоперационный рубец не визуализировался. Истончения миометрия не было.
- Иванова Н.В., Бугеренко А.Е., Азиев О.В., Штыров С.В. // Вестн. Росс. Accoц. акуш.-гин. 1996. № 4. С. 58–59.
2. Смицкий ГА. // Вест. Росс. ассоц. акуш.-гин. 1997. № 3. С. 84–86.
3. Бабунашвили Е.Л. Репродуктивный прозноз при миоме матки: Автореф. дис… канд. мед. наук. М., 2004. С. 24.
4. Вихляева Е.М. Руководство по диагностике и лечению лейомиомы матки. М: МЕДпресс-информ, 2004. С. 400.
5. Краснопольский В.И., Сергеев П.В., Гаспарян Н.Д. и др. Беременность и прогестеронзависимая миома матки // Рос. вестн. акуш.-гин. 2003. № 3:3. С. 5–57.
6. Краснопольский В.И., Логутова Л.С., Буянова С.Н. Репродуктивные проблемы оперативанной матки. М: Миклош, 2005. С. 5–136, 162.
7. Краснопольский В.И., Буянова С.Н., Щукина Н.А. и др. Хирургическая коррекция репродуктивной функции при миоме матки // Рос. вестн. акуш.-гин. 2005. № 5:2. С. 74–76.
8. Краснопольский В.И., Буянова С.Н., Щукина Н.А., Попов А.А. Оперативная гинекологии. М: МЕДпресс-информ, 2010. С. 98–125.
9. Титеченко И.П. Клиническое значение новых ультразвуковых диагностических технологии в выборе тактики лечения миомы матки вне и во время беременности: Автореф. дис… канд. мед. наук. М., 2007. С. 24.
10. Шмаков Г.С. Миомэктомия во время беременности: Автореф. дис… докт. мед. наук. М., 1997. С. 48.
11. Donnerz J., Jadoul P. What are the implications of myomas on fertility? A need for a debate? // Human Reprod. 2002. Vol. 17:6. P. 1424–1430.









Комментировать