Современные принципы и схемы морфологической оценки микроскопического колита. Колоноскопия.
А.С. Тертычный1, Х.М. Ахриева2, О.В. Зайратьянц3, Л.С. Селиванова1,Ж.В. Шароян1, Е.И. Епифанова4, Е.А. Таширова4, Н.С. Маренич51 Кафедра патологической анатомии имени академика А.И. Струкова Первого МГМУ имени И.М. Сеченова2 Кафедра факультетской терапии медицинского факультета ФГБОУ ВПО «Ингушский государственный университет»3 Кафедра патологической анатомии ГБОУ ВПО «Московский государственный медико-стоматологический университетимени А.И. Евдокимова» Минздрава России4 Кафедра патологической анатомии педиатрического факультета №2 ГБОУ ВПО «Российский научно-исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России5 Морозовская детская городская клиническая больница
В данной статье рассматриваются современные принципы и схемы морфологической оценки МК. На протяжении последнего десятилетия МК расценивается как основная причина хронической водянистой диареи, особенно в старшей возрастной группе. При проведении колоноскопии не выявляется существенных отклонений от нормы, и только при проведении морфологического исследования возможна постановка диагноза, а также определение варианта колита – коллагеновый (КК) или лимфоцитарный (ЛК). Этиология МК на данный момент остается неизвестной, но триггерная роль приписывается неконтролируемому иммунному ответу при наличии генетической предрасположенности. В связи с тем, что к МК не проявляют такой же интерес как к другим ВЗК, например как к язвенному колиту (ЯК) или болезни Крона (БК), осведомленность о данном заболевании, как среди врачей клинических специальностей, так и среди патологоанатомов весьма ограничена.
Микроскопический колит представляет собой группу хронических заболеваний, характеризующихся водянистой диареей, отсутствием макроскопических изменений при проведении колоноскопии и специфическими гистологическими признаками, обнаруживаемыми при микроскопическом исследовании биоптатов (отсюда и происхождение названия данной патологии) [1]. По данным эпидемиологических исследований заболеваемость и распространенность микроскопическим колитом сопоставимы с таковыми при болезни Крона и язвенном колите. Тем не менее, в клинической практике микроскопический колит до сих пор относится к редко диагностируемым заболеваниям, поскольку большинство клиницистов и патологоанатомов имеют лишь смутное представление о морфологических принципах его диагностики.
До сегодняшнего дня не известна этиология и точные механизмы патогенеза. Более того, в диагностике и лечении пациентов остается много спорных моментов [2-4].
Эпидемиология
Эпидемиологические исследования проводились в основном в Европе, Северной Америке и в Канаде. Однако, даже публикации отдельных клинических наблюдений и исследования небольших групп из Африки, Азии, Латинской Америки и Австралии свидетельствую о том, что МК является повсеместно распространенным заболеванием. [1, 5] Наиболее обширные популяционные исследования проводились в Олмстеде, Миннесота и в Örebro, Швеция.
Оценка непрерывно получаемых результатов с 1984 года начала исследований в обоих центрах показали тенденцию к увеличению заболеваемости МК, которая стабилизировалась лишь в течение последнего десятилетия. В целом, ежегодная заболеваемость коллагеновым колитом составляет от 2,6 до 10,8 случаев на 100 тысяч населения и от 2,2 до 14 случаев лимфоцитарного колита. [Munch A, 2012] По данным 2010 года распространенность МК в Олмстеде составляет 219 человек на 100 тысяч населения [6], и 123 человека на 100 тысяч населения по данным Örebro на 2008 год [7]. Таким образом, можно говорить, что распространенность МК сопоставима с таковой при «классических» воспалительных заболеваниях кишечника – язвенном колите и болезни Крона.
Как правило, микроскопический колит является болезнью пожилых – на момент постановки диагноза средний возраст пациентов составляет 65 лет. Однако возраст 25% среди заболевших не достигает 45 лет. Именно поэтому у молодых пациентов с хронической диареей при проведении дифференциально-диагностического поиска не стоит забывать и о микроскопическом колите. [8]. Появление МК в детском возрасте является казуистикой, однако в литературе опубликованы и такие клинические случаи. [9].
В структуре заболеваемости МК преобладают женщины. Клинические проявления ЛК и КК не имеют каких бы то ни было различий. Основным клиническим проявлением данных нозологий является хроническая диарея без примесей крови, как правило, имеющая водянистый характер, приводящая к императивным позывам (70% пациентов) и даже к недержанию кала (40% пациентов) [10]. В тяжелых случаях примерно у половины пациентов дефекация может достигать 15-ти раз в сутки (включая ночные позывы). Несмотря на значительные потери жидкости, дегидратация организма и электролитные нарушения встречаются достаточно редко.
Естественное течение заболевания недостаточно изучено, но по данным последних проспективных исследований риск развития рецидива после отмены терапии буденофальком достаточно высок и составляет 60–80%, что свидетельствует в пользу хронически рецидивирующего течения МК. [5, 11].
В период обострения качество жизни пациентов значительно снижается и может послужить причиной их социальной дезадаптации. [3]. При этом по данным исследований, не столько частота дефекаций, сколько консистенция испражнений определяет степень ухудшения качества жизни [3, 12]. Именно поэтому стадия обострения МК по Hjortswang [13] устанавливается при наличии стула 3 и более раз в день или при наличии хотя бы однократного воднястого стула (данные оцениваются в течении недели). Таким образом, при решении вопроса о целесообразности назначении терапии в первую очередь обращают внимание не на количество дефекаций, а на их консистенцию (лечение может быть назначено и в случае, если количество дефекаций менее трех, при условии, что стул является водянистым). По данным некоторых рандомизированно контролируемых исследований буденофальк значительно улучшает качество жизни пациентов, а вышеперечисленные жалобы (количество дефекаций и консистенция испражнений) могут послужить критериями оценки активности заболевания в ходе клинических испытаний. [12].
Еще одним распространенным симптомом при МК является боли в животе. [8, 10]. Чувство дискомфорта или спазмы могут встречаться у 50% пациентов. В этих случаях проведение дифференциальной диагностики с синдромом раздраженного кишечника может представлять определенную сложность. На основании последних проспективных исследований у 43% пациентов при использовании «римских критериев III» может быть поставлен диагноз «синдром раздраженного кишечника». [14]. Как правило, болевой синдром наиболее выражен в стадию обострения и регрессирует на фоне лечения буденофальком [неопубликованные данные, 2013 год]. Также при обострении у половины пациентов может наблюдаться потеря веса [8, 10]. Хотя остается неясным вследствие чего происходит уменьшение массы тела – из-за потери жидкости или же из-за ограничения
питания самими пациентами с целью уменьшения количества дефекаций. При значительной потере веса следует исключать целиакию как сопутствующее заболевание.
Часто МК ассоциирован и с другими аутоиммуными патологиями. По данным шведского многоцентрового исследования другие аутоиммунные заболевания встречаются у трети больных. Среди них преобладают целиакия (12%), аутоиммунный тиреоидит (10,3%), синдром Шегрена (3,4%), сахарный диабет (1,7%), а также заболевания кожи и суставов (6%). В большинстве случаев их диагностика предшествует установлению диагноза МК. Примечательно, что в этих случаях МК имеет более раннюю манифестацию и более выраженные симптомы со стороны желудочно-кишечного тракта [15].
Риск развития злокачественный новообразований и общая смертность у больных МК не отличается от таковых по сравнению с общей популяцией. [16].
Гистопатология
Микроскопический колит (МК) остается гистологическим диагнозом. При этом информация о клиническом течении всегда должна быть предоставлена морфологу.
Анализ данных крупных ретроспективных исследований показал, что наличие диареи непосредственно не позволяет идентифицировать пациентов с высоким риском обнаружения МК при гистологическом исследовании. Но у пациентов старше 60 лет значительно повышается вероятность обнаружения патологических изменений при морфологическом исследовании, а наиболее вероятным диагнозом будет являться именно МК. [17].
Проведение гистологического исследования необходимо не только для постановки диагноза и проведения дифференцировки между двумя главными подтипами (лимфоцитарным колитом и коллагеновым), но и для исключения других возможных причин развития хронической диареи. В ходе эндоскопической диагностики слизистая оболочка толстого кишечника практически всегда соответствует норме, но изредка можно обнаружить незначительные изменения, такие как отек, эритема, нарушение сосудистого рисунка или даже дефекты слизистой оболочки. [18].
При МК морфологические изменения могут быть диффузными и очаговыми. Анализ данных проспективных мультицентровых исследований показывает, что коллагеновые тяжи толщиной более 10 мм чаще встречаются в правой половине кишечника, (достигая максимальных значений в слепой и восходящей ободочной кишке) и значительно реже в сигмовидной и прямой кишке, тогда как мононуклеарное воспаление в собственной пластинке равномерно распределено среди различных сегментов толстого кишки. [19]. Именно поэтому рекомендуется брать материалы для гистологического исследования на протяжении всей толстой кишки, тогда как биопсии, полученные только из прямой кишки или из прямой кишки и сигмовидной могут привести к ложноотрицательным результатам в 41% или 21% случаев соответственно. При этом, предпочтительно, чтобы биоптаты
были помещены в различные контейнеры [1, 19, 20].
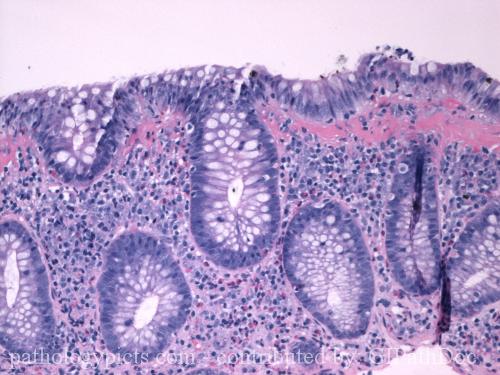
Лимфоцитарный колит
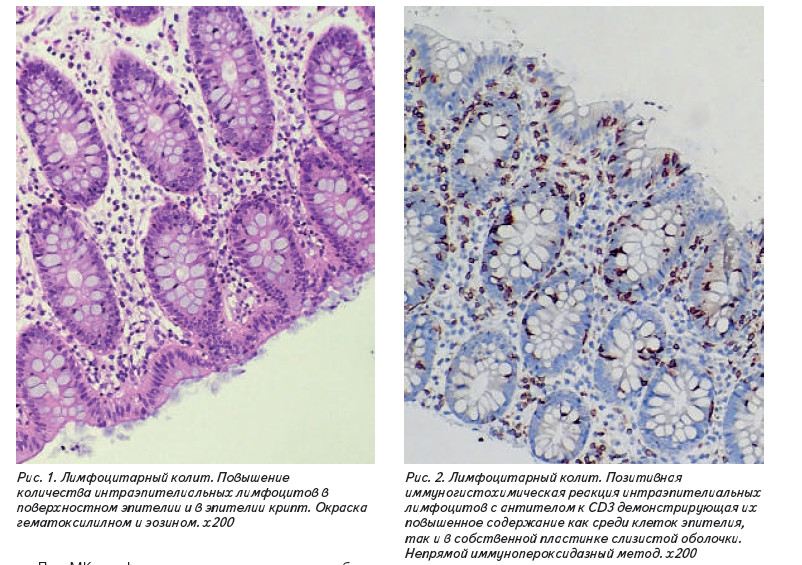
Патогномоничным признаком лимфоцитарного колита является интраэпителиальный лимфоцитоз, то есть увеличение количества поверхностных интраэпителиальных лимфоцитов с незначительным нарушением цитоархитектоники или без него [21, 23]. По данным большинства исследователей диагностическим считается увеличение ИЭЛ от 20 и более на 100 поверхностных эпителиальных клеток (тогда как в норме количество ИЭЛ составляет не более 5), но ряд авторов предполагает, что и 15 ИЭЛ уже могут указывать на наличие ЛК [24]. С целью стандартизации критериев морфологической диагностики Европейским Обществом Патологов и Европейским Обществом по изучении Болезни Крона и Язвенного Колита было рекомендовано считать пороговым значением, обладающим диагностической ценностью, увеличение количества ИЭЛ от 20 и более. [20].
Терминальный отдел подвздошной кишки считается вовлеченным в процесс (ЛК, КК) при среднем количестве интраэпителиальных клеток на ворсину превышающем 5 клеток. [25].
На препаратах, окрашенных гематоксилином и эозином, интраэпителиальные лимфоциты представляют собой преимущественно округлые клетки с компактным ядром и с компактным строением хроматина, немного неправильным контуром ядра и перинуклеарным гало.
Поверхностные эпителиальные клетки могут отражать дистрофические и/или регенеративные изменения, такие как вакуолизация и уменьшение муцина. [26]. По сравнению с нормой, количество клеток в собственной пластинке слизистой диффузно увеличено. Воспалительная инфильтрация состоит преимущественно из лимфоцитов и плазматических клеток, но также могут присутствовать эозинофилы и даже единичные нейтрофилы.
В большинстве случаев окрашивание биоптатов гемотоксилином и эозином достаточно для постановки диагноза, и ИГХ окрашивание с АТ к CD3 не является рутинным методом (Рис.1 и 2).
Коллагеновый колит
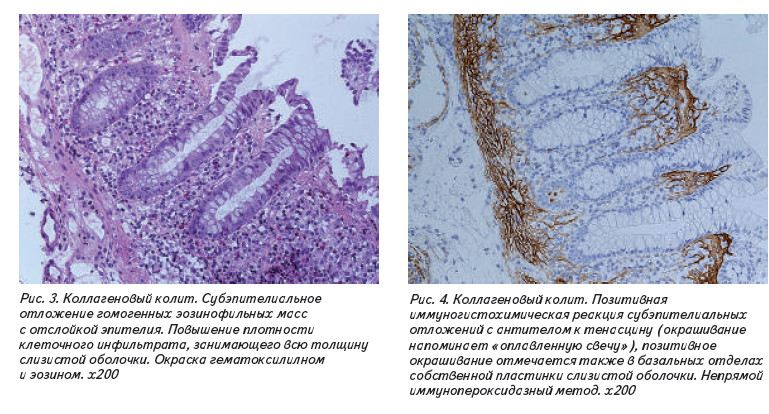
Диагностическим гистологическим признаком КК является утолщение слоя коллагена, расположенного сразу под поверхностным эпителием. Особенно хорошо эти изменения определяются между криптами. Отложения коллагена могут иметь неправильные очертания и неровную границу с подлежащей собственной пластинкой слизистой оболочки.
Коллагеновые массы могут содержать капилляры, эритроциты, а также клетки воспаления, в частности, лимфоциты [21, 23]. Повреждение поверхностного эпителия при КК встречается намного чаще, чем при ЛК, и, как правило, оно достаточно отчетливо выражено. Также характерным признаком КК является десквамация эпителиоцитов с субэпителиального коллагенового слоя. Хотя при КК наблюдается увеличение количества интраэпителиальных лимфоцитов, степень их увеличения не достигает таких значений, как при ЛК. Изменение клеточного состава собственной пластинки слизистой оболочки происходит в основном за счет мононуклеарной инфильтрации, а в редких случаях за счет изменений, сходных с ВЗК – обнаруживается активный воспалительный процесс в криптах с возможным формированием крипт-абсцессов.
Согласно Европейскому Консенсусу по Гистопатологии Воспалительных Заболеваний Кишечника, на правильно ориентированных биопсийных материалах толщина коллагенового тяжа должна превышать 10 мм (тогда как в норме это значение не превышает 3 мм) (гистологические срезы должны быть выполнены строго перпендикулярно поверхности слизистой оболочки [20]).
В большинстве случаев диагноз без затруднений может быть поставлен при окраске препаратов гематоксилинэозином. В сомнительных случаях может потребоваться окраска гистологических препаратов по Ван Гизону или ИГХ-окрашивание с АТ к тенасцину, который синтезируется субэпителиальными миофибробластами и отсутствует в слизистой оболочке в норме [28] (Рис.3 и 4).
Дифференциальный диагноз
Были опубликованы ряд случаев, когда у пациентов были клинические черты микроскопического колита, но для постановки диагноза не «выполнялись» все морфологические критерии лимфоцитарного или коллагенового колита. В этих случаях, в собственной пластинке слизистой наблюдается воспалительная инфильтрация, а расположение коллагеновых волокон отличается от нормы, но их толщина не достигает 10 μм, а увеличение количества ИЭЛ не достигает 20 клеток на 100 эпителиальных клеток.
В связи с этим были предложены следующие термины, которые отражают изменения в гистологической картине, но не отражают клинические различия: пограничный ЛК [29], частичный МК [1, 10], МК неуточненный [30] и неполный ЛК [31]. Атипичные формы до сих пор остаются спорными и не являются общепринятыми [32]. Кроме того, в ряде случаев этим больным клинически был установлен диагноз синдрома раздраженного кишечника.
Генетические факторы
Хотя в ряде случаев наблюдается семейная предрасположенность, точная роль генетических факторов остается еще не определенной. [35, 36]. В ходе исследований было показано наличие связи заболеваемости МК и обнаружением у пациентов HLA-DQ2 или DQ1/3МК локусов комплекса гистосовместимости 2 класса. Установлено, что по сравнению с контрольной группой, МК встречается чаще при идентификации DR3DQ2 гаплотипа или TNF2 аллелей. [37]. К тому же предполагается наличие связи между различными вариациями генов металлопротеиназ-9 и коллагеновым колитом [38]. В отличие от болезни Крона, не был установлен функциональный полиморфизм нуклеотидсвязывающего домен-содержащего белка 2 и набора каспаз, содержащих протеин 15 (гены NOD2/CARD15).
Барьерная функция эпителия
Еще одним возможным звеном в патогенезе МК является нарушение барьерной функции эпителия, что приводит к увеличению проницаемости слизистой оболочки для антигенов и бактериальных агентов. Таким образом, происходит стимуляция и поддержания воспалительного процесса. В ходе экспериментов в биопсийном материале толстой кишки даже в стадию ремиссии наблюдается значительное нарушение барьерной функции слизистой оболочки, проявляющееся повышенной проницаемостью для непатогенных бактерий. Данная дисфункция сохраняется, несмотря на клинически эффективные краткосрочные курсы лечения буденофальком. [40]. По данным Tagkalidis и его коллег при КК наблюдается снижение экспрессии Е-кадгерина и образования межклеточных соединений zonula occludens (в норме индуцируемые интерферономгамма), что свидетельствует об изменении барьерной функции эпителия. Burgel и другие отметили снижение синтеза клаудина-4 и окклудина – белков, участвующих в формировании плотных контактов в эпителиальных тканях. Эти данные коррелируют со сведениями о снижении эпителиальной резистентности, что проявляется увеличением парацеллюлярной проницаемости.
Иммунология
CD8+ T-лимфоциты превалируют как в эпителиальном слое, так и в собственной пластинке слизистой, при этом наблюдается увеличение соотношения Ki67 + и CD45RO+CD8+ Т-лимфоцитов, а CD4+ Т-лимфоциты сравнительно редко встречаются в собственной пластинке. [45].
«Цитокиновый профиль» представляет собой преимущественное увеличение Th1-цитокинов слизистой и ИНФ-гамма при КК, а при ЛК – ФНО-альфа. Также увеличивается количество ИЛ-8 и ИЛ-15 [41, 46]. Более поздние исследования в области иммунологии показали комбинированное увеличение Th17/Nc17 и Th1/Tc1 цитокинов. Уровни матричной РНК ИНФ-гамма, ИЛ-12, ИЛ-17А, ИЛ21 И ИЛ-22 значительно выше у пациентов с МК (по сравнению с контрольной группой), кроме того наблюдается прямая зависимость между степенью активации мРНК и степенью активности клинических проявлений. Значительное увеличение ИЛ-21 и ФНО-альфа отмечено как при КК, так и при ЛК [47].
Факторы риска
Лекарственные препараты
Предполагается, что употребление некоторых лекарственных препаратов можно рассматривать в качестве триггерного фактора при развитии микроскопического колита. [48].
Beaugerie и Pardi [49] была предположена шкала балльной оценки с различной степени достоверности участия того или иного препарата в развитии колита.
К препаратам, с высокой степенью вероятности «запускающими» МК были отнесены акарбоза, аспирин, цикло-3форт, лансопразол, НПВС, ранитидин, серталин и тиклопидин. В недавно опубликованных обзорных статьях, двумя препаратами, которые с наибольшей вероятность могут рассматривать в качестве триггерных факторов для МК являются ингибиторы протонной помпы и нестероидные противовоспалительные средства.
Некоторые ученые озадачены тем фактом, что до сих пор отсутствует такое понятие как лекарственно-ассоциированный микроскопический колит. [50]. У большинства лекарственных препаратов, рассматриваемых в качестве триггерных факторов микроскопического колита, одним из побочных эффектов является развитие диареи. [51].
Чем чаще проводить колоноскопию со взятием биопсий у пациентов с лекарственно-ассоциированной диареей, тем чаще будет устанавливаться диагноз МК, тогда как не всегда препараты, вызвавшиеся диарею можно рассматривать в качестве триггера. Поэтому, нельзя рассматривать лекарственный препарат как причину развития МК основываясь только на клинических данных.
Курение
По данным исследований, развитие заболевание у курильщиков начинается раньше, чем у некурящих людей (медиана составляет 14 лет). Курение является равноправным фактором риска для мужчин и женщин. [52-54].
Лечение
Основной целью лечения являются достижение клинической ремиссии, а также улучшение качества жизни пациентов. [13]. Является ли необходимым достижение гистологической ремиссии в настоящий момент не известно.
До начала медикаментозной терапии, всегда необходимо исключать возможность развития лекарственно-ассоциированного МК – особое внимание следует обратить на препараты, которые с высокой долей вероятности могут стать причинным фактором развития МК. [49]. В этих случаях уже отказ от приема данных препаратов может привести к исчезновению симптомов. Может быть также рассмотрен вопрос об отказе от курения, но доказательная база в настоящее время все еще слаба. Пациентам рекомендуется вести дневник, в котором они будут регистрировать стул до начала лечения и во время него.
Доказанной эффективностью обладает будесонид – местный кортикостероид, который активно метаболизируется в печени и практически не оказывает системного действия. При проведении мета-анализа, будесонид показал высокую эффективность: процент пациентов, положительно ответивших на лечение, был выше 80; препарат также хорошо подходит для индукции и поддержания ремиссии (количество пациентов, нуждающихся в поддерживающей терапии среди больных с КК достигало 2 пациентов, а при ЛК – 3).
При краткосрочном курсе терапии или при использовании препарата в качестве поддерживающей терапии, его отмена с высокой вероятностью приводит к развитию рецидива (60% случаев). [5,11].
В настоящее время нет других препаратов, обладающих доказательной базой. При микроскопическом колите часто используют антидиарейные препараты, такие как лоперамид, хотя фактически не было ни одного рандомизированного контролируемого исследования в отношении данного препарата. Однако клинический опыт показывает клиническое улучшение у некоторых пациентов. [8, 57]. Как бы то ни было, очень редко возможно достижение долгосрочной ремиссии, а воздействие на воспалительный процесс в кишечники – маловероятно.
Таким образом, в зависимости от тяжести течения антидиарейные препараты могут быть использованы в качестве монотерапии или в сочетании с другими видами лечения.
Эффективность преднизолона оценивалась в основном в ретроспективно. [8, 57]. В последних популяционных исследованиях было показано, что будесонид по сравнению с преднизолоном с большей частотой приводит к «полному ответу» (82,5% и 52,9% соответственно). Кроме того, рецидив развивался чаще у пациентов, лечившихся преднизолоном. [58]. Поэтому преднизолон не имеет никакого значения для пациентов, если они резистенты к терапии будесонидом.
Клиническая и гистологическая ремиссия была достигнута у всех 7 пациентов, получавших салицилат висмута по сравнению с контрольной группой плацебо-контролируемых пациентов [59]. Для определения значения висмута в терапии МК необходимо проведение более крупных исследований.
Недавние рандомизированные контролируемые исследования, показывающие, что достижение ремиссии при назначении месалазина пациентам с КК сопоставимо с плацебо, указывают на то, что не следует начинать лечение пациентов с данного препарата. [55].
Несмотря на тот факт, что данные ограничены, иммуноспупрессивная терапия может быть рассмотрена у пациентов с тяжелым течением, которые проявляют резистентность или непереносимость терапии будесонидом. Согласно результатам, предполагается, что пациенты с МК в течение 4 недель достигают клинической ремиссии при назначении индукционной терапии будесонидом в дозе 9 мг в сутки или поддерживающей терапии в дозе 6 мг в сутки.
Около 10-20% пациентов проявляют резистентность при краткосрочном лечении будесонидом; именно они и являются кандидатами для имунносупрессивной терапии [12, 55]. Процент пациентов, проявляющих резистентность к будесониду или его непереносимость при длительной поддерживающей терапии, нигде не опубликован.
На сегодняшний день можно найти несколько клинических публикаций, указывающих на благоприятный эффект у некоторых пациентов с КК при использовании ингибиторов ФНО-альфа (инфликсимаб, адалимумаб).
Схемы лечения и дозы соответствуют таковым при классическом течении ВЗК [60, 62]. Часто пациенты, резистентные к терапии будесонидом, длительно получали неэффективное лечение. Хронически активное заболевание с высокой частотой водянистого стула нередко «привязывает» пациента к туалету, тем самым значительно снижая качество его жизни. Но несмотря ни на что, начало биологической терапии всегда должно рассматриваться индивидуально, принимая во внимание возраст больного и наличие сопутствующих заболеваний. Чтобы избежать серьезных побочных эффектов, необходимо тщательно взвешивать риск и пользу. Опыт применения биологических препаратов ограничен, а данные по длительному приему ингибиторов ФНО-альфа тоже отсутствуют.
Азатиоприн или меркаптопурин были протестированы на небольшой группе пациентов (9 человек) со стероидозависимым или резистентным КК. Лечение дало 89% положительных ответов и стероидощадящий эффект [63]. В крупных ретроспективных мультицентровых исследованиях, 28% пациентов, принимающих азатиоприн достигли ремиссии в течение 57 месяцев, однако у большинства пациентов препарат был отменен в связи с его непереносимостью. 13 из 31 пациентов, которые не могли продолжать лечение азатиоприном, начали получать меркаптопурин, и 6 из них (48%) восстановили клиническую ремиссию, в результате чего общее количество положительных ответов достигло 41%. [64]. Эти данные указывают на то, что тиопурины могут быть использованы в первую очередь в качестве поддерживающей терапии при хроническом активном МК, но проспективные рандомизированные клинические исследования не только ожидаемы, но и необходимы.
При ретроспективном исследовании случаев прием метотрексата показал хороший эффект у пациентов, ранее не получающих терапию будесонидом [65].
Однако, анализ недавней серии случаев показал, что 9 больных, непереносящих терапию будесонидом или резистентные к ней, получали метотрексат в дозе 15–25 мг/нед в течение 12 недель подкожно. Но ни у одного из этих пациентов не была достигнута ремиссия, более того, у четверых из них были показания для отмены метотрексата. [65]. Эти данные весьма противоречивы и проведение дальнейших исследований необходимо.
На основе имеющихся в настоящее время доказательств, Европейской группой по МК был предложен алгоритм ведения пациентов с микроскопическим колитом.
Согласно данному алгоритму назначение антидиарейных препаратов и/ или холестероламина может быть оправдано только в случаях легкого течения. Тем не менее, при активной форме заболевания лечение стоит начинать с короткого курса будесонидо (6–8 недель). У пациентов, чувствительных к такой терапии, будесонид в дальнейшем может быть использован при рецидиве заболевания в качестве интермитиррующей терапии или непрерывной низкодозированной поддерживающей терапии, целью которой является определение самой низкой дозы, позволяющей достичь клиническую ремиссию.
В случаях МК средней тяжести, когда отсутствует положительная динамика при приеме будесонида, возможно назначение холестероламина, препаратов бисмута или лоперамида в виде монотерапии или комбинированно.
Заключение
Появившиеся в последнее время данные четко указывают на тот факт, что микроскопический колит становится распространенным заболеванием, поэтому как врачи, так и морфологи должны быть осведомлены о нем. У всех пациентов при наличии хронической диареи должна быть проведена колоноскопия со взятием материала для гистологического ния микроскопического колита, причем особое внимание следует уделять пациентам пожилого возраста.
Предполагается, что новые исследования должны быть нацелены не только на изучение заболеваемости – особое внимание следует уделять возможным провоцирующим факторам, таким как прием лекарственных препаратов, инфекционные заболевания, режим питания. В связи с доминированием женщин среди пациентов, необходимо также рассмотреть предположение о патогенетической роли некоторых гормонов или же просто отнести заболевание к аутоиммунным, поскольку женщины более склонных к их развитию. Масштабные генетические исследования нацелены на выявление генов, ассоциированных с МК, и особое внимание уделяют обнаружению генов предрасположенности. Хотя большинство больных положительно реагируют на терапию будесонидом, все же есть определенная группа пациентов, резистентных к такому лечению.
Углубление знаний в области иммунологических процессов может стать ключом для разработки новых стратегий лечения.







Комментировать