Симптоматическое лечение миастении – использование антихолинэстеразных препаратов
Антихолинэстеразные препараты (АХЭП) применяют при глазной и при генерализованной форме миастении. Это наиболее применяемые при данном заболевании класс препаратов. Их механизм действия связан с блокадой фермента холинэстеразы в синаптической щели. В результате происходит «пролонгация» воздействия молекулы ацетилхолина на холинорецепторы постсинаптической мембраны.
Наиболее широко применяют Пиридостигмина бромид в виде таблеток по 60 мг. Лечение обычно начинают с 30 — 60 мг каждые 8 ч. Дозу увеличивают поэтапно в зависимости от состояния пациента. Максимальная доза — 60 — 120 мг каждые 4 ч.
К самым частым побочным эффектам относятся гастроинтестинальные нарушения: абдоминальная боль, диарея, мышечные фасцикуляции. В высоких дозах способен спровоцировать холинергический кризис.
Иммуномодулирующая терапия.
Глюкокортикоиды относятся к препаратам первой линии модулирующих средств при миастении. Глюкокортикоиды широко используют в мире из-за высокой эффективности, относительной дешевизны, относительной безопасности. Механизм иммуномодулирующего влияния этого класса препаратов до конца не ясен.
Побочные действия кортикостероидов хорошо известны и имеют четкий дозозависимый эффект.
Назначать терапию следует с 10 — 25 мг преднизолона через сутки, постепенно увеличивая дозу (по 10 мг прием в неделю) до достижения целевой дозы 60 — 80 мг (в один прием через день). Можно использовать метилпреднизолон с соответствующим пересчетом дозы: 5 мг преднизолона = 4 мг метилпреднизолона.

При тяжелом состоянии больного, кортикостероиды следует применять сразу с высоких доз ежедневно (наряду с краткосрочной терапией — плазмаферез или введение иммуноглобулина внутривенно) до стабилизации состояния. После достижения ремиссии (обычно через 4 — 16 недель) дозу кортикостероидов начинают постепенно снижать к поддерживающий.
Азатиоприн — пуриновый аналог, ингибирующий синтез нуклеиновых кислот (ДНК и РНК). Первично воздействует на пролиферирующие лимфоциты, индуцирует Т и В-лимфопению.
Начинать необходимо с дозы в 50 мг / сутки, внутрь под контролем клинического анализа крови и ф-и печени (в начале терапии эти анализы следует сдавать еженедельно). В том случае, когда пациент отлично переносит препарат и нет негативных результатов анализов, то через 7 — 14 дней дозировку повышают на 50 мг каждые 7 — 14 дней до достижения max дозы 2 — 3 мг / кг массы тела в сутки (в среднем — около 150 — 200 мг / сут.).
Препарат хорошо переносится и имеет незначительные побочные эффекты (тошнота, кожные высыпания, лимфопения, панцитопения, панкреатит и др.).
Следует помнить, что начало терапевтического эффекта может быть отсрочено до 4 — 12 месяцев, а максимальный терапевтический эффект развивается обычно через 6 — 24 месяца.
Азатиоприн следует использовать как дополнительный препарат (к преднизолону) для пациентов, которые длительное время находятся на иммуносупрессивной терапии. Это позволяет не увеличивать дозу кортикостероидов и поддерживать их эффективность («спаррингэффект») .
Циклоспорин — препарат со сложным механизмом действия, конечным результатом является ингибирование активации и пролиферации Т-клеток.
Развитие побочных реакций (головная боль, артериальная гипертензия, почечная недостаточность, инсомния, тремор и др.) имеет дозозависимый характер.
Циклоспорин применяют нечасто. Учитывая спектр и характер побочных реакций, его назначают лишь пациентам, нечувствительным к азатиоприну (в сочетании с глюкокортикоидами).
В начале терапии назначают в дозе 3 — 5 мг / кг массы тела в сутки, в два приема. Уровень циклоспорина в крови необходимо измерять один раз в месяц. Целевой уровень — 200-300 мкг / мл. Одновременно с этим следует контролировать концентрацию электролитов в плазме крови, магния и ф-ю почек (количество креатинина в сыворотке крови не должно превышать показатели более чем в 1,5 раза в начала лечения).
При лечении циклоспорином необходимо избегать приема НПВС и калийсберегающих диуретиков. Если пациент одновременно с циклоспорином принимает кортикостероиды, то их дозировку удается понизить, но полная отмена преднизолона зачастую невозможна.
Микофенолат мофетила — современный препарат, основной механизм действия – ингибирование репликации В- и Т-клеток. К главным побочным эффектам относятся: диарея, головная боль, кожные реакции и др. Исследования эффективности применения данного препарата при миастении продолжаются.
Согласно данных ретроспективного анализа, показана эффективность препарата в стандартных дозах — 2000 — 3000 мг / сутки в два приема (начальная доза — 500 мг дважды в сутки, повышение дозы до 1000 мг дважды в сутки проводят через 7 — 14 дней от начала терапии).
При использовании Микофенолат мофетила ежемесячно проводят клинический анализ крови. Считается, что спектр побочных действий у данного препарата меньше, чем в циклоспорина, а эффективность их сопоставима.
Циклофосфамид применяют в качестве иммунодепрессанты при тяжелых иммунологических заболеваниях. В основе механизма действия лежит угнетение Т и В-клеток (как и других активно делящихся клеток организма).
Циклофосфамид используют редко — при неэффективности сочетанного применения кортикостероидов и азатиоприна или метотрексата, или циклоспорина.
Назначают в дозе 150-200 мг внутрь (3 — 5 мг / кг массы тела в сутки) или 250 мг / сутки при в/в введении (с дальнейшим переходом на таблетки).
Приблизительно у 50% пациентов наблюдается улучшение состояния через 1-2 месяца после начала лечебной терапии.
Употребление препарата необходимо отменить при возникновении выраженных побочных реакций.
Метотрексат ингибирует процесс деления активно делящихся клеток (в том числе Т и В-клеток). Побочные эффекты: миелосупрессия, мукозиты, тошнота, алопеция, цистит, тошнота и др.
Метотрексат следует использовать как препарат резерва (при неэффективности терапии первого ряда — глюкокортикоидов и азатиоприна).
Препарат применяют в/м по 0,02 — 0,08 мг дважды в неделю на протяжении 2 — 4 недель или в/в по 25 — 50 мг дважды в неделю.
Ритуксимаб — моноклональное антитело с высоким сродством к антигенам клеток CD20. К основным побочным действиям относят лихорадку, кожные высыпания, тошноту, редко – бронхоспазм и др. Имеются сообщения о эффективности ритуксимаб в дозе 375 мг / м2 в виде инфузий 1 раз в неделю в течение 4 недель, интервал между курсами лечения — 6 мес. многоцентровые исследования эффективности ритуксимаба при миастении продолжаются.
Краткосрочная терапия – плазмаферез и иммуноглобулин внутривенно.
В основе механизма действия внутривенного введения иммуноглобулина лежит нейтрализация активированного комплемента, аутоантител, модуляция провоспалительных цитокинов и др. К побочным действиям относят: эритематозные кожные высыпания, головную боль, миалгии, лихорадку и др.
Иммуноглобулин используют в дозе 2 г / кг массы тела в течение 3 — 5 дней (обычно применяют дозу 0,4 г / кг массы тела 1 раз в сутки на протяжении 5 дней).
В результате проведения плазмафереза из плазмы крови больных, удаляются аутоантитела, иммунные комплексы, воспалительные медиаторы.
Плазмаферез при миастении проводят коротким курсом (4 — 5 сеансов): при тяжелых формах болезни, при подготовке к оперативному лечению, при быстром темпе нарастания симптоматики.
Иммуноглобулин внутривенно при миастении используют по тем же показаниям, что и плазмаферез. Считается, что эффективность ЭТИХ методов одинаковая.
Хирургическое лечение — тимэктомия
Тимэктомия — один из наиболее часто применяемых методов в лечении миастении.
Тимэктомия обычно проводят при наличии доказанной тимомы, а также пациентам в возрасте до 50 — 60 лет с генерализованной миастенией (без тимомы) при обнаружении в них AchR-Ab. При генерализованной форме миастении пациентам, в крови которых не обнаруживаются AchR-Ab, но имеются MuSK-Ab, проводит тимэктомия нецелесообразно.
Клинический эффект после тимэктомии наступает через 6 — 12 месяцев.
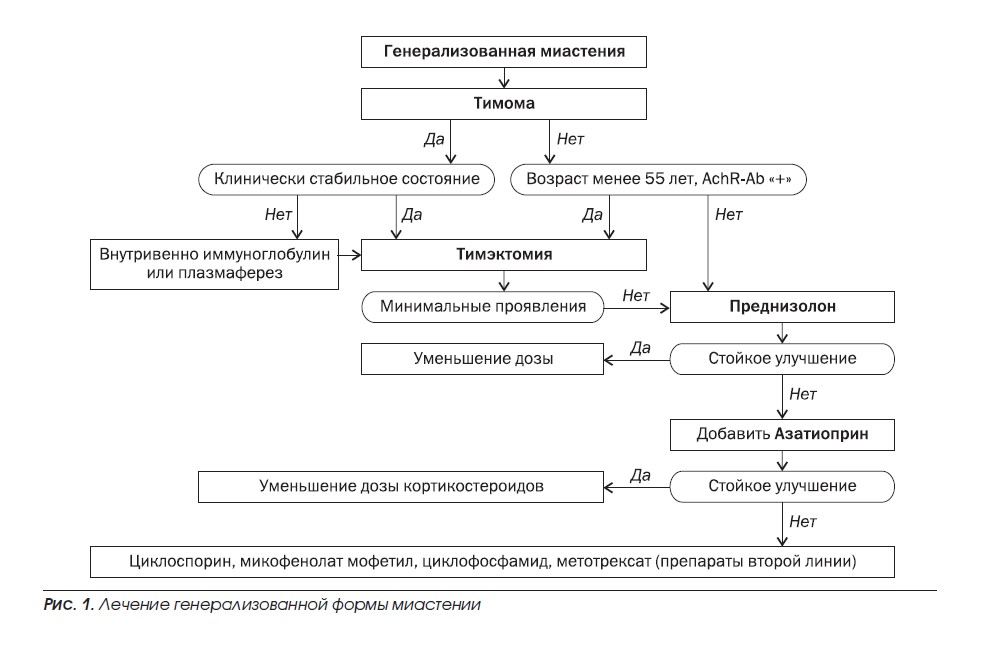
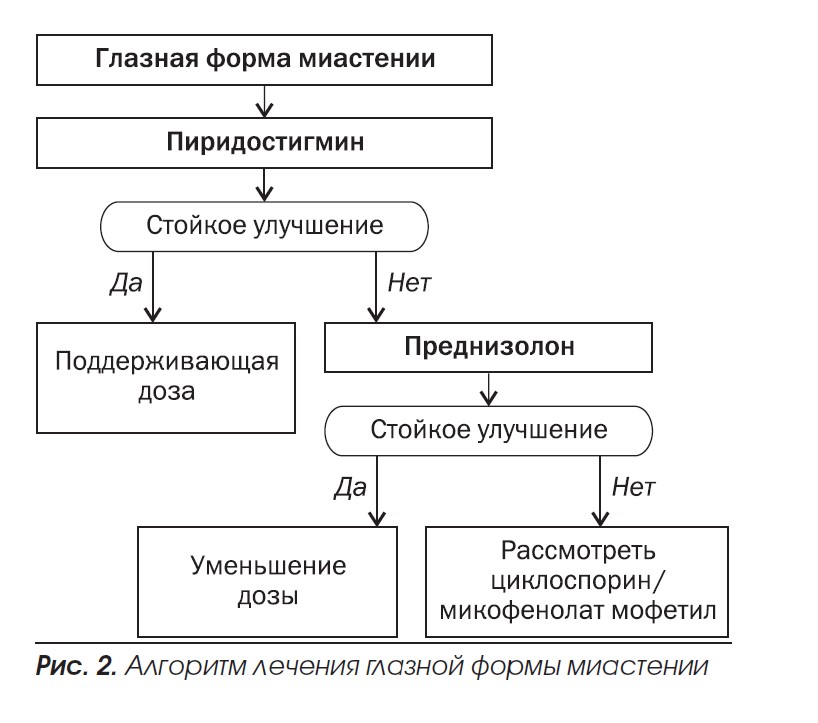
Алгоритм лечения миастении согласно рекомендациям Европейской федерации неврологических сообществ приведен на рис. 1, 2 .
Таким образом, в последние годы получено много данных, касающихся патогенеза миастении.
Современные методы исследования позволяют не только диагностировать, но и прогнозировать характер течения заболевания.
Понимание сути заболевания, основных звеньев его патогенеза, знание арсенала современных терапевтических агентов и алгоритмов их применения позволяют улучшить качество оказания помощи больным с миастенией.
Список литературы находится в редакции
В. М. ШКОЛЬНИК, А. И. КАЛЬБУС,
А. Н. БАРАНЕНКО, А. В. ПОГОРЕЛОВ
ГУ «Днепропетровская медицинская академия МЗ Украины»













Комментировать