Мезотелиома брюшины – описание. Гистологические типы мезотелиомы. Дифференциальная диагностика мезотелиомы.
А.Г. Абдуллаев1, К.И. Жорданиа1, М.И. Давыдов1, Б.Е. Полоцкий1, М.М. Давыдов1, В.И. Краснопольский2, В.А. Петрухин2, А.А. Попов2, О.В. Манчиските2 1 ФГБНУ РОНЦ им. Н.Н. Блохина РАМН, Москва 2 ФГБУ Московский областной НИИ акушерства и гинекологии, Москва
Мезотелиома брюшины — редкая злокачественная опухоль, исходящая из мезотелия. Впервые была описана в 1908 г. Miller и Wynn, частота встречаемости в мире — один-два случая на миллион, предполагаемый уровень заболеваемости — 200–400 пациентов ежегодно. При этом поражение плевры встречается примерно в 3 раза чаще, чем брюшины [9].
Клиническая картина перитонеальной мезотелиомы, как правило, не имеет специфических характеристик, и часто на ранних стадиях у пациентов отсутствуют симптомы болезни. В последующем жалобы складываются в зависимости от локализации наиболее крупных очагов опухоли, которые могут стать причиной развития синдрома компрессии полого органа, механического блока желчных протоков или мочеточника. Другой частый симптом мезотелиомы — опухолевый асцит, этиология которого может быть не распознана в течение длительного времени.
Этот факт имеет несколько причин: во-первых, мезотелиома брюшины — редкая патология, и у большинства врачей нет опыта диагностики этого заболевания; во-вторых, при биопсии необходимо получать значимое коли- чество клеток опухоли, что не всегда просто; в-третьих, немаловажную роль в диагностике играют правильная интерпретация гистологической картины и возможность провести иммуногистохимический анализ.
Согласно классификации ВОЗ выделяют следующие гистологические типы мезотелиомы:
Злокачественная:
1) Эпителиоидный — 75%;
2) Тубуло-папилярный солидный — 13%;
3) Саркоматоидный — 6%;
4) Бифазный — 6%.
Кроме того, описаны перитонеальные мезотелиомы пограничной злокачественности, которые встречаются крайне редко. Это высокодифференцированный сосочковый и мультикистозный варианты [12]. Считается, что гистологический тип опухоли — один из значимых прогностических факторов перитонеальной мезотелиомы. При этом у пациентов с высокодифференцированной сосочковой и мультикистозной мезотелиомой, а также с эпителиоидным типом мезотелиомы более благоприятный прогноз в отличие от саркомотоидного и бифазного гистологических типов [8].
При гистологическом исследовании у морфолога нередко возникают затруднения в интерпретации микроскопической картины, и опухоль может быть расценена как вторич- ное поражение или первичный серозный рак брюшины.
Для дифференциальной диагностики мезотелиомы всегда требуется проведение ИГХ. Типичным для мезотелиомы будет выявление в клетках опухоли синхронной экспрессии виментина, тромбомодулина, кальретинина, кальдесмона, D2–40 и цитокератинов, при отсутствии экспрессии других эпителиальных маркеров (РЭА, В72.3, CD15, BerEP4). В свою очередь, серозный рак независимо от органной принадлежности характеризуется прямо противоположным иммунофенотипом (В72,3+/ CD15+/BerEP4+/CA19–9+/ER+/calretinin-/ caldesmon-/thrombomodulin) [2].
На сегодняшний день не существует ни одного специфичного для мезотелиомы маркера, что диктует необходимость при диагностике мезотелиомы учитывать не только иммуногистохимические, но и свето-оптические и гистохимические данные [4]. Среди представленного спектра маркеров для диагностики мезотелиомы наиболее чувствительными считаются кальретинин и BerEP4 [6]. Сводные данные по иммунофенотипическим особенностям дифференциальной диагностики злокачественной мезотелиомы приведены в таблице 1 [2, 11, 7].
Анализ литературы последних лет показывает, что комбинированное лечение с выполнением оптимальных циторедуктивных хирургических вмешательств в сочетании с гипертермической внутриполостной химиотерапией значительно улучшает показатели выживаемости больных мезотелиомой брюшины [9, 10]. Другая важная проблема, с которой сталкивается врач при лечении больных мезотелиомой брюшины, — попытка сохранить фертильность у молодых пациенток, не имевших беременностей.
Здесь важно выяснить причину — первичное или вторичное бесплодие. Часто встречается ситуация, при которой исходно поводом обращения пациентки к врачу было бесплодие, которое послужило причиной проведения диагностической лапароскопии, где выявляется интраперитонеальная диссеминация и/или асцит, обусловленные мезотелиомой. Последующее ведение пациентки подразумевает выполнение циторедуктивной операции в сочетании с интраперитонеальной химиотерапией, при этом врач, как правило, не может до проведения лечения стимулировать яичники для последующего ЭКО, а после операции это становится невозможным.
Научные публикации, касающиеся решения этой проблемы, редки. Нас заинтересовали те из них, где описаны случаи возникновения беременности у пациенток с мезотелиомой или псевдомиксомой (другая интраперитонеально распространенная опухоль) после проведенных циторедуктивных операций в сочетании c HIPEC (hyperthermic intraperitoneal chemotherapy).
Так, в одном из наблюдений пациентке была выполнена оптимальная (CC0) циторедуктивная операция в сочетании с гипертермической внутрибрюшной химиотерапией, затем через 14 месяцев после лечения возникла незапланированная беременность [5].
Отдельный интерес представляют статьи, где беременность возникала с помощью ВРТ (вспомогательные репродуктивные технологии). При этом либо до, либо после циторедуктивной операции с гиперетермической и траперитонеальной химиотерапией проводили стимуляцию яичников с последующим оплодотворением in vitro [1, 3].
Все авторы сходятся во мнении, что представленные случаи встречаются казуистически редко, и к вопросу сохранения фертильности, особенно с использованием ВРТ и только у пациенток с относительно благоприятным прогнозом заболевания (оптимальная циторедуктивная операция, опухоли пограничной злокачественности), следует подходить с большой осторожностью.
Однако, анализируя данные мировой литературы, мы ни разу не встретили описания наблюдений беременности на фоне клинически проявляющейся мезотелиомы брюшины с отсевами в малом тазу и по диафрагме. Именно такой клинический случай мы и хотели бы представить.
Пациентка М., 39 лет. Анамнез: в январе 2000 г. в онкодиспансере г. Чебоксары была выполнена диагностическая лапароскопия, при этом выявлена диссеминация по брюшине, установлен диагноз — рак яичников. Проведены два курса химиотерапии по схеме: циклофосфан+цисплатин. В последующем лечение не получала. Эффект не был оценен.
В марте 2014 г., спустя 14 лет, установлена первая беременность — две недели. В апреле 2014 г. в г. Обнинске была выполнена лапароскопия, при которой выявлена интраперитонеальная диссеминация с поражением брюшины малого таза, большого сальника, латеральных каналов, правого купола диафрагмы. Произведена биопсия. Пациентка обратилась в ФГБНУ РОНЦ им. Н.Н. Блохина, где при пересмотре гистологических препаратов+ИГХ (№ 18248/14) был установлен диагноз высокодифференцированной папиллярной мезотелиомы.
Учитывая торпидный характер течения болезни, согласие и желание больной, консилиумом врачей было принято решение о сохранении беременности при условии тщательного динамического УЗИ-контроля с определением последующей лечебной тактики после родоразрешения. В течение всей беременности пациентке регулярно проводился УЗ-мониторинг, при котором отмечен рост опухолевых узлов в малом тазу на 20% в течение 35 недель. Однако данных за расширение ЧЛС, признаков кишечной непроходимости за время наблюдения получено не было.
УЗИ от 06.2014 г.: По капсуле правой доли печени определяются гиперэхогенные очаговые образования, неоднородные по структуре, стелющегося характера размером до 1,4 × 0,9 см и 1,1 × 5,3 см.
При ТВИ: определяются миомы размером 4,0 см в диаметре и 4,5 × 4,8 см. Сзади от матки и с двух сторон по тазовой брюшине определяются стелющиеся многоузловые объемные образования неоднородной структуры с бугристым контуром. Срединный узел разме- ром 6,0 × 4,3 см. Справа узел размером до 5,4 × 3,5 см, слева узел размером 5,5 × 4,2 × 6,9 см. Брюшина толщиной до 2,0 см. Среди опухолевых узлов определяются яичники размером: правый 3,0 × 1,9 см, левый 3,4 × 2,4 см. 30.10.2014 г.
В Московском областном научно-исследовательском институте акушерства и гинекологии на 37 неделе было произведено родоразрешение (корпоральное кесарево сечение). Извлечена живая доношенная девочка массой 2 790 грамм, рост 50 см, с оценкой по шкале Апгар 8–8 баллов.
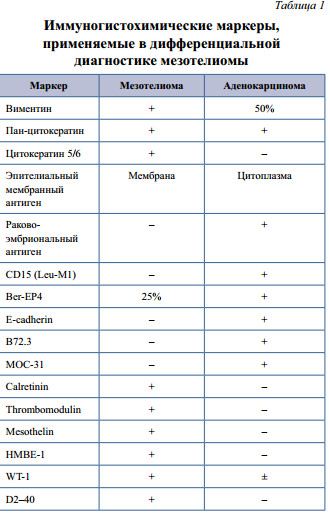
При лапаротомии в области шейки матки и в свободной части большого сальника визуализировались отсевы опухоли до 3–4 см, местами сливные (рис. 1).
21.01.2015 г. поступила в торакальное отделение ФГБНУ РОНЦ им. Н.Н. Блохина для комбинированного лечения. При осмотре: состояние удовлетворительное, кожные покровы чистые, высыпаний нет. По срединной линии передней брюшной стенке «свежий» послеоперационный рубец (лапаротомия в 10.2014 г.). Периферические лимфатические узлы (надключичные, шейные, подмышечные) пальпаторно не увеличены. Живот при пальпации мягкий, болей не отмечено.
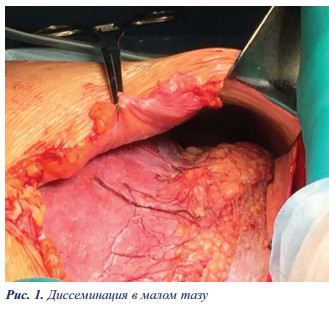
В анализах крови СА 125 — 53.44 Ед/мл (ДУ 35.0). РЭА и СА 19.9 в пределах нормы. При компьютерной томографии выявлены признаки распространенного канцероматоза с расположением наибольших опухолевых узлов в зоне правого купола диафрагмы и в малом тазу (рис. 2а, б).
26.01.2015 г. проведено комбинированное лечение. При интраоперационной ревизии в брюшной полости — умеренный асцит до 500 мл, распространенный канцероматоз, обусловленный мезотелиомой. Основная часть отсевов располагалась на правом куполе диафрагмы в виде сливной диссеминации, по брюшине латеральных каналов, отдельные отсевы опухоли определялись по брыжейке тонкой и толстой кишки, размерами от 2 до приблизительно 15 мм. Большой сальник опухолево изменен, инфильтрирован. На теле матки и ее связках, по брюшине маточно-пузырной и маточно-прямокишечной складок — тотальная сливная диссеминация с размерами отдельных узлов до 5–8 см. Яичники внешне не увеличены, расположены типично.
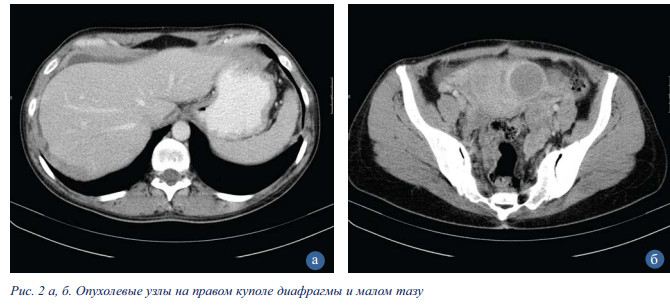
Принято решение выполнить циторедуктивную операцию (рис. 3).
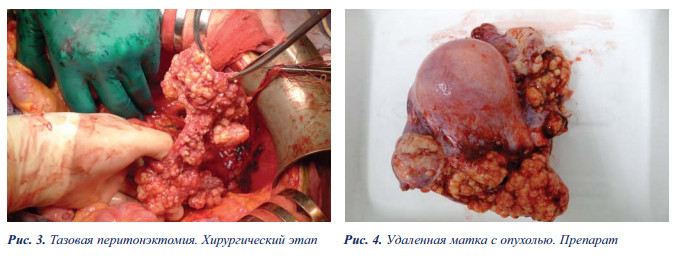

Объем хирургического вмешательства: частичная перитонэктомия (тотальная тазовая перитонэктомия); аппендэктомия; экстирпация матки с придатками; удаление большого сальника; проведена процедура гипертермической интраперитонеальной химиоперфузии аппаратом SunChip в открытом контуре при средней темпе- ратуре перфузата 43 градуса, цисплатин 100 мг, время перфузии 30 минут (рис. № 6а, б).
В послеоперационном периоде на первые-вторые сутки при УЗИ отмечалось расширение ЧЛС обеих почек до 3,1 и 3,5 см с последующим сокращением до нормы, что, вероятно, было обусловлено временем интраоперационного блока мочеточников за счет мочеточниковых катетеров и их тракции при мобилизации опухоли в малом тазу. Формирование нефростомы не потребовалось, показатели креатинина и мочевины крови сохранялись в пределах нормальных значений.
Морфологическое исследование операционного материала + ИГХ
Для верификации опухоли проведено иммуногистохимическое исследование. В опухолевых клетках определяется экспрессия цитокератина 18, кальретинина, мембранно-цитоплазматическая экспрессия СА 125, D2 — 40, НМВЕ 1, рецепторов эстрогенов, ядерная экспрессия р53, WT-1. В опухолевых клетках не определяется экспрессия рецепторов прогестерона. Индекс пролиферации опухолевых клеток (индекс мечения Ki — 67) — 40%.
Заключение: с учетом морфологической картины и характера экспрессии маркеров в данном случае имеет место высокодифференцированная папиллярная мезотелиома (рис. 7).
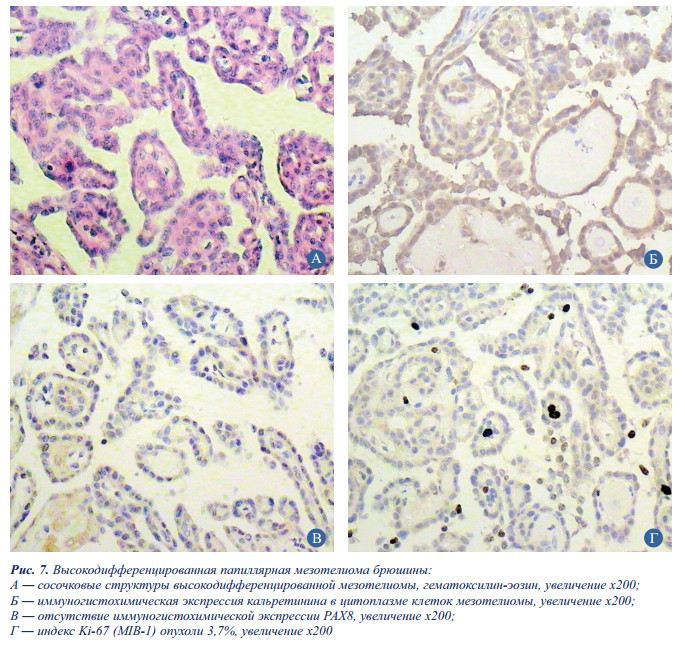
При микроскопическом исследовании опухоль брюшины демонстрировала типичные для папиллярной мезотелиомы цитоморфологические признаки: наличие высокодифференцированной сосочковой архитектуры, слабую клеточную и ядерную атипию, отсутствие типичного для серозного рака и диффузной мезотелиомы инвазивного роста, редкие митозы. Клетки опухоли диффузно и с разной степенью выраженности экспрессировали кальретинин, мезотелин и подопланин. Экспрессия BerEP4, рецепторов эстрогенов и транскрипционного фактора РАХ8, регулирующего дифференцировку тканей-производных Мюллерова протока, в клетках опухоли отсутствовала, что подтвердило диагноз высокодифференцированной папиллярной мезотелиомы.
Индекс пролиферативной активности опухоли составил 3,7%.
Заключение
Приведенное клиническое наблюдение демонстрирует, на наш взгляд, возможность изменить в исключительных случаях подходы в лечении пациентов с мезотелиомой. Для этого необходимо владеть полной информацией о болезни: анамнез, гистологический тип опухоли, ее распространенность, возможность развития ближайших осложнений при росте опухоли, возможность выполнения оптимальной циторедуктивной операции при первичном обследовании и при динамическом наблюдении.
Мы не считаем возможным обсуждать вопросы о дооперационной стимуляции яичников с целью получения ооцитов, так как исследований, оценивающих влияние используемых гормонов на поведение опухоли, мы не нашли. Кроме того, при планировании лечения у больных мезотелиомой считаем правильным изначально добиваться максимальной циторедукции при хирургическом вмешательстве, что часто требует экстирпации матки с придатками, органных резекций и внутрибрюшной химиотерапии. Такое лечение, конечно, лишает надежды больную на сохранение фертильности, однако дает больше шансов на лучшую выживаемость. Вместе с тем у молодых пациенток при невыраженной диссеминации и при пограничной злокачественности опухоли, при желании больной, можно рассмотреть вопрос о сохранении при- датков, если при этом будет выполнена полная циторедуктивная операция.
ЛИТЕРАТУРА
- . «Fertility preservation in a patient with benign multicystic Al-Safi Z.A.1, Edil B.H., Post M.D., Pearlman N.W., Alvero R peritoneal mesothelioma», J Surg Oncol. 2014 Sep; 110(4):372–4.
- Undifferentiated tumor: true identity by immunohistochemistry // Arch Pathol Lab Med — Bahrami A., Luan D.T., Jae Y.R. 2008; 132:326–348.
- Campanati RG1, Hanan B1, de Souza SS2, Gomes da Silva RPregnancy after Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy in Pseudomyxoma Peritonei» Case Rep Surg. 2014; 2014:694912.
- The peritoneum // Mills SE (Ed.): Sternberg’s diagnostic surgical pathology, 5th ed. Lippincott Clement P.B., Young R.H. Williams & Wilkins — 2010. — P. 2393–2412.
- «Spontaneous pregnancy following cytoreduction with peritonectomy and Kyser K1, Bidus M.A., Rodriguez M., Rose G.S. hyperthermic intraperitoneal chemotherapy», Elkas JC. Gynecol Oncol. 2006 Jan;100(1):198–200. Epub 2005 Sep 27.
- et al. Peritoneal tumours // Tavassoli FA, Devilee P (Eds.): World Health Organization Mok S.C., Schorge J.O., Weich W.R. Classifi cation of tumours. Pathology & genetics of tumours of breast and female genital organs. IARC Press — Lyon. — 2003. — P. 197–202.
- Application of immunohistochemistry in the diagnosis of epithelioid mesothelioma: review and update // Hum Ordonez N. Pathol — 2013; 44:1–19.
- Malignant mesothelioma / B.W. Robinson, A.W. Musk, R.A. Lake // Lancet. — 2005. — Vol.366. — Robinson, B.W. P. 397–408.
- Cytoreductive surgery (CRS)and hyperthermic Tan G.H., Cheung M., Chanyaputhipong J., Soo K.C., Teo M.C. intraperitoneal chemotherapy (HIPEC) for peritoneal mesothelioma. Ann Acad Med Singapore. 2013 Jun; 42(6):291–6.
- Current concepts in the evaluation and treatment of patients with diffuse Turner K., Varghese S., Alexander H.R. / malignant peritoneal mesothelioma/J Natl Compr Canc Netw. 2012 Jan 1;10(1):49–57.
- (Eds.): Enzinger and Weiss’s Soft Tissue Tumors, 5th ed. Mosby Elsevier. — 2008 — Weiss S.W., Goldblum J.R. P. 789–817.
- , International Histological Classifi Weiss S.W. cation of Tumours: Histological typing of soft tissue tumours. — 2nd ed. / World Health Organization. — Berlin: Springer-Verlag, 1994.
Источник: Журнал «Онкогинекология» № 1, 2015












Комментировать