Общие положения. Естественное течение болезни. Варианты рецидивирующего свистящего дыхания у детей. Детерминирующие факторы. Факторы окружающей среды и образ жизни.
Общие положения
БА относится к наиболее частым хроническим заболеваниям детского возраста во всех развитых странах. Частота БА наиболее высока у детей с семейной предрасположенностью к атопии. Симптомы и обострения БА провоцируются многочисленными триггерами, включая вирусные инфекции, аллергены, физическую нагрузку, табачный дым и другие поллютанты. У детей рецидивирующие симптомы бронхиальной обструкции (прежде всего свистящее дыхание и кашель) нередко возникают уже в первые месяцы жизни, как правило, на фоне инфекций нижних дыхательных путей, но клинический диагноз БА достоверно может быть установлен обычно лишь после 5 лет, поэтому ранняя диагностика, мониторинг и лечение БА приобретают особое значение.
К моменту подготовки Консенсуса PRACTALL существовало несколько национальных руководств, но отсутствовали современные международные рекомендации, которые бы фокусировались на БА у детей, хотя частота этого заболевания у детей выше, чем у взрослых. Вопросы фармакотерапии БА у детей представлены в недавно обновленном варианте GINA. Вместе с тем в этом документе представлена лишь ограниченная информация, касающаяся особенностей БА у детей (прежде всего в возрасте до 5 лет), которая не учитывает опыт детских аллергологов и пульмонологов. В отличие от взрослых пациентов выбор тактики лечения у детей до 5 лет весьма ограничен. Проблему усложняют также отсутствие данных рандомизированных контролируемых исследований у детей и трудности в применении представленных в систематических обзорах критериев для установления диагноза.
Консенсус PRACTALL основан на данных доступной литературы (до июня 2007 г.) и учитывает последние достижения современной клинической практики. В документе представлен обзор естественного течения и патофизиологии БА у детей и содержатся рекомендации по диагностике, тактике лечения и мониторингу БА. Он предназначен как для педиатров, так и для врачей общей практики стационаров и поликлиник.
Естественное течение болезни
БА у детей можно описать как повторяющиеся эпизоды бронхиальной обструкции и гиперреактивности дыхательных путей к таким провоцирующим факторам, как физическая нагрузка, контакт с аллергеном и вирусные инфекции. Однако это определение следует с осторожностью применять у детей раннего и дошкольного возраста, у которых рецидивируют приступы кашля или свистящего дыхания. Эти симптомы, широко распространенные у дошкольников, часто носят транзиторный характер и у 60% детей исчезают к школьному возрасту. Врачи должны проводить дифференциальную диагностику БА с другими заболеваниями со сходной симптоматикой, учитывая вариабельность естественного течения повторяющихся приступов свистящего дыхания у детей раннего возраста.
Ранее было предложено проводить дифференциальную диагностику между тремя вариантами рецидивирующих приступов свистящего дыхания, а недавно был описан и четвертый вариант. Следует помнить, что разграничение первого и второго вариантов возможно только ретроспективно и не используется при выборе лечения.
Варианты рецидивирующего свистящего дыхания у детей:
- Транзиторные приступы свистящего дыхания. Могут наблюдаться у детей первых 2–3 лет жизни, но после 3 лет не повторяются.
- Неатопическая бронхиальная обструкция. Возникает, как правило, на фоне вирусной инфекции и имеет тенденцию к уменьшению в старшем возрасте.
- Персистирующая БА. Обструкция сочетается со следующими факторами:
- клиническими проявлениями атопии (экзема, аллергический ринит, конъюнктивит, пищевая аллергия), эозинофилией и/или повышенным уровнем общего иммуноглобулина (Ig) E в крови;
- специфической IgE-опосредованной сенсибилизацией к пищевым аллергенам в грудном и раннем детском возрасте и к ингаляционным аллергенам в последующем;
- сенсибилизацией к ингаляционным аллергенам в возрасте до 3 лет, прежде всего при сенсибилизации и высоком уровне экспозиции бытовых аллергенов в домашних условиях;
- наличием БА у родителей.
- Тяжелая интермиттирующая обструкция. Редкие острые приступы, сочетающиеся с минимальной заболеваемостью в периоды между респираторными заболеваниями и характерными проявлениями атопии (экзема, аллергическая сенсибилизация, эозинофилия периферической крови). Частота рецидивирования приступов свистящего дыхания наиболее высока у детей первого года жизни. По данным продолжительного популяционного проспективного исследования по крайней мере один эпизод обструкции возникает в этом возрасте у 50% всех детей. У детей с рецидивирующими эпизодами обструкции повышен риск развития персистирующей БА в подростковом возрасте, а при наличии атопии выше вероятность сохранения обструкции.
Детерминирующие факторы
Генетические факторы
Результаты исследований у моно- и дизиготных близнецов наряду с ассоциациями фенотипов БА у близких родственников подтверждают генетическую основу БА. Последние исследования по скринингу генома с изучением ассоциаций генов-кандидатов позволили идентифицировать локусы, связанные с повышенным риском развития БА в определенных популяциях. Анализ влияния генетических отклонений на развитие БА и связанных с ней фенотипов свидетельствует о наличии выраженной гетерогенности и значительном влиянии факторов окружающей среды. Соответственно, у многих детей, болеющих БА, родители не имеют БА, а у многих родителей с БА дети не страдают этим заболеванием.
Половые различия в заболеваемости БА у детей пока недостаточно понятны.
Факторы окружающей среды и образ жизни
Аллергены. Контакт с аллергенами окружающей среды, прежде всего присутствующими в жилых помещениях, является фактором повышенного риска аллергической БА. Контакт с аллергенами у младенцев связан с ранним развитием сенсибилизации, а сочетание сенсибилизации с высокой экспозицией круглогодичных аллергенов дома приводит к персистированию БА и снижению показателей функции легких у детей. Клинические проявления заболевания разнообразны и определяются особенностями аллергена (присутствие в доме или вне дома, сезонные колебания концентрации и т.д.).
У грудных детей пищевая аллергия с кожными, гастроинтестинальными или респираторными симптомами встречается чаще, чем сенсибилизация к ингаляционным аллергенам. Пищевая аллергия является фактором риска развития БА у детей старше 4 лет. С возрастом симптомы ассоциируются с ингаляционными аллергенами, вначале с домашними (клещи домашней пыли, домашние животные, тараканы), а позже – с пыльцевыми и грибковыми аллергенами.
Повторный контакт с аллергеном приводит к повреждению вовлекаемых тканей, которое может сохраняться и после устранения аллергена.
Инфекция. Высказывается предположение, что экспозиция определенных вирусов (гепатита А, кори), микобактерий или паразитов может уменьшить частоту развития аллергии и БА, а легкие рецидивирующие инфекции могут обеспечить защиту от БА. Другие исследователи, наоборот, считают, что микробы могут быть причиной БА. На сегодняшний день пока нет убедительных доказательств в пользу этих предположений.
Респираторные вирусные инфекции служат наиболее частым триггером БА в детском возрасте. Риновирусы ответственны за большинство случаев обострений БА, а респираторно-синцитиальный вирус вызывает тяжелые респираторные симптомы у младенцев. Тяжелые респираторные инфекции ассоциированы с персистирующей БА у детей старшего возраста, а рецидивирующие респираторные инфекции могут утяжелять течение БА в последующем. Инфекции могут приводить к повреждению эпителия дыхательных путей, развитию воспаления и стимуляции как иммунных реакций, так и гиперреактивности дыхательных путей. После перенесенной инфекции гиперреактивность бронхов сохраняется в течение продолжительного времени. Инфекции остаются значимым триггером заболевания на протяжении всего детства и у взрослых.
В настоящее время нет доказательств того, что вакцинация в первые годы жизни изменяет риск атопии или БА. Применение антибиотиков у детей первого года жизни повышает риск развития БА, однако эти выводы нельзя признать окончательными, а рекомендации по проведению вакцинации и рациональному применению антибиотиков у детей остаются без изменений.
Табачный дым. Пассивный контакт с табачным дымом является одним из самых серьезных триггеров, вызывающих рецидивирующий кашель/свистящее дыхание или симптомы БА у детей. Табачный дым увеличивает выраженность оксидативного стресса и повышает активность воспалительного процесса как в нижних, так и в верхних дыхательных путях. Кроме того, курение матери во время беременности приводит к нарушению роста легких у плода, что ассоциировано с возникновением хрипов в раннем детском возрасте. При наличии БА курение способствует персистированию заболевания и может ухудшать ответ на лечение. Хотя табачный дым оказывает вредное воздействие в любом возрасте, его повреждающие эффекты у детей в раннем возрасте выражены в большей степени вследствие меньшего размера дыхательных путей.
Поллютанты. Помимо прямого токсического влияния на легкие, загрязняющие вещества становятся индукторами оксидативного стресса и воспаления в дыхательных путях, что может привести к развитию БА у пациентов с генетически повышенной чувствительностью к влиянию оксидантов.
Питание. Значение грудного вскармливания не вызывает сомнений, и недавно опубликованные систематические обзоры позволяют считать, что оно защищает от развития атопических заболеваний, особенно у детей с наследственной предрасположенностью к атопии. Применение для искусственного вскармливания смесей с гидролизованным белком не снижает частоту БА. Строгая диета, исключающая белки коровьего молока и куриного яйца, снижает частоту атопического дерматита у детей на первом году жизни, но не предотвращает развития БА.
В нескольких публикациях было высказано предположение о том, что такие диетические факторы, как содержание натрия, липидный баланс, уровень антиоксидантов, могут влиять на активность БА, но такие исследования трудно проконтролировать из-за сложного состава диеты на практике. Исследования связи БА с ожирением позволяют рекомендовать избегать излишнего веса и поддерживать образ жизни с соблюдением сбалансированного пищевого рациона.
По предварительным выводам некоторых исследований, обогащение рациона ω-3-полиненасыщенными жирными кислотами может снизить выраженность симптомов обструкции и в сочетании с другими мерами защиты (предотвращение контакта с клещами домашней пыли) может уменьшить вероятность атопической сенсибилизации.
Ирританты. Развитие респираторных симптомов и БА у детей может быть связано с воздействием многочисленных раздражающих агентов, таких как компоненты парфюмерных изделий, пыль и хлор (в частности, в бассейнах).
Физическая нагрузка сопровождается появлением симптомов у большинства детей с БА, а вызванный нагрузкой бронхоспазм может быть специфическим фенотипом БА. Патогенез бронхоспазма может быть связан с изменением осмолярности и/или температуры в дыхательных путях при нагрузке. Регулярные аэробные нагрузки необходимы для здорового роста ребенка, и поэтому их нельзя избегать. Более того, доказано, что сниженная физическая активность сопряжена с риском развития БА в подростковом возрасте.
Метеоусловия. Разные погодные условия, например очень высокая или низкая температура и высокая влажность, могут оказывать влияние на симптомы БА и быть причиной обострений. Полностью исключить вредное влияние метеоусловий невозможно, и поэтому родителям нужно помнить о том, что изменения погоды (например, гроза) могут быть триггерами обострения БА, и соответствующим образом изменять лечение.
Стресс. Психологические факторы, особенно хронический стресс, также могут влиять на активность БА, хотя эти данные требуют дополнительного исследования у детей. На функцию легких и активность БА у ребенка может повлиять и уровень стресса у его родителей. Стресс может приводить к обострению БА, а между БА и психологическими расстройствами существует корреляционная зависимость.
Сочетание триггеров. Одновременное или последовательное воздействие нескольких триггеров может оказывать суммарное и даже синергичное влияние на симптомы/обострения БА.
Фенотипы БА
Возраст и характерные триггеры могут использоваться для выделения фенотипов БА. Выделение отдельных фенотипов может быть целесообразным, поскольку БА у детей является гетерогенной. Будучи частью “синдрома астмы”, фенотипы БА не являются отдельными заболеваниями. Рекомендации, учитывающие различные фенотипы БА, должны помочь оптимизировать тактику лечения и прогноз. Ниже приведены критерии, использующиеся для определения фенотипов БА.
Возраст
Возраст – один из наиболее значимых критериев, определяющих фенотип БА у детей. Клиническая картина БА в разных возрастных группах отличается рядом особенностей, и поэтому выбор методов диагностики и стратегии лечения должен быть основан на возрасте. На практике для этих целей выделяют следующие возрастные группы:
- младенцы (от 0 до 2 лет);
- дошкольники (от 3 до 5 лет);
- школьники (от 6 до 12 лет);
- подростки.
Младенцы. У детей раннего возраста персистирование симптомов является основным критерием тяжести заболевания. Поэтому следует установить, действительно ли у ребенка симптомы обструкции отмечались в большинство дней недели на протяжении последних 3 мес. Если это так, то после тщательного исключения иных причин у ребенка диагностируют персистирующую младенческую обструкцию. У детей с интермиттирующими симптомами (рецидивирующими эпизодами) диагностируют тяжелую или легкую форму заболевания в зависимости от того, нуждаются ли они в приеме системных глюкокортикостероидов (ГКС), госпитализациях и т.д.
Дошкольники. У детей дошкольного возраста ключевым критерием для дифференциальной диагностики фенотипа БА является персистирование симптомов на протяжении последнего года (рис. 1).
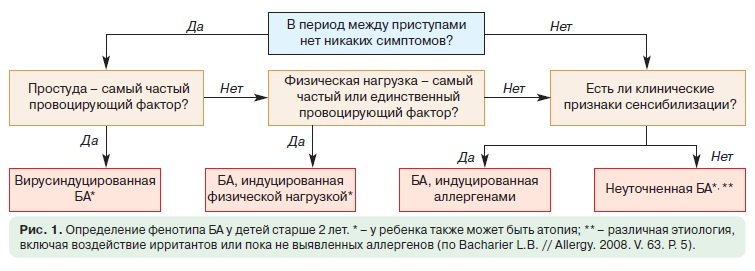
Если в период между приступами нет никаких симптомов, а симптомы в большинстве случаев возникают после простуды, наиболее вероятна вирусиндуцированная БА. В этой возрастной группе вирусы являются наиболее частыми триггерами. В этой возрастной группе может встречаться в виде отдельного фенотипа и БА, связанная с физической нагрузкой.
Необходимо провести кожные аллергопробы или определение уровней специфических IgE, а также уточнить, есть ли клинически значимая связь между контактом с аллергеном и появлением симптомов. Положительные результаты обследования свидетельствуют о наличии фенотипа аллергениндуцированной БА. Следует подчеркнуть, что атопия является фактором риска для персистирования БА независимо от того, доказана ли роль аллергенов как триггеров заболевания. Если не удается установить аллергены, которые играют роль триггера, с определенной осторожностью такой фенотип следует охарактеризовать как неаллергическую БА. Тем не менее это может означать, что причинный аллерген пока не был обнаружен.
Школьники. Критерии дифференциации фенотипов у детей школьного возраста такие же, как и у дошкольников (см. рис. 1). Однако аллергениндуцированная БА выявляется чаще и становится более явной (в том числе сезонность обострений). Вирусиндуцированная БА также остается распространенной формой заболевания у пациентов этой возрастной группы. Тяжесть течения заболевания может становиться серьезной проблемой при лечении аллергениндуцированной БА.
Подростки. Атопическая БА может впервые проявляться в подростковом возрасте, причем новых случаев БА появляется больше, чем развивается ремиссий. У подростков может впервые развиться и неатопическая БА. В этой возрастной группе могут возникать дополнительные проблемы при выборе тактики ведения. Многие подростки сопротивляются регулярному приему лекарств и любым ограничениям в образе жизни; нередко подростки курят. Кроме того, могут возникать проблемы во время перехода подростка от наблюдения педиатром к другому специалисту.
Тяжесть БА
Тяжелая БА и у детей, и у взрослых отличается рядом особенностей, заслуживая выделения в особый фенотип. Тяжесть БА ассоциируется с персистированием и резистентностью к лечению. Хотя тяжесть используется как дополнительный критерий при определении фенотипа, степень тяжести зачастую определяется произвольно. Оценка тяжести БА зависит от возраста. У детей раннего возраста при персистировании заболевания его следует расценивать как тяжелое. У детей старшего возраста тяжелыми следует считать обострения, при которых возникает необходимость в оксигенотерапии и госпитализации. Они могут развиваться независимо от обычных признаков тяжелого течения, т.е. частоты симптомов или функции дыхания.
Патофизиология
БА отличается особой сложностью у детей, поскольку несколько элементов иммунной системы, включая презентацию антигена, функцию Т-клеток и продукцию антител, являются незрелыми, что предрасполагает к развитию атопического ответа. Взаимодействия между созреванием иммунной системы и развитием легких в первые годы жизни, по-видимому, являются решающим фактором в возникновении БА.
Иммунологические нарушения
Иммунные реакции могут иметь ряд отличий у детей с БА, вызванной различными триггерами (например, при аллергениндуцированной и вирусиндуцированной БА), кроме того, особенности течения БА могут быть обусловлены возрастными изменениями.
Долгое время для объяснения иммунологических нарушений при БА использовали гипотезу о том, что развитие заболевания обусловлено простым смещением баланса между цитокинами Th1- и Th2-лимфоцитов. Тем не менее становится всё более очевидным, что взаимодействия между популяциями Т-клеток и их цитокинами более сложные и существенно различаются (в частности, в зависимости от возраста и природы стимула).
У большинства детей с БА есть атопия, определяемая как предрасположенность к выработке IgE и возникновению соответствующих клинических симптомов. Хотя атопический фенотип часто присутствует и в грудном возрасте, он становится совершенно явным в дошкольном и школьном возрасте и остается связанным с БА у пациентов любого возраста. У пациентов с атопией отмечается склонность к повышению уровня IgE в крови и дисбалансу Th2/Th1-клеток при ответе на митогены, аллергены и вирусы. Наличие атопии способствует дальнейшей сенсибилизации к аллергенам и нарушениям ответа на вирусные инфекции.
Структурно-функциональные изменения
В дополнение к воспалению в дыхательных путях при БА развиваются и структурные изменения. Эти изменения могут сохраняться более чем 6 лет даже при отсутствии клинических симптомов и после прекращения лечения БА.
Термином “ремоделирование дыхательных путей” описывают хронические, возможно необратимые изменения, которые развиваются у больных БА. Они включают гипертрофию гладкомышечных элементов, ангиогенез и гиперваскуляризацию, хроническую инфильтрацию воспалительными клетками, гиперплазию слизистых желез, отложение коллагена, утолщение базальной мембраны и снижение эластичности стенок дыхательных путей. Такие изменения были выявлены и у взрослых, и у детей, хотя у детей они выражены в меньшей степени. Наличие ремоделирования было подтверждено у детей со свистящим дыханием после вирусной инфекции, но есть доказательства того, что оно не развивается у детей раннего возраста. Ремоделирование может усиливаться элементами Th2-иммунного ответа. Раннее лечение (начиная с возраста 2–3 года)ингаляционными ГКС (ИГКС) не влияет на динамику этих изменений.
Бронхиальное воспаление – ключевая характеристика у большинства пациентов с БА; оно включает изменения эпителия, приток воспалительных клеток и продукцию большого числа медиаторов. Воспаление тесно связано с гиперреактивностью дыхательных путей. Клеточный состав и другие характеристики зависят от триггера и возраста и могут отличаться при различных фенотипах БА. Воспаление может персистировать в различной степени в периоды между обострениями.
Диагностика
Не существует патогномоничных симптомов или суррогатных маркеров, по которым можно было бы диагностировать БА у детей в первые годы жизни. В связи с этим диагноз БА следует заподозрить у любого ребенка с рецидивирующими обструкцией и приступами кашля. Нередко диагноз можно установить только в процессе длительного наблюдения, в результате проведения тщательной дифференциальной диагностики и оценки реакции ребенка на бронхолитики и/или противовоспалительное лечение.
Анамнез
В истории болезни следует обратить внимание на частоту и тяжесть таких симптомов, как свистящее дыхание, кашель по ночам, возникновение жалоб при физической нагрузке, а также на персистирование кашля после простудных заболеваний, атопическую наследственность, контакт с аллергенами и табачным дымом. Следует выяснить динамику симптомов за последние 3–4 мес, обратив особое внимание на те, которые беспокоили в течение предшествующих 2 нед. Свистящее дыхание должно быть подтверждено врачом, поскольку родители могут неправильно интерпретировать звуки, издаваемые ребенком при дыхании.
Клинический осмотр
При клиническом осмотре следует обратить особое внимание на аускультацию при форсированном выдохе и оценить состояние носа.
Основными симптомами, указывающими на наличие атопического фенотипа, являются:
- атопическая экзема или дерматит;
- сухая кожа;
- темные круги под глазами (“аллергические синяки”);
- раздражение конъюнктивы;
- персистирующий отек слизистой носа, выделения из носа, “аллергический салют” или “аллергическая складка”.
Аллергообследование
Аллергическая сенсибилизация представляет собой фактор повышенного риска развития БА, ее персистирования и тяжелого течения. Более того, на фоне наличия атопического дерматита и/или специфических IgE к пищевым аллергенам возрастает риск сенсибилизации к ингаляционным аллергенам и развития БА.
Тесты in vivo следует выполнять по стандартизированной методике и стандартизированными экстрактами аллергенов. Кожные аллергопробы (прик-тест) можно проводить у детей любого возраста.
Лабораторное определение аллергенспецифических IgE может оказаться полезным в том случае, когда выполнение кожных аллергопроб не представляется возможным (из-за выраженного атопического дерматита/экземы, когда нельзя прекратить прием антигистаминных препаратов или наблюдались жизнеугрожающие реакции на пищевой или ингаляционный аллерген). Измерение специфических IgE в сыворотке крови не повышает точность результатов, полученных при постановке кожных аллергопроб.
Оценка функции легких
Оценку функции внешнего дыхания в условиях форсированного выдоха можно осуществлять у большинства детей начиная с возраста 5–6 лет, а в отдельных случаях начиная с 3 лет. У детей дошкольного возраста можно использовать метод импульсной осциллометрии и другие методы, однако ценность этой информации для диагностики БА у детей этого возраста весьма ограничена.
Прирост показателей в ответ на ингаляцию β2-агониста позволяет судить об обратимости ограничения воздушного потока. Увеличение объема форсированного выдоха за 1-ю секунду (ОФВ1) более чем на 12% от исходного уровня свидетельствует о значимом бронхолитическом эффекте.
Другие методы обследования
Рентгенологическое обследование грудной клетки следует проводить при первичном визите к врачу. Результаты ряда методов могут указывать на наличие аллергического воспаления в дыхательных путях: определение окиси азота (NO) в выдыхаемом воздухе, анализ конденсата выдыхаемого воздуха, определение количества эозинофилов в индуцированной мокроте и в периферической крови, тест выделения базофилами гистамина.
Для подтверждения диагноза БА могут оказаться полезными непрямые методы оценки бронхиальной гиперреактивности – тесты с метахолином, гистамином, маннитолом, гипертоническим солевым раствором, гипервентиляцией/холодным воздухом, физической нагрузкой (предпочтительнее при беге).
Дифференциальный диагноз и сопутствующие заболевания
У детей с тяжелыми рецидивирующими приступами свистящего дыхания и у грудных детей с персистирующим свистящим дыханием, не поддающимся лечению, следует исключать другие заболевания и отягощающие факторы. Среди них гастроэзофагеальный рефлюкс, ринит, аспирация инородного тела, муковисцидоз, пороки развития верхних или нижних дыхательных путей. В таких случаях может потребоваться выполнение фибробронхоскопии с бронхоальвеолярным лаважом, компьютерной томографии грудной клетки или определение рН в пищеводе. Кроме того, следует оценивать ответ на лечение. Если лечение ИГКС, антагонистами лейкотриеновых рецепторов (АЛР) или бронхолитиками эффекта не дает, следует повторно верифицировать диагноз БА.
Ведение пациентов
Ведение больных БА должно предусматривать разработку подробного плана, в который необходимо включить мероприятия по элиминации причинно-значимых аллергенов и ирритантов (насколько это возможно), адекватную фармакотерапию и программы обучения для пациентов, их родителей и лиц, ухаживающих за ними. У отдельных пациентов хороший эффект может дать аллергенспецифическая иммунотерапия.
Элиминация аллергенов
Предотвращение контакта с некоторыми аллергенами (например, аллергенами кошек, собак, морских свинок, лошадей) может способствовать снижению выраженности симптомов и риска развития сенсибилизации. Первичная профилактика – это элиминация любых факторов риска до того, как к ним выработается гиперчувствительность, вторичная профилактика – это установление диагноза и начало лечения на возможно более ранних сроках развития заболевания, третичная профилактика – это ограничение влияния болезни.
Фармакотерапия
Цель ступенчатой фармакотерапии БА у детей состоит в контроле симптомов и предотвращении обострений при минимальном риске нежелательных эффектов (рис. 2).
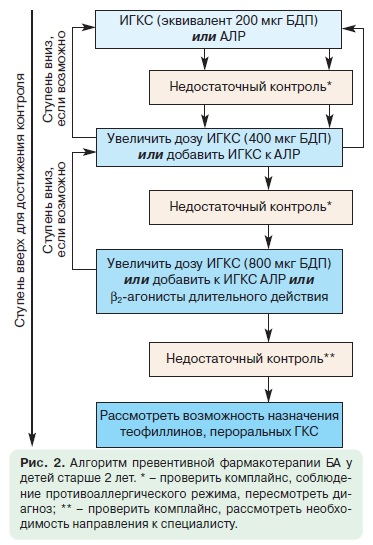
Препараты для терапии БА у детей подразделяют на:
- Препараты неотложной помощи:
- ингаляционные β2-агонисты короткого действия (КД);
- другие бронхолитики.
- Контролирующие препараты:
- ИГКС;
- антагонисты лейкотриеновых рецепторов;
- β2-агонисты длительного действия (ДД) – только в комбинации с ИГКС;
- теофиллины замедленного высвобождения;
- кромоны;
- анти-IgE-антитела;
- пероральные ГКС.
Препараты неотложной помощи
β2-агонисты КД:
- препараты выбора для лечения интермиттирующей БА и острых эпизодов БА у детей, а также для предотвращения бронхоспазма, вызываемого нагрузкой (однако наличие постнагрузочного бронхоспазма может быть показанием для начала регулярной превентивной терапии ИГКС или АЛР);
- рекомендуется минимальная эффективная доза, которая обеспечивает адекватный клинический контроль при минимуме нежелательных эффектов;
- сальбутамол, наиболее часто используемый препарат, имеет благоприятный профиль эффективности и безопасности у детей 2–5 лет;
- безопасность и эффективность тербуталина и формотерола сравнимы с сальбутамолом, показания к использованию сходны.
Ипратропия бромид:
- при обострении БА комбинируют с β2-агонистами;
- нежелательные эффекты незначительны, показано пробное использование с β2-агонистами, если монотерапия ими недостаточно эффективна.
Регулярная контролирующая терапия. Главная задача регулярной контролирующей терапии – уменьшить бронхиальное воспаление.
ИГКС:
- первая линия в лечении персистирующей БА;
- уменьшают частоту и тяжесть обострений;
- должны быть использованы как начальная поддерживающая терапия, если отсутствует контроль БА;
- атопия и снижение функциональных показателей предполагают благоприятный ответ на использование ИГКС;
- если контроль БА неадекватен на низкой дозе ИГКС в течение 1–2 мес, то доза ИГКС увеличивается или применяется их комбинация с АЛР или с β2-агонистами ДД.
Антагонисты лейкотриеновых рецепторов:
- альтернативная терапия первой линии при персистирующей БА;
- полученные доказательства поддерживают использование монтелукаста в качестве начальной контролирующей терапии при легкой БА у детей, так как монтелукаст обеспечивает бронхопротекцию и уменьшает воспаление в дыхательных путях (снижает уровень выдыхаемого NO у дошкольников с аллергической БА);
- младший возраст (<10 лет) и повышенный уровень лейкотриенов в моче предполагают хороший ответ на АЛР;
- используются у больных, которые не могут или не хотят принимать ИГКС;
- могут использоваться в сочетании с ИГКС, так как механизмы их действия отличаются и дополняют друг друга;
- предлагаются для лечения вирусиндуцированной бронхиальной обструкции и уменьшения частоты обострений у детей в возрасте 2–5 лет;
- хорошие результаты получены у детей с возраста 6 мес.
β2-агонисты ДД:
- добавляют к терапии ИГКС при частично или полностью неконтролируемой БА;
- эффективность и безопасность не доказаны у детей так же хорошо, как у взрослых, требуются дальнейшие исследования;
- использование ограничивается комбинацией с ИГКС;
- комбинация β2-агонистов ДД и ИГКС может быть использована у детей старше 4–5 лет, однако их эффект недостаточно исследован у детей младше 4 лет.
Теофиллины пероральные:
- есть сообщения, что низкие дозы теофиллина могут давать положительный эффект у отдельных групп детей, у которых недостаточно эффективны ИГКС, АЛР или β2-агонисты ДД;
- недорогие препараты, могут использоваться при недоступности других лекарств;
- из-за узкого терапевтического коридора и вариабельности метаболизма следует мониторировать уровень теофиллина в крови.
Кромоны:
- кромогликат натрия назначается детям с 2 лет;
- менее эффективны, чем ИГКС;
- используются часто (4 раза в день), для достижения эффекта может потребоваться до 4 нед терапии;
- не вызывают нежелательных эффектов;
- существуют в различных формах (пероральной, интраназальной, растворе для небулайзера, глазных капель).
Анти-IgE-антитела:
- у детей старше 12 лет могут быть эффективны при среднетяжелой/тяжелой атопической БА, которая неадекватно контролируется, несмотря на применение другой терапии;
- способ введения и стоимость ограничивают внедрение;
- терапевтический индекс (эффект/риск) еще не определен.
Лечение тяжелой БА
При неадекватном контроле БА дозу ИГКС увеличивают до эквивалентной 800 мкг беклометазона дипропионата. При необходимости дальнейшего увеличения дозы показана консультация специалиста. Высокие дозы ИГКС имеют преимущество перед пероральными ГКС по отношению эффективность/безопасность. При тяжелой БА может потребоваться регулярное использование пероральных ГКС (ежедневно или через день). Необходимо регулярно оценивать контроль БА, а при достижении эффекта следует уменьшить дозу. Тяжелая БА нечасто встречается у детей, и при ее наличии необходимо проводить тщательную дифференциальную диагностику и оценивать комплайнс к терапии.
Лечение БА у детей в возрасте до 2 лет
Эта группа наиболее трудна для диагностики и лечения в связи с ограниченной доказательной базой.
- Диагноз БА возможен, если зарегистрировано более 3 эпизодов обратимой бронхообструкции в течение предыдущих 6 мес.
- Эпизодический прием β2-агонистов (ингаляционно, через небулайзер или перорально) служит терапией первого выбора, хотя данные противоречивы.
- АЛР используются для ежедневной контролирующей терапии при обструкции на фоне вирусной инфекции (длительное или кратковременное лечение).
- ИГКС через небулайзер или дозированный аэрозольный ингалятор со спейсером применяются в качестве ежедневной контролирующей терапии при персистирующей БА, особенно тяжелой или требующей частых курсов пероральных ГКС.
- Наличие аллергии снижает порог для использования ИГКС, и они могут быть использованы в таких случаях как терапия первой линии.
- Пероральные ГКС (преднизолон 1–2 мг/кг) применяют в течение 3–5 дней при острых и частых рецидивирующих эпизодах бронхообструкции.
- АЛР уменьшают частоту симптомов БА у детей в возрасте 2–5 лет, и есть некоторые доказательства, что АЛР могут быть эффективны и у детей младше 2 лет.
Как показано в небольших исследованиях, при лечении будесонидом через небулайзер дети с легкой персистирующей или тяжелой БА имели меньше дневных и ночных симптомов, а также обострений. Однако в других исследованиях продемонстрировано, что использование ИГКС в раннем детстве не влияет на течение БА или развитие обструкции в последующие годы.
Лечение БА у детей в возрасте 3–5 лет
Первая линия терапии у детей с интермиттирующей и персистирующей БА включает ИГКС и АЛР. Ступенчатая терапия выглядит следующим образом:
- ИГКС – препараты первого выбора (будесонид 100–200 мкг 2 раза в день или флутиказона пропионат 50–125 мкг 2 раза в день через дозированный аэрозольный ингалятор);
- β2-агонисты КД по потребности (сальбутамол 100 мкг или тербуталин 250 мкг по 1–2 дозы с интервалом 4 ч);
- АЛР могут быть использованы как монотерапия вместо ИГКС при интермиттирующей и легкой персистирующей БА;
- если с помощью ИГКС полный контроль БА не достигнут, добавить АЛР монтелукаст 4 мг/сут (в гранулах или в жевательных таблетках);
- если контроль БА не достигается, обсудить следующие действия (не в порядке применения): добавить β2-агонисты ДД (по крайней мере эпизодически, хотя пока недостаточно данных, поддерживающих их использование в данной возрастной группе), повысить дозу ИГКС, добавить теофиллин.
Лечение обострений БА
Ступенчатое лечение обострения БА проводят следующим образом (вмешательства применяются в зависимости от их доступности и места, где проводится терапия, – дома, у врача общей практики или в стационаре):
- ингаляции β2-агонистов КД через спейсер по 2–4 вдоха сальбутамола каждые 10–20 мин в течение 1 ч, при отсутствии улучшения показана госпитализация;
- β2-агонисты через небулайзер – 2,5–5 мг сальбутамола можно повторять каждые 20–30 мин;
- ипратропия бромид смешивают с раствором β2-агониста в дозе 250 мкг и ингалируют через небулайзер каждые 20–30 мин;
- кислородотерапия для обеспечения нормальной оксигенации;
- пероральные и внутривенные ГКС имеют сходную эффективность, пероральные ГКС предпочтительнее ингаляционных ГКС. Доза преднизолона – 1–2 мг/кг (более высокие дозы могут быть использованы в стационаре), обычно достаточно до 3 дней лечения;
- β2-агонисты внутривенно: раннее добавление болюсных доз сальбутамола внутривенно (15 мкг/кг) может быть полезным, затем проводится продолжительная инфузия в дозе 0,2 мкг/кг/мин;
- ребенок должен быть переведен в отделение интенсивной терапии, если наблюдается прогрессивное ухудшение состояния и не поддерживается достаточная оксигенация. Маленькие дети с ограничением вентиляционных резервов имеют наибольший риск развития дыхательной недостаточности;
- аминофиллин используется в условиях отделения интенсивной терапии при тяжелом и жизнеугрожающем бронхоспазме, не отвечающем на максимальные дозы бронхолитиков и системных ГКС. Вначале его вводят в дозе 6 мг/кг в течение 20 мин, мониторируя ЭКГ, затем продолжают длительную внутривенную инфузию. Необходима особая осторожность при наличии факторов, влияющих на метаболизм аминофиллина.
Лечение БА, индуцированной физической нагрузкой
Постнагрузочный бронхоспазм у детей является частым клиническим проявлением БА, наблюдаясь у 70–80% детей с БА, которые не получают противовоспалительной терапии. Постнагрузочный бронхоспазм в отсутствие других проявлений БА можно контролировать β2-агонистами КД за 10–15 мин перед нагрузкой. Если у пациента есть и другие проявления БА, то заболевание лучше контролируется монотерапией ИГКС или их комбинацией с бронхолитиками. Согласно современным данным, АЛР могут служить альтернативой ИГКС при этом варианте заболевания, поскольку они способны быстро и длительно предотвращать падение ОФВ1 при нагрузке. Регулярное использование АЛР не вызывает толерантности к их бронхопротективному эффекту.
Если полный контроль не достигается с помощью ИГКС, то к лечению ИГКС можно добавить ингаляционные β2-агонисты КД перед нагрузкой, АЛР или ингаляционные β2-агонисты ДД. К ингаляционным β2-агонистам при регулярном использовании возможно развитие толерантности. У некоторых пациентов для предотвращения постнагрузочного бронхоспазма может быть необходима комбинация ИГКС, АЛР и β2-агонистов ДД. Можно попытаться использовать ипратропия бромид (обычно в дополнение к другим препаратам). Недостаточный эффект терапии при постнагрузочном бронхоспазме может быть связан с ошибочным диагнозом.
Резистентная к терапии БА
Резистентная к терапии (“трудная”) БА, на наличие которой указывает частое использование β2-агонистов КД, несмотря на высокие дозы ИГКС, может протекать атипично. Во всех случаях необходимо исключить другие возможные причины астмаподобных симптомов и негативное влияние факторов окружающей среды.
Выбор ингаляционного устройства
Предпочтительный метод назначения ИГКС и β2-агонистов – дозированные аэрозольные ингаляторы со спейсером или порошковые ингаляторы. Однако в ряде случаев может быть предпочтительным компрессорный небулайзер (в связи с недостаточным ответом на терапию, тяжестью состояния, персональными предпочтениями или удобством), особенно у детей младше 4–5 лет, которые не могут пользоваться названными устройствами. Для длительной терапии необходим выбор устройства в зависимости от возраста, чтобы обеспечить высокий комплайнс и таким образом – наилучшую клиническую эффективность и отношение стоимость/эффект.
Иммунотерапия
Специфическая иммунотерапия (СИТ) может предотвратить сенсибилизацию к другим аллергенам, предотвращает прогрессирование аллергического ринита в БА и уменьшает риск развития БА у детей с сезонной аллергией. Эффект СИТ после ее прекращения сохраняется, обеспечивая длительную клиническую ремиссию, особенно аллергического ринита. Эффективность СИТ зависит от качества используемых экстрактов аллергенов.
Подтвержден выраженный и длительный эффект подкожной и сублингвальной СИТ, хотя последний метод у детей младше 5 лет изучен недостаточно. На основании систематического обзора заключают, что сублингвальная СИТ оказывает только слабый или умеренный эффект у детей старше 4 лет с легкой/среднетяжелой БА, сенсибилизированных только к клещам домашней пыли. Эффективность методов сходна, однако сублингвальная СИТ более привлекательна для детей и родителей.
БА без аллергической сенсибилизации не является показанием для СИТ. Сенсибилизация более чем к одному аллергену не является противопоказанием для СИТ, но может уменьшить ее эффективность. Возраст также не служит абсолютным противопоказанием, такая терапия может использоваться с 3 лет.
Обучение
Образование является обязательным компонентом в программе лечения, и оно должно начинаться как можно раньше. Образование должно повышать знания о БА, уменьшать боязнь медикаментов и улучшать коммуникабельность между детьми. Следует объяснять необходимость в длительном ежедневном использовании лекарств у детей со среднетяжелой и тяжелой БА. Уровень обучения должен основываться на возрасте ребенка и тяжести заболевания.
Мониторирование
Для мониторирования степени контроля БА используются обычные клинические методы: анамнез, физикальное обследование, функциональные тесты.
БА является хорошо контролируемой (согласно GINA 2006), когда достигнуто и поддерживается следующее:
- дневные симптомы не чаще 2 раз в неделю (и не более 1 раза в день);
- нет ограничений активности из-за симптомов БА;
- ночные симптомы не чаще 1 раза в месяц (2 раз в месяц, если ребенок старше 12 лет);
- использование препаратов неотложной терапии не чаще 2 раз в неделю;
- нормальная функция легких (если есть возможность измерить);
- не более 1 обострения за прошедший год.
В отличие от взрослых дети (особенно дошкольники) могут переносить 1–2 обострения в год, и БА может считаться контролируемой, если симптомы отсутствуют вне обострений.
Факторы, сочетающиеся с плохим контролем БА, включают контакт ребенка с табачным дымом и недооценку родителями психосоциальных аспектов БА.
Спирометрия должна быть проведена при каждом посещении пациентом врача. Наиболее информативными функциональными параметрами являются пиковая скорость выдоха и ОФВ1, причем ОФВ1 также служит предиктором обострений БА у детей. Отношение ОФВ1 к форсированной жизненной емкости легких и максимальный среднеэкспираторный поток достоверно отражают тяжесть БА и эффективность терапии. Тест с физической нагрузкой может проводиться с помощью тредмила или обычного бега в течение 6 мин.
В современных условиях для мониторирования степени контроля БА может применяться исследование NO в выдыхаемом воздухе, а также конденсата выдыхаемого воздуха.
Ссылка на оригинал: http://medspecial.ru/for_doctors/29/383/








Комментировать