Свойства, механизмы действия и влияние различных форм витаминов группы В.
Дж. Скотт Тринити-Колледж, Дублин, Ирландия
В статье рассматриваются свойства, механизмы действия и влияние различных форм витаминов группы В. Обосновываютсяпреимущества применения в медицинской практике 5- метилтетрагидрофолата – естественного фолата – по сравнению с синтетическим провитамином – фолиевой кислотой.
Фолатные коферменты в природе
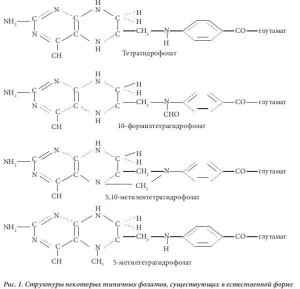
Фолаты – соединения, которые включают около 10 разных форм витамина группы B [1]. Молекула любого соединения из этой группы содержит птеридиновое кольцо, парааминобензоатную группу, а также одну или несколько глутаминовых боковых цепей (рис. 1). У естественных форм витаминов группы B птеридиновое кольцо восстановлено до тетрагидрофолата – одного или с различными присоединенными к нему одноуглеродными группами, такими как формильная (-CHO), метиленовая (-CH2-), метенильная (-CH=) или метильная (-CH3). Единственным исключением является дигид- рофолат, образующийся в результате действия фермента тимидилатсинтазы. Дигидрофолат учас- твует в превращении основания урацил (входит в состав рибонуклеиновой кислоты (РНК)) в осно- вание тимин (входит в состав дезоксирибонуклеиновой кислоты (ДНК)). Во всех клетках к фолатам присоединены не один, а несколько глутаминовых боковых цепей, связанных друг с другом посред- ством гамма-карбоксильной группы. Во время всасывания в кишечнике эта полиглутаматная цепь удаляется ферментом глутамилкарбоксипептидазой (конъюгазой), который присутствует в щеточ- ной кайме клеток слизистой оболочки двенадцатиперстной кишки. Данный фермент превращает все естественные фолаты полиглутаматы в фолаты моноглутаматы.
Всасывание фолатов из кишечника
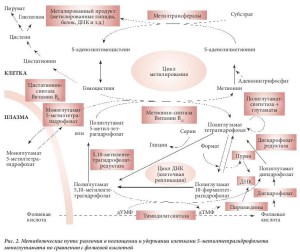
Фолаты моноглутаматы, например, тетрагидрофолат, 10-формилтетрагидрофолат и 5-метилтетра- гидрофолат, абсорбируются в кишечнике и поступают в кровь только в виде 5-метилтетрагидрофо- лата, который проникает в клетки посредством эндоцитоза при участии специфических фолатных рецепторов [2]. Скорее всего, поглощение этого кофермента клетками происходит посредством па- ссивной, или облегченной, диффузии. В клетке есть только один фермент, который использует 5- метилтетрагидрофолат в качестве субстрата, – витамин-B12-зависимый фермент метионинсинтаза. Данный фермент является частью цикла метилирования (рис. 2). Его роль заключается в повтор- ном метилировании гомоцистеина в метионин, который затем активируется аденозинтрифосфатом (АТФ) с целью продуцирования S-аденозилметионина (САМ). Данная форма метионина, иногда на- зываемая «активным метионином», является донором метила для ряда метилтрансфераз, присутс- твующих во всех клетках. Эти метилтрансферазы метилируют широкий спектр разнообразных суб- стратов, включающий гормоны (например, допамин); липиды (например, фосфатидилэтаноламин) и белки (например, основной белок миелина).
Клетки используют реакцию метионинсинтазы для удержания 5-метилтетрагидрофолата [3]. 5- метилтетрагидрофолат – это слабый субстрат для полиглутаматсинтазы, но после действия на него 3 данного фермента в процессе цикла метилирования он превращается в тетрагидрофолат. Этот ко- фермент, а также другие восстановленные однозамещенные фолаты (например, 10- формилтетрагидрофолат) являются хорошими субстратами для полиглутамации [3]. Таким обра- зом, после того как 5-метилтетрагидрофолат моноглутамат метаболизируется до тетрагидрофола- та моноглутамата, он становится полиглутаматом и будет удержан клеткой. Решающим фактором для использования метионинсинтазой нового захваченного 5-метилтетрагидрофолата моноглута- мата является его концентрация относительно концентрации полиглутамата метилтетрагидрофо- лата, уже присутствующего в клетке. Метионинсинтаза может использовать как моноглутаматную форму, так и полиглутаматную форму 5-метилтетрагидрофолата. Чаще всего в клетках, насыщен- ных фолатами, концентрация полиглутамата выше, а концентрация моноглутамата ниже, следова- тельно, очень небольшая часть моноглутамата преобразуется в тетрагидрофолат и удерживается в клетке, а непреобразованный моноглутамат покидает клетку путем диффузии. Однако если в клет- ках количество фолатов уменьшается и концентрация клеточных фолатов полиглутаматов относи- тельно фолатов моноглутаматов снижается, то метионинсинтаза, используя все больше 5- метилтетрагидрофолата моноглутамата, трансформирует его в тетрагидрофолат моноглутамат и в 10-формилтетрагидрофолат моноглутамат. Поскольку тетрагидрофолат моноглутамат и 10- формилтетрагидрофолат моноглутамат являются хорошими субстратами для полиглутаматсинта- зы, они превращаются в полиглутаматы и удерживаются в клетках. По мере того как эти кофермен- ты подвергаются полиглутамации и удерживаются в клетках, они вновь преобразуются в 5- метилтетрагидрофолаты полиглутаматы, которые все больше конкурируют за метионинсинтазу с новыми захватываемыми 5-метилтетрагидрофолатами моноглутаматами. Когда в клетках наступа- ет состояние насыщения фолатами, они удерживают все меньше и меньше недавно захваченного 5-метилтетрагидрофолата. В результате клеткам нужно захватывать и удерживать больше фолатов из-за их дефицита. Кроме того, при делении клеток дочерние клетки имеют половину от исходной концентрации фолатов, которая была в родительских клетках. Это приводит к более низкой, чем оптимальная, концентрации доступного для метионинсинтазы 5-метилтетрагидрофолата полиглу- тамата. Следовательно, метионинсинтаза будет использовать 5-метилтетрагидрофолат моноглу- тамат, захваченный из циркулирующей плазмы. Поскольку он превращается в тетрагидрофолат и удерживается, концентрация фолатов в клетке начинает повышаться. Концентрация 5- метиотетрагидрофолата также растет, поэтому все меньше и меньше моноглутамата используется метионинсинтазой и удерживается. Другим фактором, который влияет на конечную концентрацию моноглутамата, удерживаемого в клетках, является концентрация 5-метилтетрагидрофолатов мо- ноглутаматов в плазме. Чем выше эта концентрация, тем выше концентрация моноглутамата в кле- тках и тем больше шансов, что он будет использован метионинсинтазой и, таким образом, удержан.
Поглощение фолиевой кислоты клетками
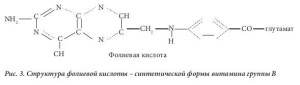
Фолиевая кислота, впервые выделенная из листьев шпината (от лат. folium – лист) [4], представля- ет собой синтетическую форму витамина группы В (рис. 3) и отличается от естественных фолатов невосстановленным птеридиновым кольцом. Из клеток можно выделить очень небольшое количес- тво фолиевой кислоты, все клеточные формы витамина находятся в восстановленном состоянии по типу тетрагидро- или дигидро- (рис. 1). В настоящее время признано, что фолиевая кислота полу- чается в результате окисления некоторых естественных тетрагидрофолатов in vitro. Синтетическая фолиевая кислота, поступающая в организм в виде принимаемой добавки или вместе с обогащен- ным ею пищевым продуктом, может превращаться, как и другие фолаты моноглутаматы, в 5- метилтетрагидрофолат в процессе абсорбции в кишечнике. Было показано, что в дозе выше 300 мкг в плазме выявляется неизмененная фолиевая кислота [5]. Такая синтетическая форма витами- на быстро выводится почками, однако за период своего нахождения в плазме крови она поступает к клеткам в процессе кровообращения. Как и 5-метилтетрагидрофолат, она проникает в клетки путем диффузии. Можно было бы предположить, что фолиевая кислота не будет активна в клетках, пос- 4 кольку не встречается в естественном виде, однако выяснилось, что она подвергается действию фермента дигидрофолатредуктазы. Этот фермент обычно служит для перехода дигидрофолатов, возникающих в процессе действия фермента тимидилатсинтетазы, обратно в тетрагидрофолаты. Тимидилат-синтетаза превращает дезоксиуридинмонофосфат (дУМФ) в дезокситимидин монофос- фат (дТМФ) в процессе биосинтеза пиримидина (рис. 2). Кофермент с замещенной одноуглеродной группой, использованный ферментом, а именно 5,10-метилентетрагидрофолат, является уникаль- ным в фолат-зависимой отдаче одного атома углерода, поскольку продуктом является не тетрагид- рофолат, а дигидрофолат. Его нужно постоянно повторно переводить в тетрагидрофолат, чтобы клетка могла продолжать метаболизм фолатов, что достигается с помощью фермента дигидрофо- латредуктазы. После преобразования фолиевой кислоты в дигидрофолат этот же фермент прев- ращает его в тетрагидрофолат, после чего образуется полиглутамат, который удерживается клет- ками. Таким образом, фолиевая кислота действительно является неактивным провитамином, но подвергается влиянию фолатзависимого фермента, участвует в метаболизме клетки и удерживается клетками благодаря превращению в полиглутамат.
В отличие от фолиевой кислоты, 5-метилтетрагидрофолат моноглутамат – единственная циркули- рующая в организме человека естественная форма витамина В – должен деметилироваться до те- трагидрофолата, прежде чем превратится в полиглутамат и будет удержан клетками. Посредством увеличения или уменьшения потребления 5-метилтетрагидрофолата моноглутамата вместо 5- метилтетрагидрофолата полиглутамата клетки контролируют число циркулирующих фолатов. По- вышенное удержание фолатов происходит в тех клетках, где был дефицит 5- метилтетрагидрофолата полиглутамата или где клеточное деление сократило его внутриклеточное содержание относительно содержания соответствующего моноглутамата. Кроме того, повышение уровня содержания 5-метилтетрагидрофолата в крови оказывает некоторое влияние на повышение внутриклеточного уровня его содержания, в результате чего в реакции с метионинсинтазой участ- вует (и, соответственно, удерживается в виде полиглутамата) большее количество 5- метилтетрагидрофолата моноглутамата. Таким образом, данная система призвана регулировать удержание новых фолатов соразмерно потребностям клетки. В отличие от сказанного выше, пог- лощение фолиевой кислоты не имеет такого ограничения в части удержания. После экспрессии клетками фермента дигидрофолатредуктазы, характерной особенности всех делящихся клеток, они будут метаболизировать и удерживать фолиевую кислоту. Чем выше будет уровень содержания фолиевой кислоты в плазме крови и, следовательно, уровень ее внутриклеточного содержания, тем в большей степени она будет поглощаться и удерживаться. Следовательно, фолиевая кислота не подвержена обычному контролю клеточного поглощения, которому подвергается 5- метилтетрагидрофолат.
Роль витамина B12 в удержании клетками 5-метилтетрагидрофолата и фолиевой кислоты
Как указывалось выше, фермент метионин-синтаза зависит от витамина B12 (рис. 2). Хорошо извес- тно, что дефицит витамина B12 приводит к двум различным клиническим последствиям – анемии и невропатии. Установлено, что невропатия возникает в результате прерывания цикла метилирова- ния [6], что по ряду причин вызывает деструкцию миелиновой оболочки [7, 8]. При перници-озной анемии также наблюдается анемия, идентичная анемии, наблюдаемой при дефиците фолатов [9], поэтому представляется вероятным, что прерывание действия метионин-синтазы каким-то образом нарушает нормальную функцию фолатов. Это объяснение, которое, возможно, подходит для боль- шей части экспериментальных и клинических доказательств, называется «гипотезой метильной ло- вушки». Она предполагает, что в клетках с дефицитом витамина B12клеточные фолаты захватыва- ются в форме 5-метилтетрагидрофолатов полиглутаматов. Согласно этой гипотезе, при пернициоз- ной анемии все больше и больше клеточных фолатов превращаются в эту форму, захватываются и становятся неспособными к дальнейшему метаболизму. Такое непрерывное захватывание приво- дит к сильному уменьшению содержания в клетках других форм фолатов, необходимых для биоси- нтеза пурина (10-формилтетрагидрофолата) и пиримидина (5,10-метилентетрагидрофолата). Таким образом, клетки начинают испытывать своего рода псевдо-дефицит фолатов: в них есть фолаты, но в той форме, которую невозможно использовать для биосинтеза пурина и пиримидина. Впослед- ствии прекращаются биосинтез ДНК и клеточное деление, как если бы в клетках был дефицит фо- латов. Если это происходит в костном мозге, развившаяся в результате анемия идентична анемии, 6 которая имеет место при дефиците фолатов.
При дефиците витамина B12, в связи со снижением уровня метионин-синтазы, повторное превра- щение гомоцистеина обратно в метионин также замедляется. Это, в свою очередь, вызывает сни- жение уровня САМ. Поскольку САМ является жизненно важным донором метила для ряда метилт- рансфераз во всех клетках млекопитающих, клетки с дефицитом витамина B12 начинают восстанав- ливать уровень САМ путем стимулирования синтеза метионина и синтеза САМ с его участием. Для того чтобы производить больше метионина, клеткам нужно повысить клеточную концентрацию двух субстратов для синтеза метионин-синтазы, зависимой от витамина B12, – гомоцистеина и 5- метилтетрагидрофолата. Это повышает уровень гомоцистеина посредством снижения САМ- зависимого ингибирования фермента 5,10-метилентетра гидрофолат-редуктазы (МТГФ-редуктазы). Данное ингибирование достигается с помощью фермента, имеющего аллостериче-ский участок связывания для САМ. Когда САМ связывается с ферментом, его активность снижается, что сигна- лизирует клетке о достаточных концентрациях составляющих элементов цикла метилирования. С точки зрения гипотезы метильной ловушки важнее, что на редуктазу, фермент, который образует 5- метилтетрагидрофолат, также влияют низкие уровни содержания САМ. Когда уровень САМ начина- ет уменьшаться, активность редуктазы прогрессивно повышается и, следовательно, все больше и больше фолатных коферментов превращаются в 5-метилтетрагид рофолат. Кроме того, гипотеза метильной ловушки предполагает, что действие МТГФ-редуктазы необратимо, и, скорее всего, это предположение является верным, поскольку для обращения редуктазы нужно наличие очень силь- ного акцептора электронов. Это условие достижимо in vitro путем использования искусственного ак- цептора электронов, такого как менадион, однако в клетках такого акцептора, по всей вероятности, нет. Кроме того, гипотеза метильной ловушки подразумевает, что единственным ферментом, кото- рый может метаболизировать 5-метилтетрагидрофолат, является витамин-B12-зависимый фермент метионин-синтаза. Это предположение подтверждается тем, что никакой другой фермент, облада- ющий подобным действием, до сих пор не обнаружен. Следовательно, при возникновении дефици- та витамина B12 в костном мозге 5-метилтетрагидрофолат метаболически захватывается и не мо- жет использоваться в фолат-зависимом биосинтезе ДНК. Это, в свою очередь, препятствует деле- нию клеток и приводит к анемии, идентичной анемии, развивающейся при дефиците фолатов. Ле- чение анемии при дефиците фолатов фолатами или фолиевой кислотой приведет к пополнению клеточных запасов фолатов и, таким образом, повторному запуску биосинтеза пурина и пиримиди- на, а с ним и биосинтеза ДНК и клеточного деления. Назначение витамина B12 не даст результата, поскольку метионин-синтаза уже находится в полностью активном состоянии. Лечение анемии при дефиците витамина B12, например, пернициозной анемии, витамином B12 приведет к реактивации метионин-синтазы и высвобождению захваченного метилтетрагидрофолата для производства тет- рагидрофолата и других фолатных коферментов. В результате возобновится биосинтез пурина и пиримидина, синтез ДНК и клеточное деление, результатом будет излечение от анемии. Восполне- ние дефицита витамина B12 с помощью фолатного кофермента 5-метилтетрагидрофолата, предпо- ложительно, не приведет к успеху. 5-метилтетрагидрофолат просто добавится к уже захваченному количеству фолата такой же формы. Как и эндогенный фолат аналогичной формы, он не сможет участвовать в реакции с ферментом метионин-синтазой, неактивным в этот период из-за недоста- точного количества витамина B12. Можно предположить, что 5-метилтетрагидрофолат даже не бу- дет удержан клетками с дефицитом витамина B12, поскольку, не являясь субстратом для полиглу- тамат-синтетазы, он просто покинет клетку. Существует убедительное доказательство того, что это происходит естественным образом, если 5-метилтетрагидрофолат находится в системе кровооб- ращения. Особенность дефицита витамина B12 заключается в том, что уровни содержания фолатов в клетках значительно снижены, даже если уровень 5-метилтетрагидрофолата в плазме соответст- вует норме или даже превышает ее.
Однако если при дефиците витамина B12 в клетках костного мозга принимать фолиевую кислоту, 7 можно увидеть другую картину. Как описывалось выше, при проникновении фолиевой кислоты в клетки, например, в клетки костного мозга, которые делятся и содержат фермент дигидрофолат- редуктазу, фолиевая кислота ферментативно восстанавливается в дигидрофолат. Он, в свою оче- редь, превращается в тетрагидрофолат и формил- и метилен-производные, которые участвуют, со- ответственно, в биосинтезе пурина и пиримидина. Последние формы также переходят в поли- глутаматы, гарантируя, таким образом, удержание клетками поглощенной метаболизированной фолиевой кислоты. Такой процесс идет и в здоровых клетках, и в клетках с дефицитом виталина B12, поскольку метионин-синтаза не вовлечена в вышеуказанный процесс. Следовательно, в здоро- вых клетках и в клетках с дефицитом витамина B12 фолиевая кислота быстро и напрямую обеспе- чивает синтез фолатных коферментов, необходимых для биосинтеза пурина и пиримидина, и ини- циирует процессы биосинтеза ДНК и деления клеток. В результате эти производные фолатов тран- спортируются к МТГФ-редуктазе, которая в это время очень активна из-за низкого уровня содержа- ния САМ, и захватываются клетками. Если человек с дефицитом витамина B12 постоянно получает фолиевую кислоту, костный мозг отвечает на терапию, имеющаяся анемия будет излечиваться. Может показаться, что данная терапия является верным решением, однако невропатию, которая также является характерной особенностью пернициозной анемии, намного сложнее распознать клинически. Маскировка анемии будет препятствовать своевременной диагностике пернициозной анемии, и, хотя анемия будет излечиваться, невропатия станет прогрессировать. Причиной невро- патии является отсутствие цикла метилирования, поскольку сама по себе фолиевая кислота, даже в случае метаболизирования до дигидро-, тетрагидро- или соответствующих формил- и метилен- фолатов, не может повторно запустить цикл метилирования. Не приведет к повторному запуску ци- кла метилирования и конечное превращение фолиевой кислоты в результате метаболизма в 5- метилтетрагидрофолат, поскольку цикл будет прерываться из-за неактивности метионин-синтазы, играющей в нем важнейшую роль. Таким образом, терапия фолиевой кислотой будет препятство- вать диагностике пернициозной анемии из-за маскировки анемии и не обеспечит лечения невропа- тии. Существуют данные, что лечение фолиевой кислотой усугубляет невропатию, способствуя ее более быстрому прогрессированию, которое становится все более и более необратимым [10].
Обоснование необходимости улучшения фолатного статуса
Ранее считалось, что прием три-четыре раза в день разнообразной пищи обеспечивает поступле- ние достаточного количества всех питательных веществ. Однако на сегодняшний день даже в бо- льшинстве развитых стран Европы и Северной Америки рацион питания не является оптимальным для профилактики некоторых заболеваний. Так, было показано, что у большинства женщин риск 8 рождения ребенка с расщеплением позвоночных дуг можно значительно снизить путем дополните- льного потребления фолатов/ фолиевой кислоты в период до и после зачатия [11]. Существует очень убедительное (и, по мнению некоторых специалистов, практически неопровержимое) доказа- тельство того, что любое повышение уровня гомоцистеина в плазме крови вызывает повышенный риск развития заболеваний сердца [12] и инсульта [13]. Гомоцистеин – это аминокислота, которая естественным образом присутствует в плазме. Она возникает при расщеплении пищевой аминоки- слоты – метионина, который обнаруживается в большей части пищи в количестве, примерно на 60% превышающем потребности организма (рис. 2). Уровень гомоцистеина строго контролируется как в клетках, так и в плазме крови посредством его разложения или обратного превращения в ме- тионин, последний используется для поддержания уровня содержания САМ и обеспечения доста- точного количества метильных групп для цикла метилирования. Это достигается с помощью трех ферментов. Двум из них для функционирования нужны фолатные коферменты. Очевидно, что пи- тание не обеспечивает то количество фолатов, которое бы позволило этим ферментам оптимально функционировать [14]. Таким образом, большинство практически здоровых людей имеют повышен- ный уровень гомоцистеина, который может быть снижен путем приема небольших физиологических доз фолиевой кислоты [15]. В целом рацион питания, не обогащенный фолиевой кисло- той/фолатами, обусловливает риск развития заболеваний сердца и инсульта [16]. Был выдвинут ряд доказательств, что потребление фолиевой кислоты/фолатов с пищей уменьшает риск колорек- тального рака [17]. Так, исследование 1998 г. показало, что длительный прием витаминной добавки, содержащей фолиевую кислоту, значительно снизил частоту случаев возникновения колоректаль- ного рака у женщин [18]. Следует подчеркнуть, что данный защитный эффект был выявлен только у тех, кто принимал витаминные добавки в течение длительного времени – от нескольких лет до де- сятилетий, чего следовало ожидать, учитывая биологические предпосылки.
Сравнение фолиевой кислоты и 5-метилтетрагидрофолата в отношении улучшения фолатного статуса
Можно выделить три способа, посредством которых можно достичь улучшения фолатного статуса:
- изменение моделей пищевого рациона с целью включения в рацион пищи, богатой естест- венными фолатами;
- прием витаминных добавок;
- обогащение пищи витаминами.
Первый вариант трудно реализуем на практике. Обычному человеку сложно изменить привычки пи- 9 тания и придерживаться новой модели пищевого рациона. Кроме того, несмотря на то что фолаты широко распространены в природе, их содержание в пищевых продуктах невысоко, исключением является печень. Таким образом, повысить содержание фолатов можно либо за счет приема вита- минных добавок, либо за счет потребления пищевых продуктов, обогащенных витаминами груп- пы В. В обоих случаях это будет дополнительный прием фолиевой кислоты. Эта форма, как указы- валось выше, не существует в природе и в действительности является провитамином. Фолиевая кислота химически чрезвычайно стабильна и, по всей вероятности, полностью всасывается в орга- низме. Однако прием свыше 300 мкг фолиевой кислоты приводит к тому, что в кровотоке появляет- ся синтетический провитамин. В рекомендуемых нормах потребления (Recommended Dietary Allowances (RDA)) оптимальная норма потребления эквивалента пищевых фолатов в сутки для взрослых повышена до 400 мкг [19]. Это соответствует 200 мкг чистой фолиевой кислоты. Употребление обогащенных витамином продуктов питания может привести к повышению уровня неизмененной фолиевой кислоты в плазме крови, поскольку практически невозможно контролиро- вать потребление продуктов, обогащенных фолиевой килотой. Существует один очевидный способ избежать этой ситуации, который заключается в том, чтобы добавки или обогащенные продукты содержали вместо фолиевой кислоты естественную форму витамина, а именно 5-метилтетра- гидрофолат.
5-метилтетрагидрофолат в виде витамина или в обогащенных продуктах питания
Для того чтобы иметь возможность использовать 5-метилтетрагидрофолат в витаминных добавках или в обогащенных продуктах питания, необходимо преодолеть две технические проблемы: полу- чить химическим путем природный изомер и его стабилизировать.
Получение природного изомера
Восстановление птеридинового кольца фолиевой кислоты до тетрагидро-формы приводит к возни- кновению асимметричной молекулы. Таким образом, традиционный химический синтез дает одина- ковое количество обоих эпимеров C-6, то есть биологически активного (6S) диастереомера и биоло- гически неактивного (6R) диастереомера [20]. Именно данная смесь является исходным материа- лом для получения 5-метилтетрагидрофолата, который имеется в продаже и используется в добав- ках. Соответствующее ферментативное восстановление фолиевой кислоты до дигидрофолата и тетрагидрофолата дает только активный (6S) диастереоизомер. Когда фолаты синтезируются в ра- стениях и бактериях, производится только активный диастереомер (6S), так что все существующие в природе восстановленные фолаты будут представлены именно этой формой. Только эта форма 10 является биологически активной, она распознается всеми системами транспорта фолатов и задей- ствуется во всех фолат-зависимых реакциях. Изомер (6R), будучи зеркальным отражением актив- ной формы, не связывается ни с одним из биологически активных фолат-связывающих веществ и не связывается с системами транспорта. Аналогичным образом он не встраивается в активный участок фолат-зависимых ферментов. Таким образом, хотя его химические и физические свойства (например, стабильность, диффузия и раст- воримость) идентичны свойствам активного (6S) изомера, он полностью лишен какой-либо биоло- гической функции. Следовательно, исходя из химических и биологических предпосылок, он пассив- но всасывается в слизистой оболочке кишечника с той же скоростью, что и активный изомер. Он проникает в клетки с такой же скоростью, но не подвергается воздействию фермента метионин- синтазы. В отличие от активной формы, он не переходит в тетрагидро-форму, которая превращает- ся в полиглутамат, удерживаемый клетками. В конце концов он выводится из организма, не выпол- нив никакой биологической функции. В некоторых научных исследованиях было установлено, что комбинация из двух изомеров терапевтически не оказывала никакого явно вредного воздействия. Однако невозможно абсолютно точно предсказать, что данный диастереомер не будет взаимодейс- твовать ни с одной из биологических систем. Несмотря на то что доказательств существования ка- ких-либо проблем при использовании рацемической смеси не выявлено, очевидно, было бы лучше использовать только биологически активный (6S) диастереомер.
Стабилизация природного изомера
Молекула фолиевой кислоты отличается химической стабильностью [21]. Однако химические свой- ства молекулы сильно изменяются, если птеридиновое кольцо восстановлено до дигидро- или тет- рагидро-формы. И дигидрофолат, и тетрагидрофолат чрезвычайно чувствительны к окислительно- му расщеплению молекулы в области связи C9-N10 с образованием двух продуктов распада: пте- ридина и p-аминобензоилглутамата [22]. Обе эти молекулы сами по себе неактивны и не могут био- логическим путем обратно превратиться в какую-то активную форму фолата. Подключение группы к азоту N-5 оказывает стабилизирующий эффект на процесс окислительного расщепления, поэтому 5-метилтетрагидрофолат не расщепляется, как тетрагидрофолат, однако он чувствителен к друго- му типу окислительного воздействия. Этот химический процесс сначала дает 5- метилдигидрофолат, который может подвергнуться обратному восстановлению до 5- метилтетрагидрофолата под воздействием фермента МТГФ-редуктазы (рис. 2). Хотя обычным ис- ходным субстратом для этого фермента является 5,10-метилентетрагидрофолат, вероятно, что 5- метилдигидрофолат представляет собой промежуточную форму при получении 5- метилтетрагидрофолата, продукта реакции данного фермента. Подвергнувшаяся частичному окис- лению форма 5-метилдигидрофолата становится чувствительной к дальнейшему химическому оки- слению, которое включает перестройку кольца для образования нового производного. Сперва оно было приписано структуре 4a-гидрокси-5-метилдигидрофолата [22], но позднее было определено, что у него иная химическая структура [23]. В любом случае данная структура абсолютно неактивна биологически. Кроме того, она ни химически, ни ферментативно не может быть превращена обрат- но в активный фолат. Что касается стабильности 5-метилтетрагидрофолата, следует обратить внимание на два важных аспекта. Первый – вопрос его стабильности в препарате, который мог бы использоваться в вита- минных добавках или добавляться в пищевые продукты в целях их обогащения витамином. Техни- чески удалось добиться создания препарата, который представляется достаточно стабильным для этих целей. Второй аспект заключается в вопросе стабильности 5-метилтетрагидрофолата на раз- ных этапах его поглощения и всасывания в организме, а также его общей биодоступности. Для по- лучения ответа на эти вопросы нужна информация о возможной стабильности 5- метилтетрагидрофолата в кислой среде желудка и далее в кишечнике. Есть некоторые прогнозы относительно возможной стабильности в данных условиях: высока вероятность того, что он доста- 11 точно стабилен, чтобы оставаться активным на этих этапах. Однако условия окисления и химичес- кого воздействия, которые будут иметь место в ходе этого сложного процесса, трудно смоделиро- вать. Для решения этого вопроса необходимо провести полное сравнительное исследование био- доступности фолиевой кислоты и 5-метилтетрагидрофолата.
Возможные преимущества 5-метилтетрагидрофолата по сравнению с фолиевой кислотой в добавках или обогащенных продуктах питания
Сравнение природного витамина и провитамина
Одно из преимуществ 5-метилтетрагидрофолата по сравнению с фолиевой кислотой заключается в том, что, учитывая одинаковую биодоступность и т.д., природная форма витамина предпочтитель- ней, поскольку можно предположить, что эволюция гарантировала его безопасность и переноси- мость.
Терапия пернициозной анемии
Главное преимущество 5-метилтетрагидрофолата заключается в том, что он не маскирует перни- циозную анемию. Любой 5-метилтетрагидрофолат, поступающий к клеткам костного мозга с дефи- цитом витамина B12, предположительно, плохо метаболизируется и удерживается, потому что для метаболизма необходим витамин-B12-зависимый фермент метионин. Как обсуждалось ранее, именно пониженная активность этого фермента или полное его отсутствие приводит к возникнове- нию ловушки для такого клеточного фолата, как 5-метилтетрагидрофолат. Очевидно, что внутрик- леточные полиглутаматы этой формы используются неэффективно. Кроме того, представляется вероятным, что 5-метилтетрагидрофолат моноглутамат не используется или не удерживается клет- ками с дефицитом витамина B12, что, следовательно, не дает проходить синтезу ДНК в клетках кос- тного мозга и, в свою очередь, предотвращает маскировку анемии. Существуют два эксперимента- льных доказательства, свидетельствующие о том, что 5-метилтетрагидрофолат не вызывает реак- цию костного мозга при дефиците витамина B12. Во-первых, в трех отдельных исследованиях было показано, что костный мозг, взятый у людей с дефицитом витамина B12, не реагирует на 5- метилтетрагидрофолат, хотя реагирует на фолиевую кислоту в отношении биосинтеза ДНК в клет- ках [24–26]. В этих исследованиях рассматривалась реакция недавно полученных клеток костного мозга in vitro посредством измерения повышения de novo биосинтеза пиримидина в сравнении со случаями добавления двух разных форм витамина [27]. Кроме того, есть исследование in vivo одно- го участника с дефицитом витамина B12. У этого участника исследования было показано отсутствие гематологической реакции, измеряемой по количеству ретикулоцитов при приеме 5- метилтетрагидрофолата в дозе ~100 мкг в день в течение 10 дней. Не было установлено и реакции на внутривенное введение 100 мкг 5-метилтетрагидрофолата. Лечение внутривенным B12 вызвало стойкое повышение количества ретикулоцитов.
Снижение уровня гомоцистеина в плазме
Поскольку 5-метилтетрагидрофолат участвует в метаболизме гомоцистеина, представляется веро- ятным, что данная форма витамина будет, так же как фолиевая кислота, эффективно нормализо- вывать концентрации гомоцистеина в плазме, повышение которых, как показано многими клиничес- кими исследованиями, является фактором риска развития сердечных заболеваний и инсульта [28].
Функция эндотелия
M.C. Verhaar и соавт. [29] выявили, что 5-метилтетрагидрофолат, в отличие от фолиевой кислоты, in vivo восстанавливает функцию эндотелиальных клеток у пациентов с семейной гиперхолестери- немией. Было высказано предположение, что это происходит в результате стимуляции регенерации эндогенного тетрагидробиоптерина, который, в свою очередь, может восстанавливать активность оксида азота.
Лечение психических заболеваний
В плацебоконтролируемом исследовании P.S. Godfrey и соавт. [30] было продемонстрировано зна- чительное улучшение состояния 123 пациентов с острыми психическими расстройствами на фоне 12 применения 5-метилтетрагидрофолата в дозировке 15 мг/сут в течение 6 месяцев в сравнении с плацебо.















Комментировать