Метастатическое поражение сердца – что это и как распознать? Варианты диагностики.
Чиж С.А., Шкребнева Э.И., Вертинский Е.А., Ушакова Л.Ю., Каминский К.М.
Белорусская медицинская академия последипломного образования, Городская клиническая больница №9, Минск, Республика Беларусь
Первичные злокачественные опухоли сердца встречаются редко и представлены в большинстве случаев саркомами [8]. Значительно чаще имеет место метастатическое поражение сердца, распространенность которого по данным аутопсий онкологических больных составляет 22–31% [5, 10, 11]. Наиболее частыми опухолями, метастазирующими в сердце, являются рак легкого, рак пищевода, лимфома, рак молочной железы, лейкозы, рак желудка и меланома [4, 7]. Поражение сердца обычно осуществляется гематогенным и лимфогенным путями, прямым распространением первичной опухоли на сердце или проникновением опухолевых тромбов в правые отделы сердца через систему нижней полой вены [1].
Прижизненно распознать метастатическое поражение сердца непросто из-за часто встречающихся неспецифических симптомов, обычно на фоне развернутой клинической картины первичной опухоли. Основными клиническими проявлениями могут быть быстро прогрессирующая сердечная недостаточность, различные виды нарушений ритма и проводимости, признаки экссудативного перикардита. Значительно более редко метастатическое поражение сердца проявляется картиной острого инфаркта миокарда. Обычно это обусловлено эмболией в коронарную артерию мелких фрагментов опухоли или сдавлением опухолевыми массами крупных эпикардиальных артерий [2, 7]. При этом наблюдается типичная динамическая картина острого инфаркта миокарда, подтвержденная ангиографическими, электрокардиографическими, ультразвуковыми и лабораторными данными. Еще реже обнаруживаются инфарктоподобные изменения, связанные с инвазией миокарда метастазирующей опухолью, на электрокардиограмме [6, 9–11]. Характерным считается отсутствие динамических изменений на электрокардиограмме. В частности, наблюдается персистирующая элевация сегмента ST, при этом не формируется патологический зубец Q. Кроме того, отсутствует клиническая картина острого инфаркта миокарда, не повышается уровень кардиоспецифических ферментов и тропонина, данные коронарографии не выявляют признаков окклюзии. При ультразвуковом исследовании сердца локализация вовлеченных сегментов соответствует тем или иным электрокардиографическим отведениям.
Имеется несколько механизмов, объясняющих подобные псевдоинфарктные изменения на электрокардиограмме. Предполагается продолжительное повреждение миокарда, препятствующее формированию новых клеточных мембран, растяжение прилежащих мышечных волокон, вторичная воспалительная реакция, изменения в трансмембранном Na+-K+ градиенте и переход К+ из пораженных тканей в прилежащий миокард [3, 5].
Наблюдавшийся нами случай метастатического поражения сердца злокачественной лимфомой с инфарктоподобными изменениями на электрокардиограмме демонстрирует сложности дифференциальной диагностики и представляет несомненный интерес для практикующих врачей.
Пациентка В., 1984 г.р., поступила в отделение гематологии учреждения здравоохранения «Городская клиническая больница №9» г. Минска 5.03.2011г. с диагнозом: Неходжкинская лимфома с поражением лимфоузлов средостения, шейных лимфоузлов слева. Вторичный перикардит. Миокардиодистрофия. Н1. ХСН ФК1 (NYHA).
До этого с 15.02.2011г. по 03.03.2011г. находилась на стационарном лечении в инфарктном отделении. Диагноз неходжкинской лимфомы подтвержден данными компьютерной томографии от 23.02.2011г.: КТ-картина системного лимфопролиферативного заболевания с поражением лимфоузлов средостения, брюшной полости и забрюшинного пространства; очаговой лимфоидной инфильтрацией легких, желчного пузыря, поджелудочной железы, селезенки, правой почки.
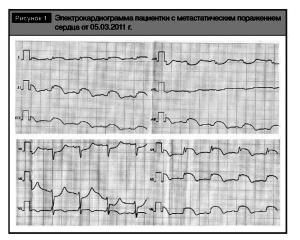
При поступлении пациентки в отделение гематологии обращала на себя внимание своеобразная электрокардиограмма, характерная для картины острого трансмурального повреждения миокарда и не соответствующая жалобам пациентки и клиниколабораторным данным (рис.1).
Подобная электрокардиографическая картина послужила поводом для госпитализации в инфарктное отделение. 15.02.2011г. была проведена коронарография: левая коронарная артерия, передняя межжелудочковая ветвь, огибающая ветвь, правая коронарная артерия – без признаков стенозирования; тип кровоснабжения смешанный. Тропонин от 16.02.2011г. составил менее 0,5.
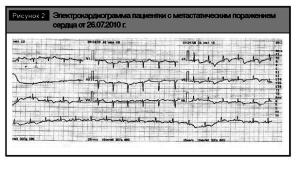
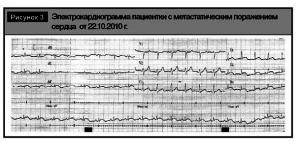
Нами был проведен ретроспективный анализ электрокардиограмм пациентки, который показал, что инфарктоподобные изменения на электрокардиограммах регистрируются более полугода с тенденцией к прогрессированию (рис. 2, 3).
10.03.2011 г. проведено ультразвуковое исследование сердца, в ходе которого выявлено объемное образование нижне-боковой области левого желудочка размером 55 ? 35 ? 40 мм неоднородной эхогенности и эхоструктуры, без четкого контура, визуализируемое из парастернального доступа по длинной и короткой осям сердца на уровне папиллярных мышц (рис. 4), а также из апикального доступа в четырехкамерной проекции (рис. 5).
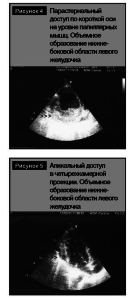
С учетом основного диагноза полученные результаты эхокардиографического исследования были интерпретированы как проявления очаговой лимфоидной инфильтрации нижне-боковой стенки левого желудочка.Таким образом, электрокардиографическая картина, характерная для острой стадии крупноочагового инфаркта миокарда, в данном случае является следствием метастатического поражения сердца при злокачественной лимфоме.
ЛИТЕРАТУРА
1. Бокерия Л. А., Малашенков А. И., Кавсадзе В. Э., Серов Р.А. Кардиоонкология. – М.: Изд-во НЦССХ, 2003. – 250 .
2. Abraham K.P., Reddy V., Gattuso P. // Am. J. Cardiovasc. Pathol. – 1990. – Vol. 3. – P. 195–198.
3. Aragon J. // Cardiol. Rev. – 2004. – Vol. 12. –P. 31–36.
4. Astorri E., Bonetti A., Fiorina P. // Int. J. Cardiol. –2000. – Vol. 74. – P. 225–226.
5. Cates C.U., Virmani R., Vaughn W.K., Robertson R.M. // Am. Heart. J. – 1986. – Vol. 112. – P. 1297–1303.
6. Harris T.R., Copeland G.D., Brody D.A. // Am.Heart. J. – 1965. – Vol. 69. – P. 392–400.
7. Lam K.Y., Dickens P., Chan A.C. // Arch. Pathol.Lab. Med. – 1993. – Vol. 117. – P. 1027–1031.
8. Lehrman K.L., Prozan G.B., Ullyot D. // Am. Heart.J. – 1985. – Vol. 110. – P. 1293–1295.
9. Nakamura A., Suchi T., Mizuno Y. // Jpn. Circ. J. –1975. – Vol. 39. – P. 531–542.
10. Strauss B.L., Matthews M.J., Cohen M.H. et al. // Chest. – 1977. – Vol. 71. – P. 607–611.
11. Tamura A., Matsubara O., Yoshimura N. et al. // Cancer. – 1992. – Vol. 70. – P. 437–442.
Данная статья взята из журнала «Медицинские новости», №6, 2011.









Комментировать