Підходи до медикаментозного лікування артеріальної гіпертензії з позицій сучасних принципів доказової медицини, даних великомасштабних рандомізованих досліджень, рекомендацій та настанов.
Лисенко Григорій Іванович — доктор медичних наук, професор, завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, Київ, Ященко Оксана Борисівна — кандидат медичних наук, доцент кафедри сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, Київ
Резюме. Розглянуто підходи до медикаментозного лікування АГ з позицій сучасних принципів доказової медицини, даних великомасштабних рандомізованих досліджень, рекомендацій та настанов.
Вступ
У ХХІ ст. значна розповсюдженість артеріально їгіпертензії (АГ) залишається провідною медиксоціальною проблемою, яка привертає увагу інтерністів в усьому світі. АГ — найбільш поширене неінфекційне захворювання на Землі, що значною мірою визначає високу смертність осіб працездатного віку та інвалідність від серцевосудинних і це— реброваскулярних захворювань.
Із впевненістю можна сказати, що проблема АГ за останні 20 років найретельніше досліджується, найчастіше дискутується і найдетальніше висвітлюється як у світовій, так і в українській медичній літературі, рекомендаціях та настановах.
Існують рекомендації щодо лікування АГ, опубліковані Всесвітньою організацією охорони здоров’я (World Health Organization — WHO) та Міжнародною cпілкою дослідження АГ (International Society of Hypertension — ISH) (WHO/ISH, 1993; Chalmers J. et al., 1999).
Виходячи з того, що деякі діагностичні і терапевтичні рекомендації WHO/ISH, можливо, не повністю підходять для всіх Європейських країн, система охорони здоров’я та економічні можливості яких значно різняться, опубліковані особливі методичні рекомендації Європейського товариства гіпертензії (European Society of Hypertension — ESH) та Європейського товариства кардіологів (European Society of Cardiology — ESC) щодо лікування АГ (ESH/ESC Guidelines Committee, 2003; Erdine S. et al., 2006; Mancia G. et al., 2007).
В умовах розвитку системи охорони здоров’я в країнах Європи для пацієнтів з АГ може бути застосована більш глибока оцінка серцево- судинного ризику та ураження органів, а також наявний більш широкий вибір антигіпертензивного лікування. Так, G. Mancia та співавторами (2010) представлена остання редакція спільних рекомендацій ESH/ESC з виправленнями та доповненнями до діючих Європейських рекомендацій щодо лікування АГ.
Не стояли осторонь проблеми АГ і українські кардіологи. Так, Указом Президента України від 04.02.1999 р. № 117/99 затверджено Національну програму профілактики і лікування артеріальної гіпертензії в Україні, яка діяла протягом 1999– 2010 рр. З 1999 р. вийшли 4 редакції рекомендацій Української асоціації кардіологів з профілактики та лікування АГ (4-те видання, виправлене та доповнене, розроблено як посібник до програми) (Свіщенко Є.П. та співавт., 2008). У 2009 р. вийшла Настанова з кардіології, рекомендована Асоціацією кардіологів України та вченою радою Національного наукового центру «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України для широкого кола фахівців: кардіологів, ревматологів, кардіохірургів, реаніматологів, терапевтів, сімейних лікарів, наукових співробітників, студентів вищих медичних навчальних закладів (Коваленко В.М. (ред.), 2009).
Але незважаючи на всебічне і своєчасне висвітлення у спеціалізованій літературі тактики ведення хворих на АГ, питання медикаментозного лікування останньої потребують постійного розтлумачування і «впровадження в свідомість» лікарів, більшість з яких, як свідчить досвід, призначають найбільш «модний», «розрекламований» препарат, або препарат, який, на їхню думку, є найкращим.
Мета лекції — розглянути підходи до медикаментозного лікування АГ з позицій сучасних принципів доказової медицини, даних великомасштабних рандомізованих досліджень, рекомендацій та настанов.
Медикаментозне лікування АГ
На сьогодні рівень знань не дає можливості ставити завдання щодо цілковитого виліковування АГ, але проведення ефективної терапії та запобігання прогресуванню захворювання є реальним завданням.
Мета лікування — зниження смертності від серцево-судинних захворювань. Чим вищий артеріальний тиск (АТ), тим вищий ризик мозкового інсульту, ішемічної хвороби серця (ІХС) та передчасної смерті. Довготривала АГ призводить до ураження органівмішеней — гіпертрофії лівого шлуночка (ГЛШ), серцевої недостатності (СН), порушення функції нирок, аж до розвитку ниркової недостатності тощо. Навіть незначне підвищення АТ несе в собі істотний ризик для здоров’я. Так, 60% серцево-судинних ускладнень спостерігають у хворих із помірним підвищенням діастолічного АТ (не вищим за 95 мм рт. ст.), оскільки такі пацієнти становлять переважну більшість осіб із підвищеним АТ. Лікуванню підлягають також хворі з ожирінням, дисліпідемією та іншими супутніми факторами ризику.
Основні принципи лікування АГ:
- Лікування (немедикаментозне і медикаментозне) необхідно починати якомога раніше і проводити його постійно, як правило, протягом всього життя. Поняття «курсове лікування» до антигіпертензивної терапії неприйнятне.
- Усі особи з підвищеним АТ підлягають немедикаментозному лікуванню чи модифікації способу життя. Дієтичні рекомендації відіграють важливу роль серед немедикаментозних методів корекції АГ.
- Схема лікування має бути простою (за можливості — за принципом «одна таблетка на день»), що сприяє збільшенню кількості хворих, які дійсно лікуються, і відповідно — зменшенню кількості тих, які припиняють лікування.
- Перевагу слід надавати антигіпертензивним препаратам тривалої дії («ретард», sustained- release — SR), що дозволяє запобігти виникненню значних коливань АТ протягом доби, а також зменшити кількість таблеток, які необхідно приймати.
- Хворі літнього віку з ізольованою систолічною АГ підлягають лікуванню так само, як і особи із систолодіастолічною АГ.
- У пацієнтів із вторинною АГ першочерговим завданням є лікування її причини. АГ також підлягає обов’язковій корекції.
Основні переваги антигіпертензивної терапії зумовлені зниженням АТ per se і значною мірою не залежать від застосованих лікарських засобів (Mancia G. et al., 2007).
Проведено безліч досліджень, у яких вивчали різні підходи до антигіпертензивної терапії та оцінювали фатальні й нефатальні події у пацієнтів з АГ. Найбільш значимими доказами з існуючих є результати рандомізованих плацебоконтрольованих випробувань, які можна підсумувати так:
- Антигіпертензивна терапія істотно знижує серцево-судинну захворюваність і смертність, але менш істотно впливає на загальну смертність.
- Поліпшення прогнозу під впливом антигіпертензивної терапії спостерігають у хворих всіх вікових (включаючи осіб з ізольованою систолічною АГ) та етнічних груп.
- Антигіпертензивна терапія на 50% знижує ризик розвитку СН, на 30–40% — фатального і нефатального інсульту та на 20% — ризик коронарних подій.
Сучасний арсенал лікарських засобів для лікування пацієнтів із серцево-судинними захворюваннями надзвичайно великий і включає близько 20 основних фармакологічних груп, що нараховують сотні препаратів із різними механізмами дії. Це вимагає від лікаря-інтерніста володіння глибокими і різнобічними знаннями в галузі клінічної фармакології як фундаментальної основи, відповідно до позицій доказової медицини та раціональної фармакотерапії.
Під раціональною фармакотерапією розуміють призначення хворим лікарських засобів згідно з клінічною ситуацією у дозах, які відповідають індивідуальним потребам, на адекватний період та з найменшими витратами для пацієнтів і суспільства. Підґрунтям раціональної фармакотерапії є клінічна фармакологія — наука, яка вивчає взаємо- дію лікарських засобів з організмом здорової та хворої людини.
Принципи здійснення раціональної фармакотерапії включають:
- Завдання для здійснення раціональної фармакотерапії:
- вибір фармакологічної групи лікарських засобів;
- вибір лікарських засобів, конкретного представника фармакологічної групи (оригінального лікарського засобу або його копії-генерика);
- призначення адекватного режиму дозування.
- Визначення фармакологічної мішені.
- Контроль за фармакологічним ефектом лікарських засобів.
- Контроль за можливим розвитком резистентності до лікарських засобів та синдрому відміни та заходи щодо їх запобігання.
- Урахування особливостей фармакотерапії залежно від віку хворих, у період вагітності та годування грудьми.
- Урахування особливостей фармакотерапії залежно від наявності різних видів токсикоманій (тютюнопаління, алкоголізм, наркоманія).
Усі етапи фармакокінетики лікарських засобів — всмоктування, розподіл, метаболізм (біотрансформація) — перебувають під контролем відповідних генів. Не викликає сумнівів те, що особливості фармакокінетики лікарських речовин мають особливості, зумовлені генетичною індивідуальністю пацієнтів, їх віком, біологічними ритмами, а також наявністю супутніх захворювань.
Інтер- та інтраіндивідуальна варіабельність ферментів біотрансформації лікарських засобів визначає відмінності у фармакокінетиці та фармакодинаміці, зумовлюючи
- надмірний терапевтичний ефект — при низькій активності (у повільних фенотипів);
- підвищену токсичність лікарського засобу у результаті відсутності його трансформації (у повільних фенотипів);
- знижений терапевтичний ефект — при високій активності (у швидких фенотипів);
- появу токсичних метаболічних продуктів, що утворюються на різних шляхах метаболізму (Blardi P., 1997).
Незважаючи на високу інформатизацію, достовірних методів прогнозування індивідуальної переносимості того чи іншого препарату в лікарській практиці не існує, хоча визначення фенотипу активності ферментів дозволяє прогнозувати декілька відповідей організму на лікарські засоби, що застосовуються:
- Токсичність лікарського засобу зумовлена його вихідним (нативним) складом при елімінації винятково шляхом дезактивації поліморфним ензимом. Ніяких додаткових шляхів («стежок») метаболізму не існує (наприклад накопичення продуктів метаболізму в повільних фенотипів (ізоніазидні невропатії, хвороба Паркінсона, індукована пестицидами)).
- При поліморфних шляхах метаболізму можливе зміщення на альтернативний, додатковий шлях з утворенням реактивної проміжної ланки токсичності (наприклад у повільних фенотипів із розвитком факторів ризику токсичності (ізоніазидна гепатотоксичність)).
- Токсичність провокується реактивним метаболітом, що генерується при дії поліморфного ензиму. В цих випадках швидкі метаболізатори, порівняно з повільними, мають більш високий ризик розвитку інтоксикації або хімічного канцерогенезу (Eichelbaum M. et al., 1992; Kato R., 1995).
Застосування плацебо при АГ вважають неприйнятним через очевидність користі антигіпертензивної терапії, тому такі дослідження на сьогодні не проводять. Протягом останніх 10 років всі дослідження щодо лікування АГ мають характер порівняння різних препаратів не з плацебо, а між собою.
Плацебо може бути використане додатково до базової терапії. У таких випадках досліджуваний препарат додають до тієї ж самої базової терапії.
Результати ряду досліджень показали, що зниження АТ хоча б на кілька мм рт. ст. зменшує ризик розвитку ускладнень на 20–30%. У цілому більш істотне зниження АТ дає більш істотний превентивний ефект щодо ускладнень, незалежно від характеру терапії, що застосовують. Порівняння різних класів антигіпертензивних препаратів між собою свідчить, що вони мають певні особливості щодо запобігання ускладненням.
Як показує метааналіз BPLTTC (Blood Pressure Lowering Treatment Trialists’ Collaboration), антагоністи кальцію дещо ефективніші, ніж блокатори β-адренорецепторів, діуретики та інгібітори ангіотензинперетворювального ферменту (ІАПФ) у запобіганні інсульту, але менш ефективні щодо запобігання СН (BPLTTC, 2003). Щодо запобігання ІХС, зниження смертності від серцево-судинних захворювань і загальної смертності ці групи препаратів істотно не відрізняються між собою.
Ефективність блокаторів β- адренорецепторів у запобіганні інсульту нижча, ніж у блокаторів рецепторів ангіотензину II (БРА) і антагоністів кальцію. Це продемонстровано у дослідженнях LIFE (Losartan Intervention For Endpoint) і ASCOT (Anglo- Scandinavian Cardiac Outcomes Trial), у яких ризик інсульту був вищим у пацієнтів, які застосовували атенолол у поєднанні з тіазидним діуретиком, порівняно з пацієнтами, яким проводили лікування лозартаном або амлодипіном в поєднанні з периндоприлом (Scheen A.J., 2002; Moser M., 2005). Як показало дослідження BPLTT (Blood Pressure Lowering Treatment Trial), ІАПФ мають додаткову здатність запобігати ускладненням ІХС (Mancia G. et al., 2007).
Відповідно до рекомендацій ESH/ESC та Української асоціації кардіологів з профілактики та лікування АГ для лікування АГ необхідно застосо- вувати антигіпертензивні препарати 5 основних класів — препарати першої лінії, які при застосуванні в еквівалентних дозах сприяють зниженню АТ та суттєво знижують ризик серцево-судинних ускладнень (Mancia G. et al., 2007; Свіщенко Є.П. та ін., 2008):
- діуретики;
- ІАПФ;
- антагоністи кальцію тривалої дії;
- БРА;
- блокатори β-адренорецепторів.
До антигіпертензивних препаратів другої лінії відносять:
- блокатори α1-адренорецепторів;
- агоністи α2- адренорецепторів центральної дії;
- алкалоїди раувольфії;
- агоністи імідазолінових рецепторів.
Існує значно менше доказів ефективного зниження ризику серцево-судинних ускладнень при застосуванні препаратів другої лінії порівняно з препаратами першої лінії.
Антигіпертензивні препарати першої лінії Діуретики
Діуретики широко застосовують для лікування пацієнтів з АГ протягом близько 50 років. За даними численних проспективних досліджень, лікування АГ діуретиками сприяє зниженню частоти розвитку інфаркту міокарда (ІМ) на 14–16%, інсульту — на 38–42%. За даними дослідження EWPHE (European Working Party on High Blood Pressure in the Elderly), серед хворих похилого віку, які застосовують комбінацію тіазидного та калійзберігаючого діуретиків, виявляють зниження смертності внаслідок ІМ на 60% (EWPHE, 1985). У результаті досліджень SHEP (Systolic Hypertension in the Elderly Program), MRC (Medical Research Council) та STOP-Hypertension встановлено, що діуретики ефективніше, ніж блокатори β- адрено- рецепторів, запобігають виникненню ускладнень з боку серцево-судинної системи у пацієнтів похилого віку (Dahlоf B. et al., 1991; Singer R.B., 1991; Mitchell A.B., 1992). У дослідженні SHEР також показано, що застосування тіазидоподібного діуретика хлорталідону дозволило знизити частоту розвитку СН на 50% (Singer R.B., 1991).
З початку 90-х років ХХ ст. у країнах Європи спостерігали тенденцію до зменшення використання діуретиків для лікування АГ. Частково це пов’язано з публікацією результатів дослідження MRFIT (Multiple Risk Factor Intervention Trial), у якому у хворих на АГ, в яких встановлено вихідні зміни на електрокардіограмі у спокої, виявляли вищу смертність внаслідок ІХС. Це пов’ язували з розвитком фатальних аритмій, зумовлених гіпокаліємією і негативною дією діуретиків на ліпідний профіль (Grimm R.H. Jr. et al., 1985).
Однак всебічна оцінка результатів інших великих досліджень показала, що роль діуретиків у запобіганні смертності внаслідок ІМ недооцінена. Дослідження HYVET (Hypertension In The Very Elderly Trial) у популяції пацієнтів з АГ похилого і старечого віку продемонструвало достовірне зниження ризику загальної смертності на 21%, фатального інсульту — на 39% і СН — на 64% при лікуванні індапамідом тривалої дії в дозі 1,5 мг (HYVET, 2009).
Застосування пролонгованої форми індапаміду (Індапамідратіофарм SR, «TEVA», Ізраїль (1,5 мг)), на відміну від індапаміду у стандартному дозуванні (2,5 мг), забезпечує постійну концентрацію діючої речовини у крові та запобігає різким коливанням АТ протягом доби.
Дані досліджень свідчать, що діуретики є препаратами вибору при лікуванні хворих похилого віку, пацієнтів із систолічною АГ, а також при супутній СН.
У дослідженні ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) вивчена порівняльна ефективність амлодипіну, лізиноприлу, доксазозину і хлорталідону у запобіганні ускладненням ІХС. У січні 2000 р. частину дослідження, в ході якої вивчали дію доксазозину, було передчасно зупинено, тому що цей препарат виявився менш ефективним у запобіганні ускладненням АГ порівняно з тіазидоподібним діуретиком хлорталідоном: частота розвитку ускладнень у пацієнтів, які застосовували хлорталідон, була на 25% нижчою, ніж у осіб, які застосовували доксазозин (ALLHAT, 2002).
Підтвердження високої ефективності діуретиків отримані також у дослідженні INSIGHT (Intervention as a Goal in Hypertension Treatment), у ході якого >6 тис. пацієнтів з АГ застосовували лікування або гідрохлоротіазидом у комбінації з амілоридом, або ніфедипіном GITS (Gastro-Intestinal Therapeutic System) (Kjeldsen S.E. et al., 2000). Загальна частота розвитку ускладнень з боку серцево-судинної системи, випадків інсульту та ІМ та смертності внаслідок них були практично однаковими у хворих, які застосовували діуретики та ніфедипін, а частота розвитку СН і фатального ІМ — відповідно в 2 і 3 рази нижча у хворих, які застосовували діуретики.
Дослідження STOP-Hypertension, STOP- Hypertension-2 і NORDIL (Nordic Diltiazem) показали, що діуретики не поступаються за ефективністю антигіпертензивним препаратам більш нових класів — антагоністам кальцію та ІАПФ (Dahlоf B. et al., 1991; 1993; Kjeldsen S.E. et al., 2000).
Крім антигіпертензивної дії, важливою особливістю діуретиків є їхня здатність запобігати ураженням органів-мішеней при АГ. Метааналіз рандомізованих досліджень показав, що діуретики (головним чином індапамід) сприяють регресії ГЛШ. Несподіваними стали результати досліджень VACS (Veterans Affairs Cooperative Study) і LIVE (Losartan Intervention For Endpoint), у яких більш виражену дію щодо ГЛШ мали діуретики і меншу — ІАПФ. Доведено, що діуретики зумовлюють також помірну ренопротекторну дію, яка проявляється у зниженні мікроальбумінурії на 10% (VAC STUDY, 1972; Sheridan D.J., 1999).
Таким чином, діуретики залишаються ефективними препаратами першої лінії в лікуванні АГ, а використання їх у низьких дозах дозволяє значно знизити ризик виникнення небажаних метаболічних ефектів.
Найбільш прийнятними для лікування АГ є тіазидні та тіазидоподібні діуретики (табл. 1), а калійзберігаючі та петльові діуретики застосовують лише в певних ситуаціях.

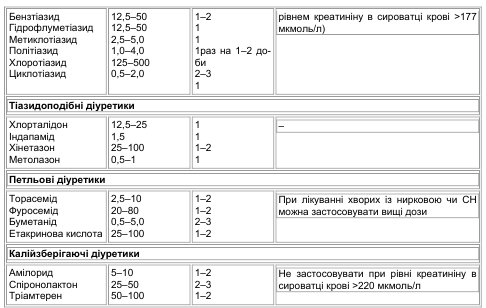
Діуретичний ефект тіазидних діуретиків реалізується внаслідок гальмування реабсорбції іонів натрію переважно в кортикальному сегменті петлі нефрону (петлі Генле). Еталонний представник тіазидних діуретиків — гідрохлоротіазид.
Петльові діуретики діють впродовж усього висхідного відділу петлі Генле, у зв’язку з чим і одержали свою назву. Найбільш широко застосовувані з них — фуросемід і торасемід.
Для лікування хворих на АГ фуросемід використовують рідко через нетривалість дії (до 6 год) і незначний антигіпертензивний ефект. Крім того, фуросемід має ряд суттєвих недоліків, головними з яких є виражені порушення електролітного складу крові, ототоксичність і синдром «рикошету». Суть останнього полягає в тому, що короткодіючі діуретики призводять до вираженого натрійурезу протягом 6 год після застосування. Однак екскреція натрію протягом останніх 18 год знижується до дуже низького рівня, оскільки втрата рідини, що була викликана діуретиком, призводить до активації натрійзберігаючих механізмів, які запускають ренінангіотензинальдостеронову (РААС) і симпатичну нервову системи. Підвищення концентрації таких нейрогормонів, як ангіотензин II, альдостерон і норадреналін, викликає підвищення реабсорбції натрію у канальцях, що призводить до ще більшої затримки натрію в організмі.
Петльові діуретики застосовують для лікування пацієнтів з АГ при наявності ниркової недостатності, коли підвищення рівня креатиніну в сироватці крові становить >177 мкмоль/л, а також у хворих із СН у разі неефективності тіазидних діуретиків.
Торасемід (Діувер, «TEVA», Ізраїль) характеризується менш вираженим піковим ефектом і більшою, ніж у фуросеміду, тривалістю дії, що розширює показання щодо лікування пацієнтів з АГ.
Як і всі петльові діуретики, торасемід інгібує реабсорбцію натрію і хлоридів у висхідній частині петлі Генле і, на відміну від фуросеміду, також блокує ефекти альдостерону, тобто меншою мірою підсилює ниркову екскрецію калію. Це знижує ризик розвитку гіпокаліємії — одного з головних побічних ефектів петльових та тіазидних діуретиків.
Ефективність торасеміду перевищує таку фуросеміду та інших діуретиків. Так, за даними Нью- Йоркської кардіологічної асоціації (New York Heart Association — NYHA) зниження функціонального класу СН відзначили у 45,8 та 37,2% пацієнтів, які застосовували торасемід та фуросемід відповідно (р=0,00017) (Cosin J. et al., 2002). Крім то- го, торасемід рідше викликав гіпокаліємію. Позитивний вплив торасеміду щодо прогнозу у хворих на хронічну СН (ХСН) підтверджено зниженням загальної смертності більше ніж у 2 рази та зниженням серцево-судинної смертності на 59,7% порівняно з групою хворих, які застосовували фуросемід та інші діуретики.
Вивченню ефективності та безпеки неінтенсивного режиму дегідратації під час застосування торасеміду порівняно з фуросемідом при лікуванні хворих із декомпенсованою ХСН присвячено багатоцентрове рандомізоване порівняльне дослідження ДУЕЛЬ-ХСН. При загальній оцінці досягнення компенсації без ускладнень і необхідності переведення хворих на внутрішньовенне застосування діуретиків повної компенсації ХСН досягли 94,8 і 86,1% (р<0,01) пацієнтів, які застосовували торасемід і фуросемід відповідно. За фактом збе- реження III–IV функціонального класу ХСН ефек- тивність терапії торасемідом становила 83,7 проти 72,1% (р<0,01) відповідно.
Калійзберігаючі діуретики характеризуються слабкою діуретичною і антигіпертензивною дією. Самостійного значення в лікуванні АГ вони не мають, однак їх застосовують у комбінації з іншими діуретиками для зниження гіпокаліємії.
Калійзберігаючі діуретики реалізують свій ефект переважно в ділянці дистальних ниркових канальців, у корковому і мозковому відділах ниркової паренхіми та збірних трубках. Вони знижують реабсорбцію іонів натрію, пригнічують екскрецію іонів калію і протонів водню.
Спіронолактон — препарат вибору для симптоматичного лікування пацієнтів з АГ при первинному гіперальдостеронізмі (синдромі Кона).
Механізм антигіпертензивної дії діуретиків
Механізм вазодилатаційної дії діуретиків остаточно не з’ясований. Його пояснюють рефлекторним впливом часткового зменшення ОЦК і тка- нинного кровотоку на тонус судин. У зниженні судинного тонусу відіграє роль також регресія гіпертрофії м’язового шару судин при тривалому лікуванні.
Як антигіпертензивні засоби діуретики найбільш ефективні в таких клінічних ситуаціях:
- похилий вік;
- ізольована систолічна АГ у людей похилого віку;
- затримка рідини і ознаки гіперволемії (периферичні набряки, пастозність шкіри);
- супутня СН, ниркова недостатність (петльові діуретики);
- остеопороз;
- гіперальдостеронізм (спіронолактон).
На початковому етапі лікування (1–2 тиж) антигіпертензивний ефект діуретиків зумовлений зменшенням об’єму циркулюючої крові (ОЦК) і позаклітинної рідини внаслідок підвищення екскреції натрію. У цей період протягом кількох днів можливе деяке підвищення загального периферичного судинного опору (ЗПСО) і зменшення серцевого викиду. Ці реакції нетривалі й пояснюються зниженням ОЦК. Через 1–2 тиж терапії починає проявлятися вазодилатаційна дія діуретиків, яка зберігається протягом усього наступного періоду лікування.
Вазодилатація є основним механізмом зниження АТ при тривалому застосуванні діуретиків. Певний час (до 1 міс) вищезазначені фактори, що викликають антигіпертензивний ефект, діють паралельно і одночасно. Потім серцевий викид і ОЦК відновлюються до вихідного рівня
Підвищення дози значно підвищує ймовірність побічних явищ, тому діуретики призначають у невисоких дозах (наприклад гідрохлоротіазид — 12,5 мг/добу, індапамід (SR) — 0,625–1,5 мг/добу, кратність застосування — 1 раз на добу). Для запобігання втраті калію рекомендують комбінувати тіазидні і калійзберігаючі діуретики (крім випадків, коли діуретики застосовують у низьких дозах (6,25–12,5 мг/добу) або в комбінації з ІАПФ).
Основні негативні ефекти діуретиків — гіпокаліємія та несприятливий вплив на обмін глюкози, ліпідів, пуринів. Індапамід (SR) зумовлює найменший вплив на вуглеводний та ліпідний обмін.
ІАПФ
В Україні та деяких інших країнах ІАПФ — найбільш широко використовувана група з усіх антигіпертензивних препаратів (табл. 2).
ІАПФ
В Україні та деяких інших країнах ІАПФ — найбільш широко використовувана група з усіх ан тигіпертензивних препаратів (табл. 2).
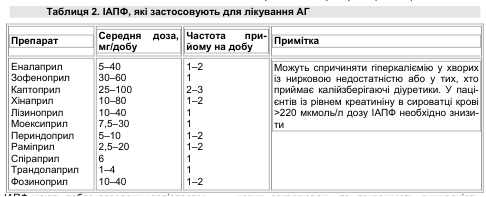
ІАПФ мають добре доведену кардіопротекторну і ренопротекторну дію. Вони більш істотно, ніж діуретики, антагоністи кальцію, блокатори β- адренорецепторів гальмують прогресування ниркових захворювань та покращують виживаність пацієнтів із хронічною хворобою нирок.
ІАПФ рекомендовані асоціаціями кардіологів, нефрологів та діабетологів до застосування у хворих із діабетичною і недіабетичною нефропатією, оскільки, крім гіпотензивного ефекту, позитивно впливають на внутрішньониркову гемодинаміку й зменшують вираженість протеїнурії та мікроальбумінурії, знижують проникність базальної мембрани клубочків, покращують функції ендотелію, блокують фактори росту та запалення. ІАПФ доцільно призначати усім хворим із діабетичною нефропатією на тлі цукрового діабету (ЦД) 1-го та 2-го типу, хворим із недіабетичними ураженнями нирок незалежно від рівня АТ та протеїнурії. За L.Н. Opie (1999) існують ІАПФ 3 класів (табл. 3).

Каптоприл — добре вивчений препарат І класу з нефропротекторною дією. Однак у зв’язку з короткотривалою (6–8 год) дією його застосовують 3–4 рази на добу. ІАПФ ІІ класу мають більш тривалий період напіввиведення (18–24 год); їх застосовують 1–2 рази на добу. Препарати ІІІ класу діють протягом 24 год та забезпечують м’який стабільний ефект.
Ліпофільні властивості ІАПФ зумовлюють їх схильність до кумуляції в жировій тканині та низьку ефективність у хворих з надмірною масою тіла.
ІАПФ ІІІ класу лізиноприл (Лізиноприл- ратіофарм, «TEVA», Ізраїль) завдяки гідрофільним властивостям не метаболізується в організмі, а виділяється нирками в незмінному вигляді, тому безпечний для лікування хворих на АГ та з ураженнями печінки. До того ж він незначно зв’язується з білками плазми крові, не змінює фа- рмакокінетику інших препаратів і може застосовуватись у комбінації з серцевими глікозидами, антикоагулянтами, антиаритмічними та іншими препаратами.
Лізиноприл довів свою ефективність і безпеку при застосуванні у пацієнтів з надмірною масою тіла (Weir M.R. et al., 1998).
У перші 2 міс застосування ІАПФ можливе транзиторне підвищення концентрації креатиніну в сироватці крові (як наслідок змін ниркової гемодинаміки), тому необхідний контроль рівня останнього.
У більшості пацієнтів через 3–6 тиж застосування ІАПФ функціональні показники ниркової функції покращуються, а рівень креатиніну в сироватці крові швидко стабілізується, а потім знижується. Підвищення рівня креатиніну <30% на фоні застосування ІАПФ не вважають показанням для відміни препарату. При прогресуючому погіршенні функції нирок на фоні застосування ІАПФ або БРА слід виключити двобічний стеноз ниркових артерій або стеноз артерії єдиної нирки.
Гіперкаліємія — потенційно можливе ускладнення застосування ІАПФ, особливо у хворих на ЦД, нефротичним синдромом і хронічною нирковою недостатністю при паралельному проведенні гемотрансфузій, кровотечах (носових, шлункових, кишкових), гемолізі, застосуванні медикаментів (тріамтерен, манітолу гексанітрат, спіронолак- тон), сепсисі.
Виникнення гіперкаліємії потребує відповідних дієтичних обмежень та медикаментозного лікування.
Препаратами вибору серед ІАПФ є еналаприл, лізиноприл, хінаприл, раміприл, а при підвищеному рівні креатиніну в сироватці крові — фозиноприл або моексиприл в середніх терапевтичних дозах. З метою досягнення антипротеїнуричного ефекту дозу ІАПФ підвищують в 2–4 рази від початкової.
При лікуванні АГ на тлі хронічних захворювань нирок враховують не лише їх гіпотензивний, але й антипротеїнуричний і протисклеротичний ефекти.
За даними метааналізу BPLTT ІАПФ порівняно з плацебо знижують ризик розвитку інсульту на 28%, ускладнень ІХС — 22%, СН — 18%. Порівняно з діуретиками або блокаторами β- адренорецепторів ІАПФ не мають істотних відмінностей щодо впливу на ці ускладнення, загальну або серцево-судинну смертність, однак порівняно з антагоністами кальцію вони вірогідно ефективніше запобігають СН і менш ефективно — інсульту.
Незважаючи на те що на сьогодні існує величезна доказова база ефективності та безпеки застосування ІАПФ у пацієнтів з АГ (враховуючи хворих на ЦД, ХСН), триває дискусія щодо ролі ІАПФ у лікуванні пацієнтів з гострим ІМ (Ambrosioni
- et , 1995; Ball S.G. et al., 1995; Latini R. et al., 1995; Goa K.L. et al., 1996; Преображенский Д.В., Сидоренко Б.А., 1997).
У дослідженнях, в яких вивчали застосування ІАПФ у хворих після перенесеного ІМ, отримано негативні результати, а саме: відсутність позитивного терапевтичного ефекту, іноді — небажані побічні реакції. Як свідчать результати дослідження CONSENSUS II (Cooperative New Scandinavian Enalapril Survival Study II), стратегія застосування еналаприлу з перших годин захворювання не мала успіху у всіх хворих на ІМ (смертність у групі плацебо становила 10,2%, а в групі пацієнтів, які застосовували еналаприл — 11%), тому дослідження було зупинено достроково. Більше того, частота розвитку стійкої гіпотонії, пов’язаної із застосуванням еналаприлу, становила 12%, що призвело до вірогідного підвищення смертності (в середньому — на 9%) (Swedberg K. et al., 1992).
У дослідженні GISSI-3 (Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico) оцінювали ефективність застосування лізиноприлу в початковій добовій дозі 5 мг з подальшим її підвищенням до 10 мг у 19 394 пацієнтів у гострий період ІМ. Період спостереження становив 6 тиж. Терапію нітратами або лізиноприлом починали не пізніше ніж через 24 год від моменту появи симптомів ІМ. Лише у пацієнтів, які застосовували лізиноприл, на 6-му тижні лікування відзначили вірогідне зниження смертності на 7,7% та первинної комбінованої кінцевої точки — на 11%. Таку саму відмінність спостерігали протягом 6 міс після ІМ. Крім того, у пацієнтів, які застосовували лізиноприл, знизився ризик розвитку тяжкої дисфункції ЛШ, зменшувалося його ремоделювання (GISSI-3, 1994).
GISSI-3 лягло в основу підтвердження існуючої на сьогодні думки про необхідність застосування ІАПФ при гострому коронарному синдромі. Доказана також висока економічна ефективність раннього застосування лізиноприлу при гострому ІМ.
У 2008 р. опубліковано дані додаткового аналізу дослідження GISSI-3, присвяченого детальному вивченню причин смерті хворих під час проведення попереднього дослідження. Показано, що за 6 тиж лікування лізиноприлом на 12% знизилася внутрішньошпитальна смертність, в тому числі на 39% — частота смертності від розривів міо карда. Лікування також сприяло значному зниженню смертності з приводу електромеханічної дисоціації та насосної недостатності ЛШ. Найбільш суттєве зниження ризику цих ускладнень спостерігали у перші 4 дні від початку ІМ, що, на думку дослідників, свідчить про користь якомога ранішого застосування лізиноприлу у цих хворих.
Відзначимо, що досягнуті на початкових етапах лікування позитивні ефекти лізиноприлу щодо прогнозу зберігалися протягом тривалого часу, і навіть підвищувалися. Так, зниження загальної смертності, яке спостерігали до 6-го тижня лікування (на 8 смертей менше на 1000 пролікованих хворих), зберігалося до 5-го року спостереження (на 10 смертей менше на 1000 пролікованих хворих) (Pedrazzini G. et al., 2008).
Існує велика доказова база з чітко визначеним дозуванням щодо лікування пацієнтів із ХСН лізиноприлом. Результати багатоцентрового рандомізованого подвійного сліпого дослідження ATLAS (Assessment of Treatment with Lisinopril and Survival trial) свідчать про поліпшення прогнозу (зниження ризику смерті або госпіталізації з приво- ду будь-яких причин на 12% (p=0,002), госпіталізації з приводу декомпенсації ХСН — на 24%) у хворих на ХСН, які застосовували лізиноприл. Отримані результати дають змогу з впевненістю стверджувати, що тривала терапія лізиноприлом (при дотриманні режиму дозування) є високоефективною, безпечною та впливає на прогноз пацієнтів усіх груп. Підкреслюємо, що терапевтична дія лізиноприлу у пацієнтів із ХСН проявлялася незалежно від наявності чи відсутності у них клінічних ознак захворювання, статі, віку, наявності ураження серцево-судинної системи (Rydén L. et al., 2000).
Механізм антигіпертензивної дії ІАПФ
Гальмування перетворення неактивного ангіотензину І в ангіотензин ІІ завдяки зниженню активності АПФ є основною ланкою в механізмі антигіпертензивної дії ІАПФ. Порушення утворення АПФ супроводжується вазодилатацією і зниженням АТ. На початку лікування вираженість антигіпертензивної дії ІАПФ і зниження концентрації ангіотензину ІІ у плазмі крові залежать від активності РААС: дія препаратів тим сильніша, чим вища її активність. Ця залежність нівелюється через кілька днів або тижнів лікування, тому висока активність РААС не є предиктором ефективності ІАПФ при тривалій терапії. Разом з тим, у хворих із підвищеною активністю РААС і вираженим ефектом першої дози лікування ІАПФ, як правило, дуже ефективне.
Крім основного, існують альтернативні шляхи утворення ангіотензину ІІ за участю тканинних хімаз, катепсину G, тоніну та інших активних речовин, але ІАПФ не впливають на зазначені механізми. Цей факт, а також те, що в багатьох хворих у процесі терапії ІАПФ спостерігають подальше зниження АТ, незважаючи на повернення вихідного рівня ангіотензину ІІ, свідчить про наявність інших, не пов’язаних із пригніченням АПФ, механізмів антигіпертензивної дії цих препаратів.
Зменшення розпаду брадикініну, який має вазодилатаційний ефект, — один із них. Існує тісна взаємодія між калікреїнкініновою системою і РААС. АПФ не лише сприяє утворенню ангіотензину ІІ, але й, будучи кініназою, викликає руйнування брадикініну. Характерно, що при цьому концентрація брадикініну в плазмі крові підвищується незначно: основним фактором, що визначає брадикінінзалежні відповіді при лікуванні ІАПФ, є локальне підвищення продукції кінінів у судинній стінці. Брадикінін, стимулюючи брадикінінові рецептори другого типу, індукує цілий ряд ендотелійзалежних відповідей: вивільнення трьох релаксуючих факторів, утворених ендотелієм — оксиду азоту, ендотелійзалежного гіперполяризуючого фактора і простацикліну.
Зменшення секреції альдостерону при лікуванні ІАПФ пов’язане зі зниженням рівня ангіотензину II. Воно сприяє збільшенню натрійурезу і діурезу, а також зменшенню компенсаторної затримки натрію у нирках у відповідь на вазодилатацію. Тривале застосування ІАПФ призводить до незначного зниження загального вмісту натрію в організмі.
Зменшення вираженості ендотеліальної дисфункції під впливом ІАПФ супроводжується поліпшенням релаксації судинної стінки. У дослідженні TREND (Trial on Reversing ENdothelial Dysfunction) встановлено, що ІАПФ хінаприл у дозі 40 мг 1 раз на добу значно зменшує дисфункцію ендотелію коронарних судин, на 10–20% збільшуючи його відповідь на введення ацетилхоліну в нормотензивних пацієнтів з ІХС (Mancini G.B. et al., 1996).
Гальмування вивільнення ендотеліну-1 шляхом зниження рівня ангіотензину II викликає безпосереднє поліпшення релаксаційних властивостей судин, а також сприяє зменшенню дисфункції ендотелію.
Основним гемодинамічним механізмом дії ІАПФ є зниження ЗПСО і системного АТ. ІАПФ знижують систолічний та діастолічний АТ у стані спокою і при фізичному навантаженні, не впливаючи на частоту серцевих скорочень (ЧСС), оскільки пригнічують контррегуляторні механізми, що активують РААС і симпатоадреналову систему.
За допомогою монотерапії ІАПФ вдається досягти адекватного контролю АТ приблизно у 50% пацієнтів із м’якою й помірною АГ. Підвищити ефективність лікування можна за рахунок обмеження вживання кухонної солі або додаткового застосування діуретиків (зниження вмісту натрію в організмі стимулює секрецію реніну, підвищуючи тим самим ефективність препаратів).
Зниження судинного тонусу під час застосування ІАПФ не супроводжується зміною серцевого викиду. При вихідному порушенні скоротності міокарда ІАПФ покращують його інотропну функцію. Зменшення перед- та післянавантаження, зумовлене зниженням АТ і венодилатаційними властивостями ІАПФ, сприяє таким позитивним гемо- динамічним зрушенням, як зниження тиску наповнення ЛШ та тиску у легеневій артерії та правому передсерді.
ІАПФ відіграють важливу роль у поліпшенні коронарного резерву, зменшуючи ендотеліальну дисфункцію судин серця і вазоконстрикцію, зумовлену симпатичними впливами. При зниженні АТ важливе значення має збереження адекватної церебральної перфузії, особливо у хворих похилого віку. ІАПФ зумовлюють антигіпертензивну дію без порушення мозкової гемодинаміки. Навіть при їх
застосуванні у хворих із низьким рівнем АТ (лікування СН) погіршення мозкового кровотоку, як правило, не відбувається. Це пов’язано з тим, що ІАПФ зрушують нижню межу його ауторегуляції до нижчого рівня АТ. В експериментальних моделях відзначено швидке зниження нижньої границі ауторегуляції церебральної гемодинаміки за допомогою ІАПФ на 20–30 мм рт. ст. без погіршення перфузії мозку.
ІАПФ поліпшують ниркову гемодинаміку, що пов’язано з їх здатністю зумовлювати дилатаційний ефект переважно на еферентні (постгломерулярні) ниркові артеріоли. У разі, якщо швидкість клубочкової фільтрації значною мірою залежить від тонусу еферентних артеріол нирок, як це спостерігається при двобічному стенозі ниркових ар- терій, стенозі артерії єдиної нирки, вираженій дегідратації, тяжкій застійній СН, застосування ІАПФ протипоказане, оскільки може спровокувати неконтрольоване зниження ниркової перфузії та розвиток гострої ниркової недостатності.
Таким чином, застосування ІАПФ має переваги в таких ситуаціях:
- супутня СН;
- безсимптомне порушення систолічної функції ЛШ;
- ЦД;
- ГЛШ;
- ІХС, в тому числі перенесений ІМ;
- атеросклероз сонних артерій;
- наявність мікроальбумінурії;
- хронічна хвороба нирок (гіпертензивна або діабетична нефропатія);
- фібриляція передсердь;
- метаболічний синдром.
Рекомендують починати лікування з невисоких доз (наприклад 12,5 мг каптоприлу чи 5 мг еналаприлу), щоб запобігти розвитку гіпотензії, яка інколи виникає при прийомі першої дози препарату (за винятком периндоприлу).
ІАПФ — метаболічно нейтральні препарати. Негативні сторони їх дії — здатність викликати ниркову недостатність у хворих із двобічним стенозом ниркових артерій або стенозом артерії єдиної функціонуючої нирки, а також сухий кашель, який спостерігають у 10–12% пацієнтів під час застосування препаратів.
Антагоністи кальцію
Антагоністи кальцію синтезовані у 1970-х роках, а застосовують їх для лікування АГ з 1980-х років. Як і блокаторів β-адренорецепторів, їх спочатку розцінювали як антиішемічні засоби. Сьогодні антагоністи кальцію належать до найбільш широкозастосовуваних антигіпертензивних препаратів в усьому світі.
За даними аналізу BPLTT та J.G. Wang,
- Staessen (2002), антагоністи кальцію порівняно з плацебо знижують ризик розвитку інсульту та ІХС на 38 та 20% відповідно. Порівняно з діуретиками і блокаторами β-адренорецепторів антагоністи кальцію більш ефективно запобігають інсульту (на 8– 10%), але менш ефективно — СН (її ризик вищий на 33%, ніж при лікуванні діуретиками і блокаторами β- адренорецепторів). Порівняно з ІАПФ антагоністи кальцію також більш ефективно запобігають інсульту (на 12%), але менш ефективно — СН (Mancia G. et al., 2007).
Антагоністи кальцію представляють неоднорідну за хімічною структурою і фармакокінетичними властивостями групу препаратів (табл. 4) із загальним механізмом дії, який полягає в гальмуванні проникнення іонів кальцію в клітину по специфічних повільних кальцієвих каналах.
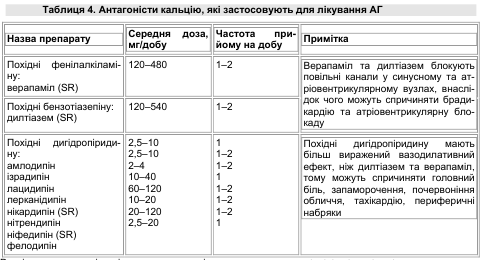
Розрізняють потенціал- і рецепторзалежні кальцієві канали. Основний шлях транспорту іонів кальцію в клітину лежить через потенціалзалежні кальцієві канали. Саме на їх блокаді заснована терапевтична дія антагоністів кальцію. Ідентифіковано 6 типів кальцієвих каналів: L, T, N, P, Q і R. Клінічне значення встановлене тільки для каналів L-типу (L — від англ. long lasting — тривалий, довгодіючий). Вони широко представлені у клітинах тканин серцево-судинної системи та інших органів і тканин.
Залежно від хімічної структури виділяють 4 основні групи антагоністів кальцію:
- похідні фенілалкіламіну;
- похідні бензотіазепіну;
- похідні дигідропіридину;
- препарати іншої хімічної структури.
Т. Тоуо-Оkа і W.G. Nayler (1996) запропонували класифікацію антагоністів кальцію, яка враховує тривалість дії, тканинну селективність, фармакодинамічні та фармакокінетичні особливості препаратів, розділених на 3 групи: препарати І, ІІ та ІІІ поколінь (табл. 5).
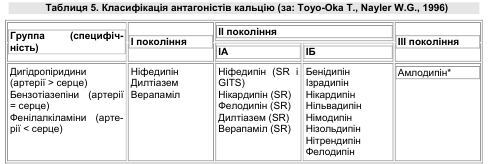
*До групи препаратів ІІІ покоління на сьогодні включають також лацидипін, лерканідипін і манідипін, що за тривалістю дії близькі до амлодипіну.
Найвищу вазоселективність мають препарати дигідропіридинової групи. Для верапамілу більш характерна негативна інотропна та хронотропна дія, але у вищих дозах він зумовлює також судинорозширювальний ефект. Дилтіазем за вираженістю впливу на судини і міокард займає проміжне положення між ніфедипіном і верапамілом. Інші дослідники вважають, що дилтіазем за фармакологічними характеристиками близький до верапамілу.
Антагоністи кальцію, що спричиняють негативний хронотропний ефект, подібно блокаторам β-адренорецепторів, мають виражену антиішемічну дію. Вона властива також препаратам ІІІ покоління — амлодипіну і лацидипіну, що не впливають на серцевий ритм і знижують споживання міокардом кисню за рахунок зменшення постнавантажен- ня і поліпшення коронарного кровотоку.
Верапаміл і дилтіазем мають здатність блокувати кальцієві канали водіїв ритму та провідної системи серця. Ця властивість не характерна для дигідропіридинових похідних, що пояснюється їхньою дією на різні ділянки L-каналів, а також різною локалізацією місць зв’язування в каналі. Точка прикладання верапамілу, який зумовлює найбільш виражений негативний хронотропний ефект, перебуває всередині каналу, а ніфедипіну — в зовнішній його частині.
Антиаритмічна дія верапамілу і дилтіазему більш виражена, коли ЧСС вища. Це так звана «usеdepended» — ефективність, що залежить від застосування. Вважають, що верапаміл і дилтіазем діють лише при відкритому L-каналі. Це зумовлено необхідністю досягнення ними ділянок зв’язування, що знаходяться всередині каналу. Чим довше канали перебувають у відкритому стані (наприклад при суправентрикулярних порушеннях ритму), тим ефективніша дія препаратів.
Дигідропіридинові похідні, що мають високу селективність до судин, діють на N-сегменти кальцієвого каналу, які перебувають у початковій його частині. Їх ефективність не залежить від ступеня відкриття кальцієвого каналу. Очевидно, цим можна пояснити відсутність антиаритмічної дії у препаратів групи дигідропіридину.
Механізм антигіпертензивної дії антагоністів кальцію
Антигіпертензивний ефект антагоністів кальцію зумовлений їх прямою чи непрямою дією. Пряма дія полягає в блокаді трансмембранного надходження іонів кальцію в клітини через повільні кальцієві канали L-типу, впливі на їх функціональний стан і щільність каналів плазматичних мембран. Зменшуючи надходження іонів кальцію у гладком’язові клітини судин, антагоністи кальцію сприяють їх релаксації і зниженню судинного тонусу, а також зменшують перевантаження клітини кальцієм за рахунок запобігання активації кальцієвих каналів L-типу вазопресорними агентами: ендотеліном, ангіотензином ІІ, катехоламінами та іншими біологічно активними речовинами.
Непряма дія антагоністів кальцію пов’язана з їх впливом на гормони та ендотеліальні фактори, що регулюють тонус судин. Встановлено, що антагоністи кальцію поліпшують функцію ендотелію судин, регулюючи виділення ними вазодилататорних (оксид азоту, брадикінін, простациклін Е) і вазоконстрикторних медіаторів (ендотелін-1, ангіотензин ІІ, простагландин F2α).
Гемодинамічною основою антигіпертензивної дії антагоністів кальцію є зниження ЗПСО. Вони викликають більш виражений вазодилатаційний ефект у хворих з вихідно підвищеним тонусом судин, знижують АТ тим значніше, чим вищим був його рівень до лікування. Препарати не мають ефекту першої дози і рідко знижують АТ нижче норми.
Антагоністи кальцію зумовлюють переважно артеріолодилатаційну дію, не впливаючи на тонус венозних судин. Цим зумовлена відсутність ортостатичної гіпотензії при їх застосуванні. Існує регіональна чутливість судинного русла до дії цих препаратів. Вони істотно знижують тонус коронарних і периферичних артерій. Менш виражений вплив антагоністи кальцію мають на резистивні судини нирок і практично не впливають на тонус судин шкіри і травного тракту.
Антагоністи кальцію ефективно знижують систолічний та діастолічний АТ в умовах спокою і при фізичному навантаженні, однак їх дія на систолічний АТ в умовах фізичного навантаження проявляється менш значимо, ніж у спокої. Це характерно, зокрема для ніфедипіну, верапамілу і дилтіазему при їх застосуванні в низьких дозах. Виявлено залежність антигіпертензивного ефекту від віку пацієнта й активності реніну плазми крові: ефективність антагоністів кальцію вища у пацієнтів похилого віку з низькореніновою формою АГ.
Вазодилатаційна дія препаратів не супроводжується затримкою рідини в організмі, що пояснюється їхньою здатністю чинити легкий натрійуретичний і діуретичний ефект.
Перевагу антагоністам кальцію слід надавати у таких випадках:
- середній та похилий вік;
- ізольована систолічна АГ (у людей старшого віку);
- атеросклероз сонних/коронарних артерій;
- стабільна стенокардія;
- ГЛШ;
- суправентрикулярна тахікардія та екстрасистолія (верапаміл, дилтіазем);
- порушення периферичного кровообігу;
- період вагітності.
При лікуванні АГ слід надавати перевагу застосуванню антагоністів кальцію тривалої дії, оскільки короткодіючі дигідропіридинові похідні можуть справляти негативний вплив на перебіг АГ: є дані про підвищення ризику розвитку ІМ та смертності осіб похилого віку при застосуванні ніфедипіну короткотривалої дії. У виняткових випадках, коли препарати тривалої дії є недоступними (наприклад з економічних причин), на короткий термін можна застосовувати дигідропіридинові похідні короткої дії у комбінації з блокаторами β- адренорецепторів. Останні частково нівелюють побічні ефекти дигідропіридинів, зокрема активацію симпатадреналової системи.
Амлодипін, лацидипін та лерканідипін — препарати, які мають найбільшу тривалість дії серед дигідропіридинових похідних.
Антагоністи кальцію знижують АТ завдяки зниженню судинного тонусу, зумовленого зменшенням концентрації кальцію в гладких м’язах судин. Верапаміл та дилтіазем діють також на синусний та атріовентрикулярний вузли, у зв’язку з чим вони протипоказані при слабкості синусного вузла, атріовентрикулярній блокаді та вираженій брадикардії. Дигідропіридинові антагоністи кальцію мають більш сильну вазодилативну дію, ніж верапаміл та дилтіазем, через що можуть викликати тахікардію, приливи крові, набряки на ногах.
Фелодипін (Фелодип, «TEVA», Ізраїль) має у 20 разів більшу судинну селективність, ніж амлодипін, тому побічні явища у вигляді набряків гомілок, приливів при його застосуванні майже відсутні. Крім того, препарат виявляє легку діуретичну дію.
Всі антагоністи кальцію, крім амлодипіну та фелодипіну, протипоказані при СН із систолічною дисфункцією, оскільки мають виражену негативну інотропну дію. Застосування антагоністів кальцію у хворих із СН, зумовленою діастолічною дисфункцією, не протипоказане. Антагоністи кальцію, як і ІАПФ, є метаболічно нейтральними препаратами
- вони не впливають на толерантність до глюкози та рівень ліпідів у крові. БРА
Ця група антигіпертензивних препаратів використовується у клінічній практиці з 1994 р., однак вона відразу зайняла своє місце в лікуванні АГ серед препаратів першої лінії. Накопичені за цей час дані багатоцентрових рандомізованих досліджень свідчать, що ефективність БРА з точки зорузниження АТ, частоти ІМ, загальної серцево- судинної смертності така ж, як у діуретиків і блокаторів β- адренорецепторів, однак вони ефективніше знижують ризик розвитку інсульту (на 21–24%) і СН (на 16%). БРА так само ефективні у запобіганні ускладненням ІХС, як ІАПФ, хоча останні, як свідчить метарегресійний аналіз BPLTT, мають додатковий сприятливий вплив на ризик розвитку ІМ, який не залежить від зниження АТ. Перевагою БРА II є їх більш виражена церебропротекторна і добре доведена ренопротекторна дія (Mancia G. et al., 2007).
Шляхи утворення ангіотензину ІІ
Відповідно до класичних уявлень, основний ефекторний гормон РААС — ангіотензин ІІ — утворюється в системному кровотоці внаслідок каскаду біохімічних реакцій. Результати досліджень двох останніх десятиріч свідчать, що ангіотензин ІІ утворюється не тільки в системному кровотоці, але й у різних тканинах, де виявлені всі компоненти РААС (ангіотензиноген, ренін, АПФ, рецептори ангіотензину), а також експресія генів реніну й ангіотензину ІІ. Значення тканинної системи зумовлене її провідною роллю в патогенетичних механізмах розвитку захворювань серцево- судинної системи на органному рівні.
Відповідно до концепції про двокомпонентність РААС, головну роль у її короткочасних фізіологічних ефектах відводять циркулюючій ланці. Тканинна ланка РААС забезпечує довгострокову дію на функцію та структуру органів.
Вазоконстрикція і вивільнення альдостерону у відповідь на стимуляцію ангіотензином є негайними реакціями, що виникають протягом секунд, відповідно до їхньої фізіологічної ролі, яка полягає в підтримці кровообігу після крововтрати, дегідратації чи ортостатичної гіпотензії. Інші ефекти (гіпертрофія міокарда, СН) розвиваються протягом тривалого часу. Для патогенезу хронічних захворювань серцево-судинної системи повільні відповіді, які виконуються на тканинному рівні, важливіші, ніж швидкі, що реалізуються системною ланкою РААС.
Рецептори ангіотензину ІІ
Основні ефекти ангіотензину ІІ здійснюються через його взаємодію зі специфічними клітинними рецепторами. На сьогодні виділено кілька типів і підтипів ангіотензинових рецепторів: АТ1, АТ2, АТ3 і АТ4. У людини виявлені тільки АТ1- і АТ2- рецептори (табл. 6).


Відомо, що всі серцево-судинні, а також екстракардіальні ефекти ангіотензину ІІ опосередко- вуються переважно через АТ1-рецептори.
АТ1-рецептори виявлені в серці, печінці, головному мозку, нирках, наднирковій залозі, матці, ендотеліальних і гладком’ язових клітинах, фібробластах, макрофагах, периферичних симпатичних нервах.
Про АТ2-рецептори відомо значно менше, ніж про рецептори АТ1-типу. В організмі дорослої людини АТ2-рецептори у високих концентраціях виявлені в мозковому шарі надниркової залози, матці та яєчниках, а також у судинному ендотелії, серці й різних ділянках мозку. У тканинах ембріона АТ2-рецептори представлені значно ширше, ніж у тканинах дорослого організму, і є в них переважаючими. Незабаром після народження АТ2-рецептор
«вимикається» і активується при певних патологічних станах (наприклад ішемії міокарда, СН, ушкодженні судин). Те, що АТ2-рецептори найбільш широко представлені у тканинах плода і їх концентрація різко знижується в перші ж тижні після народження, свідчить про їх роль у процесах, пов’язаних із клітинним ростом, диференціацією і розвитком.
Вважають, що АТ2-рецептори опосередковують апоптоз — запрограмовану загибель клітини, яка є закономірним наслідком процесів її диференціації та розвитку. Завдяки цьому стимуляція АТ2- рецепторів зумовлює антипроліферативну дію.
АТ2-рецептори вважають фізіологічною противагою АТ1-рецепторам. Очевидно, вони контролюють надмірний ріст, опосередкований через АТ1-рецептори або інші фактори росту, а також урівноважують вазоконстрикторний ефект стимуляції АТ1-рецепторів.
Механізм антигіпертензивної дії БРА
Ефекти БРА зумовлені їх здатністю зв’язуватися зі специфічними рецепторами ангіотензину ІІ. Блокада АТ1-рецепторів приводить до пригнічення його основних фізіологічних ефектів — вазоконстрикції, синтезу альдостерону, вивільнення катехоламінів із надниркової залози і пресинаптичних мембран, виділення вазопресину, а також до вповільнення гіпертрофічних і проліферативних процесів у стінці судин та міокарді.
Основним гемодинамічним ефектом блокаторів АТ1-рецепторів (БРА АТ1) є вазодилатація і, отже, зниження рівня АТ. Антигіпертензивний ефект препаратів залежить від вихідної активності РААС: у хворих із високою активністю реніну вони діють сильніше.
Усі БРА АТ1 зумовлюють тривалу антигіпертензивну дію, що триває протягом 24 год. Вона проявляється через 2–4 тиж терапії і підсилюється до 6–8 тиж лікування. Більшість препаратів викликають дозозалежне зниження АТ, не порушуючи його нормальний добовий ритм. Клінічні спостереження свідчать, що при тривалому застосуванні БРА (≥2 років) звикання до них не відбувається. Скасування лікування не призводить до «рикошетного» підвищення АТ. БРА АТ1 не знижують рівень АТ, якщо він перебуває в межах нормальних значень (табл. 7).
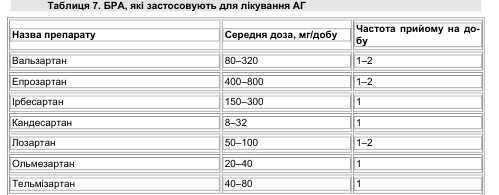
При порівнянні з антигіпертензивними препаратами інших класів виявлено, що БРА АТ1, спричиняючи аналогічний антигіпертензивнийефект, викликають менше побічних явищ і краще переносяться хворими.
Відмінна риса цього класу антигіпертензивних препаратів полягає в хорошій, порівняно з плацебо, переносимості. Побічні ефекти при їх застосуванні відзначають значно рідше, ніж при використанні ІАПФ. На відміну від останніх, застосування БРА не супроводжується накопиченням брадикініну і появою зумовленого цим кашлю. Значно рідше розвивається також ангіоневротичний набряк.
ПодібнодоІАПФцізасобиможутьвикликати досить швидке зниження АТ при ренінзалежних формах АГ. У хворих із двобічним звуженням ниркових артерій можливе погіршення функції нирок. У пацієнтів із хронічною нирковою недостатністю існує ризик розвитку гіперкаліємії у зв’язку з пригніченням вивільнення альдостерону в процесі лікування. Застосування БРА АТ1 у період вагітності протипоказане у зв’язку з високим ризиком порушень розвитку плода і його загибелі.
Незважаючинавищезазначенінебажаніефекти, БРА АТ1 є найкраще переносимою хворими групою антигіпертензивних препаратів із найнижчою частотою розвитку побічних реакцій.
ДослідженняLIFE (Losartan Intervention For Endpoint reduction in hypertension study), SCOPE (The Study on Cognition and Prognosis in the Elderly), MOSES (Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention) продемонстрували високу ефективність БРА щодо первинної та вторинної профілактики інсульту (Dahlof B. et al., 2002; Lithell H. et al., 2003; Schrader J. et al., 2005).
Як правило, препарати цієї групи не викликають кашлю та ангіоневротичного набряку. Відсутність істотних побічних ефектів є їх особливістю. Препарати ефективні при одноразовому прийомі. Антигіпертензивна дія посилюється при застосуванні разом із діуретиками.
БРА найбільш ефективні у таких випадках:
супутня СН;
перенесенийІМ;
супутній ЦД 2-го типу;
наявність мікроальбумінурії;
хронічнахворобанирок(гіпертензивна чи діабетична нефропатія);
ГЛШ;
пароксизмальна форма фібриляції передсердь;
наявністьпобічнихефектів(кашлю) у разі застосування ІАПФ.
На сьогодні надати перевагу якійсь одній групі препаратів важко. Після публікації метааналізів щодо підвищення кількості пацієнтів з ішемією міокарда на тлі застосування БРА, їх промоційна привабливість порівняно з ІАПФ зазнала сумніву. Підвищення частоти ішемічних подій при більш вираженому зниженні АТ (+9%) отримано як при застосуванні БРА порівняно з ІАПФ, так і при поєднанніІАПФтаБРА, коли підвищується ризик небажаних ефектів, що реалізуються у зниженні функції нирок (Tobe S.W. et al., 2011).
На сьогодні іде пошук нових напрямків у лікуванні АГ. Прямі інгібітори реніну — перший серед нових класів антигіпертензивних препаратів, який показав свою ефективність у доклінічних та клінічних дослідженнях.
Аліскірен— перший представник цього класу, який успішно пройшов всі стадії випробувань і отримав реєстрацію для клінічного застосування в США та країнах Європи (в тому числі в Україні). Механізм дії аліскірену полягає у пригніченні активності реніну (а також прореніну), який згідно із сучасними уявленнями бере участь у перетворенні ангіотензиногену в ангіотензин I. Крім того, ефект цього препарату виявляється за рахунок зв’язування рецепторів реніну на клітинній мембрані. Відомо, що активність реніну плазми крові вірогідно впливає на ризик розвитку серцево— судинних захворювань, зокрема ІМ. Тому важливо не лише блокувати його ефекти, але й контролювати активність. Аліскірен знижує активність реніну і, тим самим, може знижувати ризик виникнення тяжких серцево—судинних ускладнень. На вивчення цього факту спрямована великомасштабна програма клінічних досліджень ASPIRE HIGHER (Aliskiren study in post miocardial infarction patients to reduce remodeling) із включенням понад 35 тис. пацієнтів. Результати вже завершених досліджень цієї програми (AVOID (Aliskiren in the Evaluation of Proteinuria in Diabetes), ALOFT (Aliskiren Observation of Heart Failure Treatment), ALLAY (Aliskiren in Left ventricuar hypertrophy), AGELESS (Aliskiren for Gеriatric Lowеring of Systolic hypertension)) демонструють високу клінічну ефективність аліскірену щодо лікування АГ, а також його кардіо— та нефропротекторних властивостей (Parving H.H. et al., 2008; Sever P.S. et al., 2009; Uresin A.Y., Baran E., 2009).
Блокатори β—адренорецепторів
Блокатори β—адренорецепторів протягом останніх десятиліть займали лідируючу позицію серед антигіпертензивних засобів, що зумовлено їх ефективністю щодо зниження АТ, доведеною в ході численних досліджень, і здатністю знижувати ризик ускладнень у хворих на АГ.
Однак останніми роками їхню рольулікуванні АГ переглядають. Це пов’язано з результатами порівняльних досліджень, які показали, що блокатори β— адренорецепторів поступаються БРА в запобіганні інсульту (LIFE) і сприяють появі нових випадків ЦД серед лікованих ними хворих, особливо при застосуванні в комбінації з тіазидними діуретиками (Dahlof B. et al., 2002).
ЗгіднозрекомендаціямиESH/ESС блокатори β— адренорецепторів посідають своє місце серед антигіпертензивних препаратів першої лінії, однак необхідно уникати їх застосування у хворих,схильнихдорозвиткуЦД, з уже наявним ЦД і в осіб з метаболічним синдромом (Mancia G. et al., 2007; 2010).
Незважаючи на критику на адресу блокаторів β—адренорецепторів, останні залишаються важливим компонентом антигіпертензивної терапії. Це зумовлено необхідністю їх призначення при таких супутніх захворюваннях, як стенокардія, перенесений ІМ, СН, порушення ритму серця, а також тим, що вони не поступаються іншим антигіпе— ртензивним засобам у запобіганні ускладнень ІХС і смертності від серцево—судинних захворювань. Блокатори β—адренорецепторів є необхідним компонентом лікування хворих з явними ознаками активації симпато—адреналової системи (тахікардія, високий пульсовий АТ у людей молодого віку), а також при стресіндукованій АГ.
Слідтакожвраховувати, що практично всі дослідження, присвячені оцінці застосування блокаторівβ—адренорецепторів у хворих на АГ, проведені з випробуванням атенололу. Жоден із сучасних блокаторів β— адренорецепторів (бізопролол, бетаксолол, карведилол, небіволол) не вивчали у великих багатоцентрових дослідженнях, тому переносити результати оцінки атенололу на ці препарати немає підстав. Низьку активність атенололу в запобіганні інсульту пояснюють недостатньою тривалістю дії (<24 год), а також недостатньою пенетрацією у тканину головного мозку через гідрофільність препарату.
Виділяють3 покоління блокаторів β— адренорецепторів: неселективні (I покоління), β1— селективні (II покоління) і блокатори β— адренорецепторів із вазодилатаційними властивостями (III покоління) (табл. 8). Кожне наступне покоління відрізняється від попереднього новими, корисними для клінічного застосування властивостями.
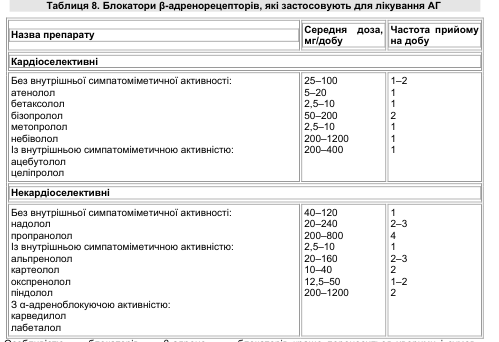
Особливістю блокаторів β-адренорецепторів ІІ покоління є їх більша спорідненість до β1-адренорецепторів (розташовані в серці), ніж до β2-адренорецепторів (розташовані у бронхах, підшлунковій залозі та судинній стінці).
Одним із високоселективних блокаторів β- адренорецепторів є бізопролол (Бісопрололратіофарм, «TEVA», Ізраїль), спорідненість якого до β1-адренорецепторів в 4 рази вища, ніж у метопрололу та більше ніж у 2 рази вища, ніж у атенололу та бетаксололу. Застосування селективних
блокаторів краще переноситься хворими і зумовлює менше побічних явищ.
Вазодилатаційна дія блокаторів β- адренорецепторів зумовлена їх α1- адреноблокуючою активністю (лабеталол, карведилол), β2- агоністичною активністю (целіпролол) або здатністю індукувати утворення оксиду азоту клітинами ендотелію (небіволол). Карведилол має також додаткову пряму вазодилатаційну дію.
Механізм антигіпертензивної дії блокаторів β- адренорецепторів
Значну увагу при вивченні антигіпертензивної дії блокаторів β- адренорецепторів приділяють їхньому впливу на активність реніну в плазмі крові. Однак у процесі лікування не виявлено чіткої залежності між зниженням АТ і вихідною активністю реніну плазми крові або ступенем її зниження. Зниження активності реніну плазми крові в резуль- таті зменшення його утворення за допомогою блокади β1- адренорецепторів має більш важливе значення у лікуванні хворих із переважно гіперреніновою формою АГ. Для зниження АТ у цих хворих достатньо застосовувати досить низькі дози пропранололу (160 мг/добу), тоді як при низькореніновій АГ необхідні вищі дози препарату (320–960 мг/добу). Антигіпертензивний ефект в останньому випадку досягається незалежно від впливу на активність реніну плазми крові. Очевидно, зниженням активності РААС повністю пояснити антигіпертензивний ефект блокаторів β-адренорецепторів не можна.
Не одержала повного підтвердження гемодинамічна концепція зниження АТ при блокаді β- адренорецепторів. Відомо, що первинний гемодинамічний ефект блокаторів β-адренорецепторів полягає у зниженні скоротності міокарда та ЧСС, що в результаті приводить до зменшення хвилинного об’єму крові на 15–20% (за винятком піндололу, який має високу внутрішню симпатоміметичну активність). Зниження серцевого викиду супроводжується підвищенням ЗПСО у початковий період терапії. Цей ефект пояснюють як підвищенням концентрації катехоламінів у плазмі крові, так і превалюванням α-адренергічного впливу на тонус судин, який супроводжує блокаду β- адренорецепторів. При тривалому застосуванні блокаторів β- адренорецепторів ЗПСО повертається до вихідного чи нормального рівня.
Антигіпертензивна дія блокаторів β- адренорецепторів не може бути пояснена лише зменшенням хвилинного об’єму крові, оскільки він знижується також у тих випадках, коли блокатори β- адренорецепторів не впливають на рівень АТ. Разом з тим виявлена тісна залежність між зниженням АТ і зменшенням ЗПСО. У тих випадках, коли тонус судин, що підвищився від початку терапії блокаторами β- адренорецепторів, не повертається до вихідного рівня, не спостерігають суттєвого зниження АТ.
Антигіпертензивний ефект блокаторів β- адренорецепторів пов’язували з блокадою пресинаптичних β2-адренорецепторів, стимуляція яких призводить до вивільнення норадреналіну. Встановлено, що рівень норадреналіну в плазмі крові тісно корелює із рівнем діастолічного АТ і вираженістю антигіпертензивного ефекту блокаторів β- адренорецепторів. Проте селективні блокатори β1- адренорецепторів мало впливають на пресинаптичні β2-адренорецептори, але мають такий самий антигіпертензивний ефект, як і неселективні блокатори β- адренорецепторів. Більше того, отримано дані про те, що селективні блокатори β2-адренорецепторів не знижують АТ. Отже, гальмування вивільнення норадреналіну із симпатичних нервових закінчень не є основною ланкою в механізмі дії препаратів цієї групи.
Викликає інтерес здатність блокаторів β- адренорецепторів стимулювати синтез простагландинів, що мають судинорозширювальну дію. Блокада β-адренорецепторів підвищує ефективність взаємодії аденілатциклази та циклічного аденозинмонофосфату за допомогою стимуляції утворення простацикліну і підвищення щільності β- адре- норецепторів.
Виявлено підвищення рівня передсердного натрійуретичного фактора і зниження вмісту внутрішньоклітинного іонізованого кальцію у гладком’язових клітинах судин при терапії блокаторами β-адренорецепторів, що також має значення в механізмі їх антигіпертензивної дії.
Таким чином, не можна виділити якунебудь ланку в механізмі зниження АТ під впливом блокаторів β-адренорецепторів. Очевидно, в кожному конкретному випадку превалює той чи інший антигіпертензивний механізм. Це залежить від багатьох умов, у тому числі від вихідного стану РААС і симпатоадреналової системи, гормональних і гемодинамічних факторів.
Блокатори β-адренорецепторів більш ефективні в таких випадках:
- молодий та середній вік пацієнта;
- ознаки гіперсимпатикотонії (тахікардія, високий пульсовий АТ, гіперкінетичний тип гемодинаміки);
- СН;
- супутня ІХС (стенокардія та ІМ);
- супутня передсердна і шлуночкова екстрасистолія та тахікардія;
- гіпертиреоз;
- мігрень;
- глаукома;
- АГ перед чи після проведення хірургічних операцій.
Таким чином, блокатори β- адренорецепторів сприяють зниженню захворюванності на ІХС та смертності від серцево-судинних захворювань. Вони запобігають розвитку СН, однак менш ефективні, ніж антагоністи кальцію та БРА у запобіганні інсульту. Неселективні блокатори β- адренорецепторів менш ефективні при застосуванні у курців, ніж у осіб, які не палять.
Для лікування пацієнтів з АГ застосовують всі групи блокаторів β-адренорецепторів: селективні та неселективні, із внутрішньою симпатоміметичною активністю та без неї. В еквівалентних дозах вони мають схожий антигіпертензивний ефект. Небажаними ефектами блокаторів β- адренорецепторів є бронхоконстрикторна дія, погіршення провідності міокарда та периферичного кровообігу, негативний вплив на метаболізм глюкози і ліпідів.
Антигіпертензивні препарати другої лінії
До препаратів першої лінії не ввійшли блокатори α1-адренорецепторів, агоністи α2- адренорецепторів центральної дії, алкалоїди раувольфії, агоністи імідазолінових рецепторів (табл. 9).
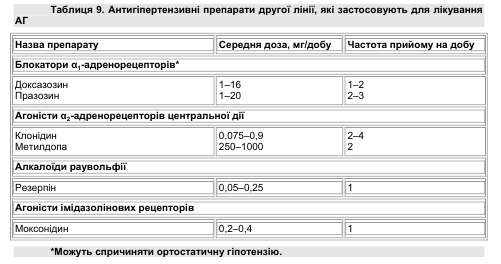
У дослідженні ALLHAT (2002) виявлено нижчу ефективність блокаторів α1- адренорецепторів (доксазозин), ніж тіазидоподібного діуретика хлорталідону, у зв’язку з чим їх тепер не вважають препаратами першої лінії, придатними для монотерапії і рекомендують застосовувати у складі комбінованої терапії. Вони зумовлюють виражену судино- розширювальну дію в результаті селективної блокади α1- адренорецепторів у судинах. Ці препарати найістотніше викликають зниження АТ при прийомі першої дози (ефект першої дози) та при переході з горизонтального у вертикальне положення. Отже, починати лікування слід з мінімальної дози (0,5 мг празозину або 1 мг доксазозину).
Доксазозин є препаратом пролонгованої дії, завдяки чому ортостатичні реакції та ефект першої дози при його застосуванні спостерігають рідко (на фоні празозину — часто). Основним станом, за якого слід надавати перевагу цим препаратам, є аденома передміхурової залози завдяки зниженню ступеня обструкції сечовивідних шляхів.
Агоністи α2- адренорецепторів центральної дії (клонідин, гуанфацин), незважаючи на достатню антигіпертензивну ефективність та суттєве зниження частоти ускладнень АГ при тривалому застосуванні, відсунуті на другий план новими, більш специфічними засобами.
Найважливіша причина цього — небажані ефекти, що погіршують якість життя хворих. Агоністам α2- адренорецепторів центральної дії властиві седативна дія та сухість у роті, алкалоїдам раувольфії — седативна дія, набряк слизової оболонки носа, подразнення слизової оболонки шлунка; прямі вазодилататори спричиняють рефлекторну тахікардію і затримують рідину в організмі. Седативний ефект порушує працездатність, емоційний стан, знижує увагу, уповільнює реакцію хворих. Проте використання цих препаратів у невисоких дозах дозволяє значно зменшити їх небажані ефекти. Комбіноване застосування агоністів α2- адренорецепторів центральної дії з діуретиками та ва- зодилататорами супроводжується значним зниженням АТ при мінімальних небажаних реакціях. Досить ефективна комбінація резерпіну з гідралазином, гідрохлоротіазидом або клопамідом.
Метилдопа — препарат вибору для лікування хворих із підвищеним АТ у період вагітності.
Агоністи імідазолінових рецепторів є порівняно новою генерацією препаратів, що діють на центральну нервову систему (ЦНС). Їх особливість
- нижча частота побічних ефектів порівняно з іншими препаратами центральної дії, такими як метилдопа, клонідин, гуанфацин. Останні знижують АТ внаслідок зв’язування з α2- адренорецепторами в ЦНС та на периферії, що зменшує вивільнення норадреналіну з нервових закінчень. Однак взаємодія з α2адренорецепторами поряд зі зниженням АТ призводить і до побічних ефектів — втоми, сухості в роті, сонливості.
Протягом останніх років синтезовані препарати, які мінімально впливають на α2- адренорецептори і стимулюють переважно імідазолінові рецептори в ЦНС — моксонідин та рильменідин. Клінічні дослідження показали, що за ефективністю ці препарати не поступаються іншим антигіпертензивним засобам і значно рідше, ніж клонідин, викликають побічні явища.
Вибір антигіпертензивних препаратів
Дані доказової медицини свідчать про те, що раціональна антигіпертензивна терапія суттєво поліпшує прогноз пацієнтів з АГ, які мають супутні захворювання — СН, нефропатію, ЦД тощо. У табл. 10 наведено рекомендації щодо застосування різних класів антигіпертензивних препаратів в особливих клінічних ситуаціях.
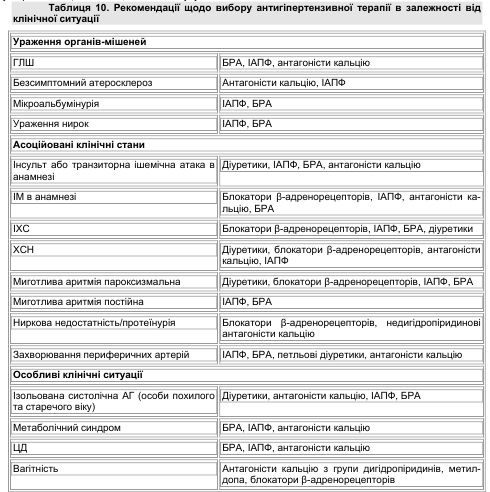
На вибір препарату суттєво впливають численні фактори, найбільш важливими з яких є:
- наявність у хворого факторів ризику;
- ураження органів-мішеней;
- асоційовані клінічні стани: ураження нирок, метаболічний синдром, ЦД;
- супутні захворювання, при яких необхідне застосування чи обмеження застосування антигіпертензивних препаратів різних класів;
- індивідуальні реакції хворого на препарати різних класів в анамнезі;
- ймовірність взаємодії з ліками, які застосовують з іншого приводу;
- соціально-економічні фактори, включаючи вартість лікування.
При виборі антигіпертензивного препарату необхідно, перш за все, оцінити його ефективність, ймовірність розвитку побічних явищ і переваги лікарського засобу в певній клінічній ситуації (див. табл. 10). При цьому вартість препарату не повинна бути основним вирішальним фактором.
Спираючись на результати багатоцентрових рандомізованих досліджень, можна стверджувати, що антигіпертензивні препарати першої лінії не дуже відрізняються за своєю загальною здатністю знижувати АТ при АГ.
Не існує беззаперечних доказів того, що основні класи препаратів різняться за їх здатністю запобігати ризику розвитку серцево-судинних захворювань і таких причинноспецифічних серцево- судинних ускладнень, як інсульт і ІМ. Таким чином, усі групи придатні для початку і/або продовження антигіпертензивного лікування.
Наявність великої кількості варіантів медикаментозної терапії значно підвищує шанси контролю АТ у більшості хворих на АГ. Це має вирішальне значення, оскільки зниження АТ, незалежно від способу його досягнення, сприяє серцево- судинній протекції.
Кожний клас антигіпертензивних препаратів має протипоказання щодо застосування, так само як і сприятливі ефекти в конкретних клінічних ситуаціях.
Комбінована терапія АГ
- Mancia та співавтори (2007) підкреслюють, що незалежно від препарату, який застосовують, монотерапія може ефективно знижувати АТ лише у обмеженої кількості хворих, а більшість із них потребують поєднання як мінімум двох препаратів для досягнення контролю АТ. У проведеному метааналізі 42 досліджень показано, що комбінація двох лікарських засобів із будь-яких двох класів антигіпертензивних препаратів сприяє більшому зниженню АТ, ніж подвоєння дози одного препарату.
Це може бути частково пов’язане з тим, що будь-який препарат, застосовуваний у монотерапії, є неефективним або малоефективним у частини пацієнтів, а його поєднання з іншим, ефективним препаратом у цих хворих викликає більший відгук, аніж подвоєння дози неефективного. При цьому цілком ймовірно, що застосування обох препаратів разом не виключає застосування одного непотрібного.
Пошук найбільш ефективної монотерапії у кожного конкретного пацієнта є кропітким і важким завданням. Припускають, що розвиток фармакогенетики сприятиме в майбутньому вирішенню цієї проблеми. Окрім цього, є фізіологічні та фармакологічні взаємодії, які виправдовують вищу ефективність комбінованої терапії АГ.
На сьогодні при проведенні комбінованої терапії АГ лікарі у своїй практичній діяльності повинні опиратися на перегляд Європейських рекомендацій по веденню АГ (Mancia G. et al., 2010), згідно з якими:
- У переважної більшості хворих на АГ ефективний контроль АТ може бути досягнутий лише шляхом поєднання як мінімум двох антигіпертензивних препаратів.
- Рекомендованою стратегією лікування є додання препарату іншого класу до початково застосовуваного, за винятком випадків, коли початковий препарат необхідно відмінити у зв’язку з виникненням побічних ефектів або відсутністю зниження АТ.
- Навіть на початку лікування комбінація двох антигіпертензивних препаратів може забезпечити переваги у пацієнтів із високим серцево- судинним ризиком, у яких бажане швидке зниження АТ.
- У разі можливості слід надавати перевагу застосуванню фіксованих комбінацій (або одній таблетці), оскільки спрощення режиму лікування підвищує прихильність до нього.
- Існує декілька комбінацій двох препаратів, рекомендованих для пріоритетного клінічного застосування. Докази зниження частоти усклад- нень відомі для таких комбінацій:
- діуретик + ІАПФ (наприклад Лізотіазид, «TEVA», Ізраїль);
- діуретик + БРА;
- діуретик + антагоніст кальцію;
- ІАПФ + антагоніст кальцію;
- антагоніст кальцію + БРА.
- Незважаючи на докази щодо зниження частоти ускладнень, комбінації блокатор β- адренорецепторів + діуретик слід уникати (за винятком випадків, коли вона необхідна з інших причин) у зв’язку з можливістю розвитку ЦД у схильних до цього пацієнтів. Застосування комбінації ІАПФ + БРА дає сумнівне потенціювання антигіпертензивної дії зі стійким підвищенням ризику розвитку серйозних побічних ефектів. Специфічні переваги у пацієнтів із нефропатією та протеїнурією (у зв’язку з вираженим антипротеїнуричним ефектом) необхідно підтвердити доказами у майбутніх дослідженнях.
Нагадаємо, що ESC не розглядає комбінацію ІАПФ + БРА як пріоритетну, оскільки вона призводить до підвищення ризику розвитку побічних ефектів (зниження ниркової функції) (Tobe S.W. et al., 2011).
Не менше ніж у 15–20% хворих на АГ контроль АТ не може бути досягнутий за допомогою комбінації двох препаратів. У разі, коли необхідне застосування трьох препаратів, найбільш раціональним є поєднання БРА, антагоніста кальцію та діуретика в ефективному дозуванні.
Лікування пацієнтів із супутніми факторами ризику
Гіполіпідемічна терапія
У дослідженні ASCOT-LLA (Anglo- Scandinavian Cardiac Outcomes Trial — Lipid Lowering Arm) чітко доведені переваги застосування статинів (аторвастатину) та антигіпертензивних препаратів у хворих на АГ (ASCOT-LLA, 2008). Це підтверджено і в перегляді Європейських рекомендацій щодо ведення АГ (Mancia G. et al., 2010).
Негативні результати, отримані з іншим статином у дослідженні ALLHAT (2002), можуть пояснюватися недостатнім зниженням рівня загального холестерину — 11% (ALLHAT) порівняно з 20% (ASCOT-LLA).
Результати дослідження GREACE (Greek Atorvastatin and Coronary Heart Disease Evaluation) показали, що аторвастатин майже у 2 рази більше знижував загальну смертність, смертність від ІХС, кількість випадків ІМ та інсульту, ніж симвастатин (Athyros V.G. et al., 2010).
Аторвастатин довів можливість регресу атеросклеротичної бляшки в як мінімум 2 дослідженнях із застосуванням внутрішньосудинної методики REVERSAL (Reversal of Atherosclerosis with Aggressive Lipid Lowering) та ESTEBLISH. При цьому 6-місячна терапія аторвастатином (20 мг/добу) (ESTEBLISH) та розувастатином (40 мг/добу) (ASTEROID (A Study To evaluate the Effect of Rosuvastatin On Intravascular ultrasound-Derived coronary atheroma burden)) приводила до зменшення атероми на 13,1 і 6,8% відповідно (Okazakiet al., 2004; Nissen S. et al., 2006; Choi S.H. et , 2008).
Аторвастатин (Аторвастатин-ратіофарм, TEVA, Ізраїль) сприяє значному зниженню частоти фатальних серцево-судинних захворювань і нефатального інфаркту міокарда, загальної частоти кардіоваскулярних захворювань, частоти фатального і нефатального інсульту, необхідності у реваскуляризації міокарда.
Подальший аналіз даних дослідження ASCOT-LLA (2008) показав, що приєднання статину до антигіпертензивної терапії на основі амлодипіну сприяло більш значущому зниженню частоти розвитку первинної кінцевої точки, ніж приєднання статину до антигіпертензивної терапії на основі атенололу. Сприятливий вплив застосування статинів у пацієнтів без наявності серцево-судинних ускладнень підтверджений у дослідженні JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin), результати якого показали зниження рівня холестерину ліпопротеїнів низької щільності на 50% (при вихідному рівні — <130 мг/дл (3,4 ммоль/л)) та ризику розвитку серцево-судинних ускладнень — на 44% при підвищенному вмісті С-реактивного білка крові (Hsia J. et al., 2011).
Підтверджено висновок про необхідність застосування терапії статинами у хворих на АГ з прогнозованим 10-річнім ризиком серцево- судинних ускладнень. Дані дослідження JUPITER дають змогу припустити, що позитивний ефект статинів може спостерігатися також у пацієнтів із підвищенним вмістом С- реактивного білка крові при помірному рівні серцево-судинного ризику (біля 15% серцево-судинних ускладнень протягом 10 років).
Антитромбоцитарна терапія
В останньому перегляді Європейських рекомендацій щодо ведення АГ наголошується на доцільності застосування антитромбоцитарної терапії (зокрема ацетилсаліцилової кислоти в низьких дозах) у пацієнтів із АГ з серцево-судинними захворюваннями у минулому, а також у осіб без серцево-судинних захворювань в анамнезі, але зі зниженною функцією нирок або високим ризиком серцево-судинних ускладнень (Mancia G. et al., 2010). У пацієнтів, які застосовують ацетилсаліцилову кислоту, особливу увагу слід приділяти потенційному ризику підвищення вірогідності кровотеч, особливо шлунково-кишкових.
Контроль глікемії
У зв’зку із широкою розповсюдженістю поєднання ЦД і АГ у методичних рекомендаціях ESH/ESC щодо лікування АГ положення про цільові рівні глюкози та глікозильованого гемоглобіну (HbA1C), які повинні бути досягнуті у хворих на ЦД, розглядались як питання практичної важливості (Mancia G. et al., 2007). Вказувалося, що жорсткий контроль рівня глюкози в крові, тобто рівень глікемії <6,0 ммоль/л (108 мг/дл) і HbA1C <6,5% є бажаними для зведення до мінімуму ризику макроі мікросудинних ускладнень, пов’язаних із підвищенням рівня глюкози в крові.
В перегляді Європейських рекомендацій щодо ведення АГ цільовий рівень глюкози залишається незмінним, але з поправками (Mancia G. et al., 2010):
- жорсткий контроль рівня глюкози крові необхідно здійснювати обережно;
- рівню HbA1C <6,5% слід запобігати. У нещодавньому метааналізі, в який увійшли 4 рандомізованих дослідження щодо впливу жорсткого контролю вмісту глюкози в крові (ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified-Release Controlled Evaluation), ACCORD (Action to Control Cardiovascular Risk in Diabetes), UKPUDS (The UK Prospective Diabetes Study), VADT), в цій групі спо- стерігають приблизно в 2,5 раза вищий ризик розвитку тяжких гіпоглікемічних епізодів, ніж у групі зі стандартною стратегією контролю рівня глюкози. Таким чином, отримані дані свідчать про необхідність застосування стратегії жорсткого контролю глюкози у крові лише за умови суворого моніторин- гу пацієнтів (Evans M., 1998; Heller S.R., ADVANCE Collaborative Group, 2009; Anderson R.J. et al., 2011; Аnderson R.T. et al., 2011).
Висновки
- АГ — важлива медико-соціальна проблема сучасності, пильна увага до якої зумовлена тим, що підвищення АТ є значущим і незалежним фактором ризику розвитку інших серцево-судинних захворювань, інвалідизуючих ускладнень і смертності хворих.
- Враховуючи широку розповсюдженість АГ в усьому світі, проблема її лікування перестала бути суто кардіологічною і набула міждисциплінарного характеру.
- Провідну роль у лікуванні АГ посідає медикаментозна терапія. На сьогодні в лікуванні АГ застосовують п’ять основних класів антигіпертензивних препаратів — препарати першої лінії (діуретики, ІАПФ, антагоністи кальцію тривалої дії, БРА, блокатори β-адренорецепторів) та препарати другої лінії (блокатори α1- адренорецепторів, агоністи α2- адренорецепторів центральної дії, алкалоїди раувольфії, агоністи імідазолінових рецепторів).
- Основні класи антигіпертензивних препаратів суттєво не відрізняються за своєю загальною здатністю знижувати АТ при АГ та здатністю щодо запобігання загальному серцево-судинному ризику і причинно-специфічним серцево-судинним ускладненням.
- Кожний клас антигіпертензивних препаратів має свої показання та протипоказання в конкретних клінічних ситуаціях, яких слід чітко дотримуватися. На вибір препарату суттєво впливають численні фактори, найважливішими з яких є: наявність у хворого факторів ризику, ураження органівмішеней, асоційовані клінічні стани (ураження нирок, метаболічний синдром, ЦД), супутні захворювання, при яких необхідне застосування чи обмеження застосування антигіпертензивних препаратів різних класів, індивідуальні реакції хворого на препарати різних класів в анамнезі, ймовірність взаємодії з ліками, призначеними пацієнту з іншого приводу, соціально-економічні фактори (включаючи вартість лікування).
- Наявність великої кількості варіантів медикаментозної терапії значно підвищує шанси контролю АТ у більшості хворих на АГ. Це має вирішальне значення, оскільки зниження АТ, незалежно від способу його досягнення, сприяє серцево- судинній протекції.
- Монотерапія, незалежно від застосовуваного препарату, може ефективно знижувати АТ лише у обмеженої кількості хворих; більшість із них потребують поєднання, як мінімум, двох препаратів.
- Є декілька комбінацій двох препаратів, придатних для клінічного застосування. До пріоритетних комбінацій відносять: діуретик + ІАПФ; діуретик + БРА; діуретик + антагоніст кальцію; ІАПФ + антагоніст кальцію; антагоніст кальцію + БРА.
- Комбінації блокатор β- адренорецепторів + діуретик слід уникати (за винятком випадків, коли вона необхідна з інших причин) у зв’язку з ризиком розвитку ЦД у схильних пацієнтів. Застосування комбінації ІАПФ + БРА дає сумнівне потенціювання антигіпертензивної дії зі стійким підвищенням ризику розвитку серйозних побічних ефектів.
- Не менше ніж у 15–20% хворих на АГ контроль АТ не може бути досягнутий за допомогою комбінації двох препаратів. У разі необхідності застосування трьох препаратів найбільш раціональним є поєднання БРА, антагоніста кальцію та діуретика в ефективному дозуванні.
Література
- Коваленко В.М. (ред.) (2009) Настанова з кардіології. МОРІОН, Київ, 1368 с.
- Преображенский Д.В., Сидоренко Б.А. (1997) Применение ингибиторов АПФ при лечении острого инфаркта миокарда. Кардиология, 3: 100–104.
- Свіщенко Є.П., Багрій А.Е., Єна Л.М. та ін.; Робоча група з артеріальної гіпертензії Української асоціації кардіологів (2008) Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Посібник до Національної програми профілактики і лікування артеріальної гіпертензії. 4-те вид., випр. і доп. ННЦ«Інститут кардіології ім. М.Д. Стражеска», Київ, 55с.
- ALLHAT (2002) The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (allhat.sph.uth.tmc.edu).
- Ambrosioni E., Borghi C., Magnani (1995) The effect of the angiotensin-converting- enzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. The Survival of Myocardial Infarction Long-Term Evaluation (SMILE) Study Investigators. N. Engl. J. Med., 332(2): 80–85.
- Anderson R.J., Bahn G.D., Moritz E. et al.; VADT Study Group (2011) Blood pressure and cardiovascular disease risk in the Veterans Affairs Diabetes Trial. Diabetes Care, 34(1): 34–38.
- Anderson R.T., Narayan K.M., Feeney
- et al.; Action to Control Cardiovascular Risk in Diabetes (ACCORD) Investigators (2011) Effect of intensive glycemic lowering on health-related quality of life in type 2 diabetes: ACCORD trial. Diabetes Ca re, 34(4): 807–812.
- ASCOT-LLA (2008) Extended ASCOTlipid lowering (ASCOT-LLA) study shows positive results of atorvastatin. Cardiovasc. J. Afr., 19(1): 49–
- Athyros V.G., Tziomalos K., Gossios T.D.; GREACE Study Collaborative Group (2010) Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc Lancet, 376(9756): 1916–1922.
- Ball G., Hall A.S., Murray G.D. (1995) Angiotensin-converting enzyme inhibitors after myocardial infarction: indications and timing. J. Am. Coll. Cardiol., 25(7): 42–46.
- Blardi P. (1997) Pharmacogenetics: pharmacokinetics and clinical implications. Prog. Med., 88(1): 46–55.
- BPLTTC (2003) Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively- designed overviews of randomised Lancet, 362(9395): 1527–1535.
- Chalmers J., MacMahon S., Manciaet al. (1999) 1999 World Health Organization- International Society of Hypertension Guidelines for the management of hypertension. Guidelines sub- committee of the World Health Organization. Clin. Exp. Hypertens., 21(5–6): 1009–1060.
- Choi S.H., Chae A., Miller E. et (2008) Relationship between biomarkers of oxidized low-density lipoprotein, statin therapy, quantitative coronary angiography, and atheroma: volume observations from the REVERSAL (Reversal of Atherosclerosis with Aggressive Lipid Lowering) study. J. Am. Coll. Cardiol., 52(1): 24–32.
- Cosіn J., Dіez J.; TORIC investigators (2002) Torasemide in chronic heart failure: results of the TORIC study. Eur. J. Heart Fail., 4(4): 507–513.
- Dahlof B., Devereux R.B., KjeldsenS.E. et al. (2002) Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet, 359: 995–1003.
- Dahlоf B., Lindholm L.H., Hansson et al. (1991) Morbidity and mortality in the Swedish Trial in Old Patients with Hypertension (STOP- Hypertension). Lancet, 338(8778): 1281–1285.
- Dahlоf В., Hansson L., Lindholm H. et al. (1993) STOP-Hypertension 2: A Prospective Intervention Trial of «Newer» versus «Older» Treatment Alternatives in Old Patients with Hypertension. Blood Pressure, 2(2): 136–141.
- Eichelbaum M., Kroemer H.K., Mikus (1992) Genetically determined differences in drug metabolism as a risk factor in drug toxicity. Toxicol. Lett., 64–65.
- Erdine , Ari O., Zanchetti A. et al. (2006) ESH/ESC guidelines for the management of hypertension. Herz., 31(4): 331–338.
- ESH/ESC Guidelines Committee (2003) 2003 European Society of Cardiology guidelines for management of arterial hypertension. Hypertens., 21(6): 1011–1053.
- Evans M. (1998) The UK Prospective Diabetes Study. Lancet, 352(9144): 1932–1933.
- EWPHE (1985) An international trial of antihypertensive therapy in elderly Objectives, protocol and organization. Arch. Int. Pharmacodyn. Ther., 275(2): 300–334.
- GISSI-3 (1994) GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Lancet, 343(8906):1115–1122.
- Goa K.L., Balfour J.A., Zuanetti (1996) Lisinopril. A review of its pharmacology and clinical efficacy in the early management of acute myocardial infarction. Drugs, 52(4): 564–588.
- Grimm R.H. Jr., Cohen J.D., SmithW.M. et al. (1985) Hypertension management in the Multiple Risk Factor Intervention Trial (MRFIT). Six- year intervention results for men in special intervention and usual care groups. Arch. Intern. Med., 145(7): 1191–1199.
- Heller S.R., ADVANCE Collaborative Group (2009) A summary of the ADVANCE Diabetes Care, 32 (2): 357–361.
- Hsia J., MacFadyen J.G., Monyak , Ridker P.M. (2011) Cardiovascular event reduction and adverse events among subjects attaining low- density lipoprotein cholesterol <50 mg/dl with rosuvastatin. The JUPITER trial (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin). J. Am. Coll. Cardiol., 57(16): 1666–1675.
- HYVET (2009) Hypertension in the Very Elderly Trial (www.hyvet.com).
- Kato R. (1995) Molecular pharmacological and toxicological studies of drug- metabolizing Yakugaku Zasshi., 115(9): 661–680.
- Kjeldsen S.E., Westheim A.S., Os (2000) INSIGHT and NORDIL. International Nifedipine GITS study: Intervention as a Goal in Hypertension Treatment. Nordic Diltiazem Study. Lancet, 356(9245): 1929–1930.
- Latini R., Maggioni A.P., Flather M. et (1995) ACE inhibitor use in patients with myocardial infarction. Summary of evidence from clinical trials. Circulation, 92(10): 3132–3137.
- Lithell H., Hansson L., Skoog I. et ; SCOPE Study Group (2003) The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J. Hypertens., 21(5): 875–886.
- Mancia G., De Backer G., Dominiczaket al.; Management of Arterial Hypertension of the European Society of Hypertension; European Society of Cardiology (2007) 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J. Hypertens., 25(6): 1105–1187.
- Mancia G., Laurentb S., AgabitiRoseicet al. (2010) Пересмотр Європейских рекомендаций по ведению артериальной гипертензии: документ рабочей группы Європейского общества гипертензии. Артериальная гипертензия, 1(9): 63– 106.
- Mancini G.B., Henry G.C., Macaya et al. (1996) Angiotensinconverting enzyme inhibition with quinapril improves endothelial vasomotor dysfunction in patients with coronary artery disease. The TREND (Trial on Reversing ENdothelial Dysfunction) Study. Circulation, 94(3): 258–265.
- Mitchell B. (1992) MRC trial of treating hypertension in older adults. BMJ, 304(6842): 1631.
- Moser M. (2005) The ASCOT trial. Clin. Hypertens., 7(12): 748–750.
- Nissen S., Nicholls S., Sipahi I. (2006) Effect of very high-intensity statin therapy on regression of coronary atherosclerosis. The ASTERIOD trial. JAMA, 295: 1556–1565.
- Okazaki S., Yokoyama T., Miyauchi et al. (2004) Early statin treatment in patients with acute coronary syndrome: demonstration of the beneficial effect on atherosclerotic lesions by serial volumetric intravascular ultrasound analysis during half a year after coronary event: the ESTABLISH Study. Circulation, 110(9): 1061–1068.
- Opie L.H. (1999) Angiotensin- Converting Enzyme Inhibitors: The Advance Continues. Authors’ Publ. House, New York, 275
- Parving H.H., Persson F., Lewis B. et al.; AVOID Study Investigators (2008) Aliskiren combined with losartan in type 2 diabetes and nephropathy. N. Engl. J. Med., 358(23): 2433–2446.
- Pedrazzini G., Santoro E., Latini R. et ; GISSI-3 Investigators (2008) Causes of death in patients with acute myocardial infarction treated with angiotensin-converting enzyme inhibitors: findings from the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto (GISSI)-3 trial. Am. Heart J., 155(2): 388–394.
- Rydén L., Armstrong P.W., ClelandJ.G. et al. (2000) Efficacy and safety of high-dose lisinopril in chronic heart failure patients at high cardiovascular risk, including those with diabetes mellitus. Results from the ATLAS trial. Eur. Heart J., 21(23): 1967–1978.
- Scheen A.J. (2002) Clinical study of the month. The LIFE study: cardiovascular protection of hypertensive patients by Rev. Med. Liege., 57(4): 240–244.
- Schrader J., Lüders S., Kulschewskiet al.; MOSES Study Group (2005) Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principalresults of a prospective randomized controlled study (MOSES). Stroke, 36(6): 1218–1226.
- Sever P.S., Gradman A.H., Azizi (2009) Managing cardiovascular and renal risk: the potential of direct renin inhibition. J. Renin Angiotensin Aldosterone Syst., 10(2): 65–76.
- Sheridan D.J. (1999) Left ventricular hypertrophy regression: the LIVE trial. Cardiologia, 44 1(Pt 2): 541–543.
- Singer B. (1991) Stroke in the elderly treated for systolic hypertension (SHEP). J. Insur. Med., 23 (4): 265–269.
- Swedberg K., Held P., Kjekshus J. et (1992) Effects of the early administration of enalapril on mortality in patients with acute myocardial infarction. Results of the Cooperative New Scandinavian Enalapril Survival Study II (CONSENSUS II). N. Engl. J. Med., 327 (10): 678– 684.
- Tobe S.W., Clase C.M., Gao P. et (2011) Cardiovascular and renal outcomes with telmisartan, ramipril, or both in people at high renal risk: results from the ONTARGET and TRANSCEND studies. Circulation, 123(10): 1098–1107.
- Toyo-Oka , Nayler W.G. (1996) Third generation calcium entry blockers. Blood. Pressure, 5: 206–208.
- Uresin Y., Baran E. (2009) The future of renin inhibition. Turk. Kardiyol. Dern. Ars., 37 (7): 32–38.
- VAC STUDY (1972) Effects of treatment on morbidity in hypertension. Circulation, 45:
- Wang G., Staessen J.A. (2002) Conventional therapy and newer drug classes for cardiovascular protection in hypertension. J. Am. Soc. Nephrol., 13(3): 208–215.
- Weir M.R., Reisin E., Falkner B. et (1998) Nocturnal reduction of blood pressure and the antihypertensive response to a diuretic or angiotensin converting enzyme inhibitor in obese hypertensive patients. TROPHY Study Group. Am. J. Hypertens., 11(8 Pt. 1): 914–920.
- WHO/ISH (1993) 1993 guidelines for the management of mild hypertension. Memorandum from a World Health Organization/International Society of Hypertension meeting. Guidelines Subcommittee of the WHO/ISH Mild Hypertension Liaison Committee. Hypertens., 22 (3): 392–403.










Комментировать