П.И.Раснер, Д.Ю.Пушкарь Кафедра урологии ГОУ ВПО Московский государственный медико- стоматологический университет Минздравсоцразвития РФ.
Чем обычно лечат
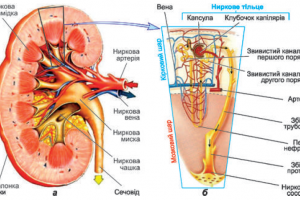
Традиционно лечение больных аденомой предстательной железы (АПЖ) может идти по трем основным сценариям: динамическое наблюдение, хирургическое вмешательство или медикаментозная терапия. Принцип выбора тактики лечения зависит от нескольких показателей. Одним из наиболее важных является выраженность симптоматики, которая измеряется при помощи опросника IPSS (Международная система суммарной оценки заболеваний предстательной железы). При более детальном анализе симптомы могут быть отнесены к разряду нарушения функции опорожнения, накопления и постмиктурическим нарушениям, что также оказывает влияние на выбор тактики лечения. Главным объективным критерием следует считать качество мочеиспускания, которое оценивается на основании данных урофлоуметрии. При этом значение имеет не только максимальная скорость потока мочи (Qmax), но и время мочеиспускания, время достижения Qmax и многие другие показатели. Количество остаточной мочи также является важным объективным критерием, отражающим уровень компенсации функции детрузора в ситуации постепенно нарастающей инфравезикальной обструкции (ИВО).
Выбор терапии
Следующая группа показателей, оказывающих не меньшее влияние на выбор тактики лечения АПЖ, чем данные урофлоуметрии и IPSS, объединяются в понятие факторов риска прогрессии заболевания. Безусловно, мы не можем игнорировать размеры предстательной железы, но сами по себе они не являются показанием к тому или иному виду лечения, а лишь дополнительным настораживающим фактором, потенциально влияющим на риск развития острой задержки мочеиспускания (ОЗМ), ухудшения симптоматики и т.д. К важным факторам риска в последние годы относят уровень простатоспецифического антигена (ПСА) сыворотки крови. Сегодня значимость ПСА увеличилась и отражает не только вероятность выявления рака простаты, но и активность пролиферативных процессов в предстательной железе. При более высоких показателях ПСА риск скорой прогрессии заболевания выше, чем при низких значениях у пациентов с сопоставимыми показателями балла IPSS и объемом простаты [1].
Все перечисленные факторы оказывают влияние на принятие решения о выборе оптимальной лечебной тактики у конкретного пациента. Исходя из современных представлений, медикаментозная терапия должна назначаться больным АПЖ с начальными проявлениями нарушения мочеиспускания без вовлечения в процесс верхних мочевых путей и осложнений, больным с относительными и абсолютными противопоказаниями к оперативному лечению, пациентам, отказавшимся от оперативного лечения или откладывающим его по различным причинам.
Динамическое наблюдение допустимо у пациентов с умеренно выраженными симптомами нижних мочевых путей (СНМП) на фоне АПЖ (IPSS менее 8), а также у пациентов, качество жизни которых существенно не страдает из-за имеющихся симптомов. Наблюдение за такими пациентами включает объяснение им необходимости контроля образа жизни, регулярную сдачу анализов крови и мочи, ПСA, ультразвукового исследования и урофлоуметрии.
Оперативное лечение показано пациентам с выраженной симптоматикой, вовлечением в процесс верхних мочевых путей, у которых имеются противопоказания к назначению медикаментозной терапии или есть основания предполагать, что медикаментозное лечение будет неэффективным [2].
Увеличение продолжительности жизни и старение населения приводит к увеличению числа пациентов с АПЖ и СНМП. Известно, что причин возникновения СНМП у мужчин довольно много, но наиболее частой является именно АПЖ. Так, вероятность наличия СНМП составляет всего 14% для мужчины 30–40 лет и увеличивается до 40% и более к 50–60 годам [3].
Медикаментозное лечение
Медикаментозное лечение за последнее десятилетие стало стандартом терапии пациентов с симптоматической АПЖ при отсутствии абсолютных показаний к оперативному лечению. Хирургическое вмешательство становится все менее популярным при выборе лечебной тактики у больных с СНМП. В исследовании Triumph из более чем 2 тыс. первичных пациентов в 6 европейских странах, в течение года обратившихся за медицинской помощью в связи с наличием у них СНМП, оперативное вмешательство было рекомендовано менее чем 3% больных! Интересно, что 23,8% пациентов нуждались лишь в динамическом наблюдении, медикаментозная терапия была рекомендована в 72,5% случаев. Эти данные как нельзя лучше отражают современные тенденции к сужению показаний к оперативному вмешательству и все большей популяризации медикаментозных методов коррекции расстройств мочеиспускания. Интересен тот факт, что среди всех средств, применявшихся для консервативной терапии у больных АПЖ, a-адреноблокаторы занимали 80% [4].
Анализируя историю медикаментозного лечения СНМП, ее можно разбить на несколько этапов, каждый из которых отмечен пиком популярности того или иного подхода. a-Aдреноблокаторы стали первой альтернативой хирургическому вмешательству. Понятно, что само по себе увеличение простаты в размерах не является единственной причиной возникновения расстройств мочеиспускания. Большое значение в их формировании имеет тонус гладких мышц шейки мочевого пузыря (МП). Именно устранение повышенного тонуса этих мышц и лежит в основе эффекта воздействия a-адреноблокаторов. Тамсулозин как препарат, обладающий наибольшей селективностью к рецепторам простаты и МП, стал в последние годы наиболее популярным препаратом этой фармгруппы.
Следующим важным этапом явилось появление ингибиторов 5-a-редуктазы (5АРИ). Эти препараты за счет устранения гормонального влияния на простату останавливают ее рост и в некоторых случаях даже способствуют ее уменьшению. Надо сказать, что ни один из препаратов группы 5АРИ так и не стал серьезной альтернативой a-адреноблокаторам, и их популярность среди всех средств для медикаментозного лечения СНМП во всем мире не превышает 3–5%. Несколько большую популярность получила идея комбинации 5АРИ и a-адреноблокаторов, которая основывается на комплексном подходе к лечению СНМП. Работы по доказательству эффективности такой комбинированной терапии в настоящее время активно продолжаются.
Для дальнейшего понимания патогенеза СНМП основополагающей стала теория, раскрывшая значение мышцы мочевого пузыря (детрузора) в процессе формирования симптомов расстройства мочеиспускания. Доказано, что наличие спонтанных сокращений
детрузора приводит к возникновению частых, а иногда и императивных позывов к мочеиспусканию. Термин «гиперактивный мочевой пузырь» (ГМП), впервые предложенный Полом Абрамсом (Paul Abrams) в 1997 г. [5], в настоящее время трактуется как комплекс симптомов, включающий ургентность, учащенное мочеиспускание, императивное недержание мочи и ноктурию.
Современные эпидемиологические исследования указывают на крайне широкую распространенность симптомов ГМП у взрослого населения Европы. Так, общие цифры заболеваемости ГМП, по некоторым данным, достигают 17%. Важно то, что распространенность ГМП не ассоциирована с полом пациента, – в возрасте 30–50 лет симптомы ГМП одинаково часто встречаются и у мужчин, и у женщин, а в преклонном и старческом возрасте мужчины страдают от ГМП чаще, чем женщины. Современные данные свидетельствуют, что 70–75% больных АПЖ страдают именно от ирритативных дизурических расстройств [6], которые причиняют им большее беспокойство, чем жалобы, напрямую связанные с ИВО (ослабление и прерывистость струи мочи, напряжение брюшной стенки при мочеиспускании и т.д.). Ирритативные расстройства мочеиспускания оказывают выраженное негативное воздействие на общее самочувствие, значительно ухудшая качество жизни больного. Исходя из этих данных, становятся очевидными причины некоторого снижения интереса к оперативному подходу в лечении АПЖ во всем мире, с помощью которого невозможно в большинстве случаев эффективно бороться с ирритативной составляющей СНМП.
Гиперактивность детрузора может быть выявлена примерно у 45–50% пациентов с ИВО. Этот феномен может иметь двоякое объяснение – быть следствием нарушения чувствительности (гиперсенсетивности) холинергических рецепторов (закон Кеннона) или результатом структурных изменений в детрузоре на фоне его ишемии [7]. Oelke в 2008 г. обнаружил признаки гиперактивности детрузора у 60,9% пациентов с ИВО, являвшейся следствием АПЖ [8].
До сих пор предметом обсуждения является первичный или вторичный характер ГМП у пациентов с ИВО. Часть авторов придерживаются мнения о независимом характере этих изменений, но некоторые высказываются в пользу наличия причинно-следственной связи между ИВО и ГМП. В качестве одной из наиболее вероятных причин нарушения работы детрузора приводят фактор повышения внутрипузырного давления и влияния этого фактора на состояние мышцы МП [9]. Важный факт, с которым согласно подавляющее большинство исследователей, – высокая вероятность сохранения «расстройств накопления», являющихся проявлением ГМП у пациентов, которым проведено эффективное лечение ИВО, будь то медикаментозная терапия или хирургическое вмешательство. Наличие этих «симптомов нарушения накопления», безусловно, является основанием для назначения таким пациентам м-холиноблокаторов [10].
Athanasopoulos в 2011 г. приводит диаграмму причинно-следственной связи расстройств мочеиспускания и ГМП (рис. 1).
Оценивая современную концепцию медикаментозной терапии СНМП, важно осознавать необходимость изначальной «двойной» направленности такого лечения: борьба с расстройствами «накопления» и «опорожнения» МП. Современным стандартом медикаментозной терапии у больных АПЖ является назначение селективных a-адреноблокаторов. Эти препараты обладают наибольшей эффективностью и наилучшей переносимостью. Но даже они не в состоянии обеспечить 100% избавление пациентов от СНМП. Их эффективность приближается к 80–85%. В зависимости от выраженности эффекта консервативной терапии больных можно разделить на следующие группы:
- больные с полным исчезновением симптомов заболевания;
- больные с частичным исчезновением симптомов заболевания;
- больные, у которых терапия оказалась неэффективна.
В случае отсутствия ожидаемого эффекта от первичной консервативной терапии пациентам должно быть предложено альтернативное лечение. Очевидно, что оперативное вмешательство маловероятно избавит пациента от расстройств накопления, удельный вес которых среди СНМП у больных АПЖ весьма велик. Перед лечащим врачом встает проблема определения дальнейшей тактики лечения, в то время как выбор эффективных лечебных мероприятий значительно ограничен. Kaplan и соавт. в 2005 г. опубликовали результаты собственных исследований эффективности назначения препаратов с антихолинергической активностью (АХП) после безуспешной терапии a-адреноблокаторами [12]. Через 6 мес лечения толтеродином авторы отмечали значительное уменьшение поллакиурии и никтурии. Острая задержка мочи не возникла ни у одного из больных. После назначения толтеродина пациентам, у которых имелись данные о неэффективной терапии a-адреноблокаторами, у 63% больных Lee и соавт. отметили уменьшение индекса IPSS на 3 балла и более [13]. Именно так сформировалось мнение о возможности применения АХП у пациентов, страдающих СНМП, обусловленных АПЖ. В качестве теоретического обоснования уместности подобных назначений приводятся данные о наличии у больных АПЖ признаков ГМП, которые наиболее эффективно устраняются именно АХП.
Тем не менее, несмотря на все большее количество публикаций, повествующих об успешном применении этих препаратов у больных АПЖ, назначение АХП при лечении симптомов ГМП при АПЖ многими урологами по-прежнему воспринимается с опаской. Чаще всего причиной подобных опасений является расхожее мнение о высоком риске развития ОЗМ на фоне применения АХП у больных ИВО. Безосновательность таких опасений доказана в метаанализе, обобщившем результаты 19 исследований эффективности применения АХП у больных АПЖ за последние 15 лет [14].
В этой статье приведены данные о динамике основных показателей на фоне такого лечения. Так, объем простаты оставался неизменным, максимальная скорость потока мочи, по данным урофлоуметрии, также не менялась, количество остаточной мочи увеличилось в среднем на 10 см3, что не имело никакого клинического значения. Самым важным выводом этой работы явилось доказательство отсутствия риска ОЗМ: в группе активной терапии (применение АХП) ОЗМ зафиксирована у 0,8% пациентов, а без такого лечения в контрольной группе за тот же промежуток времени – у 0,6%. Основным ожидаемым эффектом явилось увеличение объема МП в момент первого спонтанного сокращения детрузора на 47 см3. Это существенно снизило частоту позывов к мочеиспусканию в дневные часы и особенно ночью, увеличило эффективную емкость МП и уменьшило выраженность ирритативной симптоматики. Безусловно, возможность применения существует только у пациентов со средней и умеренной выраженностью расстройств мочеиспускания в отсутствие показаний к оперативному вмешательству.
Одной из наиболее перспективных сегодня методик консервативного лечения СНМП является комбинированное назначение a-адреноблокаторов и АХП. Идея их совместного применения основывается на понимании механизма действия – первый класс препаратов эффективно устраняет ИВО, в то время как второй способен значительно снизить выраженность ирритативных расстройств. Первый опыт их совместного применения относится к 1985 г., когда McGuir и соавт. опубликовали результаты своих исследований сократимости изолированного МП. Феноксибензамин вызывал снижение давления детрузора и увеличивал емкость МП, а добавление атропина или любого другого антихолинергического препарата усиливало этот эффект [15].
В 2006 г. в журнале Американской медицинской ассоциации вышла статья Steven Kaplan, получившая большой резонанс в урологических научных кругах [16].
В этом исследовании приняли участие 95 урологических центров США. Основной идеей исследования явилось желание доказать несостоятельность монотерапии АХП препаратами или a-адреноблокаторами и преимущества их сочетанного назначения. Были сформированы 4 группы из мужчин в возрасте старше 40 лет с IPSS более 12, QoL (оценка качества жизни по 6-балльной шкале) более 3, количеством мочеиспусканий более 8 или эпизодов ургентности более 3 за сутки. Из них 222 пациента получали плацебо, 217 – толтеродин, 215 – тамсулозин и 225 – комбинацию толтеродина и тамсулозина. Через 12 нед эффект от проведенного лечения отметили 80% пациентов в группе комбинированной терапии, 62% в группе плацебо, 71 и 65% в группах монотерапии толтеродином и тамсулозином соответственно. Наилучшая динамика баллов IPSS и QoL также была зафиксирована в группе комбинированной терапии. Лечение хорошо переносилось пациентами, при этом ОЗМ развилась у 0,5% пациентов в группе терапии толтеродином и у 0,4% пациентов в группе сочетанной терапии. На фоне приема плацебо и тамсулозина эпизодов ОЗМ не зафиксировано.
В 2009 г. в журнале Американской медицинской ассоциации был опубликован алгоритм, предложенный Graves и соавт. Этот алгоритм был разработан в соответствии с положением о том, что стандартом 1-й линии медикаментозной терапии АПЖ являются a-адреноблокаторы. Но даже они не позволяют достичь абсолютной эффективности лечения у всех без исключения больных, и иногда бывает необходима 2-я линия терапии.
В соответствии с этим алгоритмом a-адреноблокаторы являются не только препаратами выбора для лечения СНМП у больных АПЖ, но и тестовым, или пробным вариантом лечения, при неэффективности которого пациенту должны быть назначены АХП в режиме монотерапии или в сочетании. В 2010 г. этот алгоритм (рис. 2) получил одобрение на ежегодном конгрессе Американской урологической ассоциации [17].
В апреле 2010 г. Европейская урологическая ассоциация опубликовала «Обновленные рекомендации по консервативному лечению ненейрогенных симптомов нижних мочевых путей у мужчин» [18]. Помимо стандартных положений о ведущей роли a-адреноблокаторов и возможности комбинированного назначения 5АРИ и a-адреноблокаторов, в рекомендациях 2010 г. впервые появилась глава о высокой эффективности применения комбинированной терапии a-адреноблокаторами и препаратами с антихолинергической активностью (м-холинолитиков– мХЛ). В этой главе приведены результаты рандомизированных исследований, в которых доказывается высокая эффективность подобного лечения (большинство из них приведены в данной статье). Перечислены препараты, которые использовались для такой комбинированной терапии: это тамсулозин, доксазозин и теразозин в качестве a-адреноблокаторов и оксибутинин, пропиверин, солифенацин и толтеродин в качестве АХП. В рекомендациях указывается необходимость мониторинга количества остаточной мочи для предотвращения риска развития ОЗМ. Такая терапия должна с осторожностью назначаться пациентам с ИВО.
Если наличие ГМП может быть зарегистрировано на начальном этапе лечения, то существует возможность сразу рекомендовать больному АПЖ и СНМП комбинированную терапию a-адреноблокатором и АХП. Результаты такого лечения приводит в своей статье Seung Hwan Lee и соавт. [19]. Согласно 12-недельному протоколу 176 пациентов в возрасте старше 50 лет получали в 2 параллельных группах комбинированное лечение или монотерапию АХП. В 2 группах регистрировались положительные изменения симптоматики, но на фоне комбинированного лечения эти изменения были более выраженными. Так, средний суммарный балл симптомов накопления в анкете IPSS сократился с 9,5 до 7,8 в группе монотерапии (-1,7) и с 9,3 до 5,9 (3,4) – в группе комбинированной терапии. Аналогичная закономерность выявлена в отношении балла по вопроснику QoL и выраженности ургентности.
Одной из наиболее интересных публикаций последнего времени явилось исследование VICTOR (VESIcareR In Combination With Tamsulosin in OAB Residual Symptoms) – использование Везикара в комбинации с тамсулозином для лечения остаточных симптомов ГМП.
В общей сложности в исследовании приняли участие 398 пациентов от 45 лет и старше, рандомизированных в 2 группы: прием тамсулозина + солифенацина (1-я группа) и тамсулозина + плацебо (2-я группа). Общим для всех пациентов явился вводный период монотерапии тамсулозином, к исходу которого все больные имели не менее 8 мочеиспусканий и не менее 1 эпизода ургентности в течение суток. При этом балл IPSS должен был быть не менее 13, балл опросника Patient Perception of Bladder Condition не менее 3, количество остаточной мочи не более 200 мл и максимальная скорость потока мочи – более 5 мл/с. Наиболее частыми побочными эффектами лечения явились сухость во рту – 7% пациентов 1-й группы и 3% 2-й группы, головокружение – 3 и 2% в 1 и 2-й группах соответственно. ОЗМ имело место у 7 пациентов 1-й группы. В группе комбинированной терапии через 12 нед лечения отмечено более выраженное уменьшение количества мочеиспусканий в сутки (1,05 против 0,67) и статистически более значимое снижение количества эпизодов ургентности (2,18 против 1,1) [20].
Список работ, касающихся опыта применения АХП в качестве монотерапии, и особенно в сочетании с адреноблокаторами у больных СНМП, быстро пополняется. Подробный анализ литературы за последние 5 лет даже по основным печатным изданиям выявил не менее 20 статей. Несмотря на такое количество публикаций говорить о возможности терапии АХП у данной категории пациентов как об общепризнанном стандарте пока рано. Тем не менее комбинированное назначение
a-адреноблокаторов и АХП может быть рекомендовано пациентам со средней и тяжелой степенью выраженности СНМП, если попытка монотерапии адреноблокаторами не позволила обеспечить достаточную эффективность лечения.
Список литературы:
- Hutchison A, Farmer R, Verhamme et al. The efficacy of drugs for the treatment of LUTS/BPH, a study in 6 European countries. Eur Urol 2007; 51: 207–16.
- Abrams P, Wein AJ. The overactive bladder: from basic science to clinical management. Urology 1997; 50 (Suppl 6A): 1–144.
- Irwin DE, Milsom I, Hunskaar S et al. Population-based survey of urinary incontinence, overactive bladder, and other lower urinary tract symptoms in five countries: results of the EPIC study. Eur Urol 2006; 50: 1306–15.
- Chapple CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: focus on the bladder. Eur Urol 2006; 49: 651–9.
- Oelke M, Baard J, Wijkstra H et al. Age and Bladder Outlet Obstruction Are Independently Associated with Detrusor Overactivity in Patients with Benign Prostatic Hyperplasia. Eur Urol 2008; 54: 419–26.
- de Nunzio C, Franco G, Rocchegiani A et al. The evolution of detrusor overactivity after watchful waiting, medical therapy and surgery in patients with bladder outlet obstruction. J Urol 2003; 169: 535–9.
- Thomas AW, Cannon A, Bartlett E et al. The natural history of lower urinary tract dysfunction in men: the influence of detrusor underactivity on the outcome after transurethral resection of the prostate with a minimum 10-year urodynamic follow-up. BJU Int 2004; 93: 745–50.
- Athanasopoulos A. The Role of Antimuscarinics in the Management of Men With Symptoms of Overactive Bladder Associated With Concomitant Bladder Outlet Obstruction: An Update. Eur Urol 2011. http://www.doi:10.1016/ j.eururo. 2011.03.054
- Kaplan SA, Walmsley K, Te AE. Tolterodine extended release attenuates lower urinary tract symptoms in men with benign prostatic hyperplasia. J Urol 2005; 174: 2273–6.
- Lee JY, Kim HW, Lee SJ et al. Comparison of doxazosin with or without tolterodine in men with symptomatic bladder outlet obstruction and an overactive bladder. BJU Int 2004; 94: 817–20.
- Blake-James BT, Rashidian A, Ikeda Y, Emberton M. The role of anticholinergics in men with lower urinary tract symptoms suggestive of benign prostatic hyperplasia: a systematic review and meta-analysis. BJU Int 2006; 99: 85–96.
- McGuire EJ, Savastano JA. Effect of alphaadrenergic blockade and anticholinergic agents on the decentralized primate bladder. Neurourol Urodyn 1985; 4: 139.
- Steven A. Kaplan MD, Claus G et al. Tolterodine and Tamsulosin for Treatment of Men With Lower Urinary Tract Symptoms and Overactive Bladder. A Randomized Controlled Trial. JAMA 2006; 296: 2319–28.
- Gravas S, Melekos MD. Male lower urinary tract symptoms: How do symptoms guide our choice of treatment? Curr Opin Urol 2009; 19 (1): 49–54.
- Oelke M, Bachmann A, Descazeaud A et al. Guidelines on Conservative Treatment of Nonneurogenic Male LUTS. Update March 2011. European Association of Urology 2011.
- Lee SH, Chung BH, Kim SJ et al. Bucheon, Initial Combined Treatment with Anticholinergics and Alpha-blockers for Men with Overactive Bladder and Bladder Outlet Obstraction Secondary to Benign Prostatic Hyperplasia: a Prospective Randomized Multicenter double-blind Placebo-controlled Study 2011; 185 (Suppl. 4).
- Kaplan SA, McCammon K, Fincher R et al. Safety and tolerability of solifenacin add-on therapy to alpha-blocker treated men with residual urgency and frequency. J Urol 2009; 182: 2825–30.







Комментировать