Співвідношення вартості та ефективності лікування, відповідний профіль безпеки. Визначення гострого інфаркту міокарда. Патогенез гострого інфаркту міокарда. Природний перебіг гострого інфаркту міокарда. Невідкладні заходи. Зменшення болю, задишки і збудження. Догоспітальна або рання госпітальна допомога. Хірургічне втручання: шунтування вінцевих артерій. Незначна і помірна серцева недостатність. Виражена серцева недостатність і шок.
Проект рекомендацій Асоціації кардіологів України
Передмова
Упродовж останніх 25 років лікування гострого інфаркту міокарда (ГІМ) продовжує зазнавати істотних змін. Упровадження за цей час у клінічну практику методів фармакологічної і механічної реваскуляризації міокарда, інгібіторів ангіотензинперетворюючого ферменту, блокаторів pадренорецепторів, нових антитромбо цитарних та антикоагулянтних засобів, статинів суттєво змінило перебіг захворювання та його прогноз. Ми є свідками того, як кожні 45 років отримуються нові дані, реєструються нові препарати та підходи до лікування хворих на ГІМ. Оновлення діючих рекомендацій базується на даних доказової медицини, тому належна клінічна практика повинна ґрунтуватися на вагомих доказах, отриманих у рандомізованих клінічних дослідженнях. Слід визнати, що навіть при бездоганному виконанні клінічних досліджень і отриманні на цих засадах нових рекомендацій лікар має право вибору у відповідній клінічній ситуації. Дуже важливим для цього є співвідношення вартості та ефективності лікування, відповідний профіль безпеки, що стає дедалі більш важливим аспектом у прийнятті рішень щодо стратегій лікування.
Визначення гострого інфаркту міокарда
Інфаркт міокарда визначають за клінічними, електрокардіографічними, біохімічними і патоморфологічними характеристиками. Визнано, що термін «інфаркт міокарда» відображає смерть кардіоміоцитів, спричинену тривалим збереженням ішемії. На електрокардіограмі (ЕКГ) можна виявити ознаки ішемії міокарда зміни ST і T, а також ознаки некрозу міокарда, зокрема конфігурації комплексу QRS. ГІМ, який формується (evolving), діагностують у пацієнтів з відповідними клінічними симптомами і (1) елевацією сегмента ST, а саме, новою елевацією сегмента ST у точці J принаймні на 0,2 мВ у відведеннях V1V3 і на 0,1 мВ в інших відведеннях, або (2) без елевації сегмента ST, а саме з депресією ST або порушеннями морфології зубця T. Клінічно сформований (established) інфаркт міокарда діагностують у випадку появи зубця Q у будьякому відведенні від V1 до V3, або зубця Q тривалістю 0,03 с у відведеннях I, II, aVL, aVF, V4, V5 або V6.
Діагноз інфаркту міокарда доводять у тому випадку, коли на фоні гострої ішемії міокарда підвищується рівень у крові біомаркерів загибелі кардіоміоцитів. Серед існуючих біомаркерів перевагу в діагностиці пошкодження міокарда надають ферменту МВКФК. Його клінічна специфічність для діагностики незворотного пошкодження є стійкою. Альтернативним маркером є серцевий тропонін Т (кількісний аналіз), який характеризується майже абсолютною специфічністю до тканини міокарда, а також високою чутливістю. Для діагностики некрозу можуть бути використані також рівні тропоніну І та міоглобіну.
Ці рекомендації стосуються ведення пацієнтів, які госпіталізуються із симптомами ішемії та персистуючою елевацією сегмента ST на ЕКГ. У переважної більшості цих пацієнтів спостерігають типове підвищення рівня біомаркерів некрозу міокарда і прогресування патологічного процесу до формування інфаркту міокарда із зубцем Q. Рекомендації щодо лікування пацієнтів із симптомами ішемії, але без стійкої елевації сегмента ST були розроблені робочою групою Асоціації кардіологів України у 2007 р. і надруковані в «Українському кардіологічному журналі».
Патогенез гострого інфаркту міокарда
Причиною гострого коронарного синдрому майже завжди є раптове зменшення коронарного кровотоку, викликане атеросклерозом у поєднанні з тромбозом, з або без супутньої вазоконстрикції. Клінічні прояви та прогноз залежать від локалізації обструкції, тяжкості і тривалості ішемії міокарда. При інфаркті міокарда з елевацією сегмента ST переважно виникає оклюзивний і пер систуючий тромбоз. Приблизно в 2/33/4 випадків формуванню коронарного тромбу передує раптовий розрив вразливої бляшки (запаленої, багатої на ліпіди, покритої тонкою фіброзною оболонкою). Інші випадки пов’язують з механізмами, які визначені не до кінця (як ерозія бляшки та вторинний вазоспазм). У 3/4 випадків тромби, які ведуть до інфаркту, формуються в ділянці бляшок, які викликають лише незначний або помірний стеноз вінцевої артерії. Втім, на фоні вираженого стенозу частіше виникають розриви бляшок, які ведуть до утворення стійкої оклюзії артерії, великого інфаркту. Інфаркт міокарда, викликаний повною оклюзією вінцевої артерії, починає розвиватися через 1530 хв після початку вираженої ішемії (відсутність кровотоку по артерії або колатералях) і прогресує з часом від субендокар діальної до субепікардіальної ділянки (феномен фронту хвилі). Реперфузія і залучення колатералей можуть сприяти зменшенню ушкодження міокарда та зони некрозу. Наявність субкритичного, але стійкого кровотоку може розширити часове вікно для досягнення порятунку міокарда шляхом повної реперфузії.
Відповідь на розрив бляшки є динамічною: тромбоз і вторинний фібриноліз, часто асоційовані з вазоспазмом, виникають одночасно, викликаючи минущу обструкцію кровотоку і дистальну емболізацію. Остання веде до мікросудинної обструкції, яка може стати перепоною для успішної реперфузії міокарда, незважаючи на адекватний кровоток в артерії, що зумовила інфаркт. При коронарному тромбозі початкова обструкція кровотоку, як правило, викликана агрегацією тромбоцитів, але для подальшої стабілізації раннього та нестійкого тромбоцитарного тромбу важливий фібрин. Отже, еволюція персистуючого коронарного тромбу відбувається за участю і тромбоцитів, і фібрину.
Природний перебіг гострого інфаркту міокарда
Істинний природний перебіг інфаркту міокарда встановити важко з огляду на кілька причин: часте виникнення «німого» інфаркту, відносно висока частота раптової (в тому числі коронарної) смерті поза лікарнею, різноманітність і часто неадекватність методів діагностики захворювання. Рівень смертності внаслідок гострих серцевих нападів протягом першого місяця становить 3050 %, і серед цих випадків смерті приблизно половина стаються протягом перших 2 год. Цей високий рівень ранньої смертності істотно не змінився протягом останніх 25 років. Натомість, істотно зменшилася смертність пацієнтів, яких лікують у лікарні. До впровадження в 1960х роках спеціальних підрозділів допомоги при розладах коронарного кровообігу вну трішньогоспітальнасмертністьусередньомустановила25 30 %. Систематичний огляд досліджень з дотромболі тичної ери, виконаних у середині 1980х років, свідчить про середню смертність 18 %. З того часу, внаслідок широкого застосування фібринолітичних засобів, аспірину і коронарних втручань летальність протягом 1 міс у розвинених країнах зменшилася до 67 %. У нещодавно виконаному European Heart Survey, летальність пацієнтів з гострими коронарними синдромами та елевацією сегмента ST становила 8,4 % протягом 1 міс. Учасники дослідження WHOMONICA переконливо довели, що впровадження нових засобів лікування гострих коронарних синдромів дозволило зменшити кількість коронарних подій і летальність протягом 28 днів.
Багато років тому було встановлено деякі фактори, які дозволяють передбачити ризик смерті у пацієнтів, госпіталізованих з приводу інфаркту міокарда. Основними серед них були вік, особливості анамнезу захворювання (цукровий діабет, раніше перенесений інфаркт), клінічні маркери великого розміру інфаркту, включаючи передню локалізацію інфаркту, низький початковий рівень артеріального тиску, клас лівошлу ночкової недостатності за Кілліпом при госпіталізації і вираженість ішемії, про що свідчить елевація і/або депресія сегмента ST на ЕКГ. Ці фактори продовжують визнавати і зараз.
Завдання щодо ведення хворих
Первинна мета лікування полягає в запобіганні смерті. Втім, ведення хворих з інфарктом міокарда обов’язково спрямоване на зменшення до мінімуму почуття дискомфорту пацієнтів та обмеження ступеня пошкодження міокарда. Зручним видається виділення чотирьох фаз лікування.
- Невідкладні заходи. Основні завдання цієї фази надання допомоги полягають у швидкому встановленні діагнозу, знятті болю, профілактиці або лікуванні ускладнень захворювання (гемодинамічних та аритмічних).
- Ранні заходи. Принципове завдання цієї фази якомога швидший початок реперфузійної терапії для обмеження розмірів інфаркту, запобігання розширенню зони некрозу (extension) та раннього ремоделюван ня (expansion).
- Подальші заходи з метою подолання ускладнень, які виникають пізніше.
- Оцінка ризику та заходи з метою профілактики прогресування ішемічної хвороби серця, нового інфаркту, серцевої недостатності і смерті.
Ці фази здійснюються на етапах догоспітальної допомоги, у відділенні або блоці невідкладної кардіологічної допомоги, в спеціалізованому відділенні для постінфарктних хворих або звичайному відділенні терапевтичного профілю (при відсутності спеціалізованих відділень).
Невідкладні заходи
Встановлення діагнозу і рання стратифікація ризику
Швидке встановлення діагнозу і рання стратифікація ризику в пацієнтів, які звертаються з гострим болем у грудній клітці, важливі для виявлення тих хворих, у яких раннє втручання може поліпшити прогноз. Спочатку потрібно встановити робочий діагноз інфаркту міокарда. Звичайно підставою для цього є виникнення вираженого болю в грудній клітці тривалістю 20 хв або більше, який не зменшується після прийому нітрогліцерину. Важливими моментами для діагностичного пошуку є попередній анамнез ІХС, іррадіація болю в шию, нижню щелепу або ліву руку. Біль не завжди є вираженим. У пацієнтів похилого віку поширені такі прояви як втома, задишка, непритомність, синкопе. Не існує специфічних фізикальних ознак, які б дозволили встановлювати діагноз інфаркту міокарда. Проте, у багатьох пацієнтів з’являються риси, характерні для активації вегетативної нервової системи (бліда шкіра, пітливість), а також гіпотензія або зниження пульсового тиску. Можуть спостерігатися нерегулярний пульс, брадикардія або тахікардія, третій тон серця, вологі хрипи у нижніх відділах легень.
Якомога швидше потрібно зареєструвати ЕКГ. У випадку елевації сегмента ST або появи нової, чи ймовірно нової, блокади лівої ніжки пучка Гіса слід призначити реперфузійну терапію або здійснити заходи для її початку. Втім, картина ЕКГ часто є неоднозначною, і навіть при доведеному інфаркті можуть ніколи не з’явитися класичні риси елевації сегмента ST і нові патологічні зубці Q. Слід отримати повторні записи ЕКГ і, коли це можливо, порівнювати нові ЕКГ з попередніми записами. В окремих випадках (при істинно задньому інфаркті) корисно зареєструвати ЕКГ у додаткових відведеннях, наприклад, V7 і V8 та S1S4 по СлопакуПартіло. У всіх хворих потрібно якомога швидше почати моніторування ЕКГ для виявлення життєво небезпечних аритмій. У гострій фазі захворювання рутинно здійснюють аналіз крові на сироваткові маркери, але для рішення про початок реперфузійної терапії не потрібно чекати на результати цього аналізу.
Корисною методикою обстеження хворих з гострим грудним болем стала приліжкова двомірна ехо кардіографія. Регіональні порушення рухливості стінки з’являються протягом хвилин після виникнення коронарної оклюзії, до формування некрозу. Втім, порушення рухливості стінки не є специфічними для ГІМ і можуть бути зумовлені ішемією або раніше перенесеним інфарктом. Двомірна ехокардіографія особливо доцільна в диференціальній діагностиці з іншими причинами грудного болю, такими як гостре розшарування аорти, випіт у перикард або масивна легенева емболія. Відсутність порушень рухливості стінки дозволяє виключити наявність широкого інфаркту міокарда.
Резюме: початкова діагностика гострого інфаркту міокарда
- Анамнез болю / дискомфорту в грудній клітці.
- Елевація сегмента ST або припущення щодо нової блокади лівої ніжки пучка Гіса на ЕКГ при госпіталізації. Слід зареєструвати повторні ЕКГ.
- Підвищені маркери некрозу міокарда (МВКФК, тро поніни, міоглобін). Для рішення про початок реперфузійної терапії не потрібно чекати на результати.
Зменшення болю, задишки і збудження
Зменшенню болю надають надзвичайно важливого значення не лише через міркування гуманності, а й тому що біль асоціюється із симпатичною активацією, яка спричиняє вазоконстрикцію та підвищення навантаження на серце. У цьому контексті найчастіше застосовують внутрішньовенні опіоїди морфін (наприклад, у дозі 510 мг морфіну з додатковим введенням 28 мг з інтервалами по 515 хв до зникнення болю); слід уникати внутрішньом’язових або підшкірних ін’єкцій. Можливі побічні ефекти нудота, блювота, гіпотензія з брадикардією, пригнічення дихання. З метою корекції побічних ефектів можна призначати протиблювотні засоби разом з опіоїдами. Брадикардія, як правило, може коригуватися атропіном або стимуляцією серця, пригнічення дихання штучною вентиляцією легень. У випадках, коли опіоїди не дозволяють зняти біль при повторному призначенні, доцільні внутрішньовенні вадреноблокатори та/або нітрати. Кисень (24 л/хв через маску або назальні трубки) потрібно призначати пацієнтам із задишкою або будьякими ознаками серцевої недостатності і шоку. Неінвазивне моніторування насичення крові киснем істотно допомагає у прийнятті рішень щодо призначення кисню або, в тяжких випадках, допоміжної вентиляції легень. Звичайною реакцією на біль і обставини, за яких виникає серцевий напад, є збудження. Дуже важливо заспокоїти пацієнта, для чого може бути корисним призначення препарату з групи транквілізаторів, але частіше достатньо обмежитися опіоїдами. Також важливим питанням є з’ясування анамнезу щодо прийому знеболювальних препаратів з групи нестероїдних протизапальних засобів, включаючи інгібітори циклооксигена зи (ЦОГ), у першу чергу ЦОГ2 селективних). Якщо пацієнт приймав ці препарати систематично, їх треба відмінити; також їх не можна використати для зменшення болів (у тому числі м’язовоскелетних) у хворих на ГІМ з огляду на доведене значне підвищення коронарного ризику на тлі призначення цих засобів.
Резюме: зменшення болю, задишки і збудження
- Внутрішньовенні опіоїди (від 5 до 10 мг морфіну) з додатковими дозами по 2 мг з інтервалами по 5 хв (контроль дихання).
- Кисень (24 л/хв) при задишці або серцевій недостатності.
- Розглянути необхідність внутрішньовенного введення pадреноблокаторів або нітратів, якщо після застосування опіоїдів біль не проходить.
- Корисним може бути введення транквілізаторів.
- Не використовувати для зменшення болю інгібітори циклооксигенази.
Догоспітальна або рання госпітальна допомога
Відновлення коронарного кровотоку або реперфузія тканини міокарда
У пацієнтів з клінічними ознаками інфаркту міокарда та стійкою елевацією сегмента ST або новою, або ймовірно новою, блокадою лівої ніжки пучка Гіса слід здійснити механічну або фармакологічну реперфузію, якщо немає очевидних протипоказань.
Фібринолітична терапія
Докази користі
У рандомізованих дослідженнях ефективності тромболі тичних препаратів порівняно з плацебо, або одного фі бринолітичного засобу порівняно з іншим взяли участь понад 150 000 пацієнтів. Сприятливий вплив фібринолі тичної терапії в пацієнтів, в яких після початку симптомів інфаркту пройшло до 12 год, переконливо доведений. Метааналіз Fibrinolytic Therapy Trialists (1994) свідчить, що у пацієнтів, які поступають протягом 6 год після початку симптомів, з елевацією сегмента ST або блокадою ніжки пучка Гіса введення тромболітичних засобів дозволяє запобігти приблизно 30 смертельним випадкам на 1000 лікованих пацієнтів, а введення у проміжок часу 712 год після початку симптомів 20 смертельним випадкам на 1000 пацієнтів. Переконливих доказів ефективності здійснення тромболітичної терапії у більш пізні терміни (після 12 год) немає.
Дослідження ISIS2 (1988) довело істотний додатковий ефект аспірину з комбінованим зменшенням кількості летальних випадків приблизно 50 на 1000 лікованих пацієнтів. Сприятливий ефект терапії спостерігався у всіх попередньо визначених підгрупах. Найбільший ефект був у пацієнтів з найвищим ступенем ризику. У пацієнтів віком понад 75 років, лікування яких здійснювалося протягом 24 год, вплив на виживання був незначним і статистично недостовірним ^ТТ, 1994). Втім, коли тромболітична терапія здійснювалася протягом 12 год після початку симптомів, рівні летальності були достовірно знижені на 26,029,4 %.
Час до початку лікування
Користь тромболітичної терапії є найбільшою, коли вона здійснюється в найбільш ранні терміни після початку симптомів. Аналіз досліджень із залученням понад 6000 пацієнтів свідчить, що при здійсненні догоспі тального тромболізису рання летальність зменшувалася на 1520 %. При затримці введення тромболітиків на кожну годину кількість смертельних випадків збільшувалася на 1,6 на 1000 пролікованих пацієнтів. За даними іншого метааналізу, більш виражене зменшення летальності спостерігали у випадку, коли лікування починалося протягом перших двох годин захворювання (44 % проти 20 % при більш пізньому здійсненні тромболізису). За будьяких умов, оптимальні строки проведення тромболізису в межах 30 хв від надходження хворого у стаціонар (у випадку догоспітального тромболізису від першого контакту лікаря швидкої допомоги з пацієнтом), якщо на цей час немає протипоказань до тромболітичної терапії.
Небезпека фібринолізу
Тромболітична терапія асоціюється з незначним, але істотним збільшенням кількості інсультів приблизно на 3,9 на 1000 лікованих пацієнтів, причому це збільшення відбувається переважно за рахунок інсультів, що траплялися протягом першого дня після лікування. Ранні інсульти були здебільшого зумовлені церебральною кровотечею; більш пізні інсульти частіше є тромботичними або емболічними. Частина інсультів, що розвинулися після тромболізису, припадала на пацієнтів, які в подальшому померли, що потрібно враховувати при оцінці ризику смерті (збільшення на 1,9 на 1000). Похилий вік, мала маса тіла, жіноча стать, перенесене раніше церебросудинне захворювання або гіпертензія, систолічна і діастолічна гіпертензія на час госпіталізації вважаються істотними предикторами виникнення внутрішньочерепних кровотеч. Тяжкі нецеребральні кровотечі (які вимагають переливання крові або є життєво небезпечними) можуть виникати у
- 13 % від кількості лікованих пацієнтів. Джерело кровотечі переважно пов’язане з місцем процедури. Незалежні предиктори нецеребральної кровотечі похилий вік, мала маса тіла, жіноча стать, у тому числі у пацієнтів, яким не здійснюють черезшкірні втручання.
Призначення стрептокінази може асоціюватися з гіпотензією, але тяжкі алергійні реакції виникають рідко. Рутинне призначення гідрокортизону не показане. При виникненні гіпотензії слід зменшити швидкість введення препарату, а в разі необхідності тимчасово припинити інфузію, підняти нижні кінцівки або поповнити об’єм внутрішньосудинної рідини.
Порівняння фібринолітичних засобів
У дослідженнях GISSI2 (1990) та ISIS3 (1992) не виявили відмінностей летальності при застосуванні стрептокінази і тканинного активатора плазміногену або аністре плази. Крім того, додаткове підшкірне введення гепарину не зменшувало летальності порівняно з терапією без гепарину. Втім, у дослідженні GUSTO (1993) порівнювали прискорене введення тканинного активатора плазміногену (tPA) протягом 90 хв із звичайною схемою введення протягом 3 год. Прискорене введення tPA і внутрішньовенне введення гепарину, яке контролювали за показником активованого часткового тромбопластиново го часу (АЧТЧ), дозволило зменшити кількість летальних випадків на 10 серед 1000 лікованих пацієнтів. Ризик інсульту дещо більший при застосуванні tPA порівняно із стрептокіназою.
У дослідженні GUSTO при застосуванні прискореного режиму введення tPA і гепарину порівняно із стрептокіназою та підшкірним введенням гепарину спостерігали три додаткові випадки інсульту на 1000 лікованих пацієнтів, причому лише один з трьох пацієнтів вижив із залишковими дефектами. При оцінці аспектів клінічної користі це потрібно брати до уваги. Вивчали кілька варіантів tPA. Одинарний болюс тенектеплази (TNKtPA) з корекцією залежно від маси тіла є еквівалентним до прискореної tPA за показником смертності через 30 днів, асоціюється з істотно меншою частотою виникнення нецеребральних кровотеч і меншою потребою в переливанні крові. Здійснення фібринолітичної терапії болюсом може сприяти швидкому застосуванню її у лікарні або поза нею і зменшити ризик помилок, пов’язаних із введенням препарату. Вибір фібринолітичного засобу буде залежати від індивідуальної оцінки ризику та користі, а також факторів доступності і вартості. У пацієнтів, яким тромболізис здійснюється пізно, ефективнішими можуть бути препарати з більшим ступенем фібри носпецифічності.
Клінічні наслідки
З огляду на накопичені до цього часу докази, з метою зменшення кількості ускладнень і летальності у хворих на гострий інфаркт міокарда потрібно якомога швидше застосовувати фібринолітичні засоби і аспірин, які характеризуються взаємодоповнюючим ефектом. Якщо немає очевидних протипоказань, пацієнти з інфарктом, діагностованим за клінічними симптомами і картиною ЕКГ, повинні з мінімальною затримкою отримати аспірин і фібринолітичну терапію. Реальна мета починати фібриноліз протягом 90 хв від моменту звертання пацієнта за медичною допомогою («від звертання до введення голки») або протягом 30 хв після госпіталізації («від дверей до введення голки»). У пацієнтів з інфарктом міокарда, який формується повільно або хвилеподібно, слід здійснити серійну реєстрацію ЕКГ або моніторуван ня сегмента ST, клінічну оцінку та повторні аналізи сироваткових маркерів для діагностики інфаркту.
Фібринолітична терапія не повинна призначатися пацієнтам, у яких інфаркт діагностований більше ніж 12 год тому, якщо немає ознак збереження ішемії, з крите
ріями ЕКГ для проведення фібринолізу. Пацієнти похилого віку без протипоказань повинні отримувати фібри нолітичну терапію, якщо немає умов для своєчасного виконання механічної реперфузії.
Протипоказання до фібринолітичноїтерапії
Абсолютні та відносні протипоказання до фібринолітичної терапії наведені в табл. 1. Слід наголосити, що цукровий діабет та його ускладнення (зокрема, діабетична ретинопатія) не є протипоказанням для фібринолітичної терапії. Хоча травматична реанімація розглядається як відносне протипоказання для здійснення тромболізису.
Таблиця 1
Протипоказання до фібринолітичної терапії
Режими фібринолітичної терапії
Дозування сучасних фібринолітичних засобів та інформація щодо потреби в супутньому застосуванні антитромбінів наведені в табл. 2.
Примітка. 1 Наведена інформація щодо препаратів, зареєстрованих в Україні. №В. Аспірин повинен призначатися всім пацієнтам без протипоказань до застосування цього препарату
Повторне призначення фібринолітичного засобу
Якщо наявні ознаки реоклюзії або реінфаркту з відновленням елевації сегмента ST або блокадою ніжки пучка Гіса, слід знову призначати фібринолітичну терапію, якщо немає умов для здійснення механічної реперфузії. Повторно не повинна призначатися стрептокіназа, оскільки антитіла до стрептокінази зберігаються протягом принаймні 10 років, в концентраціях, які можуть вплинути на її активність. Альтеплаза 0>РА) та TNKtPA не ведуть до формування антитіл. Повторне призначення фібринолітичних засобів може призвести до надмірного ризику ускладнень у зв’язку з кровотечами.
Додаткова антикоагулянтна і антитромбоцитарна терапія
Незалежні та додаткові сприятливі ефекти аспірину описані вище. Не до кінця відомо, чи діє аспірин шляхом сприяння фібринолізу, запобігання реоклюзії чи обмеження мікросудинних ефектів активації тромбоцитів. У дослідженнях пізньої реоклюзії аспірин був більш ефективним у запобіганні зворотним клінічним подіям, ніж у підтриманні прохідності вінцевої артерії. Спочатку пацієнт повинен розжувати першу дозу 150325 мг (не застосовувати аспірин із захисною оболонкою!), потім щодня застосовувати більш низьку дозу (75160 мг) перорально. Якщо пероральний прийом неможливий, аспірин можна ввести внутрішньовенно (250 мг).
Агрегація тромбоцитів лише частково пригнічується аспірином, і прогрес був досягнутий завдяки розробці інгібіторів глікопротеїнових рецепторів тромбоцитів ІІb/Ша, які блокують кінцевий етап агрегації тромбоцитів. Ангіографічні дослідження довели здатність цих препаратів, разом з половинною дозою фібринолі тиків і зменшеною дозою гепарину, поліпшувати коронарний кровоток подібно до повної дози фібринолітиків, але з більш повною реперфузією тканин. Застосування цих препаратів не зменшувало летальність протягом З0 днів та кількість внутрішньочерепних кровотеч, але супроводжувалося збільшенням кількості неце ребральних кровотеч (переважно спонтанних), особливо у пацієнтів похилого віку. Тому рутинне застосування зменшеної дози фібринолітичного засобу разом з аб сиксимабом або іншими інгібіторами глікопротеїнових рецепторів тромбоцитів IIb/IIIa не можна рекомендувати. Необхідно далі оцінювати можливі сприятливі ефекти такої комбінованої терапії в окремих підгруп пацієнтів, наприклад, у таких з найбільшим ступенем ризику або ймовірним виконанням ранньої перкутанної інтервенції черезшкірних коронарних втручань (ЧКВ).
Ефективність гепарину вивчали у багатьох дослідженнях під час або після фібринолізу, особливо разом з тканинним активатором плазміногену. Гепарин не сприяє поліпшенню негайного лізису згустка. Втім, прохідність вінцевої артерії через 12 год після тромболітичної терапії тканинним активатором плазміногену краща при одночасному застосуванні гепарину. Не спостерігали відмінностей прохідності вінцевої артерії у пацієнтів, яких лікували гепарином і стрептокіназою. Тривале внутрішньовенне призначення гепарину не дозволяло запобігти реоклюзії після досягнення успішного коронарного фібринолізу, доведеного ангіографічним методом. Інфузію гепарину після терапії тканинним активатором плазміногену можна припинити через 2448 год. Під час внутрішньовенної терапії гепарином необхідне ретельне моніторування показника АЧТЧ, величини якого понад 70 с асоціюються з більшою ймовірністю смерті, кровотечі та реінфаркту.
Більш часте моніторування АЧТЧ та корекція дози гепарину залежно від маси тіла дозволяють зменшити ризик нецеребральних ускладнень у зв’язку з кровотечами. Крім того, потрібно перевіряти рівень тромбоцитів крові для вчасної діагностики гепариніндукованої тромбоцитопенії.
Низькомолекулярний гепарин підфракція стандартного гепарину зі зменшеною молекулярною масою. Він має низку теоретичних переваг порівняно із стандартним гепарином. Серед них краще запобігання новому утворенню тромбіну внаслідок більшого ступеня пригнічення фактора Xa, краще передбачувана кінетика, менше зв’язування з протеїнами, менша активація тромбоцитів, нижча частота виникнення тромбоцитопенії, відсутність необхідності контролю АЧТЧ. Низькомолекулярні гепарини вивчені у великих дослідженнях у пацієнтів з гострими коронарними синдромами без елевації сегмента ST. У дослідженні ExTRACT TIMI25 вивчали ефективність еноксапарину порівняно з нефракціоно ваним гепарином у пацієнтів з інфарктом міокарда після фібринолітичної терапії. В цьому дослідженні терапія еноксапарином приводила до зменшення на 17,5 % частоти виникнення З0денної смерті або інфаркту міокарда (9,9 % у групі еноксапарину та 12 % у групі гепарину). Але, незважаючи на модифіковану схему введення препарату (без болюсного введення та зі зменшенням дози підшкірних ін’єкцій у пацієнтів віком понад 75 років), частота виникнення кровотеч у групі еноксапарину була більшою (2,1 %), ніж у групі гепарину (1,4 %). У трьох ангіографічних дослідженнях застосування еноксапарину або дальтепарину асоціювалося з тенденцією до зменшення ризику реоклюзії і/або більш пізнім збереженням прохідності інфарктзалежної судини. У дослідженні ASSENTЗ (2001), першому великому дослідженні з застосуванням низькомолекулярного гепарину на тлі TNKtPA, еноксапарин (З0 мг внутрішньовенно болюсом і 1 мг/кг кожні 12 год) разом з тенектеплазою протягом максимум 7 днів зменшив ризик рецидиву інфаркту міокарда або внутрішньогоспітальної рефрактерної ішемії порівняно з гепарином. Це не супроводжувалося збільшенням частоти внутрішньочерепних крововиливів, зауважили лише незначне збільшення кількості нецеребральних кровотеч порівняно з гепарином. Тенденція до зменшення летальності через З0 днів була на користь еноксапарину, хоча протягом 1 року спостереження не було виявлено різниці щодо летальності між групами нефракціонованого та низькомолекулярного гепаринів. У дослідженні ASSENTЗ PLUS (2002) догоспі тальне призначення еноксапарину супроводжувалося істотним збільшенням ризику внутрішньочерепних кровотеч, порівняно із застосуванням гепарину, в пацієнтів віком 75 років і більше. Для того щоб рекомендувати застосування еноксапарину або інших низькомолекулярних гепаринів у поєднанні з фібринолітичними засобами, необхідні більші за обсягом дослідження, особливо у хворих похилого віку.
У раніше проведених дослідженнях у доповнення до фібринолітиків застосовували прямі інгібітори тромбіну гірудин, бівалірудин і аргатробан. Ці препарати покращували прохідність вінцевих артерій і зменшували частоту кровотеч, порівняно з гепарином. Незважаючи на це, у двох великомасштабних дослідженнях застосування гірудину на фоні фібринолітичної терапії не давало чітких клінічних переваг, порівняно з гепарином. У нещодавно опублікованому дослідженні бівалірудин в комбінації із стрептокіназою не зменшував летальність протягом З0 днів, порівняно з внутрішньовенним гепарином, проте при внутрішньовенному введенні бівалі рудину протягом 48 год було менше випадків рецидиву інфаркту міокарда.
Слід відзначити, що в останні роки з’явилася нова група препаратів, з якою пов’язані сподівання щодо оптимізації антикоагулянтної терапії у хворих на ГІМ. Це селективні інгібітори Ха фактора. За хімічною структурою вони є пентасахаридною послідовністю, яка входить до Хаактивної ділянки молекули гепарину. У ран домізованому дослідженні MICHELANGELOOASIS 5 брало участь понад 20 000 пацієнтів з гострим коронарним синдромом без елевації сегмента ST. У цьому дослідженні пентасахарид фондапаринукс натрію в дозі 2,5 мг один раз на добу був такий же ефективний, як і еноксапарин, у запобіганні смерті, нефатального інфаркту міокарда та рефрактерної ішемії протягом 9 діб після включення в дослідження. Призначення пентасахариду привело до зниження З0денної летальності на 17 %, зниження 6місячної летальності на 11 %, зниження частоти великих геморагічних ускладнень 47 %. Більше того, при використанні пентасахариду значно меншою була частота виникнення гепариніндукованої тромбоцитопенії. В іншому великому дослідженні MICHELANGELO OASIS 6 брало участь понад 12 000 хворих на ГІМ з елевацією сегмента ST. Пентасахарид, що призначався з першої доби в дозі 2,5 мг один раз на добу тривалістю до 8 днів, дозволив знизити частоту розвитку смерті та реінфаркту до 30 діб на 18 % у хворих, які не проходили ургентну ангіопластику, а частота геморагічних ускладнень при його застосуванні була навіть дещо нижчою, ніж у хворих, які отримували нефракціонований гепарин.
Рекомендовані дози гепарину наведені в табл. 3.
Таблиця 3
А. Супутня терапія антикоагулянтами
Б. Супутня терапія антикоагулянтами, якщо хворий потребує проведення коронарних втручань
В. Терапія антикоагулянтами у пацієнтів, що не отримували реперфузійної терапії
Черезшкірні коронарні втручання
Серед черезшкірних коронарних втручань, які здійснюються в перші години інфаркту міокарда, розрізняють первинне ЧКВ, ЧКВ у поєднанні з фармакологічною ре перфузійною терапією і «ЧКВ порятунку» після невдалої спроби фармакологічної реперфузії.
Первинне ЧКВ
Під цим терміном розуміють ангіопластику і/або стенту вання без попередньої або супутньої фібринолітичної терапії. Первинному ЧКВ надають перевагу, якщо його можна виконати протягом 90 хв після першого контакту з медичним персоналом. Здійснення первинного ЧКВ можливе за наявності досвідченої бригади, в яку включені не лише інтервенційні кардіологи, а й допоміжний персонал з відповідними навичками. Лише у тих лікарнях, де здійснюється програма з інтервенційної кардіології, первинне ЧКВ повинне бути рутинним шляхом вибору в пацієнтів із симптомами і ознаками ГІМ (причому частота «вчасно» виконаних втручань не повинна бути меншою за 75 % від загального обсягу випадків лікування). Нижчі рівні смертності в пацієнтів, яким здійснюють первинне ЧКВ, спостерігають у центрах, де виконують значний обсяг процедур ЧКВ. У випадках, коли пацієнтів госпіталізують у лікарню, де немає умов для виконання катетеризації, слід здійснити ретельну індивідуалізовану оцінку потенційних переваг механічної реперфузії над фармакологічною, враховуючи можливі ризики обох стратегій, а також потенційні витрати часу на транспортування в найближчу лабораторію катетеризації серця. При цьому слід мати на увазі, що оптимальний час від першого медичного контакту із хворим до проведення ЧКВ у спеціалізованому відділенні (враховуючи загальний час, витрачений на перевезення хворого в «неінтервенційний» госпіталь, на клінічну оцінку стану хворого в цій лікарні, та час, потрібний для перевезення хворого в спеціалізований госпіталь) не повинен перевищувати 90 хв. У датському дослідженні DANAMI2 (2000) стратегію рутинного перевезення хворих у спеціалізований госпіталь для виконання первинної ЧКВ порівнювали із стратегією внутрішньогоспітального тромболізису. Перевезення хворих із територіальних госпіталів у центри інвазивної кардіології дозволяли здійснювати протягом не більше 3 год. У середньому термін транспортування каретою невідкладної допомоги становив менше 32 хв, а час між прибуттям у територіальний госпіталь і початком ЧКВ менше 2 год. Через 30 днів спостерігали достовірне зменшення загальної кількості випадків смерті, реінфаркту та інсульту в пацієнтів, яких перевозили для здійснення первинної ЧКВ (14,2 % проти 8,5 %), тоді як зменшення смертності було недостовірним (8,6 % проти 6,5 %).
Результати цього дослідження були підтверджені дослідженнями PRAGUE та PRAGUE2, а також іншими великими дослідженнями. Суттєвим доповненням до стратегії первинної ЧКВ були отримані в цих дослідженнях дані щодо однакової ефективності первинної ЧКВ та тромболітичної терапії, якщо лікування починалося J 3 год від розвитку симптомів ГІМ. Первинна ЧКВ дає змогу ефективно забезпечувати та підтримувати прохідність вінцевої артерії, уникаючи ризику кровотечі, притаманного фібринолітичній терапії. Рандомізовані клінічні дослідження з порівнянням своєчасно виконаної первинної Ч№ і фібринолітичної терапії у досвідчених центрах з великим обсягом процедур свідчать про більш ефективне відновлення прохідності, менш часте виникнення реоклюзії, покращання залишкової функції лівого шлуночка і кращі клінічні виходи після виконання первинної Ч№. Рутинна імплантація коронарного стента у пацієнта з ГІМ зменшує потребу в реваскуляризації цільової судини, але асоціюється лише з тенденцією до зменшення частоти смерті або реінфаркту, порівняно з первинною ангіопластикою. У пацієнтів з протипоказаннями до фібринолітичної терапії рівень захворюваності і смертності вищий, ніж у таких без протипоказань. Первинна Ч^ може успішно виконуватися у переважної більшості цих пацієнтів. Первинне Ч№ є переважним шляхом лікування пацієнтів у стані шоку.
ЧКВ у поєднанні з фібринолізом
Виконання Ч№ негайно після фібринолітичної терапії з метою сприяння реперфузії або зменшення ризику реоклюзії не виправдало сподівань. У низці раніше виконаних досліджень спостерігалася тенденція до збільшення ризику ускладнень і смерті. Втім, ефективність та безпечність Ч^ після введення тромболітиків підвищилися внаслідок накопичення досвіду виконання процедур, а також появи стентів і більш потужних антитромбоци тарних засобів (антагоністів глікопротеїнових рецепторів тромбоцитів IIb/IIIa та тієнопіридинів).
«ЧКВ порятунку»
«ЧКВ порятунку» визначають як виконання ЧКВ на вінцевій артерії, яка після фібринолітичної терапії залишається закритою. Обмежений досвід дозволяє припустити тенденцію до сприятливих наслідків реканалізації інфарктзалежної судини методом ангіопластики. Хоча ймовірність успіху ангіопластики висока, невирішеною проблемою залишається брак надійних неінвазивних методів оцінки прохідності інфарктзалежної вінцевої артерії. Обмежені дані вказують на можливість безпечного перевезення хворого у територіальний госпіталь для виконання «Ч^ порятунку». Коронарне втручання в пацієнтів, які отримали повну дозу фібринолітичного засобу в поєднанні з антагоністом рецепторів глікопро теїну IIb/IIIa, може супроводжуватися надмірним ризиком ускладнень, зумовлених кровотечами. Одним з головних питань стосовно рутинного використання алгоритму первинного (чи догоспітального) тромболізису з наступною «ЧКВ порятунку» є складність неінвазивного визначення ступеня ефективності тромболітичної терапії в найближчі терміни від її початку. Оскільки проведення коронароангіографії для визначення необхідності «ЧКВ порятунку» є складною процедурою та потребує доставки хворого в катетеризаційну лабораторію, доцільним є виділення групи хворих з ГІМ після фібрино літичної терапії, яким ця процедура показана в першу чергу. На думку провідних експертів, термін для оцінки ефективності фібринолітичної терапії повинен становити 180 хв, оцінка має проводитися за єдиним показником зниження елевації сегмента ST у відведенні з найбільш вираженою елевацією ST > 50 % при передній локалізації інфаркту та > 70 % у випадку задньої локалізації інфаркту.
Хірургічне втручання: шунтування вінцевих артерій
Кількість пацієнтів, які потребують шунтування вінцевих артерій у гостру фазу інфаркту міокарда, обмежена. Втім, це втручання може бути показане після невдалого ЧКВ, коли подальше виконання ЧКВ невиправдане. Крім того, шунтування вінцевих артерій здійснюють в окремих пацієнтів з кардіогенним шоком або в поєднанні з хірургічним лікуванням дефекту міжшлуночкової перегородки або мітральної регургітації, зумовленої дисфункцією або розривом папілярного м’яза. На теперішній час немає даних, які б вказували на ефективність рутинного хірургічного шунтування вінцевих артерій у терміни менше двох тижнів від початку інфаркту міокарда.
Реперфузійна терапія: резюме
Насосна недостатність і шок
У табл. 4 узагальнені порушення гемодинаміки, які можуть виникати при інфаркті міокарда. Крім того, серцева недостатність може бути наслідком аритмічних або механічних ускладнень (дивись відповідні підрозділи).
Таблиця 4 Клінічний спектр станів гемодинаміки при інфаркті міокарда та їх лікування
Серцева недостатність
Лівошлуночкова недостатність під час гострої фази інфаркту міокарда асоційована з несприятливим коротко та довготривалим прогнозом виживання. Її клінічні риси задишка, синусова тахікардія, третій тон серця і легеневі вологі хрипи, спочатку в базальних ділянках, пізніше по всіх полях легень. Утім, виражений застій у легенях може не супроводжуватися аускультатив ними ознаками. Повторна аускультація серця і легень повинна здійснюватися у всіх пацієнтів у ранній період інфаркту міокарда, разом з оцінкою інших життєво важливих ознак.
До загальних заходів відносять моніторування на предмет порушень ритму, оцінку електролітних порушень, своєчасну діагностику супутніх станів, таких як дисфункція клапанів або захворювання легень. Застій у легенях можна оцінити з допомогою рентгенографії. Ехокардіографія корисна для оцінки вираженості пошкодження міокарда, механічної функції шлуночків та виявлення ускладнень, зокрема, мітральної регургіта ції та дефекту міжшлуночкової перегородки, які можуть спричиняти порушення насосної функції серця. У пацієнтів з тяжкою серцевою недостатністю або шоком пер кутанна або хірургічна реваскуляризація можуть покращити виживання.
Ступінь серцевої недостатності класифікують за Km ліпом: клас 1 немає вологих хрипів або третього тону серця; клас 2 хрипи над менш ніж 50 % поверхні легень або третій тон серця; клас 3 хрипи більш ніж над 50 % поверхні легень; клас 4 кардіогенний шок.
Незначна і помірна серцева недостатність
Слід від самого початку призначити кисень, але бути обережним за наявності хронічного захворювання легень. Рекомендують моніторування насичення крові киснем. Незначна серцева недостатність легко коригується діуретиками, наприклад фуросемідом 2040 мг або торасемідом у дозі 510 мг повільно внутрішньовенно, за необхідності з повторним введенням через 14 годинні інтервали. Якщо немає задовільного ефекту, показані внутрішньовенний нітрогліцерин або перо ральні нітрати. Дозу слід титрувати під контролем
артеріального тиску для того, щоб уникнути гіпотензії. Інгібітори ангіотензинперетворюючого ферменту повинні бути призначені протягом 24 годин за відсутності гіпотензії, гіповолемії або тяжкої ниркової недостатності. Останнім часом все більша роль у терапії лівошлуноч кової недостатності при ГІМ відводиться антагоністам альдостерону. Найбільш відомий та поширений препарат цієї групи спіронолактон. У рандомізованому дослідженні із участю 1663 хворих із хронічною серцевою недостатністю III класу за NYHA (фракція викиду J 35 %) спіронолактон при хронічному застосуванні в дозі 25 мг на добу показав зниження смертності з будьякої причини за 2 роки на 24 % порівняно з плацебо. До недоліків спіронолактону слід віднести досить велику кількість побічних ефектів, серед яких найголовніший гіне комастія. Інший препарат із цієї групи еплеренон позбавлений цих недоліків. У дослідженні EPHESUS у хворих на ГІМ з ознаками ГЛШН призначалася тривала терапія цим препаратом порівняно з плацебо. Частота смерті з будьякої причини в групі лікування еплереноном зменшувалася вже під час 30 діб спостереження. Застосування вадреноблокаторів повинно починатися з титруючих доз пероральних препаратів під контролем параметрів гемодинаміки.
Виражена серцева недостатність і шок
Дослідження газового складу артеріальної крові (за Аструпом) дозволяє оцінити ступінь оксигенації (рО2), дихальну функцію (рСО2), кислотнолужний стан (рН), його порушення. Його виконання доцільне у всіх пацієнтів з тяжкою серцевою недостатністю. Неінвазивний метод дослідження пульсоксиметрія може бути використаний замість дослідження крові за Аструпом за відсутності вираженого синдрому малого викиду або вазокон стрикторного шоку. В разі розвитку цих станів відхилення результатів неінвазивного дослідження починає перевищувати 2 % від результатів інвазивного дослідження.
Для лікування цього стану слід призначити кисень і петлевий діуретик так, як зазначено вище. Якщо немає гіпотензії, потрібно почати введення нітрогліцерину з дози 0,25 мкг·кг-1·хв-1, із збільшенням дози кожних 5 хв до зниження артеріального тиску на 15 мм рт. ст. Доцільно вимірювання тиску в легеневій артерії і тиску заклинювання в легеневих капілярах, а також серцевого викиду з допомогою балонного флотаційного катетера. Тиск заклинювання повинен бути менше 18 мм рт. ст., серцевий індекс перевищувати 2 лхв1м»2.
За наявності гіпотензії корисним може бути введення інотропних засобів. Якщо наявні ознаки гіпопер фузії нирок, рекомендують допамін внутрішньовенно в дозі 2,55,0 мкгкг^хв»1. Якщо домінує застій у легенях, перевагу надають добутаміну, починаючи з дози 2,5 мкгкг «’хв»1. Дозу можна поступово збільшувати з 10 хвилинними інтервалами до 10 мкгкг^хв»1 або до поліпшення стану гемодинаміки. Треба брати до уваги, що незважаючи на покращення показників гемодина міки, ця терапія асоціюється зі збільшенням випадків кардіальної смерті внаслідок більш швидкого вичерпання контрактильного та кисневого ресурсу серцевого м’яза, підвищення внутрішньоклітинної концентрації вільного кальцію, розвитку толерантності до вазо пресорів та до проаритмогенного ефекту. Новий іно тропний препарат левосимендан позбавлений цих недоліків. Активна речовина стійко з’єднується з тропо ніном С та стабілізує його стан, підвищуючи віддачу ак томіозинових містків на стимуляцію кальцієм. При внутрішньовенному використанні левосимендану в дозі 824 мкг/кг внутрішньоклітинна концентрація вільного кальцію залишається постійною, скоротлива здатність серцевого м’яза підвищується, але збільшення використання макроергів не відбувається. Також виявлена здатність цього препарату здійснювати вазоди латацію як артеріального, так і венозного русла. Період наявності активних метаболітів препарату в плазмі крові становить 80 год, тому ефект однієї дози зберігається досить тривалий час. Введення левосимендану (824 мкг/кг навантажувальна доза протягом 10 хв з наступною інфузією 0,1 0,2 мкгкг^хв»1 протягом доби) призводить до покращення гемодинаміки та зменшення 30денної летальності (6,8 проти 17 % при використанні добутаміну). При застосуванні левосимендану в дослідженні RUSSLAN порівняно з плацебо відзначали зниження на 54 % летальності протягом першої доби інфаркту та на 42 % 14денної летальності.
Під час лікування слід перевіряти рівень газів у крові. Якщо, незважаючи на введення 100 % кисню через маску із швидкістю 810 л/хв і адекватне застосування бронходилататорів, невдається підтримувати парціальне напруження кисню понад 60 мм рт. ст., показана ендотрахеальна інтуба ція зі штучною вентиляцією легень. Причиною гострої серцевої недостатності може бути оглушений (реперфу зія із затримкою відновлення скоротливості) або гібер нований (внаслідок тривалого зниження перфузії із збереженням життєздатності) міокард. Виявлення життєздатного міокарда і його реваскуляризація може сприяти поліпшенню функції шлуночків.
Кардіогенний шок
Кардіогенний шок клінічний стан гіпоперфузії, який характеризується зниженням систолічного артеріального тиску < 90 мм рт. ст. та підвищенням центрального тиску наповнення > 20 мм рт. ст., або зменшенням серцевого індексу <1,8 лхв1м2. Інші характеристики шоку необхідність введення внутрішньовенних інотропних засобів і/або внутрішньоаортальної балонної контрпуль сації для підтримання систолічного артеріального тиску на рівні > 90 мм рт. ст. і серцевого індексу > 1,8 лхв1м2. Рання тромболітична терапія або первинне ЧКВ зменшує ймовірність виникнення кардіогенного шоку. Для встановлення діагнозу кардіогенного шоку потрібно виключити інші причини гіпотензії, такі як гіповолемію, ва зовагальні реакції, електролітні розлади, побічні ефекти ліків або аритмії. Як правило, кардіогенний шок асоціюється з широким пошкодженням лівого шлуночка, але може також виникати при інфаркті міокарда правого шлуночка. Функцію лівого шлуночка та наявність асоційованих механічних ускладнень слід оцінювати методом двомірної допплерехокардіографії. Для оцінки стану гемодинаміки можливе застосування балонного флотуючого катетера. Слід прагнути досягнення тиску наповнення (заклинювання в легеневих капілярах) принаймні 18 мм рт. ст. із серцевим індексом > 2 лхв1м2. З метою покращання функції нирок можна застосувати низькі дози допаміну (2,55 мкгкг^хв»1), а також за необхідності додаткове призначення добутаміну (510 мкгкг^хв»1).
Припускають, що кардіогенний шок супроводжується ацидозом. З огляду на те, що катехоламіни малоефективні у кислому середовищі, корекція ацидозу має важливе значення. Як «місток» до проведення механічних втручань, рекомендують підтримуюче лікування з допомогою балонної аортальної контрпульсації.
На ранніх стадіях захворювання слід розглянути можливість здійснення невідкладного ЧКВ або хірургічного втручання. Якщо це неможливо, або ці втручання можуть бути виконані лише після тривалої затримки, слід застосувати фібринолітичну терапію.
Резюме: насосна недостатність і шок
Механічні ускладнення: розрив серця і мітральна регургітація
Розрив вільної стінки
Гострий розрив вільної стінки
Клінічна картина характеризується серцево судинним колапсом з електромеханічною дисоціацією, тобто збереженням електричної активності із втратою серцевого викиду та відсутністю пульсу. Як правило, цей стан закінчується фатальним виходом протягом кількох хвилин, і стандартні заходи із серцеволегеневої реанімації неефективні.
Підгострий розрив вільної стінки
Приблизно в 25 % випадків невелика кількість крові потрапляє у порожнину перикарда, що спричиняє наростаючі порушення гемодинаміки. Мінічна картина може нагадувати рецидив інфаркту з огляду на відновлення болю та реелевацію сегмента ST, але частіше спостерігається раптове погіршення стану гемодинаміки з минущою або стійкою гіпотензією. З’являються класичні ознаки тампонади серця, які можна підтвердити ехо кардіографічним методом. Хоча під час ехокардіографії зазвичай не встановлюють локалізацію розриву, можна довести наявність рідини у перикарді з ознаками тампонади або без них. Для діагностики підгострого розриву вільної стінки недостатньо виявити лише рідину в перикарді, оскільки ця ознака трапляється досить часто після ГІМ. Типовою знахідкою є ехощільна маса в пе рикардіальному просторі, яка нагадує згусток (гемоперикард). Слід розглянути необхідність негайного хірургічного втручання, залежно від клінічного стану. Пери кардіоцентез може сприяти корекції тампонади у пацієнтів у стані шоку в період очікування перед хірургічним втручанням.
Розрив міжшлуночкової перегородки
Дефект міжшлуночкової перегородки може з’явитися в ранні терміни після інфаркту міокарда, частота цього ускладнення становить приблизно 12 % від усіх випадків інфаркту. Якщо не виконати хірургічну корекцію, смертність становить 54 % протягом першого тижня і 92 % протягом першого року. Діагноз можна запідозрити через значне погіршення клінічних проявів. Його підтверджують за появою гучного систолічного шуму, методом ехокардіографії і/або шляхом виявлення підвищення вмісту кисню в правому шлуночку. Втім, шум може бути м’яким або взагалі відсутнім. Ехокардіографічне дослідження дозволяє встановити локалізацію і розмір дефекту міжшлуночкової перегородки. Шунтування крові зліва направо доводять кольоровим допплерівським методом і кількісно оцінюють методом пульсової доп плерехокардіографії. Оцінка пікової швидкості потоку через місце розриву методом постійної допплерехокар діографії використовується для вимірювання систолічного тиску в правому шлуночку (легеневій артерії).
Медикаментозне лікування вазодилататорами, наприклад внутрішньовенним нітрогліцерином, може забезпечити деяке покращання стану, коли немає кардіогенного шоку. Але найбільш ефективним методом підтримки кровообігу в період підготовки до хірургічної корекції є внутрішньоаортальна балонна контрпульса ція. Ургентне втручання дає єдиний шанс для виживання при великому постінфарктному дефекті міжшлуночкової перегородки з кардіогенним шоком. Навіть коли немає гемодинамічної нестабільності, як правило, показане раннє хірургічне втручання, також з огляду на те, що розмір дефекту може збільшитися.
При вирішенні питання про проведення хірургічного втручання слід виконувати доопераційну коронарну ангіографію і, за необхідності, проводити шунтування. Предикторами поганих результатів після хірургічних втручань є кардіогенний шок, задня локалізація, дисфункція правого шлуночка, вік, значна затримка часу між моментом розриву перегородки і здійсненням втручання. Госпітальна смертність після хірургічних втручань становить у межах 2560 %, а серед тих пацієнтів, які виживають, функціональний стан у 95 % відповідає класам ІІІ за NYHA.
Мітральна регургітація
Мітральна регургітація є поширеним ускладненням ГІМ. Існують три механізми гострої мітральної регургі тації: (1) розширення кільця мітрального клапана внаслідок дилатації та дисфункції лівого шлуночка, (2) дисфункція папілярного м’яза, зазвичай унаслідок інфаркту міокарда нижньої локалізації, і (3) розрив папілярного м’яза. Розрив папілярного м’яза, як правило, проявляється раптовим погіршенням стану гемодинаміки. Через раптове та тяжке підвищення тиску в лівому передсерді шум часто є м’яким. Ступінь мітральної регургітації найкраще оцінити методом кольорової допплерехокардіо графії. Найчастішою причиною часткового або тотального розриву папілярного м’яза є малий інфаркт задньо медіального папілярного м’яза в басейні правої або огинаючої артерії. У деяких пацієнтів для встановлення кінцевого діагнозу необхідною може бути черезстравохід на ехокардіографія.
Кардіогенний шок і набряк легень з тяжкою мітраль ною регургітацією вимагають невідкладного хірургічного лікування. Під час підготовки корисна внутрішньоа ортальна балонна контрпульсація, потрібно виконати коронарну ангіографію.
Методом вибору при розриві папілярного м’яза є протезування клапана. Якщо немає розриву папілярного м’яза, доцільно здійснити спробу механічної репер фузії інфарктзалежної артерії.
Внутрішньопорожнинне тромбоутворення
Внутрішньопорожнинне тромбоутворення зазвичай супроводжує широкі інфаркти передньої стінки лівого шлуночка серця. Поява цього феномена, в першу чергу, має захисний характер. При великому ураженні міокарда відбувається стоншення стінки лівого шлуночка, порушення її скоротливості, може навіть спостерігатися парадоксальний рух, що створює локальну турбулентність кровотоку в порожнині шлуночка. В зоні інфаркту часто спостерігається запальна реакція ендокарда. Всі ці явища сприяють пристінковому тромбоутворенню, яке за несприятливих обставин може перейти у внутрішньопорожнинне. Внутрішньопорожнинний тромб вже не має профілактичного значення, може суттєво порушувати кардіогемодинаміку та несе загрозу тромбо емболічних ускладнень.
При утворенні внутрішньопорожнинного тромбу необхідне проведення активної антикоагулянтної терапії із застосуванням гепаринів з наступним призначенням непрямих антикоагулянтів протягом 6 міс.
Хірургічне лікування внутрішньопорожнинного тромбозу здійснюється в комплексі хірургічних заходів, що включає: аневризмектомію, тромбектомію та аорто коронарне шунтування.
Аритмії і порушення провідності
Аритмії і порушення провідності надзвичайно поширені в перші години після інфаркту міокарда. В деяких випадках, зокрема, при шлуночковій тахікардії, фібриляції шлуночків і повній атріовентрикулярній блокаді, виникає загроза для життя і вимагається негайна корекція. Часто аритмії є проявом серйозного основного захворювання, наприклад, збереження ішемії, насосної недостатності, зміненого вегетативного тонусу, гіпоксії, розладів електролітного (гіпокаліємія) або кислотно лужного балансу, станів, які вимагають уваги та коригуючих заходів. Необхідність лікування і ступінь його невідкладності в основному залежать від гемодинамічних наслідків порушення ритму.
Шлуночкові аритмії
Шлуночкові ектопічні ритми
Шлуночкові ектопічні ритми майже завжди зустрічаються в перший день захворювання; поширеними є складні аритмії: поліморфні комплекси, короткі епізоди тахікардії, феномен RнаT. За Лауном (Lown) шлуночкові екс трасистоли розділяють на 5 типів: I мономорфна із частотою до 5 за 1 хв, II мономорфна із частотою більше 5 за 1 хв, III поліморфна, IV парна (а), або групи з 35 (Ь) та V рання з феноменом RнаT. Незважаючи на зручність такої градації, значення цих аритмій як предикто рів фібриляції шлуночків у хворих на ГІМ сумнівне. Специфічна антиаритмічна терапія не потрібна.
Шлуночкова тахікардія
Короткі епізоди нестійкої (до 6 комплексів) шлуночкової тахікардії можуть добре переноситися і не обов’язково вимагають антиаритмічного лікування. Більш тривалі епізоди можуть викликати гіпотензію і серцеву недостатність, з можливим переходом у фібриляцію шлуночків. Також виділяють ранню шлуночкову тахікардію (що виникає у перші 48 год інфаркту міокарда) та пізню, яка має поганий прогноз і асоційована з персистуючою ішемією та дисфункцією лівого шлуночка. За морфологією розрізняють мономорфну та поліморфну шлуночкові тахікардії. Важливо відрізняти істинну шлуночкову тахікардію від прискореного ідіовентрикулярного ритму, який, як правило, є нешкідливим наслідком реперфузії, коли частота ритму шлуночків менше 120 скорочень за 1 хв і не потребує лікування.
Препаратами першої лінії для лікування та запобігання шлуночковій тахікардії, коли немає протипоказань, є вадреноблокатори. За високого ступеня ризику (зворотної) фібриляції шлуночків зазвичай препаратом першого вибору є лідокаїн. Спочатку застосовують навантажувальну дозу 1 мг/кг внутрішньовенно, потім половину цієї дози кожних 810 хв до максимальної дози 4 мг/кг, або здійснюють тривалу інфузію в дозі 1 мг/хв. Втім, у пацієнтів із зворотною стійкою шлуночко вою тахікардією, яка вимагає кардіоверсії, або у випадку фібриляції шлуночків перевагу може мати внутрішньовенний аміодарон (5 мг/кг протягом першої години, потім 9001200 мг протягом 24 год). При збереженні ге модинамічно значущої шлуночкової тахікардії показана електрична кардіоверсія. За відсутності можливості негайно скористатися дефібрилятором, слід спробувати застосувати прекордіальний удар.
Фібриляція шлуночків
Слід негайно виконати дефібриляцію згідно з міжнародними рекомендаціями із серцеволегеневої реанімації 2005 р. При рецидивуючих формах доцільне внутрішньовенне болюсне введення аміодарону в дозі 5 мг/кг; якщо рецидиви продовжують виникати, можливі повторні введення препарату. Також важливою є корекція тканинного та дихального ацидозу (шляхом введення стандартного розчину натрію гідрокарбонату та вентиляції легень), рівня електролітів крові (введення стандартного розчину калію хлориду, магнезії сульфату).
Суправентрикулярні аритмії
Фібриляція передсердь є ускладненням інфаркту міокарда в 1520 % випадків і часто асоційована з тяжким пошкодженням лівого шлуночка і серцевою недостатністю. Також серед її причин можуть бути: інфаркт передсердь (частіше при тромбозі в правій вінцевій артерії), перикардит, запалення легень, тромбози у системі легеневої артерії. Безпосередніми причинами початку та збереження аритмії є розтягнення передсердя, надмірна симпатична активність та електролітний дисбаланс. Вона часто проходить спонтанно, а її епізоди можуть тривати від хвилин до годин і часто є повторними. У багатьох випадках частота шлуночкового ритму не збільшується, аритмія добре переноситься, і лікування не вимагається. В інших ситуаціях тахікардія сприяє виникненню серцевої недостатності і тому потребує негайного лікування. З метою сповільнення частоти ритму у багатьох пацієнтів ефективні вадреноблокатори, але аміодарон може бути більш ефективним для припинення аритмії. Використання новокаїнаміду чи про пафенону менш прийнятне з огляду на значний кар діодепресивний ефект першого та проаритмогенний ефект другого. Можливе також виконання кардіоверсії. Втім, з огляду на велику частоту рецидивів, її застосовують лише за необхідності (зокрема, при наявності значної гемодинамічної декомпенсації). Використання ди гоксину може збільшити ризик виникнення фібриляції шлуночків і повинно бути заборонено.
Інші суправентрикулярні тахікардії зустрічаються рідко і звичайно проходять самостійно. Вони можуть також припинятися при масажі каротидного синуса (дуже обережно у хворих похилого віку!). Ефективними нерідко є вадреноблокатори; не рекомендують застосовувати верапаміл. Якщо виключена наявність тріпотіння передсердь і стан гемодинаміки стабільний, одним із можливих засобів лікування є аденозин; під час введення препарату потрібно моніторувати ЕКГ. При поганій переносності аритмії слід здійснити кардіоверсію.
Синусова брадикардія та блокади серця
Синусова брадикардія може спостерігатися протягом перших годин захворювання, особливо при інфаркті міокарда нижньої локалізації та застосуванні великих доз опіоїдів. Вона може супроводжуватися досить вираженою гіпотензією. В цьому випадку слід застосувати атропін внутрішньовенно, починаючи з дози 0,30,5 мг, з повторними введеннями до загальної дози 1,52,0 мг. Якщо в цьому випадку немає реакції на введення атропіну, може бути рекомендована тимчасова кардіостиму ляція. Слід наголосити, що стимулятори серцевої діяльності (ізопротеренол, амінофілін) не рекомендовані до застосування в цій ситуації.
Атріовентрикулярна (АВ) блокада першого ступеня не вимагає лікування. АВ блокада другого ступеня типу I (Мобітц I або Венкебаха) звичайно спостерігається у хворих з інфарктом нижньої локалізації і рідко викликає негативні гемодинамічні ефекти. При виникненні порушень гемодинаміки слід спочатку ввести атропін, а при його неефективності призначити кардіостимуляцію.
АВ блокада другого ступеня типу II (Мобітц II) і повна АВ блокада є показаннями для введення стимуляційного електрода, якщо брадикардія викликає гіпотензію або серцеву недостатність. У випадку тяжких розладів гемодинаміки слід розглянути можливість послідовної АВ стимуляції.
Розвиток нової блокади ніжки пучка Гіса або гемі блокади зазвичай вказує на широкий інфаркт передньої локалізації. У цьому випадку високою є ймовірність виникнення повної АВ блокади, а також насосної недостатності. Як запобіжний захід, може бути показаним введення тимчасового електрода. Після АВ блокади, бі або трипучкової блокади, а також електричної кардіоверсії може виникати асистолія. Якщо був введений електрод, у цій ситуації слід спробувати здійснити кардіостимуляцію. Інший шлях масаж серця і штучна вентиляція легень, а також трансторакальна кардіостимуляція.
За наявності АВ блокади високого ступеня, а також у багатьох випадках бі чи трипучкової блокади слід встановити трансвенозний електрод для кардіостимуляції. Деякі кардіологи надають перевагу підключичному підходу, але його слід уникати після введення фібриноліти ків або під час інтенсивної антикоагулянтної терапії. У цій ситуації слід обирати альтернативні доступи до вени.
Стандартні засоби профілактичної терапії в гострій фазі захворювання
Аспірин та тієнопіридини
Переконливі докази ефективності аспірину отримано в дослідженні ISIS2 (1988). У цьому дослідженні доведено адитивний сприятливий вплив аспірину і стрептокінази. Існує небагато протипоказань до застосування аспірину: відома гіперчутливість, подагра, пептична виразка, яка кровоточить, хвороби крові, тяжке захворювання печінки. Інколи аспірин є запускаючим фактором бронхоспазму в пацієнтів з бронхіальною астмою. На відміну від фібринолітичної терапії, немає чітких доказів зв’язку між ефективністю аспірину і періодом часу від початку симптомів. Незважаючи на це, аспірин потрібно призначати всім пацієнтам з гострим інфарктом міокарда або підозрою на інфаркт якомога раніше. Цей препарат повинні отримувати 8595 % пацієнтів з інфарктом міокарда. Слід пам’ятати про необхідність контролю кількості тромбоцитів та нейтрофілів. При наявності протипоказань до застосування аспірину слід розглянути можливість призначення тієнопіридинів, які мають інший механізм дії та позбавлені властивих аспірину побічних ефектів. Найсуттєвіша вада перших тієнопіридинів (ти клопідин) при застосуванні їх у хворих на гострий інфаркт міокарда це надто довге досягнення піку їх фармакологічної ефективності, тоді як аспірин починає ді яти з перших хвилин після прийому під язик або у внутрішньовенному болюсі. Поява тієнопіридину нового покоління клопідогрелю із розробкою навантажувальних режимів його дозування (300 мг одноразово) наблизили швидкість їх клінічного ефекту до такої в аспірину. Комбіноване застосування аспірину та тієнопіриди нів протягом принаймні 14 діб зменшує частоту смерті, реінфаркту та інсульту на 9 % порівняно з монотерапією аспірином незалежно від того, чи проводилася репер фузійна терапія. Ці результати отримані в дослідженні COMMIT CCS2 із залученням майже 46 тисяч пацієнтів. Доцільність застосування тієнопиридинів як додаткового до аспірину препарату ще більше зумовлена тим, що коли призначення аспірину не викликає селективного блокування метаболізму арахідонової кислоти із опти мізацією співвідношення продукції простагландинів та тромбоксану А2 блокада АДФзалежних рецепторів адгезії тромбоцитів тієнопіридинами є дуже важливою для зниження схильності до тромбоутворення. Прямим показанням для призначення тієнопіридинів є попередній систематичний прийом аспірину, який не запобіг розвитку інфаркту міокарда, інтервенційні втручання в гострій фазі захворювання (однак треба зазначити, що в дослідженні CLARITY TIMI 28 на тлі більш стійкого порівняно з терапією аспірином збереження коронарного кровотоку після ЧКВ не відзначено суттєвого впливу на летальність чи коронарні події протягом 30 діб від початку ГІМ). У такому разі дозу аспірину треба принаймні зменшити до 100 мг для запобігання виникненню геморагічних та/або пептичних ускладнень. Непереносність аспірину також є приводом для призначення терапії ті єнопіридинами.
Блокатори глікопротеїнових рецепторів IIB/IIIA
Ще однією групою антитромбоцитарних препаратів є блокатори глікопротеїнових рецепторів IIB/IIIA. На теперішній час декілька інфузійних препаратів з цієї групи (абсиксимаб, ептифібатид та тирофібан) є «золотим стандартом» антитромбоцитарної терапії при проведенні
ЧКВ чи стентування для припинення тромбоутворення в зоні дилатації вінцевої артерії. Також є інформація щодо позитивного ефекту на частоту ургентного ЧКВ при застосуванні абсиксимабу із половинною дозою те нектеплази в якості модифікації реперфузійної терапії (дослідження ASSENT3), хоча за показником 1річної летальності достовірної різниці між цією тактикою та режимом введення повної дози тенектеплази із додаванням прямого антикоагулянта не було. Жоден з перо ральних препаратів цієї групи не показав своєї ефективності у хворих з ІХС. Крім обов’язкової внутрішньовенної інфузії протягом принаймні однієї доби, до негативних якостей цих препаратів слід віднести їх високу вартість та збільшення геморагічних ускладнень при їх застосуванні.
Антиаритмічні засоби
Хоча показано здатність лідокаїну зменшувати частоту виникнення фібриляції шлуночків у гостру фазу інфаркту міокарда, цей препарат істотно збільшує ризик асистолії. Результати метааналізу 14 досліджень виявили недостовірне підвищення смертності у пацієнтів, які отримували лідокаїн, порівняно з плацебо. Рутинне профілактичне застосування цього препарату не виправдане.
Бетаадреноблокатори та аміодарон
У гострій фазі інфаркту міокарда здійснено чимало досліджень із призначенням вадреноблокаторів, які здатні подовжувати діастолу, покращувати перфузію міокарда, в особливості субендокарда, обмежувати зону некрозу, зменшувати частоту фатальних аритмій, послаблювати біль та частоту інших ускладнень, особливо у хворих без супутньої тромболітичної терапії. Також доведено зменшення кількості рецидивів після тромболітичної терапії та зниження ранньої летальності. За даними сукупного аналізу 28 досліджень, внутрішньовенна вадреноблокада забезпечує абсолютне зменшення смертності через 7 днів з 4,3 до 3,7 %, або шість врятованих життів на 1000 лікованих пацієнтів. Ці дослідження здійснювалися до впровадження фібринолітичних засобів або виконання первинного ЧКВ. У двох рандо мізованих дослідженнях з внутрішньовенним введенням вадреноблокаторів на тлі фібринолітиків була мала кількість подій, що не дозволило зробити певні висновки. Втім, вадреноблокатори, зокрема пероральні, повинні отримувати всі хворі на ГІМ, починаючи з першої доби захворювання, якщо в них немає: а) ознак важкої серцевої недостатності, б) синдрому низького серцевого викиду, в) ризику розвитку кардіогенного шоку (як сукупності наступних факторів: вік понад 70 років, систолічний АТ < 120 мм рт. ст., частота скорочень серця (ЧСС) > 110 за 1 хв або < 60 за 1 хв, пізні строки госпіталізації) г) ознак порушення АВпровідності (інтервал PR > 0,24 с або АВблокада другого чи третього ступеня) та д) ознак наявності бронхіальної астми чи бронхообструктивно го синдрому. Лікування доцільно починати з короткодіючої форми препарату, щоб мати змогу вчасно попередити виникнення ускладнень цієї терапії. Ці висновки підкріплені результатами дослідження застосування великих доз (200 мг) метопрололу (COMMIT/CCS2). Призначення внутрішньовенних вадреноблокаторів є особливо показання за наявності тахікардії (коли немає прогресуючої серцевої недостатності або ризику розвитку кардіогенного шоку), відносної гіпертензії, або коли біль не проходить після введення опіоїдів. За наявності ознак серцевої недостатності доцільно призначати вадреноблокатори з мінімальних доз і поступово титрувати до оптимальних. Для більш безпечного призначення вадреноблокаторів у гострий період захворювання спершу потрібно оцінити насосну функцію лівого шлуночка за допомогою ехокардіографії.
Великий метааналіз, проведений у 1993 р., показав також ефективність аміодарону у зниженні кардіаль ної летальності у хворих у післяінфарктний період. Крім того, було виявлено, що комбінована терапія аміодаро ном та вадреноблокаторами у хворих з високим ризиком шлуночкових тахіаритмій має більшу ефективність, ніж монотерапія кожним з цих препаратів. Особливо помітним цей ефект виявився у хворих з високою (понад 80 за 1 хв) ЧСС до початку лікування. Є підстави вважати, що найбільшим ефект аміодарону є при зменшенні ЧСС менше 70 за 1 хв, що робить комбінацію цих препаратів патогенетично обґрунтованою. Також доцільно призначати аміодарон хворим, у яких унаслідок прогресування серцевої недостатності виникли фібриляція або тріпотіння передсердь.
Нітрати
Метааналіз 10 досліджень з раннім внутрішньовенним введенням нітратів, виконаних у 2041 пацієнта, виявив достовірне зменшення летальності приблизно на одну третину. Але кожне з цих досліджень було малим за обсягом. Було зареєстровано всього 329 смертельних випадків і, хоча результати виявилися висо кодостовірними, вони характеризувалися широкими довірчими інтервалами. У дослідженні GISSI3 (1994) порівнювали стратегії застосування нітратів рутинно або в окремих пацієнтів з тривалою ішемією, всього у 19 394 пацієнтів. При стандартизованому призначенні нітратів не спостерігали достовірного зменшення смертності. У дослідженні ISIS4 (1995) перораль ний ізосорбіду мононітрат призначали від початку захворювання протягом одного місяця, і також не було отримано доказів сприятливого впливу препарату. У дослідженні ESPRIM (1994) також не довели користі застосування молсидоміну, донора оксиду азоту. Отже, внутрішньовенне застосування нітратів показане при наявності больового синдрому, гострої серцевої недостатності, для корекції артеріальної гіпертензії. Пероральні нітрати призначають у хворих для лікування та профілактики дисфункції лівого шлуночка в поєднанні з інгібіторами АПФ. Крім того, є дані, які свідчать, що нітрогліцерин здатний пригнічувати адгезію та агрегацію тромбоцитів.
Антагоністи кальцію
Метааналіз досліджень із застосуванням антагоністів кальцію при ГІМ виявив негативну тенденцію. Для використання антагоністів кальцію з профілактичною метою у гострій фазі інфаркту міокарда немає підстав.
Інгібітори ангіотензинперетворюючого ферменту
Чітко встановлено, що інгібітори ангіотензинперетворюючого ферменту (АПФ) повинні призначатися пацієнтам із зниженою фракцією викиду або в яких на ранній фазі захворювання виникали прояви серцевої недостатності. У дослідженнях GISSI3 (1994) та ISIS4 (1995) застосування інгібіторів АПФ від першого дня захворювання незначно, але достовірно зменшувало летальність протягом наступних 46 тиж. Утім, у дослідженні CONSENSUS II (1992) із внутрішньовенним введенням препарату сприятливого впливу не виявили. Систематичний аналіз досліджень ефективності пероральних інгібіторів АПФ у ранні терміни інфаркту міокарда вказує на безпечність і добру переносність цих препаратів (табл. 5). Їх прийом асоціюється з невеликим, але достовірним зменшенням летальності через 30 днів після початку захворювання, причому більша частина сприятливого ефекту досягається протягом першого тижня. Зараз існує загальна згода щодо початку застосування інгібіторів АПФ протягом перших 24 год хворим з дисфункцією лівого шлуночка, наявністю серцевої недостатності, цукрового діабету, артеріальної гіпертензії, з передньою локалізацією інфаркту, якщо немає протипоказань.
Таблиця 5
Дозування інгібіторів АПФ у пацієнтів, які перенесли інфаркт міокарда в контрольованих дослідженнях
Блокатори рецепторів ангіотензину II першого типу
Проведена оцінка ефективності блокаторів рецепторів ангіотензину II першого типу при ГІМ показала, що ефективність валсартану така сама, як і в каптоприлу, тоді як лозартан був менш ефективним, ніж каптоприл, у запобіганні несприятливому перебігу захворювання в дослідженнях OPTIMAL і VALIANT. На сьогоднішній день бло катори рецепторів ангіотензину II першого типу залишаються препаратами вибору в пацієнтів з протипоказаннями для призначення інгібіторів АПФ. Немає переконливих даних щодо додаткового ефекту від комбінації цих груп препаратів у хворих з гострим інфарктом міокарда.
Магній
Метааналіз досліджень ефективності препаратів магнію при ГІМ дозволяв припустити наявність їх достовірного ефекту. Проте, здійснене пізніше дослідження ISIS (1995) не підтвердило цієї думки, хоча були суперечки щодо недостатньої дози магнію в цьому дослідженні. Нещодавно оприлюднені результати великого дослідження MAGIC(1997) підтвердили відсутність сприятливого впливу магнію. Проте, внутрішньовенне введення солей магнію може бути застосовано у хворих з подовженням інтервалу QTта наявністю поліморфних шлу ночкових тахікардій.
Глюкозаінсулінкалій
Існують експериментальні та обмежені клінічні докази того, що призначення глюкозоінсулінокалієвої суміші (ГІК) може сприятливо впливати на метаболізм ішемізо ваного міокарда і, таким чином, забезпечувати клінічні переваги. Однак дані великих досліджень дають підстави вважати, що позитивного ефекту від цієї терапії слід очікувати лише у хворих із супутнім порушенням вуглеводного обміну (зокрема, дослідження CREATE не підтвердило ефективності HK для зменшення летальності та ускладнень у хворих без порушень цукрового обміну). Підвищений рівень глюкози крові при надходженні хворого на ГІМ у стаціонар (більше 200 мг/дл, або 11 ммоль/л) асоційований із значним зростанням ризику смерті в післяінфарктний період. Інтерпретуючи результати досліджень DIGAMI та DIGAMI2, можна зробити висновок, що цей показник навіть більшою мірою вказує на можливість отримання бажаного ефекту від терапії □K, ніж сам факт наявності у хворого цукрового діабету.
Отже, призначення HK можна вважати виправданим у пацієнтів із цукровим діабетом та порушенням толерантності до глюкози, але лише за умов ретельного контролю за рівнем глюкози крові. Також це лікування може бути використане з метою корекції гіпокаліємії та відновлення об’єму циркулюючої крові.
Препарати з кардіопротекторною дією
Ця група об’єднує препарати з мембранопротекторною дією, модулятори метаболічних процесів у кардіоміо цитах. На теперішній час є обмежений досвід використання при лікуванні хворих з ГІМ триметазидину, кверцетину (також в якості внутрішньовенної інфузії кор вітину) та екзогенного креатинфосфату з метою обмеження розміру інфаркту міокарда (критерій кардіопро текції). Проте на теперішній час відсутні переконливі ба гатоцентрові клінічні дослідження з доказами ефективності терапії вищевказаними препаратами для зниження летальності у хворих з ГІМ, тому питання включення кардіопротекторів до комплексної терапії ГІМ є відкритим. Доцільність застосування цих препаратів у кожному конкретному випадку може залишатися на розсуд лікаря.
Рання гіполіпідемічна терапія і статини
На сьогоднішній день доведена доцільність призначення статинів після гострого коронарного синдрому для запобігання прогресуванню атеросклерозу та його гострих ускладнень. Питання про раннє (у перші доби) застосування статинів залишається відкритим щодо можливості отримання швидких позитивних наслідків такого лікування порівняно з ризиком побічної дії на печінку. Теоретичні очікування ранніх плейотропних ефектів статинів та необхідність початку лікування у стаціонарі (як запорука подальшої тривалої терапії) обґрунтовує призначення статинів усім хворим з інфарктом міокарда у перші 3 доби захворювання, якщо немає протипоказань.
Рутинні засоби профілактичної терапії у гострій фазі захворювання
Ведення хворих із особливими типами інфаркту
Інфаркт правого шлуночка
Діагностика інфаркту правого шлуночка має важливе значення, оскільки це захворювання може проявлятися кардіогенним шоком, але стратегія лікування відрізняється від такої при шоку внаслідок тяжкої дисфункції лівого шлуночка. Інфаркт міокарда правого шлуночка можна запідозрити за специфічною, але нечутливою клінічною тріадою, коли гіпотензія, чисті легеневі поля та підвищення тиску в яремних венах спостерігаються в пацієнтів з інфарктом нижньої локалізації. Елевація сегмента ST у відведенні V4R дозволяє запідозрити інфаркт правого шлуночка; реєстрацію ЕКГ у цьому відведенні потрібно обов’язково здійснювати у всіх випадках шоку, а можливо, рутинно. Поява зубців Q та елева цій сегмента ST у відведеннях V13, негативних зубців Т у цих відведеннях також дозволяє запідозрити діагноз інфаркту правого шлуночка. При ехокардіографічному дослідженні типовими для інфаркту правого шлуночка є такі риси: дилатація, гіпокінез або акінез правого шлуночка, дилатація правого передсердя, поява вираженої трикуспідальної регургітації внаслідок дилатації трикус підального кільця.
Коли при інфаркті правого шлуночка є ознаки гіпотензії або шоку, важливо підтримувати переднаванта ження правого шлуночка. Якщо це можливо, бажано уникати застосування засобів з вазодилатуючою дією, таких як опіоїди, нітрати, діуретики та інгібітори АПФ. У багатьох випадках ефективним є внутрішньовенне навантаження рідиною. Інфаркт правого шлуночка часто ускладнюється фібриляцією передсердь. Це порушення ритму потрібно швидко усувати, оскільки передсердя робить істотний внесок у наповнення правого шлуночка. Подібним чином у випадку виникнення блокади серця, слід здійснити двокамерну кардіостимуляцію, незважаючи на підвищення ризику індукованої катетером фібриляції шлуночків. Певному сумніву піддавали ефективність фібринолітичної терапії при інфаркті правого шлуночка, але вона, безперечно, показана в пацієнтів з гіпотензією. Інший можливий шлях пряме ЧКВ, здатне швидко покращити показники гемодинаміки.
Інфаркт міокарда у хворих із цукровим діабетом
Близько однієї чверті всіх пацієнтів з інфарктом міокарда хворіють на цукровий діабет, і цей показник може збільшитися. Слід наголосити, що пацієнти з цукровим діабетом можуть звертатися з атиповими симптомами, і досить частим ускладненням є серцева недостатність. У пацієнтів з інфарктом міокарда на фоні цукрового діабету летальність удвічі більша порівняно з пацієнтами без діабету. Існують вказівки на те, що пацієнти з діабетом не отримують таке ж активне лікування, як хворі без діабету, очевидно з огляду на ускладнення терапії. Діабет не є протипоказанням для проведення фібринолітичної терапії, навіть за наявності ретинопатії. Більше того, застосування вадреноблокаторів та інгібіторів АПФ може бути навіть більш ефективним, ніж у пацієнтів без діабету, а ризик виникнення ускладнень дуже низький. Гостра фаза захворювання часто характеризується погіршенням контролю метаболічних показників, а гіперглікемія є незалежним предиктором смерті. Показано, що суворий контроль рівня глікемії шляхом внутрішньовенного застосування суміші глюкозаінсулін (або ГІК) у хворих з діабетом як 1го, так і 2го типу з подальшою терапією множинними дозами інсуліну зменшує смертність при тривалому спостереженні. Питання призначення пероральних цукрознижувальних препаратів у гострій фазі інфаркту міокарда повинно вирішуватися індивідуально для кожного хворого із порушеннями глюкозного профілю, оскільки немає доказів позитивного впливу терапії цими препаратами на перебіг захворювання. З особливою обережністю треба вирішувати питання щодо призначення метформіну та препаратів з групи тіазолідиндіонів у хворих з лівошлуночковою недостатністю, оскільки є підстави вважати, що ці препарати можуть сприяти затриманню рідини в організмі. В усякому разі, навіть за умов відсутності анамнезу цукрового діабету, треба намагатися здійснювати контроль за рівнем глюкози крові в разі його підвищення, причому перевагу слід віддавати короткодіючим формам інсуліну.
Ведення хворих у більш пізній госпітальній фазі
Ведення хворих з інфарктом міокарда у більш пізній вну трішньогоспітальній фазі залежить від розмірів некрозу міокарда, демографічних характеристик пацієнтів, наявності супутніх захворювань. Після зникнення симптомів і при мінімальному пошкодженні міокарда пацієнти можуть бути виписані додому через кілька днів. У випадках вираженої дисфункції лівого шлуночка або при високому ступені ризику нових подій вимагається більш тривала госпіталізація.
Фізична активність
Пацієнти з пошкодженням лівого шлуночка повинні залишатися в ліжку протягом перших 23 діб. До цього часу стає ясно, чи виникнуть ускладнення інфаркту. В неускладнених випадках пацієнт може сідати на 3тю добу, йому дозволяють використовувати тумбочку, обслуговувати себе і самостійно їсти. На 5ту добу хворим дозволяється стояти та ходити по палаті. Розширення фізичного режиму починають з другого тижня, збільшуючи ходьбу на 5075100 м на день, а з 12ї доби починають освоювати підйом східцями. Якщо інфаркт ускладнювався серцевою недостатністю, шоком або тяжкими аритміями, слід продовжувати ліжковий режим довше. У цьому випадку розширення фізичної активності повинно здійснюватися повільніше, залежно від симптомів та розмірів пошкодження міокарда.
Ведення хворих із специфічними внутрішньогоспі тальними ускладненнями
Тромбоз глибоких вен і емболія легень
Ці ускладнення зараз трапляються відносно нечасто, за винятком випадків тривалого збереження ліжкового режиму через виникнення серцевої недостатності. Цим ускладненням можна запобігти профілактичними дозами низькомолекулярного гепарину. Лікування здійснюють терапевтичними дозами низькомолекулярного гепарину, після чого протягом 6 міс продовжують терапію пероральними антикоагулянтами.
Внутрішньошлуночковий тромб і системні емболії
При ехокардіографічному дослідженні можуть виявлятися тромби в порожнині шлуночків, особливо в пацієнтів з великими інфарктами передньої локалізації. Якщо тромби мобільні або виступають у порожнину шлуночків, спочатку слід призначити внутрішньовенно нефрак ціонований гепарин або черезшкірно низькомолекулярний гепарин із наступним призначенням перораль них антикоагулянтів протягом принаймні 6 міс.
Перикардит
Інфаркт міокарда може ускладнюватися гострим перикардитом, який асоціюється з гіршим прогнозом. Він спричиняє біль у грудній клітці, який можна помилково інтерпретувати як рецидив інфаркту або ранню піс ляінфарктну стенокардію. Особливість болю його різкість, зв’язок з положенням тіла і фазами дихання. Діагноз підтверджують за наявністю шуму тертя перикарду. Якщо біль сильно турбує, можна застосувати перо ральний або внутрішньовенний аспірин у високих дозах або стероїди. Нестероїдні протизапальні засоби можуть бути використані з великою обережністю як короткотривала терапія. Геморагічний випіт у перикард з виникненням тампонади серця зустрічається нечасто і може бути пов’язаний з антикоагулянтною терапією на тлі порушення функції нирок. Звичайно його виявляють ехокардіографічним методом. При виражених розладах гемодинаміки здійснюють перикардіоцентез.
Пізні шлуночкові аритмії
Шлуночкова тахікардія і фібриляція шлуночків, які виникають протягом першого дня захворювання, мають низьку цінність для передбачення зворотних аритмій. При більш пізньому виникненні аритмії можуть відновлюватися і асоціюються з високим ризиком смерті. Шлуночкова тахікардія або фібриляція шлуночків протягом першого тижня після інфаркту асоціюються з більш поширеним пошкодженням міокарда; слід завжди здійснювати ретельну оцінку анатомії вінцевих артерій і функції шлуночків. При високій імовірності індукування аритмії на фоні ішемії, слід розглянути можливість реваскуляризації методом ЧКВ або шляхом хірургічного втручання. Якщо це малоімовірно, існує можливість застосування інших терапевтичних підходів, у тому числі комбіноване призначення вадреноблокаторів та аміодарону, імплантація кардіовертерадефібрилятора.
Післяінфарктна стенокардія та ішемія
Стенокардія або зворотна чи індукована ішемія у ранній післяінфарктній фазі вимагають подальшого обстеження. Так, у кількох рандомізованих дослідженнях після проведення фібринолітичної терапії рутинне застосування вибіркового ЧКВ порівнювали з традиційним підходом. Було зроблено висновок, що рутинне ЧКВ за відсутності спонтанної або індукованої ішемії не поліпшує функції лівого шлуночка і виживання. Втім, при лікуванні стенокардії або зворотної чи індукованої ішемії, зумовленої реоклюзією чи залишковим стенозом, певну роль відіграє реваскуляризація (ЧКВ або хірургічне шунтування вінцевих артерій). Вона також може бути корисною у лікуванні аритмій, асоційованих із стійкою ішемією. Хоча в кількох дослідженнях показано, що прохідна інфарктзалежна судина є маркером доброго тривалого
виходу, немає даних, що пізнє ЧКВ з єдиною метою відновлення прохідності судини впливає на пізні події.
Хірургічне шунтування вінцевих артерій може бути показане, якщо симптоми не коригуються іншими засобами або якщо при коронарній ангіографії виявляються стеноз стовбура лівої вінцевої артерії або трисудинне захворювання із зниженою функцією лівого шлуночка, при яких хірургічне лікування покращує прогноз.
Оцінка ризику, реабілітація і вторинна профілактика
Оцінка ризику
Клінічна картина перебігу гострого періоду інфаркту міокарда значною мірою визначає подальший прогноз. Найбільш частими причинами смерті в післяінфарктний період є шлуночкові тахіаритмії та раптова кардіальна смерть. Нижче представлені маркери ризику раптової смерті в післяінфарктний період (табл. 6).
Таблиця 6
Маркери розвитку раптової смерті в післяінфарктний період
Терміни
Після ГІМ важливо виявити пацієнтів з високим ризиком виникнення подальших подій, таких як повторний інфаркт і смерть. Бажано своєчасно здійснити втручання для запобігання цим подіям. Оскільки ризик виникнення подій зменшується з часом, бажано здійснювати ранню оцінку ризику. Клінічне обстеження, оцінка розміру інфаркту і функції лівого шлуночка в спокої повинні здійснюватися протягом перших 2448 год, але час подальшого обстеження буде залежати від особливостей оснащення на місці. Традиційно пробу з максимальним навантаженням на велоергометрі для виявлення індукції ішемії доцільно виконувати протягом 6 тиж. Більш новими засобами ранньої оцінки ризику є ехокардіо графія з добутаміном. Цей метод дозволяє розрізняти ішемію у віддалених ділянках, а також у життєздатному міокарді, який зберігається в зоні інфаркту. Стрес ехокардіографія може виконуватися на другому тижні захворювання, при неускладненому перебігу інфаркту і використовуватися для оцінки потреби в проведенні коронарної ангіографії і необхідності корекції медикаментозної терапії. Якщо первинне коронарне втручання закінчилось успішно, рання оцінка ризику має менше значення. У цьому випадку можна припустити, що інфарктзалежне пошкодження вінцевої артерії вдалось усунути і стабілізувати, і основна проблема полягає у виявленні індукованої ішемії в інших басейнах. Цим пацієнтам доцільно здійснити стрестестування в амбулаторних умовах через 6 тиж з використанням ЕКГ або методів візуалізації серця.
Клінічна оцінка та подальші обстеження
На рисунку показаний алгоритм оцінки ризику після інфаркту міокарда, а в таблиці 7 показання для методів візуалізації. Клінічними індикаторами високого ризику в гострій фазі є гіпотензія, стійка серцева недостатність, злоякісні аритмії, стійкий біль у грудній клітці або рання стенокардія при мінімальному навантаженні. Пацієнти з цими клінічними маркерами переважно старші за віком, частіше мають кілька факторів ризику, перенесений у минулому інфаркт і є кандидатами для ранньої коронарної ангіографії.
Якщо під час ангіографії анатомія коронарного русла підходить для втручання і є ознаки ішемізованого життєздатного міокарда, показана реваскуляризація.
Пацієнти без клінічних маркерів високого ризику характеризуються нижчим рівнем ризику, але серед них є пацієнти, в яких пізніше трапляються події, і тому показана подальша стратифікація ризику. Хоча цим пацієнтам часто виконують коронарну ангіографію, доцільно почати з неінвазивного обстеження. Після закінчення гострої фази захворювання прогноз тісно пов’язаний із ступенем дисфункції лівого шлуночка, обсягу та тяжкості залишкової ішемії. Обидва ці параметри можна оцінити методами перфузійної сцинтиграфії міокарда або ехокардіографії. Фракція викиду і кінцевосистолічний об’єм є сильними предикторами смертності, а в пацієнтів з порушеною функцією лівого шлуночка перфузійна візуалізація особливо корисна, оскільки життєздатний, але ішемізований міокарда може стати субстратом для подальших серцевих подій.
Ступінь ризику є високим у пацієнтів, в яких фракція викиду за даними візуалізації серця становить <35 % або таких з широкою або глибокою індукованою ішемією, з ураженням понад 50 % решти життєздатного міокарда. Цим пацієнтам потрібно виконувати коронарну ангіографію, і їх ведуть так само, як пацієнтів з високим ступенем ризику, оціненим лише за клінічними критеріями.
Ступінь ризику є низьким у пацієнтів, в яких фракція викиду за даними візуалізації серця становить >50 % або таких із обмеженою або незначною індукованою ішемією з ураженням менше 20 % решти життєздатного міокарда, особливо коли ішемія виникає у зоні інфаркту, а не віддаленій зоні. Цих пацієнтів можна лікувати медикаментозно, крім випадків, коли втручання необхідне для усунення симптомів.
Рисунок. Алгоритм оцінки ризику після інфаркту міокарда.
Таблиця 7
Резюме рекомендацій з візуалізації та навантажувальних тестів 1 Перевагу надають ранній оцінці ризику. 2 Ехокар-
діографія у спокої показана при будь-якій стадії серцевої недостатності, шоку або при появі нового шуму. 3 Вибір опти-
мального методу залежить від місцевих особливостей, але перевагу надають візуалізації.
Пацієнтів, які за критеріями візуалізації не належать до групи високого чи низького ризику, можна вести залежно від клінічних симптомів. Наприклад, пацієнти із стійкою стенокардією, яка адекватно не контролюється медикаментами, є кандидатами для проведення коронарної ангіографії та можливого подальшого втручання. Тоді як пацієнтів з мінімальними або контрольованими симптомами можна починати лікувати медикаментозно.
Усім пацієнтам потрібно здійснити оцінку метаболічних маркерів ризику, включаючи рівні креатиніну, загального холестерину, холестерину ліпопротеїдів низької і високої густини, тригліцеридів натще, а також глюкози в плазмі.
Оцінка життєздатності міокарда, оглушення і гібернації
Оцінка життєздатності міокарда та пошук ішемії після перенесеного інфаркту є взаємодоповнюючими завданнями, оскільки лише життєздатний міокарда може бути іше мізованим, а у вирішенні цих завдань використовуються подібні методи візуалізації серця. Дисфункція лівого шлуночка після ГІМ може бути зумовлена некрозом, оглушенням життєздатного міокарда в зоні інфаркту, гібернацією життєздатного міокарда, або усіма трьома причинами. Просте оглушення повинно проходити протягом 2 тиж після гострого ішемічного пошкодження, якщо зникає ішемія. При збереженні ішемії зворотне оглушення переходить у гібернацію, коли для відновлення функції потрібна реваскуляризація. Ці концепції мають найбільше значення у пацієнтів з тяжким ураженням функції лівого шлуночка після інфаркту, коли розглядається потреба у ре васкуляризації для поліпшення функції. Їх значення зменшується у пацієнтів, в яких симптоми дисфункції лівого шлуночка не домінують. Найбільш поширеним методом оцінки життєздатності міокарда є стресехокардіографія з добутаміном, яка відповідає критеріям безпеки та діагностичної значущості і має бути більш широко впроваджена у клінічну практику.
Оцінка ризику аритмії
У пацієнтів з імовірно високим ризиком порушень ритму корисно здійснити холтерівське моніторування ЕКГ і неінвазивні електрофізіологічні дослідження. Прогностичне значення у післяінфарктних пацієнтів мають показники варіабельності серцевого ритму, чутливості барорефлексу і пізні потенціали шлуночків. Утім, необхідний додатковий клінічний досвід для того, щоб встановити, наскільки ці дослідження додають діагностичної інформації порівняно із звичайними прогностичними тестами. Результати дослідження MADIT II (2002) свідчать про покращання прогнозу виживання внаслідок зменшення розвитку загрозливих для життя тахіарит мій при імплантації кардіовертера»дефібрилятора у пацієнтів після перенесеного раніше інфаркту міокарда з фракцією викиду менше 30 %, незалежно від результатів електрофізіологічного дослідження.
Реабілітація
Мета реабілітації відновити максимально повноцінне життя пацієнта, включаючи повернення до праці. Під час реабілітації потрібно брати до уваги фізичні, психологічні і соцЮ»економічні фактори. Реабілітація показана пацієнтам з тяжкою дисфункцією лівого шлуночка. Процес потрібно починати якомога раніше після госпіталізації в лікарню і продовжувати протягом наступних тижнів і місяців.
Психологічні та соціоекономічні аспекти
У пацієнтів і в осіб, що їх супроводжують, майже завжди виникає почуття тривоги. Тому велике значення надається заспокоєнню та поясненню суті захворювання. Важливо також запобігти виникненню депресії та подразливості, які частіше спостерігаються після повернення додому. Слід визнати поширеність феномену заперечення; у гострій фазі захворювання він має захисний ефект, але в подальшому може затрудняти сприйняття діагнозу.
Перед випискою з лікарні слід обговорити питання повернення до роботи та відновлення інших видів активності. В деяких випадках розвитку депресивного стану доцільним є призначення терапії антидепресантами без проаритмогенного ефекту.
Поради щодо способу життя
Під час госпіталізації потрібно обговорити з пацієнтами та їх партнерами можливі причини коронарної хвороби, дати індивідуалізовані поради щодо здорової їжі, контролю маси тіла, артеріального тиску, рівня глюкози крові, припинення куріння та збільшення регулярних фізичних навантажень.
Фізична активність
Усім пацієнтам потрібно дати поради щодо фізичної активності, залежно від перебігу відновлення після серцевого нападу, беручи до уваги вік, рівень активності перед інфарктом та фізичні обмеження. Важливим елементом прийняття рішень є навантажувальна проба перед випискою, яка не лише забезпечує корисну клінічну інформацію, а й дозволяє заспокоїти хворого відносно його можливостей фізичної активності. Метааналіз реабілітаційних програм, виконаних у період до впровадження методів реперфузії, які передбачали включення навантажень, дозволяє припустити можливість істотного зменшення летальності. Слід визнати, що, крім впливу на летальність, фізична реабілітація може мати інші сприятливі ефекти, зокрема, сприяння розвитку кола тералей. Такий адаптивний ефект викликає поліпшення толерантності до навантаження, загального стану серцевосудинної системи, почуття благополуччя, принаймні під час періоду тренувань, навіть у пацієнтів похилого віку. Зокрема, в дослідженні ETICA регулярне фізичне тренування помірної інтенсивності у пацієнтів з ішемічною хворобою серця після проведення коронарної ангіопластики привело до збільшення обсягу навантаження, яке може переноситися, та зменшення частоти кардіальних подій у подальшому без суттєвого впливу на динаміку прохідності прооперованої судини. Цілком логічно, що позитивний ефект від фізичного тренування зумовлений поступовим пристосуванням метаболізму міокарда до ішемічних умов, а не припиненням прогресування атеросклерозу. Рекомендована частота навантажень для досягнення значущого підвищення функціонального стану становить 35 разів на тиждень. Кожне підвищення фізичної працездатності на одну сходинку асоціюється із зменшенням ризику смерті від усіх причин на 814 %. Отже, після оцінки ризику всім післяінфарктним пацієнтам з тяжкою дисфункцією лівого шлуночка слід радити участь у реабілітаційній програмі.
Вторинна профілактика
Куріння
Переконливий досвід тривалих спостережень свідчить про те, що припинення куріння дозволяє зменшити рівень летальності протягом наступних кількох років більш ніж удвічі. Потенційно це найбільш ефективний захід із вторинної профілактики, і слід докласти всіх зусиль для припинення хворим куріння. У гострій фазі захворювання більшість пацієнтів не курять, і протягом періоду відновлення пацієнтам найлегше допомогти подолати шкідливу звичку. Відновлення куріння нерідко спостерігається після повернення додому, і під час періоду реабілітації необхідна відповідна підтримка і поради лікаря з цього приводу.
Дієта та харчові добавки
Ліонське дослідження впливу дієти на серце довело, що середземноморська дієта зменшує частоту рецидивів у пацієнтів, які перенесли перший інфаркт міокарда, принаймні протягом 4 років. Всім пацієнтам слід радити середземноморську дієту, яка характеризується малою кількістю насичених жирів, багата на поліненасиче ні жири, фрукти та овочі. Є підстави думати, що прийом жирної морської риби принаймні двічі на тиждень зменшує ризик повторного інфаркту і смерті. Додавання до дієти ш3 поліненасичених жирних кислот з риб’ячого жиру (12 г на добу), але не вітаміну Е, асоціювалося з достовірним зменшенням летальності від усіх причин та ймовірності раптової смерті. Немає доказів доцільності застосування харчових добавок, які містять антиоксиданти, після перенесеного інфаркту. Призначення фолієвої кислоти доцільне у випадку підвищення вмісту в крові гомоцистеїну.
Антитромбоцитарна та антикоагулянтна терапія
Метааналіз Antiplatelet Trialists Collaboration виявив, що у хворих з перенесеним інфарктом міокарда, які одержували антитромбоцитарну та антикоагулянтну терапію, ймовірність розвитку повторного інфаркту і смерті менша на 25 %. У проаналізованих дослідженнях доза аспірину коливалася від 75 до 325 мг на добу, хоча є свідчення того, що низькі дози забезпечують досягнення ефекту з меншою кількістю побічних проявів.
Виконані ще у період до широкого застосування аспірину дослідження довели ефективність також пе роральних антикоагулянтів у запобіганні новому інфаркту і смерті. У цих дослідженнях пацієнтів рандо мізували принаймні через 2 тижні після інфаркту міокарда. Ефективність рутинного застосування перо ральних антикоагулянтів на противагу аспірину в піс ляінфарктних хворих оцінювали в дослідженні АFTER (1996). У цих пацієнтів не було отримано чітких переваг порівняно з аспірином. Пероральне застосування антикоагулянтів є корисним в окремих підгрупах пацієнтів, зокрема з великою зоною акінезії передньої стінки лівого шлуночка, фібриляцією передсердь або наявністю ехокардіографічно доведеного тромбу в лівому шлуночку. Аспірин в поєднанні з фіксованою низькою дозою пероральних антикоагулянтів не більш ефективний для запобігання новим ішемічним подіям, ніж аспірин в якості монотерапії. Помірно та високоінтенсивна пероральна антикоагулянтна терапія (міжнародне нормалізоване співвідношення >2,0) в поєднанні з аспірином забезпечує зменшення кількості реоклюзій після успішного тромболізису, порівняно з монотерапією аспірином. Таке поєднання препаратів дозволило також зменшити загальну кількість випадків смерті, реінфаркту та інсульту у післяінфар ктних пацієнтів (дослідження ASPECT2, WARIS2), але ціною достовірного збільшення кількості нефаталь них ускладнень, зумовлених кровотечами. На цей час немає підстав рекомендувати поєднане застосування пероральних антикоагулянтів і аспірину після ГІМ. Можливість самостійного призначення пероральних антикоагулянтів потрібно розглядати у пацієнтів, які не переносять аспірин.
Хоча ефективність вторинної профілактики шляхом призначення клопідогрелю доведена лише у хворих після гострого коронарного синдрому без стійкої елевації сегмента ST (CURE, 2001), клопідогрель можна вважати добрим альтернативним засобом антитромбоцитар ної терапії, особливо у хворих із непереносністю та/або толерантністю до аспірину. Немає даних щодо клінічної ефективності тривалого рутинного застосування клопідогрелю на доповнення до аспірину після реперфузій ної терапії.
Бетаадреноблокатори
У кількох дослідженнях і метааналізах показано, що Радреноблокуючі засоби зменшують летальність та ризик повторного інфаркту на 2025 %. Позитивні результати отримано в дослідженнях пропранололу, метопро лолу, тимололу, ацебутололу і карведилолу. Втім, дослідження із застосуванням інших радреноблокаторів, хоча й менші за обсягом, давали подібний ефект. Метааналіз 82 рандомізованих досліджень переконливо свідчить на користь тривалого застосування Радреноблокаторів для зменшення захворюваності і смертності після ГІМ, навіть якщо були застосовані фі бринолітики і одночасно призначені інгібітори АПФ.
Вираженезменшеннялетальностіухворихізсерцевою недостатністю на фоні застосування Радреноблокаторів дає нові підстави для застосування цих препаратів у піс ляінфарктних хворих. Досвід усіх доступних досліджень дозволяє припустити, що pадреноблокатори без внутрішньої симпатоміметичної активності повинні призначатися всім пацієнтам після перенесеного інфаркту міокарда, в яких немає протипоказань.
Антагоністи кальцію
Докази можливого сприятливого впливу не дигідро піридинових антагоністів кальцію значно слабші, ніж Радреноблокаторів. У дослідженні INTERCEPT з участю 874 пацієнтів з ГІМ без застійної серцевої недостатності, яких лікували фібринолітичними засобами, 6місяч не застосування дилтіазему в дозі 300 мг на добу зменшило кількість коронарних втручань. Використання ве рапамілу і дилтіазему може бути доцільним за наявності протипоказань до Радреноблокаторів, особливо при обструктивних захворюваннях дихальних шляхів. Слід бути обережним за наявності порушеної функції шлуночків. Дигідропіридинові антагоністи кальцію короткої дії в якості монотерапії призводять до помірного збільшення летальності у хворих з ГІМ, тому таке лікування повинно призначатися лише за наявності чітких клінічних показань і у комбінації з pадреноблокаторами. Питання рутинного призначення антагоністів кальцію тривалої дії як доповнення до терапії радреноблокаторами та інгібіторами АПФ з метою вторинної профілактики у хворих після інфаркту міокарда залишається відкритим.
Нітрати
Немає доказів того, що пероральні або трансдермаль ні нітрати поліпшують прогноз післяінфарктних хворих. Ще у ранніх дослідженнях ISIS4 (1994) і GISSI3 (1995) не було показано користі застосування нітратів через 46 тиж після події. Звичайно, нітрати залишаються засобами вибору при стенокардії, яка має місце на тлі комплексної терапії pадреноблокаторами, інгібіторами АПФ, дезагрегантами, статинами та у випадку персистування серцевої недостатності.
Інгібітори ангіотензинперетворюючого ферменту
У кількох дослідженнях встановлено, що інгібітори АПФ зменшують летальність після перенесеного ГІМ із зниженою залишковою функцією лівого шлуночка. У дослідження SAVE (1992) включали пацієнтів у середньому через 11 днів після гострої події. У всіх пацієнтів фракція викиду була менше 40 % при радіоізотопній вентрику лографії і не було клінічно вираженої ішемії при навантажувальному тесті. Протягом першого року не спостерігали сприятливого впливу на смертність, але в наступні 35 років летальність зменшилася на 19 %. Водночас навіть протягом першого року спостерігали менше повторних інфарктів і випадків виникнення серцевої недостатності.
У дослідженні AIRE (1993) пацієнтів, в яких виникли клінічні або рентгенологічні ознаки серцевої недостатності, рандомізували для терапії раміприлом в середньому через 5 днів після початку інфаркту міокарда. Через 15 міс летальність зменшилася на 27 %.
У дослідженні TRACE (1995) лікування трандолапри лом або плацебо починалося в середньому через 4 дні після інфаркту, ускладненого дисфункцією лівого шлуночка. Індекс рухливості стінки у всіх пацієнтів становив 1,2 або менше. В середньому через 108 тиж спостереження, летальність становила 34,7 % в групі активного лікування і 42,3 % в групі плацебо. Автори цього дослідження далі спостерігали пацієнтів протягом мінімум 6 років і довели збільшення очікуваної тривалості життя на 15,3 міс (27 %). З огляду на наведені результати трьох досліджень, існують вагомі докази доцільності призначення інгібіторів АПФ пацієнтам, у яких після гострої події виникала серцева недостатність, з фракцією викиду менше 40 %, або індексом рухливості стінки 1,2 або менше за умови, що немає протипоказань.
Дані тривалих спостережень, здійснених після досліджень ефективності інгібіторів АПФ у післяінфарктних пацієнтів, а також дані дослідження HOPE свідчать про користь призначення цих препаратів принаймні протягом 45 років, навіть коли немає дисфункції лівого шлуночка. Досягнутий ефект може бути навіть більшим у пацієнтів з цукровим діабетом, які перенесли інфаркт міокарда. В іншому великому дослідженні раміприл продемонстрував свою здатність зменшувати частоту кардіоваскулярних подій в якості профілактичної терапії у хворих із цукровим діабетом. Результати дослідження EUROPA вказують на ефективність застосування периндоприлу у хворих після інфаркту міокарда. Призначення периндоприлу навіть хворим з низьким ступенем ризику, незалежно від наявності серцевої недостатності, артеріальної гіпертензії, цукрового діабету, приводило до зменшення частоти повторних інфарктів міокарда на 24 %, розвитку серцевої недостатності на 39 %. Тривале призначення інгібітора АПФ після інфаркту міокарда, подібно до аспірину і вадреноблокаторів, виправдане, якщо пацієнти добре переносять ці препарати.
Блокатори рецепторів ангіотензину II першого типу
Хоча ефективність вторинної профілактики препаратами цієї групи після інфаркту міокарда доведена лише для валсартану і відповідає такій у каптоприлу, можна вважати цю групу препаратів придатними до тривалого застосування у пацієнтів з протипоказаннями для призначення інгібіторів АПФ. Дані нещодавно закінченого дослідження ONTARGET (2008) свідчать, що інший бло катор рецепторів ангіотензину телмісартан має схожий до раміприлу ефект при тривалому застосуванні. Комбінування цих препаратів з інгібіторами АПФ у більшості випадків недоцільне.
Ліпідознижувальні препарати
Скандинавське дослідження впливу симвастатину на виживання (4S, 1994) чітко довело користь зниження рівня ліпідів у популяції 4444 пацієнтів із стенокардією і/або після інфаркту міокарда з рівнями холестерину в сироватці крові 212308 мг/дл (5,58,0 ммоль/л), після спроби застосування дієтичних заходів. Пацієнтів включали в дослідження після 6 місяців після ГІМ і була відібрана група пацієнтів з відносно низьким ступенем ризику. В середньому через 5,4 року загальна летальність у групі лікування симвастатином була меншою на 30 %, що при перерахунку результатів означає 33 врятованих життя на 1000 лікованих пацієнтів протягом цього періоду. Користь застосування симвастатину у хворих віком понад 60 років була такою ж, як і в молодших за віком пацієнтів.
У дослідженні CARE (1996) 4159 пацієнтів після інфаркту міокарда з «середніми» рівнями холестерину (в середньому 209 мг/дл) отримували правастатин 40 мг або плацебо протягом 320 міс після гострої події. Правастатин забезпечив відносне зменшення ризику фатальних коронарних подій або повторного інфаркту на 24 %. Подібні сприятливі ефекти спостерігали також у підгрупі пацієнтів, яким виконали реваскуляризацію міокарда.
У дослідженні LIPID (1998) близько 9000 пацієнтів з перенесеним раніше інфарктом міокарда або нестабільною стенокардією і рівнем холестерину в широкому діапазоні [42 % J 213 мг/дл (5,5 ммоль/л), 44 % у межах 213250 мг/дл (5,56,4 ммоль/л) і 13 % і 251 мг/дл (6,5 ммоль/л] рандомізовано отримували 40 мг правастати ну або плацебо, протягом 6 років. Лікування праваста тином дозволило зменшити ризик коронарної смерті на 24 %, ризик повторного інфаркту на 29 %.
Субаналіз дослідження ASCOT підтвердив ефективність терапії аторвастатином у пацієнтів із порушенням обміну ліпідів щодо розвитку коронарних подій (у тому числі фатальних).
У дослідженні гемфіброзилу (препарату з групи фі братів), результати якого опубліковані у 1999 р., включали пацієнтів з рівнями холестерину ліпопротеїнів високої густини J 40 мг/дл (1,04 ммоль/л), рівнями холестерину ліпопротеїнів низької густини J 140 мг/дл (3,6 ммоль/л) і тригліцеридів J 300 мг/дл (7,7 ммоль/л). У пацієнтів, які раніше перенесли інфаркт міокарда, в групі гемфіброзилу летальність зменшилася на 24 %. У дослідженні BIP (2000) призначення безафібрату пацієнтам з раніше перенесеним інфарктом міокарда або стабільною стенокардією з низькими рівнями холестерину лі попротеїдів високої густини и 45 мг/дл) асоціювалося з недостовірним зменшенням на 7,3 % частоти фатальних або нефатальних інфарктів міокарда або раптової смерті.
Загалом, ліпідознижувальні засоби повинні призначатися пацієнтам, які відповідають критеріям включення у згадані вище дослідження. Статини повинні призначатися у тому випадку, якщо рівень холестерину ліпо протеїдів низької густини і 100 мг/дл (2,6 ммоль/л). Рекомендації щодо застосування статинів повинні поширюватися навіть на пацієнтів з нижчими рівнями ліпідів, включаючи пацієнтів похилого віку. У пацієнтів з низькими рівнями холестерину ліпопротеїдів високої густини слід оцінити необхідність призначення фібратів. Є певні суперечності щодо термінів початку терапії. Дані Шведського реєстру свідчать про те, що перевагу може мати раннє та агресивне лікування ліпідознижувальними засобами, а за даними Американського реєстру інфаркту міокарда близько 80 % хворих на 5ту добу захворювання отримує статини.
Вторинна профілактика: резюме
Організація надання допомоги
Догоспітальна допомога
Затримка пацієнта
Критичним періодом при гострому серцевому нападі є найбільш рання фаза, коли в пацієнта зберігається сильний біль і підвищена ймовірність зупинки серця. Чим раніше пацієнт отримає засоби лікування, особливо реперфузійну терапію, тим більшими є сприятливі ефекти. Втім, нерідко за допомогою звертаються лише через годину після початку симптомів або пізніше. Інколи це свідчить про те, що симптоми не тяжкі, не типові, або починаються не раптово, але навіть у протилежному випадку пацієнт не завжди одразу звертається за допомогою. Пацієнти з діагностованою ішемічною хворобою серця та їх оточення повинні бути поінформовані про симптоми серцевого нападу і про те, як на них реагувати. Звичайно, всі повинні знати, як звертатися за невідкладною допомогою.
Ознайомлення громадськості з методиками серцево легеневої реанімації
Техніка базисної підтримки життя повинна бути частиною навчальних програм населення та спеціальних професійних груп, які з найбільшою ймовірністю можуть зустрітися з випадками зупинки серця під час роботи (міліція, персонал пожежних бригад).
Служба невідкладної допомоги
Служба невідкладної допомоги відіграє провідну роль у веденні хворих з ГІМ і зупинкою серця. Якість надання допомоги залежить від тренування персоналу. Весь персонал, який займається наданням невідкладної допомоги, повинен вміти розпізнавати симптоми інфаркту міокарда, призначати кисень та знеболювальні, забезпечувати базисну підтримку життя. Всі бригади невідкладної допомоги повинні бути оснащені дефібриляторами і включати принаймні одну особу, підготовлену в базисній підтримці життя. З огляду на те, що догоспіталь ний тромболізис є найбільш ефективним шляхом скорочення затримки часу, рекомендовані навчання медиків швидкої допомоги. Бажано, щоб персонал бригади невідкладної допомоги зареєстрував ЕКГ з діагностичною метою та інтерпретував її або забезпечив передачу у відділення невідкладної допомоги. Догоспітальна реєстрація ЕКГ може істотно прискорити ведення хворого в стаціонарі.
Процедури госпіталізації
Після госпіталізації в лікарню потрібно швидко здійснити діагностичні заходи, призначити фібринолітичну терапію і, за показаннями, ЧКВ. Пацієнти з очевидними ознаками інфаркту міокарда, в яких на ЕКГ виявляють елевацію сегмента ST або блокаду лівої ніжки пучка Гіса, повинні швидко отримати фібринолітичну терапію. Період «двериголка» не повинен перевищувати 30 хв. Інший варіант негайне переведення хворого у лабораторію катетеризації для ЧКВ.
Неінвазивне моніторування
Моніторування ЕКГ на предмет аритмій повинно починатися негайно в будь»якого пацієнта з підозрою на ГІМ. Воно має тривати протягом принаймні 24 год або до встановлення альтернативного діагнозу. Подальше моніторування ЕКГ визначається оцінкою ризику аритмій у пацієнта та наявним обладнанням. Більш тривале моніторування доцільно здійснювати у пацієнтів з проявами серцевої недостатності, шоком або тяжкими аритмія ми в гострій фазі захворювання, з огляду на високий ризик нових аритмій. Контроль динаміки сегмента ST протягом перших годин захворювання забезпечує важливу прогностичну інформацію і може бути корисним для вибору подальшого лікування, такого як «ЧКВ порятунку».
Рекомендації
Пацієнти
Пацієнти з підозрою на серцевий напад потребують швидкого встановлення діагнозу, знеболення, за необхідності реанімаційних заходів і реперфузійної терапії. Ведення цих хворих повинно здійснюватися персоналом, який підготовлений і має досвід сучасної допомоги при коронарних розладах. Персонал повинен мати доступ до методів розширеної діагностики і лікування в місці, де починається надання допомоги або після переведення в спеціалізоване відділення. Необхідно, щоб було відповідне оснащення для ведення хворих після виписки, реабілітації і вторинної профілактики. Пацієнти та особи, які їх супроводжують, повинні бути поінформовані, як розпізнавати серцевий напад і як діяти при подальших серцевих нападах.
Кардіологи
Кардіологи, разом із спеціалістами з невідкладної допомоги та організаторами надання допомоги, повинні забезпечити функціонування оптимальної системи ведення хворих із серцевими нападами, з урахуванням наявних ресурсів. Мінімальний рівень передбачає відповідне тренування персоналу бригад невідкладної допомоги і лікарів першого контакту, здійснення ефективних заходів з діагностики та лікування в осіб з підозрою на інфаркт міокарда у відділенні/блоці невідкладної допомоги, створення умов для забезпечення негайного початку реперфузійної терапії.
Слід також реєструвати пацієнтів з визначеним інфарктом міокарда, які госпіталізовані протягом 12 год після початку симптомів з елевацією сегмента ST або новою чи ймовірно новою блокадою лівої ніжки пучка Гіса та отримують фармакологічну чи механічну реперфузій ну терапію. Напевно, цей показник повинен бути високим і сягати 7090 %.
Коли є відповідні навички і оснащення, ЧКВ має переваги перед госпітальною фібринолітичною терапією. Результати первинної ЧКВ повинні фіксуватися в реєстрах.
Більшість пацієнтів з неускладненими інфарктами, особливо після успішної реперфузійної терапії, можуть бути виписані через 10 14 днів. Слід впроваджувати відповідні стратегії стратифікації майбутнього коронарного ризику. Вона, як правило, включає оцінку функції лівого шлуночка і одну з форм раннього навантажувального тестування: ЕКГ, сцинтиграфію чи ехо кардіографію. Реабілітаційна програма повинна бути доступною для всіх пацієнтів, залежно від індивідуальних потреб.
Важливо здійснювати політику припинення куріння. Спеціалісти з охорони здоров’я мають бути залучені у постійно функціонуючу програму, яка не лише заохочує пацієнтів припинити куріння, а й сприяє подальшому закріпленню відмови від куріння. Слід реєструвати засоби з вторинної профілактики, призначені пацієнтам після перенесеного інфаркту міокарда. Всім пацієнтам потрібно здійснити аналіз ліпідів крові, бажано в день госпіталізації, і слід призначити ліпідозни жувальні засоби. Аспірин, в»адреноблокатори, інгібітори АПФ, статини повинні призначатися за відсутності протипоказань.
Лікарі загальної практики
Коли лікарями «першого контакту» у випадках підозри на інфаркт міокарда є лікарі загальної практики, вони повинні негайно відреагувати або/і (бажано) викликати службу невідкладної допомоги.
Якщо лікарі загальної практики мають достатню підготовку та оснащення, вони можуть ефективно здійснювати дефібриляцію та фібриноліз. Ці лікарі повинні бути включені в координовану локальну програму з лікування невідкладних кардіологічних станів. Після виписки з госпіталю лікарі загальної практики повинні якомога швидше оглянути пацієнтів, упевнитися в правильній організації реабілітаційних заходів, здійсненні відповідних заходів з вторинної профілактики.
Організатори охорони здоров’я
Керівники охорони здоров’я повинні заохочувати навчання громадськості і спеціальних груп професіоналів щодо раннього розпізнавання симптомів коронарної катастрофи, техніки базисної серцево»легеневої реанімації, а персоналу бригад невідкладної допомоги методам базисної та розширеної підтримки життя. Вони повинні забезпечити доступність оптимальної системи допомоги пацієнтам з підозрою/після перенесених зупинки серця чи інфаркту міокарда через координацію діяльності служб швидкої допомоги, лікарів загальної практики, госпітальних служб. У відділеннях/блоках невідкладної допомоги повинні бути відповідні протоколи для негайного ведення пацієнтів з підозрою на інфаркт міокарда, цілодобова доступність персоналу з необхідними навичками. Потрібно забезпечити обладнання і достатню кількість ліжок для інтенсивної допомоги пацієнтам з інфарктом міокарда та чергування лікарів, які отримали формальну підготовку з кардіології. Слід здійснювати підготовку до реабілітації пацієнтів, виписаних з госпіталю після інфаркту міокарда.
У підготовці рекомендацій взяли участь:
Робоча група з невідкладної кардіології: професор О.М. Пархоменко (модератор), членкор. АМН України професор К.М. Амосова, академік АМН України Г.В. Дзяк, канд. мед. наук Б.І. Голобородько, доктор мед. наук О.І. Іркін, професор О.А. Коваль, професор М.П. Копиця, членкор. АМН України професор В.З. Нетяженко, професор І.К. Следзевська, професор Ю.М. Соколов, професор В.К. Тащук, професор В.О. Шумаков.
Рецензенти: членкор. АМН України професор В.М. Коваленко, професор Ю.М. Сіренко, професор М.І. Лу тай, професор В.В. Сиволап, професор М.В. Рішко, професор М.Т. Ватутін, канд. мед. наук С.М. Кожухов, канд. мед. наук О.В. Шумаков.



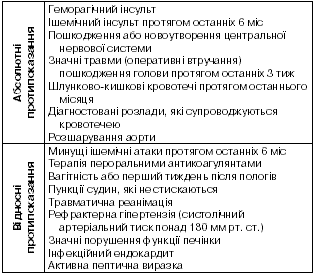
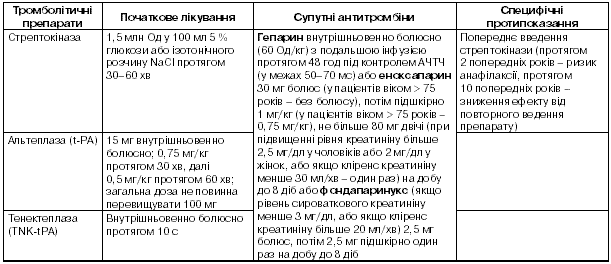





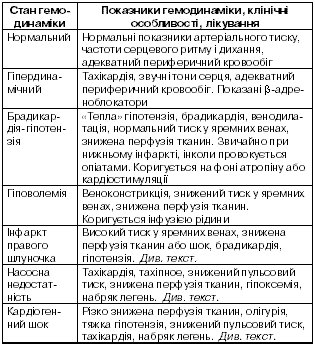

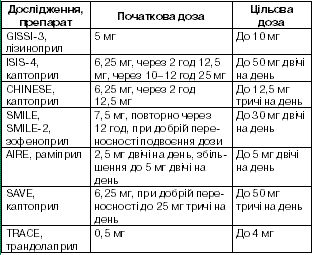
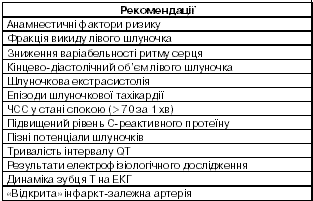
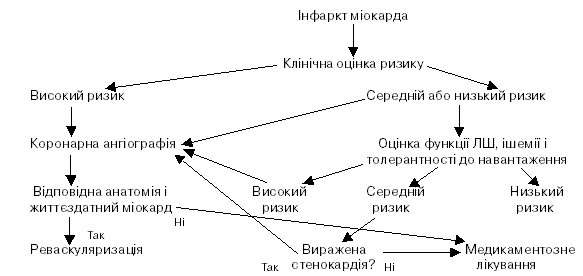
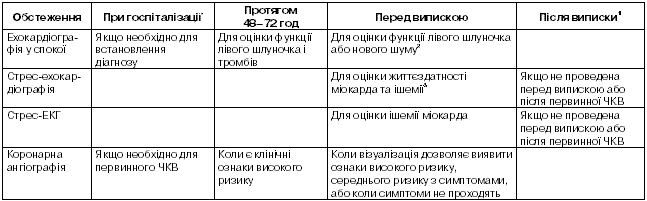









Комментировать