Рак яичников: общая характеристика и подходы в лечении. Рак яичников: первая линия химиотерапии. Системное лечение при рецидивах заболевания. Представления о лечении рака яичников.
А.С. Тюляндина, ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН
Последняя школа по раку яичников в рамках «Практической школы онкологии» с успехом проходила в СанктПетербурге в 2000 году. В то время я еще только училась в последнем классе общеобразовательной школы и готовилась к поступлению в медицинский институт. С тех пор незаметно пролетело 14 лет. И просмотрев лекции по системному лечению рака яичников начала XXI века, хочу отметить, что постулаты того времени не изменились и все еще остаются актуальными подходами к терапии этой непростой болезни.
Неоспорим тот факт, что хирургическое лечение при раке яичников является основным прогностическим фактором, определяющим дальнейшее течение заболевания. Однако большую часть борьбы с тяжелым недугом больную сопровождает системная цитостатическая терапия. Поэтому перед химиотерапевтами стоит стратегически важная задача распланировать лечение максимально длительно на весь период болезни пациентки, за который она будет способна получать химиотерапию.
За последние не сколько десятилетий с появлением новых цитостатиков продолжительность жизни больных раком яичников значительно возросла и медиана составляет прибли зительно 4 года [1]. Характерной особенностью эпителиальных опухолей яичников, позволяющей нам питать надежды, является ее высокая химиочувствительность в 70% случаев отмечается достижение полного клинического эффекта после первой линии химиотерапии. Однако при распространенном раке яичников возникновение прогрессирования заболевания неизбежно в подавляющем большинстве случаев. Поэтому до сих пор интерес к изучению биологии рака яичников и лекарственным подходам является актуальной темой для обсуждения.
В данной работе попытаемся сформулировать основные постулаты лекарственного лечения в первой линии химиотерапии и при рецидивах заболевания.
Рак яичников: первая линия химиотерапии
Напомню, что адекватных скрининговых программ для выявления рака яичников на ранних стадиях до сих пор не существует. Поэтому во всех странах мира в большинстве случаев, а именно в 60-80%, рак яичников диагностируется на поздних стадиях (III-IV) [1]. Диагноз ранний рак яичников встречается довольно редко, поэтому уделим тактике лечения этой ситуации немного времени.
Только после уверенности в адекватном стадировании во время хирургического вмешательства может быть установлена I стадия рака яичников. По этой причине химиотерапевты видят таких больных редко. В таблице 1 представлена тактика ведения пациентки в случае выявления рака яичников I стадии.
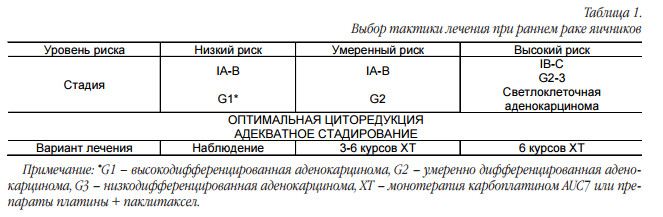
Вопрос необходимости адъювантной химиотерапии остается дискутабельным. Адъювантная химиотерапия у больных ранним раком яичников была изучена в двух рандомизированных исследованиях (ICON1 + ACTION) [2, 3]. В этих двух работах было показано, что химиотерапия у больных ранним раком яичников имеет преимущества в сравнении с наблюдением. В то же время при совместном анализе результатов этих исследований было продемонстрировано, что преимущество в 5-летней выживаемости в группе адъювантной химиотерапии составляет всего 8% (82 vs. 74%; HR0.67; 95% CI 0.50–0.90; р=0,008) в сравнении с наблюдением [4].
Объяснением полученных результатов может служить тот факт, что в этих исследованиях довольно часто не проводилось адекватное хирургическое стадирование. Например, в исследовании ACTION адекватно было простадировано 34% больных, а в ICON1 в 25% не проводилось стадирование в полном объеме. При дополнительном анализе оказалось, что в исследованиях многие первые стадии оказались скрытыми третьими стадиями заболевания, а эти пациентки однозначно выигрывают от назначения химиотерапии, что могло повлиять на полученные в ходе исследования результаты.
Любопытно, что в исследовании ACTION посмотрели эффективность адъювантной химиотерапии у больных с выполненным адекватным хирургическим стадированием, оптимальной циторедукцией и ранним раком. Оказалось, что различий между группами, находящимися под наблюдением и получающими химиотерапию, не было получено. Таким образом, в настоящий момент четких данных о том, как вести больных ранним раком яичничов после хирургического лечения, нет.
Если онколог уверен в адекватности стадирования и низком риске возникновения рецидива, можно предложить больной наблюдение (табл. 1). В случае умеренного риска вопрос о количестве курсов химиотерапии не решен. В исследовании GOG157 было показано, что больным после хирургического лечения назначение 3-х курсов химиотерапии с препаратами платины сравнимо по эффективности с 6-ю курсами, при этом большее число курсов приводило к увеличению токсичности [5].
Таким образом, если вы уверены в адекватном стадировании больной после хирургического лечения, отсутствия разрывов капсулы опухоли, то назначение 3-4-х курсов химиотерапии с препаратами платины может быть достаточным. Для больных с IC стадией или светлоклеточной опухолью требуется назначение полноценной химиотерапии как для распространенной болезни. Однако в большинстве случаев болезнь диагностируется на поздних стадиях.
При этом 5-летняя выживаемость крайне низкая: для IIIC стадии составляет 32,5%, а для IV стадии – всего 18,1% [1]. В этом случае необходимость системного лечения уже не обсуждается. В 1970-е годы лекарственное лечение рака яичников основывалось на алкилирующих агентах, таких как мелфалан, хлорамбуцил, тиофосфамид, при этом объективный ответ наблюдался в 20% случаев, а медиана продолжительности жизни составляла 10-14 мес [6].
Комбинация циклофосфан и доксорубицин увеличила продолжительность жизни больных до 16 мес. С появлением цисплатина началась новая эра в лечении рака яичников. Схемы лечения с включением цисплатина, доксорубицина и циклофосфана (CAP) стали стандартом в начале 1980-х годов, увеличивая медиану продолжительности жизни до 20 мес. [7].
Сравнительные исследования схемы CAP с комбинацией циклофосфан и цисплатин (СР) и цисплатином в монорежиме продемонстрировали равнозначную эффективность, при этом режим CAP усиливал проявления токсических реакций [8]. Комбинация препаратов платины (цисплатин и циклофосфан) в начале 80-х годов была признана стандартом лечения. В 1990-х годах новый глобальный виток в развитии лекарственного лечения рака яичников был связан с внедрением препаратов таксанового ряда, а именно паклитаксела.
По данным крупных рандомизированных международных исследований паклитаксел стал вытеснять циклофосфан из первой линии химиотерапии. В исследованиях GOG111 и OV10 было отмечено преимущество от замены циклофосфана на паклитаксел с увеличением медианы продолжительности жизни примерно на 12 мес. [9, 10]. Паклитакселсодержащая схема лечения позволяла статистически значимо увеличить частоту объективного ответа (с 60 до 73%), время до прогрессирования с 13 до 18 мес., а продолжительность жизни с 24 до 38 мес. [11].
По данным ряда авторов было показано, что циклофосфан в первой линии терапии не приносит существенной пользы, а только увеличивает проявления токсичности. Вероятно, это связано с механизмом действия препарата и его меньшей эффективностью при мутации гена ТР53, встречающейся в большинстве случаев у больных раком яичников [12].
В большинстве стран мира схема лечения цисплатин и циклофосфан осталась в историческом прошлом, однако, к большому сожалению, есть еще онкологические учреждения, где все еще продолжается лечение больных по старинке. В дальнейших исследованиях было выявлено, что монотерапия паклитакселом уступает цисплатину и его комбинациям. Это показано в исследовании GOG132, в котором сравнивались монотерапия паклитакселом 200 мг/м2 (24-часовая инфузия), монотерапия цисплатином 100 мг/м2 и комбинация паклитаксела и цисплатина, аналогичная используемой в исследовании GOG111 (цисплатин 75 мг/м2 и паклитаксел 135 мг/м2 в течение 24 часов).
Оказалось, что химиотерапия паклитакселом в монорежиме сопровождается низкой частотой полных ответов (42%) при сравнении с комбинацией на основе цисплатина и паклитаксела (67%). Медиана ВДП составила 11 мес., тогда как при использовании режимов с цисплатином – 14-16 мес. (р<0,001). При сравнении цисплатина в монорежиме и цисплатина в комбинации с паклитакселом не было отмечено различий [13]. В исследовании ICON3 комбинация паклитаксела и карбоплатина сравнивалась с режимом CAP и монотерапией карбоплатином. При медиане времени наблюдения 51 мес. не было выявлено существенных различий в длительности безрецидивного периода и продолжительности жизни [14].
В таблице 2 кратко представлены результаты вышеизложенных исследований. В трех крупных исследованиях по изучению эффективности комбинации карбоплатина + паклитаксела в сравнении со стандартным цисплатин + паклитаксел было продемонстрировано, что новый режим лечения не уступает по своей эффективности стандартной комбинации, при этом схема с карбоплатином ассоцииро валась с меньшей частотой явлений нефротоксичности и нейротоксичности, но приводила к учащению эпизодов тромбоцитопении. Однако, учитывая удобство в про ведении химиотерапии с использованием карбоплати на, эта схема лечения стала схемой выбора и так называ емым «золотым стандартом» (табл. 3).
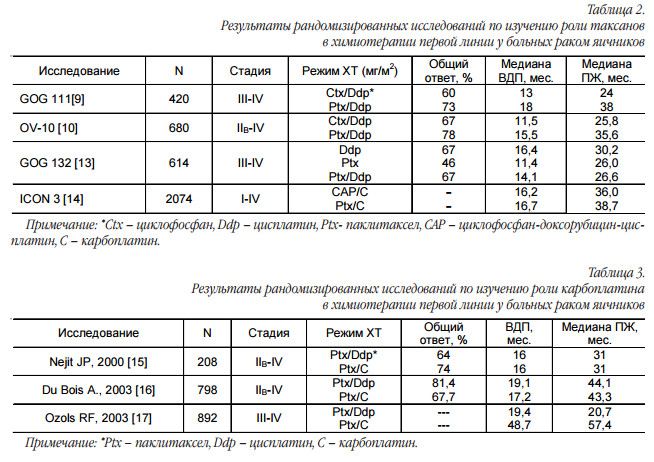
Добавление третьего цитостатика к вышеуказанной платиносодержащей комбинации не дало статистически значимых преимуществ, а только увеличивало токсичность проводимого лечения [18]. Исследования по замене паклитаксела на доцетаксел или пегилированный липосомальный доксорубицин (ПЛД) продемонстрировали схожие результаты в сравнении со стандартом, отличаясь только изменением спектра токсичности.
Таким образом, в настоящий момент стандартом первой линии терапии рака яичников являются препараты платины + паклитаксел. В случае отсутствия паклитаксела возможна его замена на доцетаксел, ПЛД, доксорубицин или проведение лечения монотерапией карбоплатином в дозе AUC7.
Попытки укорочения интервалов между введениями были рассмотрены в нескольких исследованиях. Результаты оказались двоякими, например, в исследовании NOVEL на японской популяции пациенток было достигнуто значительное преимущество как в медиане времени до прогрессирования, так и продолжительности жизни (медиана времени до прогрессирования составила 28,2 против 17,5 мес, р=0,0037; медиана продолжительности жизни 100,5 и 62,2 мес, р=0,039) [19], в то время как в исследованиях на европейской популяции (MITO7), где больным еженедельно вводился и паклитаксел, и карбоплатин, не было получено статистически значимых различий.
Однако, отмечалась лучшая переносимость лечения, поэтому авторы исследования предлагают использовать еженедельные введения для ослабленных больных [20]. В исследовании GOG162, где повторялся режим, используемый в японском исследовании, также не было получено преимуществ от сокращения интервалов между введениями. Для пациентов после оптимальной циторедукции или операции с остаточной опухолью до 1 см может быть предложена внутрибрюшинная химиотерапия. В трех исследованиях по изучению внутрибрюшинной химиотерапии было получено преимущество от внутрибрюшинных введений по сравнению со стандартными внутривенными введениями. При этом при внутрибрюшинных введениях не только цисплатина, но и паклитаксела были достигнуты максимальные цифры продолжи тельности жизни (66 мес.) [21]. Однако известно, что данный вид лечения не перешел в рутинную практику в связи с узкими показаниями, техническими трудностя ми, связанными с установкой катетера интраоперационно в брюшную полость. Помимо этого не найден баланс между токсичностью и эффективностью терапии, например, в исследовании GOG172 только 42% больных смогли получить весь запланированный объем лечения [21].
В настоящий момент проводится несколько исследований по изучению данного метода, которые могут пролить свет на спорные вопросы и найти компромиссное решение. По поводу таргетной терапии вопрос остается открытым. В России зарегистрирован только один препарат в первой линии химиотерапии – бевацизумаб. По данным поданализа исследования ICON7 было показано, что добавление бевацизумаба во время химиотерапии и затем в качестве поддерживающего лечения в течение 1 года позволяет увеличить медиану продолжительности жизни на 9,5 мес. у больных с остаточной опухолью на момент начала химиотерапии (неоперабельные больные, больные с III стадией заболевания после неоптимальной циторедукции и больные с IV стадией заболевания) [22].
Из перспективных агентов направленного действия стоит отметить PARP-ингибиторы. В настоящий момент в большей степени изучен препарат олапариб, где поданализ исследования Lederman с соавторами по поддерживающей терапии олапарибом показал, что эта группа препаратов наиболее эффективна у больных с наследственным раком яичников, а именно мутацией генов BRCA 1/2 [23]. В настоящий момент проводятся исследования III фазы по изучению поддерживающей терапии олапарибом после первой линии терапии и при рецидивах заболевания у больных с мутацией BRCA 1/2.
Системное лечение при рецидивах заболевания
Несмотря на успехи первой линии химиотерапии, в большинстве случаев рано или поздно возникают рецидивы заболевания. Результаты нескольких исследований по изучению непосредственной эффективности препаратов платины в зависимости от сроков начала лечения продемонстрировали, что чем позже возникает рецидив, тем выше частота объективного ответа на препараты платины (табл. 4).
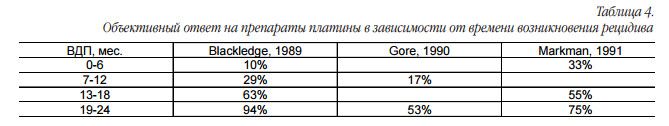
После оценки полученных результатов рецидивы стали носить название в зависимости от времени его наступления и потенциального ответа на препараты платины, а именно платинорезистентный рецидив, если безрецидивный интервал составляет 06 мес. (выделяют также платинорефрактерный рецидив, когда возвращение болезни происходит во время терапии первой линии или в течение 3х недель после последнего курса лечения). Вторая группа рецидивов, с прогностически благоприятным течением, – это платиночувствительные рецидивы, где интервал между окончанием предыдущей линии химиотерапии и появлением болезни составляет 6 месяцев и более.
Выявление рецидива или прогрессирования заболевания, как показывают последние исследования, не все гда является показанием к назначению химиотерапии. В исследовании EORTC 55955, проведенном Rustin G с соавторами, был сделан любопытный для клиницистов вывод [27]. В работе (N=1442) после выявлении маркерного рецидива больные рандомизировались в две группы: в первом случае больных начинали лечить как можно быстрее, во втором – ожидали не только появления очагов болезни (т.е. опухолевого рецидива), но и клинических симптомов заболевания.
В результате оказалось, что различия во времени начала второй линии химиотерапии между двумя исследуемыми группами составили 5,6 мес., а это приблизительно соответствует одной линии химиотерапии. При этом продолжительность жизни в обеих группах оказалась одинаковой и составила 25,7 мес. в группе раннего начала химиотерапии и 27,1 мес. в группе отложенной химиотерапии (р=0,85).
Данная работа принесла большой практический вклад, поскольку в очередной раз было показано, что маркер СА 125 является вспомогательным методом для выявления рецидива. Основным показанием к возобновлению химиотерапии являются симптомы болезни и данные инструментальных методов обследования.
Лечение больных с рецидивом заболевания носит паллиативный характер, поэтому не стоит спешить начинать вторую линию химиотерапии как можно раньше. Беседа с пациенткой с целью объяснения ей преимуществ ожидания начала лечения в удовлетворительном качестве жизни может быть весомым аргументом. Но не для всех пациенток такой подход является оптимальным. На мой взгляд, выявление рецидива на ранней стадии возникновения может быть актуальным в тех случаях, когда возможно выполнить оптимальную циторедуктивную операцию по поводу рецидивной опухоли.
Критерии для выделения данной категории больных еще до конца не определены. В исследованиях DESKTOP I/II было показано, что в 2/3 случаев операция по поводу рецидива была возможна при сочетании трех прогностических факторов: ECOG0, оптимальная первичная циторедуктивная операция и наличие асцита до 500 мл [28]. Таким образом, для больных, у которых отсутствует остаточная опухоль после первой операции по поводу рака яичников, целесообразно наблюдение с целью выявления раннего рецидива для выполнения повторной операции, но не с целью раннего начала химиотерапии.
Платиночувствительный рецидив
Выявление поздних рецидивов является наиболее благоприятным течением заболевания, поскольку в этом случае ответ на препараты платины наблюдается в половине случаев и более. В нескольких крупных исследованиях было показано, что комбинация препаратов платины с неплатиновым агентом эффективнее, чем монотерапия платиной. Напомню, что для выбора терапии в настоящий момент существует три препарата платины: цисплатин, карбоплатин и оксалиплатин. Возможно повторное назначение комбинации платины с таксанами после аналогичной схемы в первой линии лечения. Так же зарекомендовали себя такие схемы лечения, как гемцитабин–карбоплатин, карбоплатин–пегилированный липосомальный доксорубицин, цисплатин–пероральный этопозид и т.д.
Во всех исследованиях по изучению комбинаций с препаратами платины было получено статистически значимое увеличение времени до прогрессирования при отсутствии статистически достоверных различий в продолжительности жизни, за исключением исследования ICON4 (табл. 5).
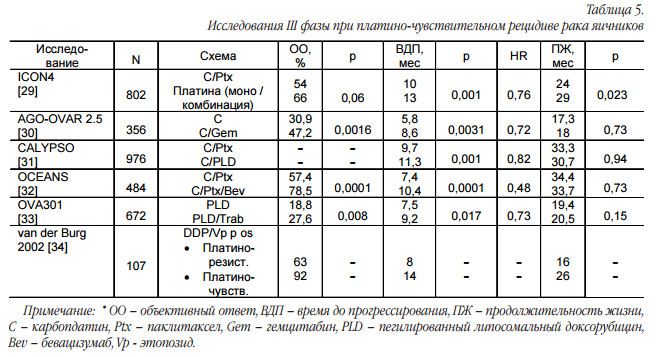
На самом деле выбор схемы лечения во второй линии терапии зависит от сохраняющейся токсичности у пациентки, удобства введения и наличия препарата в лечебном учреждении. Хочу обратить внимание на поданализ исследования ICON4, где несмотря на то, что только 57% больных получали в первой линии химиотерапии таксаны, наибольшую пользу от комбинации платина – паклитаксел во второй линии химиотерапии получают пациенты, у которых рецидив заболевания возник в интервале более 12 мес. (а не 6-12 мес.) и если в первой линии терапии не было таксанов [24].
В исследовании AGOOVAR 2.5 сравнивалась монотерапия карбоплатином с комбинацией карбоплатин – гемцитабин. В работе в 70% случаев больные получали таксаны в первой линии. Схема гемцитабин и карбоплатин была эффективна вне зависимости от времени возникновения рецидива и по необъяснимым обстоятельствам оказалась более эффективной после первой линии терапии с таксанами [30]. Из приведенного выше анализа можно сделать заключение, что при развитии рецидива в интервале 6-12 мес., если пациентка получала комбинацию с таксанами в первой линии терапии, целесообразней назначить схему платина – гемцитабин, а в интервале более 12 мес. можно вернуться к комбинации паклитаксел и препараты платины. При необходимости возможна замена пегилированного липосомального доксорубицина на обычный доксорубицин. В таблице 5 продемонстрированы результаты наиболее крупных исследований, посвященных выбору химиотерапии при платиночувствительном рецидиве.
Платинорезистентный рецидив
Платинорезистентный рецидив является одним из самых неблагоприятных исходов течения заболевания с ожидаемой продолжительностью жизни менее одного года. Основными задачами системного лечения являются контроль симптомов болезни и одновременное сохранение удовлетворительного качества жизни. Платиновые агенты в монотерапии или в комбинации не показали ожидаемого преимущества. Анализ сравнительных исследований по изучению монотерапии неплатиновыми агентами с комбинациями из неплатиновых препаратов продемонстрирован в таблице 6.
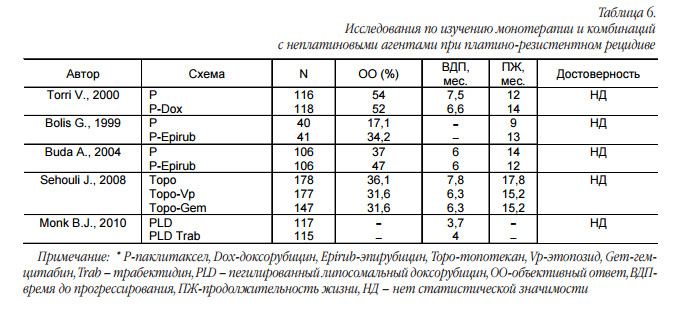
Комбинированная терапия не приводит к улучшению отдаленных результатов, при этом увеличивается выраженность токсических реакций. Сравнительные исследования по изучению монотерапии неплатиновыми агентами между собой показаны в таблице 7.
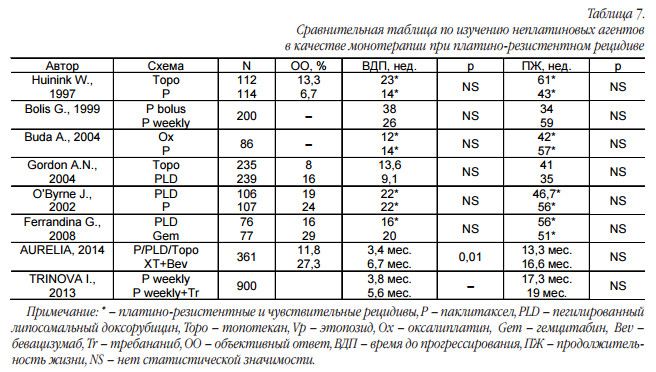
Оказалось, что большинство изученных цитостатиков имеют примерно одинаковую эффективность. В результате стандартом лечения платинорезистентного рака является терапия одним неплатиновым агентом. Выбор цитостатика зависит от сохраняющегося у пациентки спектра токсичности, клинической ситуации и удобства введения препарата. В исследовании AURELIA было показано, что добавление бевацизумаба к монотерапии паклитакселом еженедельно или топотеканом, или пегилированным липосомальным доксорубицином статистически значимо увеличивает медиану времени до прогрессирования в два раза: 3,4 и 6,7 мес. (р=0,001) [35], однако не повлияло на продолжительности жизни больных.
В момент написания этой статьи FDA одобрило результаты исследования AURELIA, и бевацизумаб был включен в стандарты лечения платинорезистентного рака яичников.
Заключение
Наши представления о лечении рака яичников накапливаются постепенно, позволяя вдоволь насладиться обсуждениями последних немногочисленных исследований. Возможности цитостатической терапии достаточно изучены и с успехом используются в рутинной практике. В настоящий момент, в эру «персонализации лечения», мы находимся в стадии неспешного накопления научных знаний об этой сложной болезни, пытаясь найти индивидуальные подходы к терапии.
Агенты направленного действия, которые показали свою эффективность при других нозологиях, в большинстве своем пока терпят неудачи. Сегодня можно обсуждать достижения бевацизумаба и многообещающие данные II фазы по изучению PARP ингибиторов (Олапариб) при наследственном раке яичников с мутациями в генах BRCA 1/2. Активное внедрение молекулярногенетической классификации, а также выделение характерных геномных нарушений, а именно часто наблюдаемых делеций и амплификаций ДНК, позволит на качественноновом уровне понять биологию этой болезни и выделить потенциальные мишени. Уже стало очевидно, что терапия направленного действия, в том понимании, в котором мы привыкли ее видеть, не оправдала наши надежды. Поиск новых подходов к выделению более значимых драйверных генов для характерных молекулярногенетических нарушений может вывести нас к осознанному подбору эффективной терапии направленного действия при распространенном раке яичников.
Источник: Журнал «ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ», Т. 15, №4 – 2014
Литература
- Heintz A., Odicino F., Maisonneuve P. et al. Carcinoma of the Ovary. FIGO 26th Annual Report on the results of treatment in gynecological cancer // Int. J. Gynecol. Obstet. – 2006. – Vol. 95 (Suppl 1). – P. S161–192.
- Colombo N. et al. International Collaborative Ovarian Neoplasm Trial 1: A Randomized Trial of Adjuvant Chemotherapy in Women With EarlyStage Ovarian Cancer // J. Nat. cancer Inst. – 2003. –Vol. 95 (2). – P.126–132.
- Trimbos J.B., Vergote I., Bolis G. et al. Impact of Adjuvant Chemotherapy and Surgical Staging in EarlyStage Ovarian Carcinoma: European Organization for Research and Treatment of Cancer–Adjuvant Chemotherapy in Ovarian Neoplasm Trial // J. Nat. cancer Inst. – 2003. –Vol.95 (2). – P.113–125.
- Trimbos J.B., Parmar M., Vergote I. et al. International Collaborative Ovarian Neoplasm Trial 1 and Adjuvant Chemotherapy In Ovarian Neoplasm Trial: Two Parallel Randomized Phase III Trials of Adjuvant Chemotherapy in Patients With EarlyStage Ovarian Carcinoma // J. Nat. Cancer. Inst. – 2003. –Vol.95 (2). – P.105–112.
- Bell J., Brady M.F., Young R.C. et al. Randomized phase III trial of three versus six cycles of adjuvant carboplatin and paclitaxel in early stage epithelial ovarian carcinoma: A Gynecologic Oncology Group study // Gynecol. Oncol. – 2006. – Vol.102. – P.432–439.
- Greene M.H., Boice J.D., Greer B.E. et al. Acute nonlymphocytic leukemia after therapy with alkylating agents for ovarian cancer: a study of five randomized clinical trials // New Engl. J. Med. – 1982. – Vol.307(23). – P.1416–1421.
- Omura G.A., Bundy B.N., Berek J.S. et al. Randomized trial of cyclophosphamide plus cisplatin with or without doxorubicin in ovarian carcinoma: a gynecologic oncology group study // J. Clin. Oncol. – 1989. – Vol.7(4). – P.65–457.
- Mangioni С., Colombo N., Bolis G. et al. LongTerm Results of a Randomized Trial Comparing Cisplatin with Cisplatin and Cyclophosphamide with Cisplatin, Cyclophosphamide, and Adriamycin in Advanced Ovarian Cancer // Gynecol. Oncol. – 1992. – Vol.45. – P.115–117.
- McGuire W.P., Hoskins W.J., Brady M.F. et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer // N. Engl. J. Med. – 1996. – Vol.334. – P.1–6.
- Piccart M.J., Bertelsen K., James K. et al. Randomized intergroup trial of cisplatinpaclitaxel versus cisplatincyclophosphamide in women with advanced epithelial ovarian cancer: threeyear results // J. Nat. Cancer Inst. – 2000. – Vol.92. – P.699–708.
- McGuire W.P., Ozols R.F. Chemotherapy of advanced ovarian cancer // Semin. Oncol. – 1998. – Vol.25 (3). – P.340–348.
- SmithSorensen B., Kaern J., Holm R. et al. Therapy effect of either paclitaxel or cyclophosphamide combination treatment in patients with epithelial ovarian cancer and relation to TP53 gene status // BJC. – 1998. – Vol.78(3). – P.375–381.
- Muggia F.M., Braly P.S., Brady M.F. et al. Phase III randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage II or IV ovarian cancer: a gynecologic oncology group study // J. Clin. Oncol. – 2000. – Vol.18. – P.15–16.
- The International Collaborative Ovarian Neoplasm (ICON) Group. Paclitaxel plus carboplatin versus standard chemotherapy with either singleagent carboplatin or cyclophosphamide, doxorubicin, and cisplatin in women with ovarian cancer: the ICON3 randomized trial // Lancet. – 2002. – Vol.360. – P.505–515.
- Neijt J.P., Engelholm S.A., Tuxen M.K. et al. Exploratory phase III study of paclitaxel and cisplatin vs paclitaxel and carboplatin in advanced ovarian cancer // J. Clin. Oncol. – 2000. – Vol.18. – P.3084–3092.
- du Bois A., Luck H.J., Meier W. et al. A randomized clinical trial of cisplatin/paclitaxel versus carboplatin/paclitaxel as firstline treatment of ovarian cancer // J. Natl. Canc. Inst. – 2003. – Vol.95. – P.1320–1329. А.С. Тюляндина Practical oncology ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ • Т. 15, №4 – 2014 175
- Ozols R.F., Bundy B.N., Greer B.E. et al. Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer: a Gynecologic Oncology Group study // J. Clin. Oncol. – 2003. – Vol.21. – P.3194–3200.
- Copeland L., Bookman M., Trimble E. et al. Clinical trials of newer regimens for treating ovarian cancer: the rationale for Gynecologic Oncology Group Protocol GOG 182ICON5 // Gyn. Oncol. – 2003. – Vol. 90. –P. S1–S7.
- Katsumata N., Yasuda M., Isonishi S. et al. Longterm results of dosedense paclitaxel and carboplatin versus conventional paclitaxel and carboplatin for treatment of advanced epithelial ovarian, fallopian tube, or primary peritoneal cancer (JGOG 3016): a randomised, controlled, openlabel trial // Lancet Oncol. – 2013. – Vol.14. – P.1020–1026.
- Pignata S., Scambia G., Lauria R. et al. A randomized multicenter phase III study comparing weekly versus every 3 week carboplatin plus paclitaxel in patients with advanced ovarian cancer: multicentre Italian trial on ovarian cancer (MITO7) – European Network of Gynecological Oncological Trial Group (ENGOTov10) – Gynecologic Cancer InterGroup (GCIG) trial // J. Clin. Oncol. – 2013. – Vol.31 (suppl; abstr LBA 5501).
- Armstrong D. Phase III randomized trial of intravenous cisplatin and paclitaxel versus an intensive regimen of intravenous paclitaxel, intraperitoneal cisplatin, and intraperitoneal paclitaxel in stage III ovarian cancer: a Gynecologic Oncology Group study / D. Armstrong, B. Bundy, L. Wenzel et al. // N. Engl. J. Med. – 2006. – Vol.354. – P.34–43.
- Oza A.M., Perren T.J., Swart A.M. et al. ICON7: Final overall survival results in the GCIG phase III randomized trial of bevacizumab in women with newly diagnosed ovarian cancer // Eur. Journal of Cancer. – 2013. – Vol.49(Suppl 3). – LBA6.
- Lederman J.A., Harter P., Gourley C. et al. Olaparib maintenance therapy in patients with platinumsensitive relapsed serous ovarian cancer and a BRCA mutation // J. Clin. Oncol. – 2013. – Vol.31.(suppl; abstr 5505).
- Blackledge G., Lawton F., Redman C. et al. Response of patients in phase II studies of chemotherapy in ovarian cancer: implications for patient treatment and the design of phase II trials // Br. J. Cancer. – 1989. – Vol.59(4). – P.650–653.
- Gore M.E., Fryatt I., Wiltshaw E. et al. Treatment of relapsed carcinoma of the ovary with cisplatin or carboplatin following initial treatment with these compounds // Gynecol. Oncol. – 1990. – Vol.36(2). – P.207–211.
- Markman M., Rothman R., Hakes T. et al. Secondline platinum therapy in patients with ovarian cancer previously treated with cisplatin // J. Clin. Oncol. – 1991. – Vol.9(3). – P. 389–393.
- Rustin G., van der Burg M., Griffin C. et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomised trial // Lancet. – 2010. – Vol.376. – P.1155–1163.
- Harter P., du Bois A., Hahmann M. et al. Surgery in Recurrent Ovarian Cancer: The Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR Trial // Ann. Surg. Oncol. – 2006. – Vol.13(12). – P.1702–1710.
- ICON 4 trial group Paclitaxel plus platinumbased chemotherapy versus conventional platinumbased chemotherapy in women with relapsed ovarian cancer: the ICON4/AGOOVAR2.2 trial // Lancet. – 2003. – Vol.361. – P. 2099–2106.
- Pfisterer J., Plante M., Vergote I. et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinumsensitive recurrent ovarian cancer: an intergroup trial of the AGOOVAR, the NCIC CTG, and the EORTC GCG // J. Clin. Oncol. – 2006. – Vol.24. – P.4699–4707.
- Wagner U., Marth C., Largiller R. et al. Final overall survival results of phase III GCIG CALYPSO trial of pegylated liposomal doxorubicin and carboplatin vs paclitaxel and paclitaxel and carboplatin in platinumsensitive ovarian cancer patients // Brit. J. Cancer. – 2012. – Vol.107. – P. S88–91.
- Aghajanian C., Blank S.V., Goff B.A. et al. OCEANS: A Randomized, DoubleBlind, PlaceboControlled Phase III Trial of Chemotherapy With or Without Bevacizumab in Patients With PlatinumSensitive Recurrent Epithelial Ovarian, Primary Peritoneal, or Fallopian Tube Cancer // J. Clin. Oncol. – 2012. – Vol.23 (Suppl. 9). – Abstr.9670
- Monk B., Herzog T.J., Kaye S. et al. Trabectidin plus pegylated liposomal doxorubicin in recurrent ovarian cancer // J. Clin. Oncol. – 2010. – Vol.28 (19). – P.3107–3114.
- van der Burg M., de Wit R., van Putten W.L.J. et al. Weekly cisplatin and daily oral etoposide is high effecrive in platinum pretreated ovarian cancer // Brit. J. Cancer. – 2002. – Vol.86. – P.19–25.
- PujadeLauraine E., Hilpert F., Weber B. et al. Bevacizumab Combined With Chemotherapy for PlatinumResistant Recurrent Ovarian Cancer: The AURELIA Open Label Randomized Phase III Trial // J. Clin. Oncol. – 2014. – Vol.32 (13). – P.1302–1308.
- Monk B.J., Poveda A., Vergote I. et al. A phase 3, randomized, doubleblind trial of weekly paclitaxel plus trebananib or placebo in women with recurrent ovarian cancer: TRINOVA1 // Int. J. Gynecol. Cancer. – 2013. – Vol. 23(8), Suppl.1. – P.48.







Комментировать