Институт ПАГ АМН Украины
Авторы: д.м.н., профессор Татарчук Т.Ф.,
к.м.н., в.н.с. Косей Н.В.
Среди доминирующих причин, которые приводят к утрате детородной функции и снижению трудоспособ- ности женщин фертильного возраста, выделяется ми- ома матки (лейомиома, фибромиома) – самая распро- страненная доброкачественная опухоль, занимающая одно из ведущих мест в структуре гинекологических за- болеваний [13, 17, 18, 25]. Частота данной патологии, по данным различных авторов, у женщин старше 35 лет со- ставляет 30–50%, при профилактических осмотрах мио- ма выявляется впервые у 5-10% обследуемых женщин.[3, 10, 13]. Пик частоты встречаемости лейомиомы мат- ки наблюдается в перименопаузальном возрасте – бо- лее 50% с тенденцией к снижению в постменопаузе [1]. Однако это лишь видимая часть “айсберга”, реальная ча- стота опухоли значительно выше. При изучении мор- фологических срезов маток, удаленных по различным причинам, лейомиоматозные узелки были обнаружены в — 77-85% случаев, при этом множественные лейоми- омы отмечались в 84% [20, 25].
В последние годы отмечается тенденция к росту заболеваемости миомой матки, особенно среди женщин мо- лодого возраста [3, 7, 18, 22]. Лейомиома матки часто со- четается с другими дисгормональными гиперпролифе- ративными заболеваниями, в первую очередь – с патоло- гией молочной железы (по нашим данным, около 86%), щитовидной железы — около 48%, а также печени, ЖКТ и другой экстрагенитальной патологией. Риск возникнове- ния лейомиомы повышен при ожирении — с каждыми 10 кг лишнего веса вероятность возникновения ее увеличи- вается на 21%. Доказано наличие наследственной пред- расположенности к лейомиоме матки, зависимости ри- ска возникновения ее от числа беременностей и родов (выше у нерожавших). Отмечена более высокая часто- та миомы у женщин — представительниц черной расы. Имеются единичные сообщения о снижении риска раз- вития данной патологии у курящих женщин [18].
В последние десятилетия произошел качественный скачок в изучении патогенеза лейомиомы матки. Новые методы исследования и улучшение технической осна- щенности позволили существенно расширить представ- ления о факторах риска и механизмах развития опухоли. Успехи фундаментальных наук в изучении данной патоло- гии, а также развитие новых технологий обосновывают необходимость пересмотра и обобщения накопленного опыта ее лечения, оптимизации схем и методов терапии.
Предложено несколько классификаций лейомиомы матки.
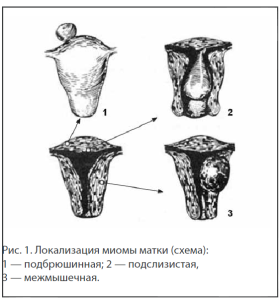
Классификация миом матки (лейомиом) по их лока- лизации [1]:
• подбрюшинные (субсерозные);
• подслизистые (субмукозные);
• межмышечные (интрамуральные).
Рост опухоли может быть:
• центрипетальным (внутрь),
• экспансивным (раздвижение ткани),
• центрифугальным (наружу),
• интралигаментарным (в листках широкой связки)
Имеются атипичные формы:
• позадишеечная,
• предшеечная,
• забрюшинная,
• надбрюшинная,
• парацервикальная,
• межсвязочная.
Предложена классификация, учитывающая размеры, локализацию и количество миоматозных узлов [18], основанная на клинических и ультразвуковых данных:
Тип І — один или множественные мелкие интрамуральные или субсерозные узлы (<3 см). Отсутствие субмукозных узлов.
Тип ІІ — один или множественные интрамуральные или субсерозные узлы (3-6 см). Отсутствие субмукозных узлов.
Тип ІІІ — один или множественные интрамуральные или субсерозные узлы (>6 см). Отсутствие субмукозных узлов.
Тип ІV — один или множественные интрамуральные или субсерозные узлы. Подозрение или наличие доказанного субмукозного узла.
Согласно классификации Европейской Ассоциации Гинекологов-эндоскопистов имеется 3 типа субмукозной лейомимомы матки по степени деформации ее полости:
• 0 тип — полностью подслизистый узел, не проникающий в миометрий,
• I тип — менее 50% узла проникает в миометрий,
• II тип — более 50% его пенетрирует в миометрий [27].
Согласно МРТ — классификации выделяют еще четвертый тип субмукозной лейомиомы (тип ІІІ) – в случаях отсутствия слоя миометрия между тканями узла опухоли и эндометрием [27].
Выделяют также 2 клинических варианта течения лейомиомы — простую и пролиферирующую.
Лечение лейомиомы должно быть индивидуализированным и комплексным.
В последние десятилетия произошло кардинальное изменение тактики ведения пациенток с лейомиомой матки.
Во-первых, выжидательная тактика сменилась на раннюю активную. Так, до второй половины 20-го века лечение лейомиомы матки было исключительно хирургическим, и данная патология рассматривалась лишь с точки зрения наличия или отсутствия показаний к оперативному лечению. При отсутствии таковых миому просто наблюдали до периода, пока не появится необходимость хирургического вмешательства. На сегодня выжидательная тактика окончательно признана неправильной. Лейомиому матки необходимо начинать лечить с момента ее диагностики. Целью лечения при обнаружении миомы на ранних стадиях должна быть стабилизация размеров опухоли и профилактика дальнейшего роста.
Во—вторых, происходит все более широкое внедрение органосохраняющих технологий на фоне постепенного уменьшения удельного веса радикальных методов лечения миомы. Расширению возможностей органосохраняющей терапии способствовало создание новых и совершенствование существовавших ранее терапевтических и оперативных методик: препаратов фармакотерапии, способов визуализации опухоли, эндоскопичекой аппаратуры, методов предоперационной подготовки (неинвазивных и инвазивных), видов хирургической энергии, шовных материалов, а также методов реабилитации. В настоящее время все большее число пациенток с миомой отказываются от гистеректомии и настаивают на сохранении матки. В связи с этим выделена целая категория «вмешательств, альтернативных гистеректомии».
Началом эры консервативного лечения лейомиомы матки считается 1966 год, когда Goldzieger впервые использовал с этой целью синтетический прогестерон — мегестрола ацетат. С этого времени развитие методов терапии данной патологии шло в двух направлениях — консервативное и хирургическое.
Исходя из современных взглядов на патогенез лейомиомы, можно сформировать основные принципы ее лечения [13].
1. Все виды воздействия на функцию яичника, снижающие продукцию в первую очередь эстрадиола, являются высокофункциональными, патогенетически обоснованными методами лечения миомы матки.
2. Изъятие «посторонних (аномальных) гормонозависимых» масс (узлов миомы, гиперплазии эндометрия) из матки разрывает порочный круг «стимуляции потреблением», резко снижает интенсивность локальной гипергормонемии матки и ведет к инволюции гипертрофированного миометрия.
Принципы старых школ о «рациональном радикализме» и «разумном консервативизме» вмешательств при миоме матки остаются в силе до наших дней, и реализация их в современной медицине в значительной степени зависит от эрудиции, опыта и технической оснащенности врача [13].
Показания к консервативной терапии лейомиомы матки:
1. Лейомиома у женщины, желающей сохранить репродуктивную функцию.
2. Клинически малосимптомное течение заболевания.
3. Миома матки, не превышающая размеров 13-14 недель беременности.
4. Интерстициальное или субсерозное (на широком основании) расположение узлов.
5. Миома, сопровождающаяся экстрагенитальными заболеваниями с высоким анестезиологическим и хирургическим риском.
6. Консервативное лечение как подготовительный этап к операции или реабилитационный — в послеоперационном периоде.
В консервативном лечении фибромиомы можно выделить два направления:
первое включает в себя разработку способов снижения уровня локальной гормонемии матки за счет снижения выработки гормонов в яичниках до какихто критических уровней, при которых не развиваются процессы гиперплазии и гипертрофии миоцитов (например, применение агонистов гонадотропин-рилизинггормонов — аГн-РГ),
второе связано с разработкой способов блокирования уже функционирующих аномальных зон роста (например, длительное применение в обе фазы небольших доз прогестагенов снижает уровень гормонов в локальном кровотоке матки, в основном, за счет ликвидации «эндометриального» компонента гормонемии); а также снижение чувствительности тканей опухоли к воздействию эстрогенов — применение «ударных» доз прогестерона, влияющее на синтез специфических рецепторов в тканях опухоли [13].
Профилактическое направление связано с профилактикой гиперэстрогенных состояний — своевременная коррекция нарушений менструального цикла, ановуляции, диагностика и лечение гиперплазии эндометрия как эстрадиолпотребляющего субстрата, стимулирующего локальную гиперэстрогению.
Учитывая полиэтилогичность заболевания, в состав комплексной терапии лейомиомы матки должны входить витамины, антиоксиданты, адаптогены, иммунокорректоры и вазоактивные препараты, своевременное лечение воспалительных процессов с включением антибактериальной терапии в зависимости от их этиологии. Большое значение следует уделять антистрессовой терапии с целью нормализации психологического статуса и стабилизации состояния ЦНС [2, 14, 15].
Основой консервативного лечения миомы является гормональная терапия. Традиционно медикаментозное лечение миомы основывалось на принципе создания абсолютной или относительной гипоэстрогении. В течение длительного времени основным, хотя и часто недостаточно эффективным средством гормональной терапии симптомной лейомиомы был прогестерон.
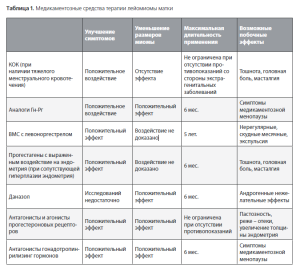
Лечебное действие гестагенов (табл.1), возможно, связано с тем, что развитие лейомиомы матки происходит на фоне нарушения эстрогенной регуляции, характерной для нормальной ткани миометрия, и повышением чувствительности лейомиомы к эстрогенам [14, 33,35]. В свою очередь, высокие концентрации эстрадиола стимулируют высокий уровень экспресии рецепторов к прогестерону. Прогестагены же, нивелируя состояние относительной гиперэстрогении, угнетают чувствительность рецепторов эндои миометрия к эстрогенам. Кроме того, оказывая прямое эндометрийсупрессивное действие, препараты данной группы подавляют развитие гиперпластических процессов эндометрия как эстрадиолпотребляющего субстрата, по принципу обратной святи блокируют гонадотропную функцию гипофиза и угнетают синтез стероидных гормонов яичниками [28]. Стимулируя синтез белка, связывающего инсулиноподобный фактор роста-1 (ИПФР-1), способствуют уменьшению количества свободного ИПФР-1 в тканях [30]. Высокие дозы гестагенов блокируют процессы гиперплазии и гипертрофии миогенных элементов миомы матки и усиливают дегенеративно-дистрофические процессы в клетке фиброматозного узла.
Однако монотерапия гестагенами не всегда была успешной, и в последующих исследованиях было показано, что длительное лечение гестагенами не имеет смысла, так как часто по окончании его все равно приходится прибегать к хирургическому вмешательству [33, 35]. В 1993 году Smith и соавт. предположили, что прогестерон может быть важным фактором, участвующим в росте миомы, что впоследствии и было доказано рядом исследований. Гестагены назначают больным репродуктивного и пременопаузального возраста при сочетании лейомиомы с гиперпластическими процессами эндометрия или эндометриозом.
С целью предотвращения системных эффектов гестагенов применяется локальная гормонотерапия, которая первоначально была предложена с целью контрацепции и впоследствии стала применяться для лечения лейомиомы матки [17, 22, 40]. Местное применение гормонов патогенетически обосновано в связи с наличием локальной гиперэстрадиолемии при миоме [15,20]. Применяются внутриматочные системы (ВМС), высвобождающие в полость матки гестагены, в частности ВМС типа «Мирена» с высвобождением локально 20 мкг левоноргестрела в сутки. Левоноргестрел обладает выраженным эндометрийсупрессивным действием, подавляет продукцию простагландинов и эстрогенов в эндометрии, угнетает экспрессию рецепторов к эстрогенам и прогестерону, стимулирует продукцию протеина, связывающего инсулиноподобный фактор роста-І (ИПФР-І), снижая пролиферативную активность данного фактора роста [22, 30, 40]. Наш опыт показывает, что внутриматочная система с левоноргестрелом является удобным, эффективным (эффективность при геморрагическом синдроме составляет около 80%) и обратимым нехирургическим методом лечения лейомиомы небольших размеров (до 2,5 см в диаметре) с минимальными системными эффектами. При использовании низкодозированных ВМС побочные эффекты в виде акне, изменения настроения, головной боли, масталгии, тошноты, гирсутизма встречаются редко. Однако применение лишь ВМС с гестагенами также существенно не влияет на размеры матки и противопоказано при наличии патологии полости матки (субмукозного узла, полипа эндометрия) [30, 40].
Применение оральных контрацептивов эффективно в отношении устранения симптомов опухоли, особенно при менои метроррагии (при исключении субмукозной локализации узла), однако не оказывает существенного влияния на размеры матки, и иногда вызывает побочные реакции в виде тошноты, головной боли и масталгии. При длительной терапии препаратами данной группы требуется тщательный мониторинг системы гемостаза (см.табл.1). Длительное применение низкодозированных ОК, содержащих гестагены третьего поколения при небольших размерах миомы (до 2 см) может способствовать стабилизации ее размеров, однако такой эффект наблюдается не всегда [17,29, 30, 35].
Следующим этапом в развитии гормональной терапии лейомиомы матки было предложение использования антиэстрогенов [18, 20]. Будучи подобными по структуре с эстрогенами, препараты данной группы на основе конкурентных взаимоотношений соединяются с их рецепторами, однако возможно также и их тканеспецифическое действие. Экспериментальными рандомизированными исследованиями возможностей использования блокаторов эстрогеновых рецепторов (ЭР) — тамоксифена и ролаксифена, доказано положительное влияние этих препаратов на течение лейомиомы матки. Так, было продемонстрировано, что тамоксифен на 40-50% снижает менструальную кровопотерю, однако не влияет на размеры опухоли, в то время как ралоксифен способствует уменьшению как симптомов, так и размеров лейомиомы [30, 38]. Ралоксифен проявляет эстрогеноподобное действие на состояние костной и липидной систем, предотвращая потерю костной массы и гиперхолестеринемию, в то время как на матку и молочную железу действует как антагонист эстрогенов.
Учитывая возможные побочные эффекты в виде гиперплазии эндометрия, применение тамоксифена у женщин с лейомиомой матки не рекомендуется, в то время как селективный блокатор ЭР не сопровождается упомянутыми осложнениями. Селективные модуляторы ЭР могут быть рекомендованы к применению в сочетании с агонистами Гн-РГ с целью нивелирования их гипоэстрогенного действия на костную и сердечнососудистую системы. Чистые антиэстрогены (фульвестрант) в ходе предварительных исследований также продемонстрировали супрессивное воздействие препарата на эндометрий и миометрий на фоне отсутствия выраженного центрального воздействия [36].
В последние десятилетия (с 1993 г.) появились сообщения о применении с целью лечения миомы препаратов с антипрогестероновым действием, в частности, мифепристона (RU 486) [18, 28]. Механизм действия этого препарата связан с его высоким сродством к прогестероновым и глюкокортикоидным рецепторам, благодаря которому препарат конкурентно вытесняет прогестерон. Под действием мифепристона происходит также снижение повышенного в миоме (по сравнению с нормальным миометрием) количества прогестероновых рецепторов [17, 28, 38]. Установлено, что в отсутствие прогестерона RU 486 может проявлять прогестиноподобное действие — угнетать фолликулогенез, отсрочивать или предотвращать естественную овуляцию. Кроме того, выявлено его угнетающее влияние на содержание в ткани опухоли эпидермального фактора роста и секрецию в ней пролактина. Наиболее изученным эффектом мифепристона является антиглюкокортикоидное действие, что может оказывать положительное действие, учитывая участие стрессогенной стимуляции функции коры надпочечников в патогенезе миомы матки. Под действием мифепристона происходит регрессия размеров опухоли, аналогичная применению агонистов Гн-РГ, однако преимуществом RU 486 является то, что он поддерживает достаточный уровень эстрогенов, предотвращая развитие осложнений со стороны костной, сердечно-сосудистой и центральной нервной систем [28]. Среди препаратов с антипрогестероновым влиянием выделяют антагонисты и агонисты прогестероновых рецепторов. В настоящее время разрабатываются селективне антагонисты прогестероновых рецепторов, лишенные минералокортикоидного побочного действия. В нашей клинике также имеется положительный опыт применения антагонистов прогестерона у женщин с миомой матки с уменьшением размеров миомы на 32% в течение 3 месяцев.
Проводятся клинические испытания модулятора прогестероновых рецепторов с частично агонистическим и частично – антагонистическим влиянием – азопризнила, который способен вызывать дозозависимое уменьшение объема миомы [28, 29]. Азопризнил демонстрирует высокий уровень маточной селективности и проявляет антипролиферативное действие как на ткань лейомиомы, так и на эндометрий, а также на пролиферацию эпителия молочной железы на фоне нормальной концентрации эстрадиола в сыворотке крови. Такие характеристики дают основания считать, что препарат может применяться длительно, учитывая отсутствие гипоэстрогенных побочных эффектов и повышенного риска развития гиперпролиферативных процессов.
Учитывая повышенную активность цитохрома 450 в тканях лейомиомы матки, одним из перспективных направлений может быть использование ингибиторов ароматаз, и единичные сообщения в литературе указывают на уменьшение на 40-50% величины опухоли при применении препаратов данной группы [30]. Однако довольно выраженные побочные эффекты в виде приступов жара, арталгий, миалгий, снижения плотности костной ткани и др. ограничивают приемлемость и длительность применения данных медикаментозных средств.
С целью лечения лейомиомы матки рекомендуют также применение антигонадотропинов, подавляющих продукцию гипофизом гонадотропных гормонов — путем опосредованного воздействия через гипоталамус. Вследствие этого антигонадотропины угнетают активность яичников, тормозят овуляцию, вызывают атрофию эндометрия и способствуют уменьшению миомы. Являясь производными тестостерона, препараты данной группы оказывают разнонаправленное антигормональное действие. Представителем данной группы является даназол, который почти не оказывает эстрогенного и гестагенного действия, однако обладая сродством к рецепторам андрогенов и глюкокортикоидов, в высоких дозах обладает слабой андрогенной активностью с сопутствующим анаболическим эффектом. Даназол взаимодействует с энзимами, участвующими в процесах синтеза стероидных гормонов в яичниках и надпочечниках, а также угнетает синтез сексстероидсвязывающего глобулина, способствуя повышению концентрации свободного тестостерона в сыворотке крови. Это усиливает андрогенные побочные эффекты препарата. По мнению некоторых авторов, даназол в дозе 400 мг в день в непрерывном режиме в течение 4-6 месяцев – достаточно эффективный метод лечения симптомной лейомиомы матки [3, 18]. Однако вследствие выраженного андрогенного воздействия применение данного препарата ограничено.
В литературе имеются данные о высоком терапевтическом эффекте применения еще одного представителя данной группы препаратов — гестринона (R-2323) с коммерческим названием Неместран (Hoechst-MarionRoussel), обладающего антигестагенным, антиэстрогенным, антигонадотропным и антиандрогенным действием. Неместран приводит к созданию обратимой псевдоменопаузы, или “гипофизарного гипогонадизма”, а также обладает прямым подавляющим действием на эндометрий [3, 15, 16].
Андрогены и их производные для лечения миомы в связи с наличием побочных эффектов в виде вирилизации и гипертрихоза в настоящее время практически не применяются.
Учитывая, что рост лейомиомы может стимулироваться и эстрогенами, и прогестероном, наиболее надежным и эффективным в ее лечении являются препараты, подавляющие синтез половых стероидов (как эстрогенов, так и прогестерона).
Наиболее распространенным методом блокады синтеза стероидных гормонов яичников является создание временной медикаментозной менопаузы с применением агонистов гонадотропин-рилизинг гормонов (аГНРг) – диферелина, бусерина, золадекса и др [5, 15].
Блокируя продукцию гонадотропных гормонов гипофиза, препараты данной группы тормозят синтез эстрогенов и прогестерона в яичниках, создавая состояние управляемой гипогормонемии [5, 18, 20]. На фоне эстроген и прогестеронового дефицита происходит уменьшение размеров опухоли и редукция маточного кровотока, что приводит к исчезновению или уменьшению степени выраженности ее симптомов. Однако механизм действия этих препаратов не ограничивается созданием обратимой медикаментозной менопаузы. Агонисты Гн-РГ также угнетают синтез факторов роста (особенно ИПФР-1, эпидермального фактора роста), уменьшают захват тимидина миоцитами, блокируя чувствительность опухоли к эстрогенам и угнетая клеточную пролиферацию, а также снижают активность ароматазных систем, блокируя локальный синтез эстрогенов [18, 21].
При назначении агонистов гонадотрофы гипофиза отвечают двухфазно. Первая фаза — короткая стимулирующая фаза с выбросом гонадотропинов и яичниковой стимуляцией (длится 3-10 дней, называется эффектом “вспышки”). В этот период клинически может наблюдаться усиление маточных кровотечений, болевого синдрома и других проявлений миомы в зависимости от локализации узлов. Затем следует фаза торможения: гипофиз больше не отвечает на Гн-РГ, возникает гипогонадотропный гипогонадизм — концентрация эстрадиола плазмы при этом аналогична менопаузальным (20пг/мл). Эта фаза важна для клинического применения агонистов [5, 21, 23].
Агонисты Гн-РГ классически рекомендуют назначать на 5-й день менструального цикла с целью исключения наличия раннего срока беременности. Однако для уменьшения выраженности симптомов “вспышки” некоторые исследователи [5] предлагают вводить их во вторую фазу менструального цикла или назначать параллельно гестагенные препараты. Эффективность такой профилактики синдрома “вспышки” подтверждена и результатами, полученными в нашей клинике.
Препараты данной группы (см. Таб. 1) высокоэффективны в отношении купирования симптомов миомы (прекращение кровотечений, уменьшение степени выраженности болевого синдрома), при этом отмечается уменьшение размеров лейомиомы на 30-50%. Однако применение агонистов Гн-Рг ограничено побочными эстрогендефицитными эффектами, такими как вегетососудистые и психопатологические нарушения, а при длительном применении – и метаболические, такие как трофические расстройства, остеопения и остеопороз. Поэтому применение препаратов данной группы длительностью более 3-5 мес. не рекомендуется. В нашей практике при назначении до 3-х инъекций аГн-РГ частота гипоэстрогенных расстройств не превышает 15%. С целью уменьшения вышеперечисленных осложнений медикаментозной менопаузы можно назначать фитоэстрогены, препараты ЗГТ, симптоматическую терапию (так называемая add-back терапия) [5, 21].
Однако из-за обратимости гипогормональных эффектов в качестве монотерапии данная группа препаратов может применяться только у пациенток в перименопаузе с целью достижения меностаза. Более широкое применение она находит в составе комбинированных методов лечения лейомиомы матки для достижения определенной цели (уменьшения степени выраженности или прекращения кровотечений, болевого синдрома, купирования анемии, симптомов сдавления смежных органов), особенно в качестве предоперационной подготовки в сочетании с эндоскопической хирургией или консервативной миомэктомией.
В настоящее время ведутся разработки третьего поколения антагонистов Гн-РГ. Блокируя непосредственно рецепторы на мембране гонадотропных клеток, антагонисты Гн-РГ индуцируют немедленную выраженную супрессию секреции гонадотропинов гипофиза, что приводит к быстрой индукции гипогонадотропного гипогонадизма. Благодаря классическому рецепторному антагонизму, блокирующему выброс ЛГ и ФСГ, отсутствует фаза первоначальной стимуляции секреции гонадотропинов в ответ на их введение, что приводит к немедленному прекращению гонадного стероидогенеза [23].
В качестве ингибиторов ангиогенеза через фактор роста фибробластов может выступать интерферон-α, и единичные литературные источники указывают на положительное влияние интерферонотерапии на размеры лейомиомы [10].
В литературе также встречаются немногочисленные указания на попытки использования антифибротических препаратов, в частности, пирфенидона, угнетающего синтез коллагенов І и ІІІ типов. Однако данных относительно перспектив практического использования препаратов с антифибротическим действием на сегодня недостаточно [30,38].
Несмотря на развитие консервативной терапии, в современной гинекологии не теряет своего значения, и даже все более совершенствуется хирургическое лечение миомы. Развитие современной медицины и рост состояния технической оснащенности представляет большое разнообразие методов, из которых современный врач должен уметь выбрать наиболее подходящий каждой конкретной пациентке.
В последние десятилетия происходит поворот от “консервативно-вы-жидательной тактики” терапевтических доктрин 60-80-х годов к “активно-выжидательной”. При этом основной задачей врача становится не желание довести больную с лейомиомой до менопаузы любым способом, а осуществить своевременное вмешательство, направленное не только на нивелировку симптомов опухоли, а, что более важно — на остановку ее роста, восстановление качества жизни и фертильности [13, 36].
До конца ХХ столетия “золотым стандартом” в лечении лейомиомы матки в мире была, а в Украине продолжает оставаться по настоящее время гистерэктомия. Последняя, хотя и является надежным и относительно безопасным методом лечения симптомов миомы матки, однако неминуемо ведет к утрате репродуктивной функции, наносит женщине физическую и пcихологическую травму и усугубляет нарушения гомеостаза, уже имеющиеся в организме женщины с лейомиомой матки [3, 8].
Учитывая мировую тенденцию последних десятилетий к “омоложению” данной патологии, а также к рождению детей женщинами в более старшем репродуктивном возрасте с одной стороны, и расширение возрастных рамок фертильного периода благодаря развитию новых репродуктивных технологий — с другой, современным подходом к лечению лейомиомы матки следует считать развитие и внедрение органосохраняющих методов ее лечения.
При выборе метода оперативного лечения важно соблюдать принцип минимизации хирургической травмы, который сегодня может быть успешно осуществлен при применении лапароскопических, миниинвазивных эндоваскулярных или комбинированных технологий.
Показания к хирургическому лечению лейомиомы матки [14]:
1. Симптомная лейомиома (с геморрагическим и болевым синдромом, наличием анемии, симптомов сдавления смежных органов).
2. Величина миомы 13-14 недель и более.
3. Наличие субмукозного узла.
4. Наличие субсерозного узла миомы на тонкой ножке (в связи с опасностью перекрута).
5. Быстрый рост (на 4-5 недель в год и более) или резистентность к терапии аГн-РГ.
6. Лейомиома в сочетании с предопухолевой патологией эндометрия или яичников.
7. Бесплодие вследствие миомы матки.
8. Наличие сопутствующей патологии придатков. Радикальным методом хирургического лечения лейомиомы матки является гистеректомия, которая может проводиться абдоминальным или вагинальным путем.
За последние годы в мире количество вагинальных гистерэктомий (ВГ) возросло на 11%, однако пока в общем количестве экстирпаций преобладает абдоминальный путь в соотношении 3:1 [20, 22, 25]. Некоторые авторы считают, что абдоминальная гистерэктомия (АГ) более предпочтительна в случаях наличия сопутствующих заболеваний придатков или подозрения на злокачественное перерождение, необходимости визуального осмотра органов малого таза и брюшной полости, а в остальных случаях гистерэктомия должна производиться вагинальным путем [3, 4, 26, 36].
При выборе метода играет немаловажную роль фактор опытности хирурга. На сегодняшний день оперирующий гинеколог выбирает тот метод, который предпочитает, и выполнение которого максимально снижает риск инвалидизации больного.
Принципы выбора доступа гистеректомии можно сформулировать следующим образом:
1. Когда ее можно выполнить любым доступом, предпочтение должно быть оказано вагинальному способу.
2. Как для абдоминальной (АГ), так и для вагинальной гистерэктомии (ВГ) существуют четкие показания.
3. Существуют противопоказания к ВГ, при которых АГ не противопоказана.
4. В некоторых ситуациях показана ВГ с лапароскопической ассистенцией (ЛАВГ).
5. Если гистеректомию можно выполнить любым способом, то в интересах пациента предпочтительнее ВГ>ЛАВГ>АГ.
Показания и условия выполнения ВГ:
1. Отсутствие сопутствующей патологии придатков.
2. Достаточная подвижность матки.
3. Достаточный хирургический доступ.
4. Размеры матки до 12 нед.
5. Лейомиома матки более 12 нед. после предоперационного уменьшения.
6. Профессиональная опытность хирурга.
Опытные гинекологи знают, что противопоказания к ВГ всегда относительные, а не абсолютные, и зависят от мастерства хирурга [26, 36].
К таким противопоказаниям к ВГ относятся:
1. Размеры матки более 12 нед., однако, опытные хирурги могут оперировать и при размерах 14-16 недель.
2. Ограничение подвижности матки.
3. Сопутствующая патология яичников и маточных труб.
4. Уменьшенные размеры влагалища (недостаточный хирургический доступ).
5. Гипертрофия шейки матки.
6. Недостижимость шейки матки.
7. Операция по поводу пузырно-влагалищного свища в анамнезе.
Состояния, при которых предпочтительна АГ:
1. Имеются противопоказания к ВГ, а ЛАВГ затруднена или рискованна.
2. Обязательное выполнение овариоэктомии, которую нельзя выполнить другим способом.
3. Спаечный процесс вследствие сопутствующего эндометриоза и воспалительных заболеваний органов малого таза.
4. Быстрый рост опухоли (подозрение на малигнизацию).
5. Подозрение на малигнизацию придатков.
6. Лейомиома широкой связки.
7. Сомнения в доброкачественности процессов в эндометрии.
8. Необходимость сопутствующей экстрагенитальной операции.
Иногда при выполнении ВГ, несмотря на тщательную и полную мобилизацию, низведение матки не представляется возможным. В случаях, когда руки хирурга не смыкаются над дном матки, для дальнейшего ее выведения предложены методы “разгрузки” матки путем вылущивания миоматозных узлов [26, 36]. При больших размерах узлов производится двустороннее рассечение шейки матки, которое дает облегченный доступ к полости матки и облегчает энуклеацию и извлечение узлов [36].
Дискуссия относительно пользы и риска вагинальной гистерэктомии с лапароскопической ассистенцией (ЛАВГ) продолжается по сей день, в то же время она открывает новые перспективы для научного роста всех форм гистерэктомии. Проведенные современные исследования свидетельствуют о том, что преимуществами данного метода являются уменьшение степени выраженности болевого синдрома в послеоперационном периоде, риска инфицирования, укорочение периода выздоровления и пребывания в стационаре, более быстрое возвращение к нормальному образу жизни, недостатком — удлинение времени операции и наркоза. Что касается интраоперационной потери крови, то уровень ее при ВГ и ЛАВГ примерно одинаков [4, 26]. При ЛАВГ длительность и результаты операции в значительной степени зависят от мастерства хирурга.
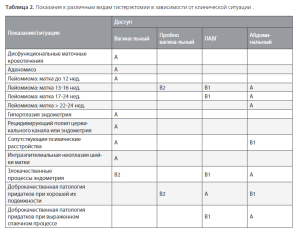
Алгоритм принятия решений о выборе доступа для гистерэктомии с учетом клинической ситуации представлен в таблице 2.
Примечания: А — метод первого выбора; В1 — первый альтернативный метод; В2 — второй альтернативный метод.
При наличии рождающегося подслизистого миоматозного узла АГ противопоказана вследствие повышенного риска возникновений инфекционных осложнений, а также ранения мочеточника из-за дилатации шейки матки [26]. В таких случаях показана вагинальная миомэктомия.
В 60-80-е годы достаточно популярной и распространенной операцией была надвлагалищная ампутация матки (субтотальная гистерэктомия), которая предполагает сохранение шейки матки. Техника этой операции проще и сопряжена с меньшим риском ранения сосудов и мочеточников по сравнению с тотальной гистеректомией. Однако в последние годы с развитием хирургической техники частота выполнения этой операции значительно снизилась в связи с риском развития злокачественных новообразований оставленной шейки матки, частота которых составляет 1-3 % случаев [13]. Субтотальная гистерэктомия может быть выполнена абдоминальным, лапароскопическим или вагинальным путем и предпочтительна у молодых пациенток.
Ранее считалось, что после удаления шейки матки нарушается сексуальная функция. Однако во время проведенных исследований, в том числе в нашей клинике, доказано, что частота и степень выраженности сексуальных расстройств после гистеректомии обусловлена особенностями половой функции до операции, уровнем полового образования, возрастом женщины, личностными особенностями, степенью ее психологической дезадаптации до операции, фактом удаления яичников и уровнем половых гормонов в сыворотке крови и не зависит от объема гистерэктомии (экстирпация или надвлагалищная ампутация матки) [8, 14].
Показания к субтотальной гистерэктомии (надвлагалищной ампутации матки (разработано с учетом данных Sheth S., 1999):
1. В случаях, когда пациентка настаивает на сохранении шейки при отсуствии патологии вагинальной ее части и эндоцервикса.
2. Тяжелая экстрагенитальная патология, требующая укорочения времени операции.
3. Выраженный спаечный процесс или тазовый эндометриоз в связи с увеличенным риском травмы сигмовидной кишки или мочеточника или других осложнений.
4. Необходимость срочной гистеректомии в чрезвычайных ситуациях.
Вопрос о необходимости удаления яичников также является предметом дискуссии на протяжении многих десятилетий. С развитием ЗГТ, широким использованием лапароскопии увеличилась частота профилактических овариоэктомий (48% против 26% согласно данным 30-летней давности), снижен возраст для ее показаний [36].
Отношение пациенток к объему операции определяется чаще всего не ее желанием, а советом врача и той формой, в какой ей это представлено.
В пользу профилактической овариоэктомии имеются следующие аргументы[36]:
Первый — это то, что в 1-5% случаев требуется повторная операция по поводу доброкачественных опухолей яичников.
Второй — хирургическая профилактика рака яичника. Значение ее определяется тем, что до сих пор нет скрининговой диагностики рака яичника и поэтому предпочтительно заниматься профилактикой (по данным литературы, таким способом можно предотвратить 10-15% случаев рака).
Третий связан с тем, что функция яичника после гистерэктомии несколько ухудшается (особенно с увеличением возраста проведения операции). Согласно данным нашей клиники, уже через 2 года после гистерэктомии с сохранением яичников развивается синдром их истощения (СИЯ), выражающийся в уменьшении площади яичников, количества фолликулов, ухудшении в них кровотока, снижении выработки стероидных гормонов, что клинически проявляется появлением вегетативных и психопатологических расстройств [8].
Против профилактической овариоэктомии свидетельствуют следующие аргументы [5, 40]:
Первое — это высокий риск развития синдрома хирургической менопаузы после удаления яичников [8], повышение смертности от осложнений остеопороза и сердечно-сосудистых заболеваний, требующий в большинстве случаев длительного приема ЗГТ.
Второе — то, что рак яичника достаточно редкая патология, т.е. необходимо провести много овариоэктомий для предотвращения 1 случая рака яичника.
Третье — психологические аспекты, связанные с удалением яичника.
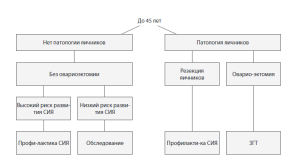
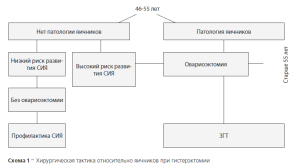
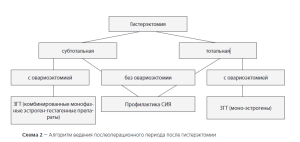
На основании накопленного в нашей клинике опыта [14], разработан алгоритм дифференцированной тактики в отношении яичников, который представлен на схеме 1, а также алгоритм ведения послеоперационного периода в зависимости от объема операции (схема 2).
По результатам проведенных исследований разработана система прогнозирования риска развития синдрома хирургической менопаузы. В случаях повышенного риска развития синдрома истощения оперированных яичников у женшин при проведении гистерэктомии с их сохранением в раннем послеоперационном периоде целесообразно назначение профилактического лечения (актовегин, нервохель, ескузан, препараты ЗГТ) на протяжении 1 месяца с последующим мониторингом функционального состояния яичников [8. 14].
Овариоэктомия при ВГ противопоказана в следующих случаях:
• при наличии тубоовариального спаечного процесса атрофичных яичников;
• при расположении неизмененных яичников высоко в тазу либо латерально у стенок таза.
Одной из наиболее распространенных органосохраняющих операций по поводу лейомиомы матки является консервативная миомэктомия, которая может быть произведена лапаротомным, минилапаротомным или лапароскопичским доступами [4, 6, 22, 32, 36].
Принципы проведения миомэктомии:
• предпочтительно сагиттальный разрез в проекции наиболее выступающей части лейомиомы;
• при множес твенной лейомиоме – же лате льно извлечение узлов через наименьшее число разрезов;
• по возможности избегать вскрытия полости матки, так как ее вскрытие может способствовать образованию синехий и непрочного рубца с риском гистопатического разрыва матки при беременности;
• анатомическое сопоставление тканей мышечного и серозного слоев (некорректное сопоставление увеличивает риск развития гематомы, локального инфицирования, что влияет на состоятельность рубца);
• перед закрытием брюшной полости – использование современных средств (гелей, сеток, растворов) для профилактики спайкообразования.
Нередко миомэктомия сопровождается значительной кровопотерей, которая зависит от общего размера матки, общей длины разрезов на матке, общего количества удаленных узлов и длительности операции. Учитывая это, предлагались различные методы уменьшения объема кровопотери: это и механические способы (накладывание клемм в области перешейка, затягивание истмуса эластической нитью, лигирование нисхо-
дящей части маточных сосудов рассасывающимися ма-
териалами), химические (инъекции in situ вазоактивных препаратов, например, вазопрессин, окситоцин, адреналин), а также предоперационная подготовка путем аутотрансфузии заготовленной аутокрови, применения агонистов Гн-РГ, предоперационного назначения мифепристона или эмболизации маточных артерий [32, 36].
В нашей клинике выработаны следующие показания к комбинированной терапии:
1. Наличие субсерозной фибромиомы с общим количеством узлов не более 8.
2. Величина узла более 5 см.
3. Заинтересованность женщины в сохранении матки и репродуктивной функции.
Комбинированную терапию рекомендуется проводить по 3-х этапной схеме:
І этап – 2-3 инъекции аГн-РГ с интервалом 28 дней.
ІІ этап — консервативная миомэктомия.
ІІІ этап — 3-4-я инъекция аГн-РГ.
Как показали результаты проведенных в нашей клинике исследований, при этом выраженность клинической симптоматики уменьшается уже после 1-2 инъекций, размеры фибромиомы (до 40%) — более всего после 2-х инъекций.
Показаниями к миомэктомии как ко второму этапу комбинированного лечения являются:
1. Отсутствие динамики уменьшения размеров миоматозного узла после 2-х инъекций. Учитывая данные литературы о возможности малигнизации узла [5,21], считаем целесообразным производить срочное хирургическое вмешательство.
2. Продолжающиеся клинические симптомы (боль, симптомы сдавления смежных органов и т.д.) даже при наличии положительной динамики размеров узла.
3. Заинтересованность пациентки в выполнении детородной функции при клинически значимых размерах узла и бесплодии в анамнезе.
Преимущества проведения хирургических вмешательств на фоне назначения аГн-РГ:
• уменьшение размеров узлов, васкуляризации и кровопотери;
• укорочение времени операции;
• укорочение длительности послеоперационной лихорадки и болевого синдрома вследствие уменьшения объема резорбции;
• укорочение сроков нормализации функциональной массы и размеров матки после консервативной миомэктомии;
• уменьшение частоты рецидивов.
Таким образом, комбинированное лечение обеспечивает минимальную травматичность операции и создает оптимальные условия для ее проведения.
Преимуществами лапароскопической миомэктомии являются: меньшая кровопотеря во время операции, менее выраженный болевой синдром в послеоперационном периоде, меньшая длительность послеоперационной лихорадки, укорочение времени выздоровления и пребывания в стационаре, более быстрое возвращение к нормальному образу жизни; недостатками — ограничения в размерах и количестве узлов, трудности удаления глубоких интрамуральных узлов, большая частота рецидивов миомы вследствие отсутствия возможности тактильного определения мелких узлов во время операции, более выраженное повреждение миометрия и сниженная способность к регенерации коагулированных тканей, что может влиять на состоятельность рубца [17, 25, 32]. На начальных этапах лапароскопическая миомэктомимя была связана с высоким риском большей кровопотери, удлинением времени операции и высокой частотой перехода в лапаротомию (около 34%), в настоящее время при использовании селективных критериев отбора и современной лапароскопической техники данный показатель составляет менее 5%. Пути устранения недостатков лапароскопической миомэктомии: тщательный отбор и подготовка пациенток, применение современных видов хирургической энергии, использование лапароскопических швов с применением современного шовного материала, морцеллятора, интраоперационное УЗИ, а также внедрение роботизированных операционных систем.
Лапаротомия показана при наличии выраженного спаечного процесса в брюшной полости, который повышает риск ранения смежных органов, больших размерах узлов, глубокой интрамуральной их локализации.
Преимуществами вагинальной миомэктомии являются минимальная кровопотеря, уменьшение длительности операции и продолжительности наркоза, недостатками – потребность в квалификации и опыте врача в вагинальной хирургии. Риск перехода в лапаротомию составляет при этом от 8 до 11% [36]. Вагинальный доступ для миомэктомии показан при низкой субсерозной локализации узла.
«Золотым стандартом» для лечения субмукозных лейомиом считается гистероскопическая резекция узла, которая применяется с 1976 г. [22, 29]. Эффективность данного вмешательства наибольшая при наличии подслизистых узлов 0 и І типа согласно классификации Европейской Ассоциации гинекологов-эндоскопистов величиной не более 5 см в диаметре. При диаметре миомы 3 см и более в качестве предоперационной подготовки рекомендуется назначение аГн-Рг с целью уменьшения размеров узла и интраоперационной кровопотери. По данным различных авторов, в случаях наличия субмукозной лейомиомы ІІ типа в 80% случаев в последующем требуется повторное хирургическое вмешательство [36], поэтому для такой локализации предпочтительнее выбирать иные методы лечения опухоли.
C развитием гистероскопических методик в качестве симптоматического лечения миом с геморрагическим синдромом у женщин в перименопаузе начали применять трансцервикальную аблацию или резекцию эндометрия [36, 38]. Данный метод следует предлагать как первый хирургический шаг ослабленным женщинам с лейомиомой матки и геморрагическим синдромом, наличием противопоказаний к оперативному вмешательству, при остутствии сопутствующего эндометриоза и показаний для удаления яичников.
В последние годы все шире применяются миниинвазивные новые методики лечение лейомиомоы матки, среди которых миолизис (коагуляция миомы) с использованием различных видов энергий (лазерного излучения, диатермии, криоили радиоволновой энергии) и доступов (лапароскопического, чрезкутанного, трансвагинального или внутриматочного), применение сфокусированного высокочастотного ультразвука, рентгенхирургическая эмболизация маточных артерий и лапароскопическая окклюзия маточных артерий.
Высокочастотный сфокусированный ультразвук был предложен в 1990 году в Вашингтоне. Применяется УЗизлучение интенсивностью 1000-10000 Вт/см2, при котором происходит нагревание ткани лейомиомы до 700, что в дальнейшем ведет к ее некрозу, гомогенизации и рубцеванию. Однако среди недостатков этого метода можно назвать необходимость тщательного отбора пациенток с отсутствием на передней брюшной стенке рубцов, толстого слоя подкожной жировой клетчатки, мочевого пузыря и петель кишечника между узлом и передней стенкой, необходимость неподвижного положення больной на протяжении нескольких часов и дороговизну процедуры, включая контроль очата деструкции при помощи МРТ в режиме реального времени. При этом воздействие оказывается только на один узел. Эффективность метода относительно симптомов лейомиомы составляет около 79%, в то время как величина узлов уменьшается всего на 13,5% за 6 месяцев [29, 31].
Одним из относительно новых перспективных малоинвазивных методик лечения лейомиомы матки является рентгенхирургическая эндоваскулярная билатеральная эмболизация маточных артерий (ЭМА), которая на сегодня приобрела уже довольно широкую популярность. Методика представляет собой катетеризацию под рентгенконтролем a.uterina поочередно с обеих сторон с последующей их окклюзией путем введения эмболизирующего вещества. В результате закупорки питающих опухоль сосудов развивается ишемия с последующим некрозом, склерозом, гиалинозом и кальцинозом миоматозных узлов [12, 34, 39]. Полного некроза матки не происходит вследствие различий в диаметре сосудов матки и перифибриноидного сплетения — диаметр последних больше, и крупные эмболы (в настоящее время применяются эмболы размером не менее 400 мкн) проходят только в сосуды опухоли, не попадая в микроциркуляторное русло матки вследствие меньшего диаметра артерий [31,34, 37]. К тому же артерии, питающие миоматозные узлы – концевые, а в миометрии развито богатое коллатеральное кровообращение [12, 37].
Преимуществами эмболизации являются значительно меньший риск возникновения анестезиологических, тромбоэмболических осложнений, меньший объем кровопотери, более низкая частота инфекционных осложнений и уровень летальности, значительное укорочение сроков выздоровления по сравнению с лапаротомными и лапароскопическими операциями [11, 13, 14, 22, 31]. Преимуществами данного вмешательства является также сохранение фертильности, отсутствие большой раневой поверхности на матке и процесса рубцевания, что способствует уменьшению вероятности гистопатического разрыва матки. При этом ЭМА не является операцией в традиционном ее понимании, вследствие чего не оказывает характерного для хирургического вмешательства психотравмирующего действия.
Недостатком ЭМА можно считать отсутствие данных о гистологической структуре узла. И хотя лейомиосаркома – достаточно редкая злокачественная опухоль (частота озлокачествления миомы составляет 0,001%), в литературе описано 3 случая эмболизации лейомиосаркомы [37, 39]. Это диктует необходимость тщательного предоперационного обследования и послеоперационного наблюдения при проведении ЭМА.
В Украине эмболизация маточных артерий применяется с 1997 года, и в настоящий момент мы располагаем опытом проведения более 650 технически успешных ЭМА.
На основании полученных данных выделены следующие показания к ЭМА при лейомиоме матки:
• симптомная лейомиома: с геморрагическим синдромом, анемией, обусловленной маточными кровотечениями, болевым синдромом, симптомами сдавления смежных органов;
• субмукозная миома и миома с центрипетальным ростом узлов;
• перешеечная локализация узла;
• бессимптомная лейомиома: при величине 14 и более недель беременности, наличии 5 и более миоматозных узлов; наличии узлов 3 см и более в диаметре (так как при размере узлов более 3 см спрогнозировать динамику роста миомы матки практически невозможно).
• бесплодие (при множественной миоме, рецидивах после консервативной миомэктомии или у пациенток, которым показана гистерэктомия при отсутствии других причин бесплодия);
• невынашивание (при множественной лейомиоме, неэффективности консервативной миомэктомии или у пациенток, которым показана гистерэктомия при отсутствии других причин невынашивания);
• неэффективность консервативной терапии;
• в качестве предоперационной подготовки. Противопоказания к проведению ЭМА мы разделили на гинекологические и общие. Противопоказания со стороны гениталий:
• наличие инфекции в органах малого таза;
• беременность;
• злокачественные новообразования органов малого таза, облигатные предраки;
• подозрение на лейомиосаркому (быс трый рос т опухоли, УЗ-допплерографические признаки, тест с агонистами Гн-Рг);
• субсерозная миома на тонкой ножке (ввиду риска развития некроза с возможным развитием перитонита).
Среди общих противопоказаний выделяли:
• почечную недостаточность;
• аллергические реакции на рентгенконтрас тные вещества;
• аутоиммунные заболевания;
• некорригируемые коагулопатии, в том числе тромбофилию.
Согласно результатам наших исследований, эффективность эмболизации в отношении менои метроррагий составила 97,3%, симптомов сдавления смежных органов – 83,9%, болевого синдрома – 57,55%, альгоменореи – 48,1%. В течение 12 мес. отмечено уменьшение среднего объема матки на 67,3%; среднего объема доминантного миоматозного узла – на 72,3%. В нашей практике имеются десятки случаев беременностей и рождения здоровых детей у женщин с лейомиомой после ЭМА, что совпадает с данными других исследователей [31, 39].
Использование ЭМА в качестве предоперационной подготовки перед консервативной миомэктомией расширяет возможности органосохраняющего лечения лейомиом больших размеров [16].
В мировой литературе в настоящее время описаны сотни случаев беременности после ЭМА, завершившихся рождением здоровых детей. Однако до настоящего времени нет данных больших рандомизированных исследований, доказывающих безопасность ЭМА в отношении перспектив репродуктивной функции. В то же время отсутствуют и какие-либо сообщения о неблагоприятном влиянии данной методики на генеративную функцию и развитие плода.
Поэтому женщинам, планирующим иметь детей, ЭМА следует предлагать только при отсутсвии альтернативного органосохраняющего метода лечения.
Осложнения ЭМА можно разделить на таковые во время проведения операции (общие реакции и локальные осложнения в месте пункции) и отсроченные. Среди отсроченных возможны инфекционные осложнения, некроз субсерозного узла на ножке с последующим развитием перитонита, аменорея (чаще преходящая). В литературе описаны также 2 случая тотального некроза матки вследствие неадекватного подбора размеров эмболов с развитиемсептическихосложненийилетальнымисходом, а также единичные случаи тромбоэмболических осложнений [39].
Учитывая, что ЭМА является органосохраняющим методом, очень важно на дооперацонном этапе исключить патологию эдометрия и шейки матки.
В 2000 г. впервые была описана лапароскопическяа окклюзия сосудов матки, которая по своей еффективности приближается к ЭМА [31], однако широкого распространения на сегодня данная методика еще не получила. Уровень и характер осложнений при данном способе лечения миомы подобен такому после ЭМА, поэтому результаты исследований относительно более изученной методики ЭМА в некоторой мере можна екстраполировать и на лапароскопическую окклюзию [38]. Хотя некоторые авторы указывают на меньшую эффективность (около 50%) данной методики в сравнении с ЭМА [31, 38].
Результаты наших разработок вошли в нормативные документы МОЗ Украины, регламентирующие врачебную тактику в отношении лечения лейомиомы матки [11].
Таким образом, принципы современного подхода к лечению миомы можно формулировать следующим образом:
1. Ранняя диагностика опухоли, учитывая возможность “химической миомэктомии” еще на стадии нодозного пролиферата.
2. Раннее применение комплексной консервативной терапии, включая антистрессовую, адаптогенную, противовоспалительную, иммунокорригирующую, антиоксидантную.
3. Своевременная коррекция гормональных расстройств и нарушений менструального цикла.
4. Коррекция сопутствующей экстрагенитальной патологии и эндокринных нарушений.
5. Своевременное назначение гормональной терапии.
6. Индивидуализированный подход к лечению.
7. Раннее применение органосохраняющих, преимущественно миниинвазивных, эндоскопических и комбинированных методик у женщин репродуктивного возраста с целью восстановления фертильности и профилактики осложнений беременности.
8. Своевременное радикальное хирургическое вмешательство при наличии показаний с дифференцированным выбором доступа.
Литература.
1. Безнощенко Г.Б. Неоперативная гинекология.–Руководство для врачей. М.: Медицинская книга, 2001.–391с.
2. Брехман Г.И., Мазорчук Б.Ф., Масиброда Н.Г. Миома матки, психосоматические аспекты, консервативное лечение и профилактика. – ИвановоВинница.: Ивановская медицинская академия,2000.– 217 с.
3. Вихляева Е.М. Миома матки. М.: МЕДпресс-информ, 2004.399 с.
4. Гладчук И.З., Лищук В.Д., Будяковская О.В. Український журнал малоінвазивної та ендоскопічної хірургії. – 2005.№9.с. 29-32.
5. Декам Ф.Ж. Абстракты международного симпозиума “Диферелин — шаг в новое тысячелетие”. — Киев,2001. — 16 с.
6. Чайка К.В., Носенко Е.Н. Основы репродуктивной медицины. Практическое руководство. — Донецк: Альматео, 2001.с. 394-397.
7. Захарченко І.А. Роль мікроелементів у прогнозуванні перебігу фіброміоми тіла матки // ПАГ –1997. – №4. с. 82
8. Кваша Т.І. Прогнозування та профілактика синдрому хірургічної менопаузи у жінок після гістеректомії // Автореф дис. .к.м.н. — Київ, 2002. 20 с.
9. Кулаков В. И., Кира Е. Ф. // Акушерство и гинекология. – 2006. – № 5. – с. 3–5.
10. Миома матки (современные проблемы этиологии, патогенеза, диагности и лечения) [под. ред. И. С. Сидоровой]. – М.: Медицинское информационное агентство, 2002. –256 с.
11. Наказ МОЗ «Про затвердження клінічних протоколів з акушерської та гінекологічної допомоги»№582 от 15.12.2003
12. Нікішин Л.Ф., Кондратюк В.А., Гладкий А.В. та ін. Одеський медичний журнал. – 2003.№4(78). – с. 41-43.
13. Савицкий Г. А., Савицкий А. Г. Миома матки. Проблемы патогенеза и патогенетической терапии // 3-е изд. – СПб.: Элби-СПб, 2003. – 236 с.
14. Татарчук Т.Ф., Косей Н.В. // Лікування та діагностика. – 2004. — №4.с. 37-44.
15. Татарчук Т.Ф., Косей Н.В., Могилевский Д.М. и др.// Репродуктивное здоровье женщины. – 2006.– №1(25).с. 123-129.
16. Татарчук Т.Ф., Косей Н.В., Березовская Е.И., Тутченко Т.Н. Особенности органосохраняющего лечения лейомиомы матки больших размеров // Здоровье женщины. – 2009. — №1 (37). – с. 160-164.
17. Тихомиров А.Л., Лубнин Д.М. Новые принципы лечения миомы матки //Методическое руководство для врачей акушер-гинекологов. – Москва, 2006.48с.
18. Brosens I.A., Lunenfeld B., Donnez J. Pathogenesis and medical management of uterine fibroids.New YorkLondon.: The parthenon publishing group., 1999.158p.
19. Cunningham E., Barreda L., Ngo M. [et al.] // J Minim Invasive Gynecol. – 2008. – Vol. 15,№ 3. – P. 301–307.
20. Donnez J., Schindler A.E., Wall weiner D., Audebert A. Fibroids: management and treatment. In: Lunenfeld B., Insler V., editors. GnRH analogues: the state of the art 1996. Carnforth, UK: Parthenon Publishing, 1996.P.71-82.
21. Mizutani T., Sugihara A. , Honma H. [et al.] // GynecolEndocrinol. – 2005. – Vol. 20, № 2. – P. 80–83.
22. Flowers J. // Adv Nurse Pract. – 2008. – Vol. 16, №10. – P. 36–40.
23. Isaacs J.D., Clinical reproductive medicine/ Ed Cowan B.D., Seifer D.B. Philadelphia — New York.: Lippincott-Raven Publishers., 1997.-225-229.
24. Isonishi S., Robert L. , Hirama M. [et al.] // OchiaiAmerican Journal of Obstetrics & Gynecology. – 2008 – Vol.198, № 3. – P. 270.e1–270.e6.
25. Levy B. S. // Acta Obstet Gynecol Scand. – 2008. – Vol.87, № 8. – P. 812–823.
26. Koh L. W. , Koh P. R., Wong C. N. [et al.] // JSLS. – 2008.– Vol. 12, № 4. – P. 417–419.
27. Fasih N., Prasad S. , Shanbhogue A. K.[et al.] // Radiographics. – 2008. – Vol. 8, № 7. – P. 1931–1948.
28. Maruo T. //Gynecological Endocrinology. – 2007. – Vol.23, № 4. – P. 186–187.
29. 404 Miller C. E. // J Minim Invasive Gynecol. – 2009. – Vol. 16, № 1. – P. 11–21.
30. Nowak R. A. // Drugs Discovery Today: Therpeutic Strategies. – 2004. – Vol. 1, № 2. – P. 237–242.
31. Pinto I. // CIRSE. – Annual Meeting and Postgraduate Course of the Cardiovascular and Interventional Radiological Society of Europe. – 2003. – P. 100-101.
32. Prapas Y. // Am J Obstet Gynecol. – 2009. – Vol. 200,№ 2. – P 144–146
33. P. Lumbiganon, S. Rugpao, S. Phandhu-fung [et al.] // Br J Obstet Gynaecol. – 1996. – Vol. 103, № 9. – Р. 909–914.
34. Ravina J.H., Aymard A., Ciraru-Vigneron N. Et al. Gynecol Obstet Fertil.2003.Vol.31(7-8).p P.597-605.
35. Schweppe K. W. // Gynecological Endocrinology. –1999. – Vol. 13, № 4. – Р. 21–24.
36. Sheth S., Sutton Sh. Menorrhagia. ISIS MedicalMedia.1999.362p.
37. Siskin G. P. , Beck A. , Schuster M. [et al.] // Journal ofVascular & Interventional Radiology. – 2008. – Vol. 19, № 1. – P.58–65.
38. Тropeano G., Amoroso S. // Scambia G.Hum ReprodUpdate. – 2008. – Vol 14, № 3. – P. 259–274.
39. Walker W.J., Palage J.P., Sutton C. Clin Radiol.2002.Vol.57.P.325-331.
40. Wildemeersch D., Schacht Е. // Eur J Contraception reprod Health Care. – 2001. – Vol. 6. – P. 93–101.














Комментировать