Лейоміома матки у жінок: загальна характеристика захворювання. Особливості діагностики, варіанти оперативного лікування.
Н.О. Удовіка, к.м.н., Луганський державний медичний університет, кафедра акушер ства, гінекології та перинатології; І.В. Чибісова Луганська обласна держадміністрація, Управління охорони здоров’я; В.М. Кладієв Луганський міський пологовий будинок.
На сьогодні загальновизнано, що лейоміома – це гормонзалежна доброякісна пухлина міометрія [8, 6].
Останніми роками значно поширилися знання про патогенез лейоміоми, і багато авторів лейоміомою називають моноклональний гормоно чутливий проліферат, що складається з фено типічно змінених гладеньком’язових клітин міо метрія [1, 4, 5, 11]. Такий погляд на проблему доз воляє вважати цю патологію не наслідком систем них гормональних змін, а локальною патологією міометрія.
Лейоміома більш характерна для жінок пізнього репродуктивного періоду та перименопаузи [1, 3, 8]. Проте нині в загальній популяції гінекологічної патології збільшилася кількість випадків захворюваності на лейоміому серед молодих пацієнток, які ще не виконали свою репродуктивну функцію. Високою також залишається частка жінок постменопаузального періоду, в яких проявляється прогресуючий ріст вузлів матки [2, 4, 8].
Відповідно до патолого-анатомічних до сліджень, розповсюдженість лейоміоми матки ся гає 85 % [11]. Це дозволяє вважати патогенетично значущою теорію, відповідно до якої ріст вузла пов’язується з ушкодженням у клітині у зрілій матці [11]. Моноклональний проліферат гладень ком’язових клітин міометрія (змінені клітини) вна слідок активації програми клональної проліферації тканини збільшується у розмірах на фоні нормаль ного гормонального фону, тоді як клітини незміне ного міометрія перебувають у стані відносного спо кою. Проте з часом автокринно-паракринна регу ляція росту вузла втрачає свою значущість. У результаті цього автономна здатність вузла збільшу ватися в умовах відсутності гормонального впливу змінюється на неможливість регресії його розмірів у разі припинення дії гормональних стимулів [1, 5, 11].
Як свідчить клінічний досвід, лейоміома матки здебільшого має асимптомний перебіг. У той же час, поява мено- і метрорагій, болю внизу жи вота, дискомфорту, частого сечовипускання, болю в попереку є підставою до обстеження пацієнтки для виключення лейоміоми. Першими симптомами лейоміоми можуть бути її ускладнення, зокрема некроз та інфаркт вузла, перекручення ніжки вузла, коли у хворої з’являються блювота, різкий біль внизу живота, у попереку, підвищення температури тіла, лейкоцитоз, прискорення ШОЕ, ознаки по дразнення очеревини [1, 4, 6, 8].
Діагностика лейоміоми базується на ре зультатах ретельно зібраних скарг і анамнезу за хворювання, бімануального та інструментального досліджень з обов’язковою оцінкою стану ендометрія.
Слід пам’ятати, що пацієнтка з лейоміомою не завжди звернеться в першу чергу саме до гіне колога: наявність болю в попереку та порушень функції прямої кишки і сечового міхура можуть ста ти причиною звернення до відповідного спеціаліста (невропатолога, травматолога, нейрохірурга, уро лога тощо). Зокрема, це відбувається внаслідок розвитку мієлопатичного та радикулалгічного син дромів при пухлині матки розмірами понад 14 тиж нів вагітності. Так, у випадку мієлопатичного варіанту, що виникає внаслідок спінальної ішемії, хворі скаржаться на слабкість та тяжкість у ногах, парестезії, які проявляються через 10–15 хвилин від початку ходьби і зникають після короткочасного відпочинку; при радикулалгічному синдромі, що розвивається внаслідок здавлювання маткою сплетінь малого тазу або окремих нервів, жінок хвилюють біль у попереково-крижовій ділянці та нижніх кінцівках, розлад чутливості у вигляді парестезій [6].
Проте значна кількість хворих на лейо міому через маткові кровотечі відразу потрапляють до кола зору гінеколога. Такі маткові кровотечі зумовлені порушенням скоротливості матки вна слідок наявності субмукозних вузлів або великих поліпів ендометрія, збільшення порожнини матки та площини ендометрія, порушення процесів розташування ендометрія і нерівномірністю його морфофункціональних змін. Слід додати, що в процесі росту пухлини в матці порушується й функція яєчників, що відіграє певну роль у перед часному відшаруванні ще непідготовленого до відторгнення ендометрія [1, 6, 8]. Повторні, як пра вило, неліковані маткові кровотечі у таких жінок супроводжуються розвитком слабкості, зниженням працездатності, швидкої втоми, погіршенням настрою внаслідок нез’ясованості ситуації, постійного гігієнічного дискомфорту, тобто появою ознак астенічного синдрому; лабораторно діагно стуються ознаки постгеморагічної анемії.
Топічний діагноз, де уточнюється розмір вузлів, їх локалізація, кількість та ехогенність, на явність супутньої гіперплазії ендометрія та пато логії придатків матки, проводять на підставі уль тразвукового дослідження. При цьому використовують як трансвагінальне, так і трансабдомінальне ультразвукове дослідження, а також транс вагінальну соногістерографію. Трансабдоміналь ному ультразвуковому дослідженню слід віддавати перевагу при розмірах лейоміоми понад 12 тижнів [6]. У решті випадків показане трансвагінальне до слідження, що є високоінформативним у діагно стиці гіперплазії ендометрія,визначенні локалізації субмукозних вузлів та поліпів [6, 7].
З тією самою метою, хоча з меншою діагностичною значущістю, може бути використана гістероскопія. Безсумнівною перевагою її над усіма іншими методами діагностики є можливість одно часної біопсії ендометрія, видалення поліпів та субмукозних вузлів, абляції та резекції ендометрія [4, 6]. Поряд з гістероскопією для діагностики субмукозних вузлів та поліпів може бути застосо вана також гістеросальпінгографія, що до сьогодні не знайшла широкого використанн в практичній роботі [6, 7].
Дані доказової медицини свідчать, що по передня трансвагінальна соногістерографія у жінок із внутрішньоматковою патологією у 40% випадків дозволяє уникнути гістероскопії [6].
На підставі даних, отриманих під час уль тразвукового дослідження та гістероскопії, ро зрізняють підслизову (субмукозну), інтрамуральну (міжм’язову) і субсерозну (підочеревинну) лейо міому [1, 6, 8]. Ріст вузла може відбуватися у ли сток широкої зв’язки (інтралігаментарно), назовні (ексцентрично), усередину (центрипетально) та з розмежуванням тканин (експансивно). Виділяють також атипові форми лейоміоми коли вузли розташовані і ростуть зашийково, передшийково, заочеревинно, надочеревинно та парацервікально [4, 6, 7].
При обранні методу лікування виправда ною та доцільною вважається клініко ультразвукова класифікація лейоміоми матки, за пропонована D.Wildemeersch та E.Schacht (2002) [6]: тип I – один або множинні дрібні інтрамуральні вузли чи субсерозні вузли (менше 3 см), відсутні субмукозні вузли; тип II – один або множинні ін трамуральні або субмукозні вузли (3–6 см), відсутні субмукозні вузли; тип III – один або множинні ін трамуральні або субмукозні вузли (понад 6 см), відсутні субмукозні вузли; тип IV – один або мно жинні інтрамуральні або субсерозні вузли з підо зрою або наявністю доведеного субмукозного вуз ла.
Для глибшого з’ясування вищевказаних да них, а також оцінки топографічного стану суміжніх органів в окремих випадках проводиться магнітно резонансна томографія, хоча широкого застосу вання в практичній діяльності у хворих на лейо міому матки цей метод діагностики не знайшов.
Останнім часом нерідко застосовують та кож доплеросонографію, що дозволяє виявити вторинні зміни в лейоміомі та оцінити особливості васкуляризації вузлів матки. Якщо п сля такого обстеження у лікаря залишається питання про топічний діагноз і виникає необхідність більш гли бокого диференціювання патологічного осередку в малому тазу, проводять діагностичну лапаро скопію.
На характер лікування, що його має бути проведено пацієнтціз лейоміомою матки, вельми впливає вихідний стан ендометрія (відповідний фазі менструального циклу, гіперплазія, аденома тоз, аденокарцинома тощо). Його оцінку здійснюють шляхом проведення гістологічного до слідження зіскрібку з цервікального каналу та по рожнини матки, який отримується під час лікуваль ного (з метою гемостазу) або спеціального діагностичного вишрібання матки.
Жінкам, у яких діагностовано лейоміому матки, доціл но обстежувати стан щитоподібної залози, зважаючи на те, що у 74% випадках міома розвивається на фоні патології щитоподібної зало зи [1, 6, 4, 8]. Тобто, можна припустити, що успіх лікування хворої на лейоміому буде залежати від корекції стану щитоподібної залози.
Лікувальна тактика щодо ле оміоми визна чається характеристикою вузла [10-13]. В цьому плані прийн то виділяти дві його частини – стабільне ядро та частину, що регресує. Стабільне ядро – це той об’єм вузла, який залишається після повного припинення кровопостачання, друга ча стина – об’є вузла, на який він зменшується у ві повідь на це [11]. Ось чому треба розуміти, що лейоміома не може зникнути повністю, навіть за повного прип нення кровопостачання. Відтак, важ ливою є ще одна характеристика вузла, що впли ває на лікувальну тактику, – це по яття «клінічно незначущого розміру вузла» [11]. Так, для субму козного вузла клінічно незначущого розміру не існує, бо за такої локалізації завжди існують клінічні симптоми лейоміоми, зокрема, кровотечі; тому такі лейоміоми завжди оперують. Разом з цим, субсерозний вузол, що перевищує розміри матки вдвічі, може взагалі клінічно себе не прояв ляти; тоді ожливість оперативного лікування вирішується індивідуально [10, 11]. Розуміння про гностичної цінності «клінічно незначущого розміру вузла» вельми важливе для інтрамуральних лейо міом з центрипетальним ростом. Клінічний досвід свідчить, що «клінічно незначущим розміром» для таких вузлів є розмір не більше 15 мм [11]. Такі вузли діагностують частіше випадково при ультра звуковій діагностиці. З патогенетичної точки зору, лейоміома на цій стадії ще керована природним гормональним фоном і не набула автономних ме ханізмів росту [9, 12]. Тому пасивна тактика у ве денні таких пацієнток недоцільна; стабілізація ро сту та профілактика подальшого збільшення дося гається шляхом використання низькодозованих оральних контрацептивів, що містять гестагени третього покоління [11]. На думку деяких авторів [6], гормональні оральні контрацептиви у жінок з лейоміомою частіше використовуються з метою гемостазу, бо здатні зменшувати менструальну крововтрату, при цьому на розміри матки вони не впливають.
За наявності клінічних проявів лейоміоми, а також розмірів вузлів понад 1,5–2 см основним принципом лікування лейоміом є зниження про дукції естрадіолу, нормалізація співвідношення факторів росту (IGF 1/IGF 2) з вилученням «сто ронніх» (аномальних) гормонзалежних мас із матки (а саме вузлів і гіперплазованого ендометрія) [4, 6, 10].
Це досягається завдяки медикаментозному та хірургічному лікуванню та/або їх комбінації. Ета пність такого лікування залежить від віку жінки, стану репродуктивної функції, розмірів, локалізації та темпу росту лейоміоми, клінічної картини захво рювання, ризику малігнізації, загального стану здоров’я пацієнтки, її побажань і завжди вирішується індивідуально.
Будь-якого пацієнта, у разі виявлення у нього пухлини, перш за все турбує питання її зло якісності, оскільки воно тісно пов’язане з мож ливістю оперативного втручання, яке само по собі може стати небезпечним. Тому відразу вкажемо на ті ситуації, коли при лейоміомі матки слід говорити про необхідність хірургічного лікування. Так, за да ними доказової медицини, показаннями до хірургічного лікування лейоміоми є симптомна лейоміома (з геморагічним та больовим синдро мом, анемією, наявністю симптомів здавлювання суміжних органів); велика лейоміома (13– 14 тиж нів та більше); наявність субмукозного вузла; підо зра на порушення живлення вузла та перекручен ня ніжки субсерозного вузла (клініка «гострого жи вота» та інтоксикації); швидкий ріст лейоміоми (на 4–5 тижнів на рік і більше) або резистентність до терапії агоністами гонадотропінрилізинг-гормону – Гн-РГ); лейоміома у сполученні з передпухлинною патологією ендометрія чи яєчників; безпліддя вна слідок лейоміоми матки; супутня патологія придат ків матки [6].
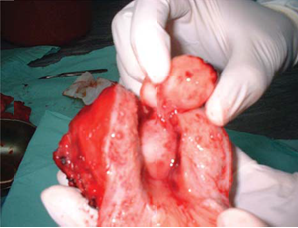
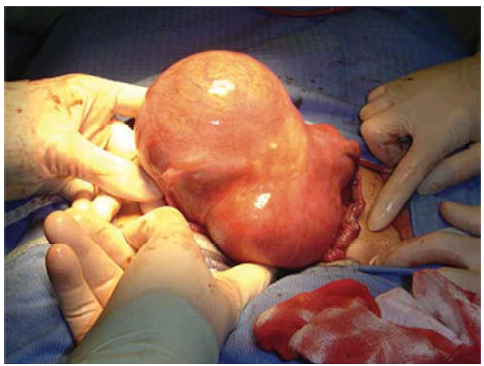
Які ж операції у жінок з лейоміомою матки можуть бути проведені? По-перше, це гістерек томія (екстирпація матки) вагінальним шляхом, гістеректомія вагінальним шляхом з лапароскопіч ною асистенцією, абдомінальна гістеректомія; по друге, – субтотальна гістеректомія (надпіхвова ампутація матки); по-третє, – консервативна міомек томія; четвертий спосіб лікування лейоміоми – оперативні втручання із застосуванням гістеро скопії, п’ятий – емболізація маткових артерій [6].
За даними багатьох гінекологічних клінік, на сьогодні широкого застосування набула вагінальна гістеректомія, в т.ч. з лапароскопічною асистен цією, що значно зменшує неминучий ризик хірургічної агресії під час абдомінальної операції. Проте за багатьох станів такі операції протипока зані. До них належать розміри матки понад 12 тиж нів гестації, підозра на лейоміому широкої зв’язки; сумніви щодо доброякісності ендометрія; обме женість рухомості матки внаслідок спайкового про цесу (ендометріоз, запальні захворювання органів малого тазу); швидкий ріст пухлини (підозра на малігнізацію); супутня патологія яєчників та матко вих труб (підозра на малігнізацію), тяжка екстра генітальна патологія; наявні в анамнезі операції з приводу міхурно-вагінальних нориць; інвазивний рак, гіпертрофія і недосяжність шийки матки, а та кож недостатній хірургічний досвід лікаря, який планує виконати таку операцію. У цих випадках перевагу слід надавати абдомінальній гістеректомії [6]. Не застосовується лапароскопічна міомектомія жінкам, які планують вагітніти, через збільшення ризику розриву матки під час виношування дитини та пологів [6, 7, 9, 11].
Тяжка екстрагенітальна патологія у хворої на лейоміому, що потребує скорочення терміну операції, високий ризик інтраопераційного травма тизму внаслідок вираженого спайкового процесу або тазового ендометріозу, необхідність терміно вої гістеректомії у надзвичайних випадках, а також відсутність патології епітеліюпіхвової частини ший ки матки та ендоцервіксу при бажанні пацієнтки зберегти шийку матки — такими можуть бути пока заннями до субтотальної гістеректомії [6].
У випадках, коли пацієнтка у майбутньому планує виконувати репродуктивну функцію, захво рювання маєасимптомний перебіг, має місце суб серозний (на широкій основі) або інтрамуральний вузол, розмір лейоміоми до 12 тижнів вагітності, існує впевненість у доброякісному стані ендометрія (без ризику малігнізації), перевага надається кон сервативній міомектомії. При цьому обов’язковим є інтраопераційне гістологічне експрес-дослідження видалених вузлів. Консервативна міомектомія до повнюється медикаментозним лікуванням з метою реабілітації [6]. Така операція має переваги для пацієнток з тяжкими екстрагенітальними захво рюваннями та високим анестезіологічним і хірургічним ризиком [6].
Альтернативою гістеректомії є гістеро скопічна міомектомія, абляція або резекція ендо метрія, які виконуються у жінок з діагностованою субмукозною лейоміомою зі значними кровотечами [6, 9].
Жінкам з лейоміомою великих розмірів(матка розмірамипонад 18 тижнів) або наявністю анемії до проведення хірургічного лікування реко мендується призначення агоністів Гн-РГ (гозерелін, трипторелін) протягом 2 місяців за умови відсут ності онкогінекологічного анамнезу з подальшою операцією [6].
Питання щодо придатків матки теж вирішується індивідуально. Проте слід пам’ятати, що у 1–5 % жінок, які перенесли гістеректомію, ви никає необхідність у повторній операції з причини розвитку доброякісних пухлин яєчників. З іншого боку, через 2–2,5 року після гістеректомії функція яєчників поступово погіршується (зокрема, вна слідок порушення кровообігу у судинах яєчнику), і у більшості таких пацієнток розвивається синдром виснажених яєчників (постгістеректомічний син дром). Профілактична оваректомія у жінок активно го репродуктивного періоду призводить до розвит ку синдрому хірургічної менопаузи, підвищення смертності від остеопорозу та серцево-судинних захворювань, що вимагає тривалого застосування замісної гормонотерапії [1–4]. Не слід також забу вати про психологічний аспект та можливість сут тєвого зниження якості життя пацієнтки, пов’язаний з видаленням будь-якого органа [1, 2, 4]. Тому профілактична оваріоектомія доцільна в постме нопаузі [6].
Як самостійний метод лікування симптом ної лейоміоми та у складі передопераційної підго товки до подальшої міомектомії останніми роками застосовують емболізацію маткових артерій шля хом пункції правої стегнової артерії. Мета, що при цьому досягається, – повна оклюзія судинного русла лейоматозних вузлів за рахунок введення емболізату (частинки з полівінілалкоголю, гідро гель, пінгіангміцинліпоїдна емульсія тощо) [11]. Рухаючись уздовж судини з током крові, емболізат перекриває судину лейоміоми. В маткових артеріях залишається сповільнений тік крові, а нормальні міометральні гілки маткових артерій залишаються функціонуючими. На мікроскопічному рівні вузли зазнають коагуляційного некрозу, організації, скле розування та гіалінізації. У подальшому навколо лейоміоми утворюється кальцифікована капсула [11]. Емболізація міоми може бути ефективною альтернативою міомектомії і гістеректомії. Така операція дозволяє зменшити об’єм інтраопе раційної крововтрати, значно скорочує терміни одужання, знижує рівень летальності та кількість гнійно-запальних ускладнень, зберігає фертиль ність. Після емболізації можуть виникнути тромбо емболічні ускладнення, некроз субсерозного вузла, а також запальні процеси та аменорея [1, 7, 8].
У випадках народження підслизового вузла лейоміоми виконують термінове хірургічне втру чання, що полягає у захопленні верхівки вузла, витягуванні його донизу та обережному відкручу ванні, після чого він легковідокремлюється від стінки матки. Цінну роль в таких випадках відіграє гістероскопія [4, 6, 8]. У разі некротизування народженого підслизового вузла лейоміоми вна слідок порушення його живлення проводиться кон
сервативне лікування (інфузійна, антибактеріаль на, спазмолітична терапія). У подальшому, якщо больовий синдром не ліквідувався, а приєдналися гіпертермія і лейкоцитоз, виконують лапаротомію з ампутацією або екстирпацією матки. У разі пере кручення ніжки підслизової лейоміоми проводиться консервативна міомектомія або гістеректомія [6, 7,10].
Медикаментозна терапія лейоміом є мето дом вибору у жінок, які не підлягають хірургічному лікуванню, відмовляються від нього, або коли опе ративне втручання як таке їм протипоказане. Про те слід пам’ятати, що розміри лейоміоми поверта ються до попередніх (на початок лікування) вже протягом перших 6 місяців після його припинення. Тому, така терапія частіше використовується у комбінованому лікуванні – до та після оперативно го втручання з приводу лейоміоми. При цьому пе ревага надається гормональним препаратам, які більш ефективно, порівняно з негормональними засобами, впливають на системний і локальний гормональний статус. У цьому плані сьогодні ефективніші агоністи Гн-РГ, здатні суттєво змен шувати розміри вузлів та матки. Проте їх застосу вання обмежене часом і не перевищує 6 місяців з огляду на розвиток синдрому медикаментозної ме нопаузи. Механізм дії агоністів Гн-РГ пов’язаний, зокрема, з активацією процесів апоптозу [11]. За даними [11, 12], використання агоністів Гн-РГ до консервативної міомектомії при розмірах вузлів до 20 мм і загальному розмірі матки до 8 тижнів вагіт ності підвищує ризик розвитку рецидиву захво рювання, а «вмурованість» у міометрій вузлів на фоні цього викликає певні труднощі при їх вида ленні. Тому, на думку авторів, застосування агоністів Гн-РГ є недоцільним до операції і по вністю обґрунтованим після її проведення [7, 11]. Це питання в клінічній практиці досі залишається відкритим. Так, інші дані вказують на перспек тивність проведення комбінованої терапії лейо міоми матки з включенням агоністів Гн-РГ до та після консервативної міомектомії [6]. Етапи такого лікування складаються з 2–4 ін’єкцій агоністів Гн РГ з інтервалом 28 днів, консервативної міомек томії та ще однієї ін’єкції агоніста Гн-РГ. Показан ням до такого лікування є бажання пацієнтки збе регти матку та виконати у майбутньому репродук тивну функцію, лейоміома матки розміром понад 5 см, велика кількість вузлів [6]. Застосування агоністів Гн-РГ у таких випадках перед хірургічним втручанням сприяє зменшенню розмірів вузлів, васкуляризації та крововтрати, а внаслідок цього – і тривалості операції. У післяопераційному періоді після консервативної міомектомії у жінок, які отри мували до операції агоністи Гн-РГ, реєструється скорочення часу нормалізації розмірів матки.
Якщо пацієнтка з лейоміомою має супутню доброякісну патологію ендометрія (гіперпластичні процеси), то протягом першого циклу лікування агоністи Гн-РГ доцільно призначати разом з проге стагенами з метою зменшення локальної гіпере строгенемії [1, 4, 6, 8]. Більш ефективними серед них, здатними супресивно впливати на строму ен дометрія,визнано дидрогестерон, норетистерон та лінестрол. Позитивні результати лікування невели ких лейоміом у поєднанні з гіперплазій ендометрія отримано при використанні внутр шньоматкових систем, що виділяють прогестагени (левонор гестрел), хоча явного зменшення розмірів лейо міом при цьому не відбувається [4, 7 8, 11].
Зменшити прояви медикаментозної менопаузи, що розвиваються при застосуванні агоністів Гн-РГ, можна шляхом їх застосування у комбінації із замісною гормонотерапією («add-back» терапія естрогенами та прогестинами) [6, 11]. Це стало можливим завдяки даним, отриманим низкою ав торів: розвиток гіпоестрогенемії не є обов’язковим фактором в регресії міоматозних вузлів, а призна чення малих доз естрогенів не чинить негативного впливу на ефективність терапії агоністами Гн-РГ [7, 11].
У лейоміомі, на відміну від незміненого міометрія, знайдено підвищений вміст ферменту ароматази та, як наслідок, механізм позагонадного синтезу естрогенів [11]. Виходячи з цього, вираже на регресія лейоміоми досягається при застосу ванні селективного блокатора ароматази (анастра золу). Такими препаратами лікуються хворі на рак молочної залози; водночас, для терапії лейоміоми цей засіб не використовується з огляду на високу ціну та недоцільність розробки схем лікування менш тяжкого порівняно з раком захворювання. Деякі дослідники медикаментозне лікування лейо міоми пропонують проводити шляхом використан ня міфепристону – антипрогестеронового препарату, здатного пригнічувати дію прогестерону на міо метрій [11].
Антигонадотропіни (даназол) не рекомендуються для лікування лейоміом, оскільки є не та кими ефективними, як агоністи Гн-РГ, і мають ви ражений андрогенний ефект [6].
Разом з гормональним лікуванням жінкам з лейоміомою за наявного больового синдрому при значають спазмолітики та нестероїдні протизапальні препарати, кровотеч – гемостатики. Врахо вуючи патогенетичну роль хронічного запального процесу геніталій в розвитку лейоміоми, також по казані курси антибактеріальної терапії, ангіопро текторів, антиагрегантів, антиоксидантів та імуно коригуючих засобів. З метою корекції внутрішнього метаболізму застосовують полівітаміни, седативні препарати, фітопрепарати (брюссельська капуста, броколі, при дисфункціональній матковій кровотечі
- Capsella bu sa pastoris; фітоконцентрати з імуно коригуючою та антиоксидантною дією). У комплексі лікування доцільні радонові та йодобромні ванни – 10–12 проце ур на курс, а також ендоназальна йоногальванізація. Обов’язковою є корекція пато логії щитоподібної залози [6]. Для покращання ме таболічних процесів як на фоні гормонотерапії лейоміоми, так і у післяопераційному періоді у жінок з гістер- та міомектомією, показані гепатоза хисні препарати.
Профілактика розвитку лейоміоми полягає у попередженні дисгормонозів. До групи ризику належать жінки різного віку з порушеннями мен струального циклу за типом полігіперменорей, ме нометрорагій, пацієнтки з ановуляціями, гіпер плазією ендометрія, ті жінки, хто не реалізував свою репродуктивну функцію, не має статевих сто сунків, не відчуває оргазму. За даними [11], єдиним засобом, що може забезпечити профілактику ро звитку лейоміоми матки, є використання оральних контрацептив в. При цьому пригнічується овуляція, не утворюється жовте тіло, відсутня секреція про гестерону та припинений щомісячний запуск про ліферативних процесів у міометрії.
Досвід свідчить, що проведення оператив ного лікування жінці, в якої випадково виявлено асимптомну міому, з метою профілактики її малігнізації не отримало широкого використання і не рекомендується, оскільки немає доказових ре зультатів на користь цього. Крім того, багато жінок не бажають видаляти матку, бо з її наявністю пов’язують свою жіночість. До того ж, недостатньо обґрунтоване оперативне втручання може супро воджуватися ризиком серйозних ускладнень, які за значущістю можуть перевищити р зик від лейо міоми.
Щодо диспансеризації жінок з асимптомним перебігом лейоміоми матки розмірами до 12 тиж нів, то вони повинні звертатися до лікаря 1 раз на рік,а у разі виникнення симптомів захворювання – частіше, з метою обрання методу лікування. При цьому важли о звертати увагу на відсутність або наявність інших утворень органів малого тазу. З іншого боку, при асимптомній лейоміоміпонад 12 тижнів, коли пацієнтка відмовляється від операції або за наявності протипоказань до неї, консульту вання у лікаря необхідне не рідше одного разу на рік з отриман ям консервативної терапії [6].
Література
- Вихляева Е.М. Миома матки. – М.: МЕД пресс- информ, 2004. – 399 с.
- Долецкая Д.В., Ботвин М.А., Победин ский Н.М., Кириллова Т.Ю. Оценка качества жизни у больных с миомой матки после различных видов хирургического лечения//Акуш. и гинекол. – 2006. –№1. – С. 10–13.
- Жилка Н.О., Іркіна Т.М., Степаненко В.А. Стан репродуктивного здоров’я в Україні (медико- демографічний огляд). – К., 2001. – 68 с.
- Іванюта Л.І., Іванюта С.О. Лейоміома матки (причини виникнення, діагностика, принципи лікування)//Лікування та діагностика. – 2002. – №3.– С. 44–48.
- Коган Е.А., Игнатова В.Е., Рухадзе Т.И. Роль ростовых факторов в развитии гистологиче ских типов лейомиомы матки//Арх. патол. – 2005. – Т.67. – С. 34–38.
- Наказ МОЗ України №582 від 12.2003 р. «Про затвердження клінічних протоколів з аку шерської та гінекологічної допомоги»//Клінічні про токоли з акушерської та гінекологічної допомоги. – К., 2003.
- Савельева Г.М., Бреусенко В.Г., Голова Ю.А. Современные технологии в диагностике и лечении заболеваний матки//Росс. мед. журн. – 2006. – №5. – С. 22–25.
- Савицкий Г.А., Савицкий А.Г. Миома матки (проблема патогенеза и патогенетической терапии). – СПб.: ЭЛБИ, 2000. – 235 с.
- Стрижаков А.Н., Давыдов А.И., Бахтия ров К.Р., Клиндухов И.А. Патогенетическое обос нование применения органосохраняющего лече ния при доброкачественных заболеваниях матки с использованием методов малоинвазивной хирур гии//Вопр. гинекол., акуш. и перинатол. – – Т.5, №3. – С. 23–27.
- 10.Татарчук Т.Ф., Косей Н.В., Альтман И.В., Кондратюк В.А. Опыт органосохраняющего лечения гигантских лейомиом матки//Зб. наук. праць Асоціації акушерів-гінекологів України. – К.: Інтер мед, 2008. – С. 697–700.
- 11. Тихомиров А.Л., Лубнин Д.М. Новый принцип лечения миомы матки: Метод. руковод ство для врачей акушеров-гинекологов. – М.,– 49 с.
- 12. Fedele L., Vercelline P., Bianchi S. Treat ment with GnRH agonists before myomectomy and the risk of short-term myoma recurrence//Br. Ob stet. Gynaecol. – 1990. – V.97, №5. – P. 393–396.
- 13.Vercelline P., Trespidi L., Zaina B. Gon adotropinreleasing hormone agonist treatment before abdominal myomectomy: a controlled trial//Fertil. – 2003. – V.79, №6. – P. 1390–1395.








Комментировать