Лабораторная диагностика надпочечниковой недостаточности. Острые гинекологические заболевания, их диагностика на догоспитальном этапе. Трудности.
Фадеев В.В., Мельниченко Г.А.
Кафедра эндокринологии ММА им. И.М. Сеченова
Публикация выполнена по материалам работ:
1. Мельниченко Г.А., Фадеев В.В. Основы лабораторной диагностики надпочечниковой недостаточности(лекция). // Клиническая лаборат. диагностика. – 1997. – N 8. – С. 25 – 32.
2. Мельниченко Г.А., Фадеев В.В. Лабораторная диагностика надпочечниковой недостаточности. // Пробл. Эндокринол. – 1997. – Т. 43, N 5. – С. 39 – 47.
I. Общие положения, классификация
Надпочечниковая недостаточность (НН) клинический синдром, обусловленнный недостаточной секрецией гормонов коры надпочечников, являющийся результатом нарушения функционирования одного или нескольких звеньев гипоталамогипофизарнонадпочечниковой системы (ГГНС). При широкой трактовке понятия НН, к этому синдрому помимо собственно гипокортизолизма, можно отнести врожденную дисфункцию коры надпочечников (ВДКН, врожденный адреногенитальный синдром), изолированный гипоальдостеронизм и некоторые другие еще более редкие заболевания. Однако, как правило под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортизолизма. Первичная хроническая надпочечниковая недостаточность (1ХНН) аутоиммунной и туберкулезной этиологии более известна под названием болезнь Аддисона, которая была названа в честь английского врача Thomas Addison, впервые в 1855 году описавшего клиническую картину заболевания.
Классификация хронической надпочечниковой недостаточности
I. Первичная ХНН
1. Аутоиммунная деструкция коры надпочечников (85% от всех случаев 1НН [27]).
2. Туберкулез, амилоидоз, грибковые инфекции, сифилис, метастазы опухолей, ВИЧ ассоциированный комплекс, адренолейкодис трофия.
3. Ятрогенная 1ХНН (двусторонняя адреналэктомия по поводу болезни ИценкоКушинга, двустороннее кровоизлияние в надпочечники на фоне терапии антикоагулянтами).
II. Центральные формы НН.
1. Вторичная ХНН (2ХНН). Обусловлена патологией гипофиза и возникает в результате любой из причин гипопитуитаризма.
2. Третичная ХНН (3ХНН). Опухоли, ишемические и любые другие повреждения гипоталамической области.
1ХНН развивается в следствии двусторонней деструкции коры надпочечников и является относительно редким заболеванием 4060 новых случаев на 1 млн. взрослых в год [27]. Центральные формы НН могут явиться следствием дефицита продукции АКТГ гипофизом (2ХНН) и/или кортикотропинрилизинггормона (КРГ), а возможно и других гипоталамических стимуляторов секреции АКТГ (3ХНН). Истинная частота центральных форм НН неизвестна, но ее наиболее частой причиной является подавление ГГНС на фоне хронической терапии глюкокортикоидами. ХНН имеет широкий спектр клинических проявлений, выраженность которых варьирует от грубых гемодинамических нарушений, до субклинической дисфункции, которая может манифестировать только на фоне тяжелого стресса. В этой связи, лабораторной диагностике НН, о которой и пойдет речь в нашей работе придается первостепенное значение.
Наиболее частыми клиническими ситуациями в которых оказывается необходимым исследовать функциональное состояние ГГНС на предмет выявления НН являются следующие:
1. Обследование пациентов у которых имеются клинические признаки НН или подозрение на нее. Целью обследования является выяснение адекватности продукции кортизола корой надпочечника. После того, как диагноз НН установлен, необходимо определить уровень повреждения ГГНС. Каждой из этих задач служат различные диагностические тесты.
2. Обследование пациентов, имеющих высокий риск развития НН. Самым частым фактором риска является длительная терапия препаратами глюкокортикоидных гормонов, затем следуют различные гипоталамогипофизарные заболевания, особенно если по их поводу предпринимались нейрохирургические вмешательства или лучевая терапия.
Лабораторная диагностика НН строится на трех основных принципах функционирования ГГНС:
1. Кортизол по механизму отрицательной обратной связи подавляет секрецию АКТГ гипофизом и КРГ гипоталамусом.
2. Основным секреторным и трофическим регулятором деятельности коры надпочечников является АКТГ. Небольшой по длительности недостаток АКТГ приводит к обратимому подавлению секреции кортизола, в дальнейшем эти изменения становятся необратимыми.
3. ГГНС может быть активизирована различными фармакологическими и/или физиологическими стимулами, что на практике используется для выяснения ее потенциальных функциональных резервов.
II. Кортизол и его метаболиты
Нормальная продукция кортизола осуществляется благодаря координированному функционированию всей ГГНС. На протяжении суток высвобождение гормона происходит в пульсирующем режиме и наиболее высокого уровня достигает в ранние утренние часы. Продукция кортизола корой надпочечников активизируется при падении уровня гормона в плазме, а также в ответ на физиологические стрессоры, такие как гипогликемия. В качестве самостоятельного теста, уровень кортизола исследуется между 6 и 8 часами утра. Кроме того, он определяется в рамках различных динамических тестов, исследующих состояние ГГНС.
Необходимо иметь в виду, что ряд препаратов глюкокортикоидов, в частности гидрокортизон (кортизол), кортизон и метилпреднизолон (медрол, урбазон) дают перекрестную реакцию с эндогенным кортизолом, что требует их отмены как минимум за 24 часа до исследования. Дексаметазон такой перекрестной реакции не дает, однако, следует иметь в виду, что он является наиболее мощным ингибитором секреции АКТГ гипофизом. В плазме крови большая часть кортизола (80%) связана со специфическим кортикостероидсвязывающим глобулином транскортином, колебание уровня которого также может сказаться на результатах определения уровня кортизола [2]. Эстрогены (в том числе входящие в контрацептивные препараты) стимулируют продукцию транскортина печенью, в результате чего увеличивается и общий уровень кортизола. При циррозе печени, нефротическом синдроме, тиреотоксикозе и ряде других состояниях, содержание транскортина в плазме уменьшается, однако на плазменном уровне кортизола это сказывается далеко не всегда.
На протяжении многих десятилетий глюкокортикоидная функция надпочечников оценивалась по уровню суточной экскреции 17оксикортикостероидов с мочой (реакция ПортераЗильбера). Несмотря на то, что 7080% экскретируемых метаболитов кортизола относится к фракции 17кетогенных стероидов (кортол, кортолон), в состав 17ОКС входят наиболее физиологически важные стероиды кортизол, кортизон, 11дезоксикортизол и их тетрагидроформы. В норме уровень экскреции 17ОКС у взрослых составляет примерно 8,222 мкмоль (38 мг) в сутки. Несмотря на достаточно низкую диагностическую ценность этого исследования, его результаты, для сопоставления с данными литературы прошлых лет продолжают описываться и в современных работах. Еще менее информативна оценка суточной экскреции 11оксикортикостероидов, к фракции которых помимо кортизола и кортизона относится кортикостерон. Экскреция 11ОКС с мочой в норме составляет 250830 нмоль в сутки. Кроме того, имеются различные варианты исследования плазменного уровня метаболитов кортикостероидов, в том числе и в рамках динамических тестов (см. ниже). Следует еще раз подчеркнуть, что определение уровней 17ОКС и 11ОКС малоинформативные методы, которые на сегодняшний день как в диагностике патологии надпочечников, так и в клинической медицине в целом, использоваться не должны.
III. Косвенные лабораторные данные
Косвенная оценка надпочечниковой функции, а в клинической практике ориентировочная оценка адекватности заместительной терапии, может производиться исходя из минералокортикоидных эффектов кортикостероидов и их препаратов. Кортизол (не говоря уже об альдостероне, а в той или иной степени, о большинстве синтетических стероидов), действуя на уровне почечных канальцев повышает задержку в организме натрия и экскрецию калия с мочой. Таким образом, для гипокортицизма характерны гиперкалиемия и гипонатриемия той или иной степени выраженности. Результатом глюкокортикоидной недостаточности является гипогликемия. Кроме того, в крови часто отмечаются нормохромная или гипохромная анемия, умеренная лейкопения, относительный лимфоцитоз и эозинофилия. СОЭ возрастает лишь при сопутствующем воспалительном процессе [1].
IV. Экскреция свободного кортизола с мочой
РИА с использованием высокоспециффических антител, которые связываются исключительно с Dкольцом кортизола, исключает перекрестную реакцию с другими стероидами. Экскреция свободного кортизола составляет менее 1% от объема его суточной секреции надпочечниками, однако вполне адекватно отражает последнюю. На фоне развернутой клинической картины болезни Аддисона, низкое содержание свободного кортизола в суточной моче (норма: 55250 нмоль (2090 мкг) в сутки), свидетельствует о НН и диктует необходимость начала заместительной терапии.
Однако ценность этого метода в диагностике НН также ограничена, поскольку 20% больных НН имеют нормальное содержание свободного кортизола в суточной моче [35].
V. Утренний уровень кортизола
Для оценки функционального состояния коры надпочечников уже длительное время используется определение уровня кортизола плазмы в утренние часы, поскольку именно этот уровень отражает пик активности ГГНС. Однако, нормальный уровень кортизола 925 мкг% (0,24 0,69 мкмоль/л) может определяться и при наличии НН.
В одном исследовании у 15% пациентов с документированной НН утренний кортизол колебался в пределах 919 мкг% [35]. При сопоставлении уровня утреннего кортизола с результатами других исследований выяснилось, что у 51 из 52 пациентов, у которых он составил 11 мкг% (0,3 мкмоль/л), инсулинотолерантный тест (ИТТ) патологии не выявил [11].
В другом исследовании, ИТТ оказался отрицательным у всех пациентов с уровнем кортизола выше 14 мкг% (0,39 мкмоль/л) [38]. Приводить оторванную от конкретной лаборатории пограничную цифру не целесообразно, однако, можно с уверенностью сказать, что уровень утреннего кортизола плазмы выше 19 мкг% (0,53 мкмоль/л) исключает НН и такие пациенты в дальнейшем обследовании на этот счет не нуждаются [10].
Нормальный уровень утреннего кортизола считается маркером нормальной надпочечниковой функции после операций на гипофизе и после длительной глюкокортикоидной терапии. Было показано, что утренний уровень кортизола, превышающий 9 мкг% (0,25 мкмоль/л) спустя несколько дней после операции на гипофизе является благоприятным и еще через 23 дня у этих пациентов можно обнаружить нормальную реакцию в ИТТ [40].
Спорной является информативность определения уровня утреннего кортизола у больных, находящихся на хронической терапии глюкокортикоидами. Только половина из них, с уровнем кортизола более 5 мкг% (0,14 мкмоль/л) демонстрировала при дальнейшем обследовании адекватную реакцию на введение КРГ [32]. Следует однако заметить, что уровень кортизола в 5 мкг% в этом исследовании был выбран достаточно низким. Большинство исследователей утверждает, что уровень кортизола менее 3 мкг% (0,08 мкмоль/л) является абсолютно диагностичным в отношении НН [11,32,40].
Таким образом, становится понятной недостаточная информативность исследования утреннего уровня кортизола у многих пациентов он будет иметь пограничные значения, то есть примерно между 3 и 19 мкг%, что требует дальнейшего обследования. И тем не менее, простое технически определение уровня кортизола в плазме крови между 6 и 8 часами утра, в обследовании пациентов с подозрением на наличие у них НН является тестом “первого уровня”. Обнаружение у пациентов нормальных, пограничных или очень низких показателей позволяет быстро сориентироваться в ситуации и определить целесообразность дальнейшего обследования.
VI. Произвольное определение уровня кортизола
Исследование уровня кортизола в произвольно взятый момент времени (не утром) целесообразно только по неотложным показаниям [10], в состоянии тяжелого стресса, когда, с одной стороны, ГГНС максимально активирована, а с другой стороны нет времени дожидаться утра или проводить динамическое исследование (стимулирующие тесты). Диагноз острой НН как правило устанавливается на основании клинической картины. Помочь в этом плане может обнаружение характерной дисэликтролитемии (гиперкалиемия, гипонатриемия). При подозрении на острую НН заместительная терапия должна быть начата сразу же после забора крови. Если с этой целью используется дексаметазон, это никак не отразиться на результатах синактенового теста, который необходимо будет провести в дальнейшем.
Уровень кортизола ниже 18 мкг% (0,49 мкмоль/л) в ситуации острого физиологического стресса расценивается как неадекватно низкий [25]. Этот вывод авторы сделали на основании последующего короткого синактенового теста. Уровень кортизола у тяжелобольных колеблется в широких пределах. Есть сообщения об уровнях кортизола 22, 40 и 15 мкг% у пациентов , соответственно с желудочнокишечными кровотечениями, дыхательной недостаточностью и сепсисом [10]. Уровень кортизола плазмы у тяжелобольных ниже 13 мкг% (0,36 мкмоль/л) является прогностически неблагоприятным: высокая смертность, как правило неадекватная реакция в ответ на стимуляцию АКТГ [25]. Существуют данные о пациентах, у которых в тяжелом состоянии уровень кортизола составлял 5 мкг%, а проведенный в дальнейшем тест с АКТГ выявлял нормальный секреторный ответ коры надпочечников [17]. Таким образом, уровень кортизола на фоне тяжелого стресса (в произвольно взятый момент времени) ниже 5 мкг% свидетельствует о НН, уровень в пределах 513 мкг% позволяет с высокой долей вероятности предполагать НН и диктует необходимость начала терапии глюкокортикоидами в связи с потенциальной опасностью ситуации. Уровень 1318 мкг% пограничный, требует динамического обследования и временного назначения глюкокортикоидов [10].
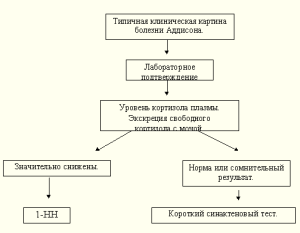
В реальной работе практического врача диагностический поиск очень часто этими исследованиями и ограничивается (см. схему 1). Такая ситуация возможна только в случае яркой, классической клинической картины, которой соответствуют выраженные и типичные лабораторные сдвиги.
Клинический пример 1.
Пациентка А., 35 лет, в течении полутора лет наблюдалась в клинике эндокринологии ММА с диагнозом первичный гипотиреоз средней степени тяжести как исход аутоиммунного тиреоидита и получала заместительную терпию Lтироксином в дозе 100 мкг. В связи с прогрессирующим ухудшением самочувствия была госпитализирована.
Жалобы: Выраженная слабость, невозможность переносить привычные нагрузки, похудание на 9 кг за истекшие полгода, потемнение кожных покровов, постоянная тяга к соленой пищи в сочетании с плохим аппетитом, дискомфортом в эпигпстральной области, неустойчивым стулом. Головокружения при вставании с пастели, частый пульс, ощущение перебоев в работе сердца.
Из анамнеза: Пять лет назад при диспансерном обследовании у пациентки была выявлена железодефицитная анемия (Hb 85 г/л, ОЖСС 105 мкмоль/л), что послужило основанием для комплексного обследования, при котором был диагносцирован первичный гипотиреоз (ТТГ 38 мкМЕ/мл).Уровень антител к тиреоглобулину 110,43 Ед/мл. На фоне адекватной заместительной терапии удалось добиться нормализации самочувствия и лабораторных показателей. Через 2 года родила здорового ребенка. На протяжении последних полугода нарастала общая слабость к которой постепенно присоединились все описанные жалобы.
При обследовании: Вес 46 кг, при росте 168 см. При осмотре выраженная диффузная гиперпигментация кожи, особенно шеи, плеч, ладонных складок, паховой области, темная окраска слизистых полости рта. АД 80/60 мм Hg, ЧСС 98 уд/мин. Тоны сердца ясные, дыхание везикулярное, При пальпации умеренная разлитая болезненность в эпигастральной области. Пальпаторно щитовидная железа плотноватая, объем при УЗИ 24 см3. ЭКГ: АВблокада I степени, низкий вольтаж во всех отведениях, относительно высокий и заостренный зубец Т. Лабораторно: Hb 115 г/л, Na+ 120 ммоль/л, K+ 5,7 ммоль/л, глюкоза 3,5 ммоль/л, ТТГ 1,1 мкМЕ/мл, кортизол плазмы (8.00) 6,4 мкг%, суточная экскреция свободного кортизола с мочой 16 нмоль/сут.
На основании приведенных данных пациентке был установлен диагноз 1НН и начата заместительная терапия.
Комментарии: Меланодермия свидетельствует о первичном генезе НН. Достаточно типично сочетание аутоиммунного тиреоидита и болезни Аддисона аутоиммунного генеза около 10% случаев последней, которое обозначается как аутоиммунный полигландулярный синдром Шмидта.
Схема 1
VII Исулинотолерантный тест (ИТТ)
ИТТ один из самых старых, однако до сегодняшнего дня не потерявших своего значения в диагностике НН тестов, который позволяет исследовать интегративную целостность сразу всей ГГНС. Гипогликемический стресс является сильным непрямым стимулятором секреции кортизола, которая опосредуется через активацию гипоталамических центров и кортикотропной функции гипофиза.
Инсулин короткого действия вводится внутривенно в дозе 0,10,15 Ед/кг. Если у пациента имеет место инсулинорезистентность того или иного генеза (например, при акромегалии), дозу инсулина можно повысить. Следует иметь в виду, что доза инсулина менее 0,1 Ед/кг не приведет к достаточной активации ГГНС [19]. Как и в синактеновом тесте (см. ниже), в ИТТ наиболее важным показателем является не прирост уровня кортизола от базального, а его пиковый уровень, более адекватно отражающий резервные функциональные способности ГГНС [8]. Нормальную надпочечниковую функцию отражает подъем уровня кортизола на протяжении теста выше 18 мкг% (0,5 мкмоль/л) [10,26]. НН диагносцируется если пиковый уровень кортизола не достигает 18 мкг% и при этом развивается гипогликемия (40 мг% = 2,2 ммоль/л). В редких случаях, при наличии клинических признаков НН, ИТТ может оказаться отрицательным. Это было продемонстрировано на группе, состоящей из 6 человек, у которых, несмотря на гипокортизолемию и регресс симптомов НН на фонетерапии глюкокортикоидами определялось достаточное повышение уровня кортизола в ответ на гипогликемию [39]. И тем не менее, ИТТ считается чувствительным тестом, исследующим функциональное состояние ГГНС, особенно в плане выявления кортикотропных резервов гипофиза у пациентов, имеющих риск развития 2НН [10,30]. Основным недостатком ИТТ является его потенциальная опасность в плане развития при имеющейся НН тяжелых гипогликемий, которые могут сопровождаться сосудистым коллапсом, то есть может быть спровоцирован аддисонический криз. Пожилым пациентам, а также при имеющейся сердечнососудистой и другой тяжелой патологии ИТТ противопоказан.
VIII Синактеновый стимуляционный тест
Синактен (кортрозин, 124кортикотропин) представляет собой соединение, состоящее из первых 24х от всего 39аминокислотного состава природного АКТГ, и обладает всеми его фармакологическими свойствами, то есть, при нормальном функциональном состоянии коры надпочечников, он стимулирует биосинтез кортикостероидов. Стимуляционный тест с исследованием уровня кортизола плазмы через 30 и 60 минут после внутривенного введения 250 мг (25Ед) синактена на 5 мл физиологического раствора классическое исследование в диагностике НН. Однако этот тест позволяет исследовать только функциональную целостность коры надпочечников и лишь косвенно судить о состоянии всей ГГНС, поскольку в такой дозе и за такой промежуток времени АКТГ не успевает оказать на кору надпочечника трофического влияния, вызывая лишь экстренный секреторный ответ. При достаточно длительном нарушении продукции АКТГ в результате гипоталамогипофизарной патологии надпочечники теряют способность реагировать на кратковременную экзогенную стимуляцию. В отношении короткого синактенового теста обсуждаются в основном два вопроса: вопервых, оцениваемые в тесте показатели (пик кортизола или относительный прирост его уровня), вовторых, диагностические критерии.
Раньше значение придавалось обоим указанным показателям, однако, как выяснилось, относительный прирост уровня кортизола плазмы (то есть в % от базального), показатель не вполне надежный [10]. В одном из исследований, было показано, что у трети нормальной контрольной группы уровень кортизола плазмы в ответ на введение АКТГ повысился менее чем на 7 мг% [36]. В связи с тем, что относительный прирост кортизола обратно пропорционален его базальному уровню, утром, когда уровни эндогенного АКТГ и кортизола максимальны, этот прирост будет небольшим [20,23]. Максимальный уровень, которого кортизол достигает в ответ на введение синактена является более ценным показателем, позволяющим судить о функциональном состоянии надпочечников[3,10]. Таким образом, ориентироваться на один только прирост уровня кортизола в тесте с синактеном, как это рекомендует ряд руководств [1,2] , не следует.
Подъем кортизола до уровня 1525 мкг% (0,420,69 мкмоль/л) в тесте с синактеном принято считать критерием нормального надпочечникового ответа на стимуляцию [10]. Уровень кортизола в 1820 мкг% (0,50,55 мкмоль/л) имеет хорошие подтверждения в литературе [36]. Ценность короткого синактенового теста показана в работах, сопоставлявших его результаты с полученными в других динамических исследованиях. Только в 8 случаях из 200 обследованных на предмет НН человек, результаты синактенового теста и ИТТ расходились. В 6 случаях эти расхождения были либо незначительными, либо они относились к неадекватной реакции на гипогликемию. В двух случаях, где у пациентов имела место острая гипофизарная дисфункция синактеновый тест патологии не выявил, тогда как ИТТ свидетельствовал о НН [22]. Эти случаи демонстрируют тот феномен, когда на протяжении нескольких недель с момента выпадения собственной секреции АКТГ кора надпочечника еще сохраняет способность нормально реагировать на экзогенное введение АКТГ [13]. Как было показано, при впервые диагносцированных (свежих) заболеваниях гипоталамогипофизарной системы тест с синактеном может оказаться ложноотрицательным, по сравнению с положительными результатами ИТТ [4]. Наиболее частой клинической ситуацией, в которой не показано проведение синактенового теста является послеоперационный период после нейрохирургического вмешательства на гипофизе, когда эндогенная секреция АКТГ может быть нарушена, а кора надпочечника еще не успела подвергнуться гипоили атрофии. В этой ситуации целесообразно определение утреннего уровня кортизола, а также проведение метирапонового теста или ИТТ. Последний тест хотя и является более чувствительным в плане исследования АКТГ резервов, имеет много противопоказаний. В этой связи, как альтернатива стандартному тесту с 250 мг синактена, был предложен тест с 5 мг синактена, который, как выяснилось, в этой ситуации оказался чувствительнее первого. Из 26 пациентов, у которых ИТТ выявил снижение резервов АКТГ, тест с 250 мг синактена обнаружил НН только у 18, тогда как тест с 5 мг у 22 пациентов, которым накануне было предпринято нейрохирургическое вмешательство на гипофизе [30]. Через месяц после вмешательства методом выбора, повидимому, является стандартный синактеновый тест, хотя были описаны его ложноотрицательные по сравнению с ИТТ результаты и через 3 месяца после операции [6].
Наиболее часто причиной относительной надпочечниковой недостаточности является подавление ГГНС длительным экзогенным введением глюкокортикоидов [10]. Основным вопросом в отношении таких больных является их способность переносить сильные стрессорные воздействия, в том числе оперативные вмешательства, без дополнительного назначения глюкокортикоидов. Нормальное повышение уровня кортизола в ответ на стимуляцию синактеном хорошо коррелирует с уровнем кортизола, который определяется во время операции [18]. Более того, пациенты с субнормальным ответом на синактен в периоперативном периоде продемонстрировали меньший подъем уровня кортизола, чем пациенты с нормальным ответом на синактен, но патологическими результатами ИТТ и метирапонового теста[15].
Таким образом, короткий синактеновый тест является на сегодняшний день “золотым стандартом” в диагностике НН, за исключением случаев de novo заболеваний гипоталамогипофизарной системы (в первую очередь речь идет о состояниях после операций на гипофизе). Повышение уровня кортизола до 18 мкг% (0,5 мкмоль/л) и более на протяжении теста является адекватным. При небольшом снижении этого уровня до 1317 мкг% (0,360,47 мкмоль/л), тест следует повторить. Решение вопроса о необходимости начала заместительной терапии решается индивидуально, в зависимости от весомости подозрения на НН [10,24].
Клинический пример 2.
Больной В.,45 лет поступил в клинику эндокринологии ММА с жалобами на общую слабость, головные боли плохой сон.
Из анамнеза: Заболел полгода назад, когда на фоне постоянного на протяжении последних 57 лет злоупотребления алкоголем, после очередного эксцесса появилось желтушное окрашивание кожных покровов, анорексия, частая рвота, посветление кала и потемнение мочи. При обследовании по месту жительства в отделении гастроэнтрологии был диагносцирован острый алкогольный холестатический гепатит. Состояние пациента было расценено как тяжелое. Проводилась массированная дезинтоксикационная терапия, в том числе два сеанса плазмафереза, а также десятидневный курс гепаринотерапии в суточной дозе около 40.000 ЕД. На этом фоне в первые дни состояние начало улучшаться, однако на десятый день резко ухудшилось, значительно усилилась слабость, давление упало до 80/55 ммHg, появились петехиально-пятнистые высыпания по всему телу. Ситуация была расценена как передозировка гепарина и давление удалось стабилизировать только вливанием преднизолона и плазмозамещающих растворов. При гормональном исследовании было выявлено снижение плазменного уровня кортизола до 6 мкг%, по поводу чего был назначен кортизон в дозе 50 мг/сут, на фоне которого состояние постепенно нормализовалось. Пациент поступил в клинику с указанными жалобами для специализированного дообследования и подбора терапии.
При обследовании: рост 181, вес 92 кг (повышенного питания), кожные покровы чистые, гиперпигментаций не обнаружено. ЧСС 72 уд/мин, АД 110/70 ммHg. При физикальном и рутинном лабораторном обследовании патологических изменений выявлено не было. При поступлении пациента в клинику с диагностической целью был отменен кортизон. На этом фоне какойлибо клинической динамики отмечено не было, несмотря на значительно сниженную экскрецию свободного кортизола с мочой до 26 нмоль/сут. Приведенные данные поставили под сомнение установленный ранее диагноз надпочечниковой недостаточности, Был проведен короткий синактеновый тест. Кортизол: исходно 7 мкг%, через 30 мин 10 мкг%, через 60 минут 9,5 мкг%. Плазменный уровень АКТГ 115 пг/мл. Пациенту был установлен диагноз 1НН и возобновлена терапия кортикостероидами. В дальнейшем, при ЯМРтомографии области надпочечников было выявлено значительное уменьшение размера левого и отсутствие правого надпочечника.
Комментарии: Эпизод петехиальной сыпи, сопровождающейся падением АД, был расценен как приступ острой надпочечниковой недостаточности, развившейся в результате кровоизлияния в надпочечники на фоне массивной гепаринотерапии. Дальнейшие рубцовые изменения и сморщивание надпочечников дали характерную ЯМРтомографическую картину.
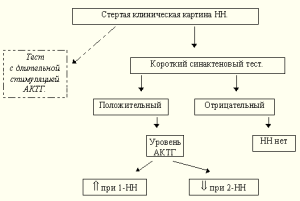
Схема 2.
IX. Метирапоновый тест
Метирапоновый (метопироновый) тест исследует наличие функциональных резервов АКТГ гипофиза. Метирапон подавляет надпочечниковый фермент 11 гидроксилазу, который обеспечивает превращение 11дезоксикортизола (вещество S) в кортизол, что является конечным этапом надпочечникового стероидогенеза. 11дезоксикортизол хотя и обладает глюкокортикоидной активностью, он не подавляет продукцию АКТГ гипофизом. В норме при приеме метирапона блокада продукции кортизола приведет к стимуляции секреции АКТГ, которая, в свою очередь, активизирует стероидогенез проксимальнее ферментного блока и приведет к накоплению избытка 11дезоксикортизола. При НН этого не произойдет.
В классической форме (Liddle et al.) метирапоновый тест заключается в даче пациенту 500750 мг препарата per os 6 раз каждые 4 часа (суммарно 3 4,5 г), с оценкой содержания 17ОКС в моче (одной из фракций которых является 11дезоксикортизол) на протяжении последующих двух дней [21]. О НН будет свидетельствовать увеличение содержания 17ОКС в суточной моче менее чем в 23 раза от исходного уровня. В дальнейшем была предложена более простая модификация метирапонового теста. Препарат в дозе 30 мг/кг выпивается пациентом одномоментно ночью в 24.00. На следующее утро в 8.00 производится забор крови для определения в ней содержания кортизола и 11дезоксикортизола [37]. Поскольку метирапон потенциально может спровоцировать острую НН, тест проводится только у госпитализированных пациентов. После забора крови, пациентам с вероятной НН профилактически вводится преднизолон или гидрокортизон [10]. Нормальную функцию ГГНС отражает уровень 11дезоксикортизола более 7 мкг% (0,19 мкмоль/л), независимо от параллельно определенного уровня кортизола [37]. НН диагносцируется если 11дезоксикортизол не достигает уровня 7 мкг% и при этом определяется низкий уровень кортизола (25 мкг% = 0,060,14 мкмоль/л). Последний свидетельствует об адекватной блокаде 11 гидроксилазы. Если уровень 11гидроксикортизола ниже 7 мкг%, а уровень кортизола превышает 5 мкг% никакого заключения по результатам теста сделать нельзя.
В плане диагностики НН метирапоновый тест, повидимому, является наиболее чувствительным [10]. В одном исследовании сравнивалась диагностическая ценность метирапонового, синактенового тестов и ИТТ у пациентов, перенесших хирургическое вмешательство на гипофизе и пациентов длительно получавших терапию глюкокортикоидами.
В 6 случаях из 25 результаты тестов расходились. Синактеновый тест оказался положительным в одном, ИТТ в трех, а метирапоновый тест в 4 из этих 6 случаев [12]. В другой работе изучалось функциональное состояние ГГНС у 31 пациента, перенесшего облучение области гипофиза, при этом определялся уровень кортизола, а также проводились тесты с синактеном, КРГ и метирапоном. У всех пациентов уровень утреннего кортизола, а также результаты тестов с АКТГ и КРГ были в пределах нормы, тогда как метирапоновый тест оказался положительным в 35% случаев [5]. Клиническое значение выявленной в данном случае дисфункции ГГНС остается непонятным.
Таким образом, высокая чувствительность метирапонового теста сомнений не вызывает, однако его специфичность требует дальнейшего изучения.
Результаты метирапонового теста могут быть искажены приемом глюкокортикоидов, фенитоина (дифенина) и фенобарбитала. Последние два препарата усиливают метаболизм метирапона, снижая таким образом его плазменный уровень и делая неадекватной блокаду 11 гидроксилазы [24].
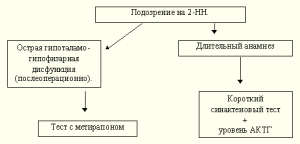
Схема 3
X. Определение уровня поражения ГГНС
После того, как с помощью описанных исследований диагноз НН установлен, на следующем этапе необходимо выявить уровень поражения ГГНС. Это во многом определяет тактику лечения. Так пациентам с 2НН нет необходимости назначать препараты минералокортикоидных гормонов (кортинефф), поскольку при этой форме клубочковая зона коры надпочечника интактна и продолжает функционировать автономно в системе ренинангиотензинальдостерон. При 1НН в деструктивный процесс вовлекается вся кора надпочечника, что в большинстве случаев требует дополнительного назначения минералокортикоидов. Информативность инструментальных методов обследования (прежде всего КТ и МРТ) варьирует в зависимости от предполагаемого уровня повреждения ГГНС и его характера. Указанные визуализирующие методы более ценны в плане выявления гипоталамогипофизарной патологии, чем в диагностике 1НН (за исключением случаев поражения надпочечников объемным процессом, и возможного обнаружения калицинатов при туберкулезе). Таким образом, целесообразность использования визуализирующих методов будет определяться исходя из данных клинической картины и лабораторных исследований.
XI. Уровень АКТГ
Исследование плазменного уровня АКТГ позволяет дифференцировать 1и 2НН. Секреция АКТГ происходит пульсаторно и, если гипофиз и гипоталамус интактны, в ответ на гипокортизолемию она возрастает. Уровень АКТГ более 100 пг/мл, определенный с помощью РИА [10], при уже подтвержденной НН, однозначно свидетельствует о ее первичном генезе. Короткое время полужизни АКТГ в плазме и его очень большая уязвимость для клеточных ферментов требует скорейшей доставки крови в лабораторию во льду. Забор крови на АКТГ необходимо произвести до назначения глюкокортикоидов, которые нормализуют его уровень буквально за несколько часов. Такое колебание уровня АКТГ можно наблюдать на фоне лечения болезни Аддисона препаратами глюкокортикоидов короткого действия [34]. К последним относят кортизол (гидрокортизон) и кортизон с периодом полувыведения 90 минут, а полураспада 812 часов, в отличии от препаратов средней продолжительности действия преднизолона и метипреда соответственно 200 минут и 1836 часов, и длительного действия дексаметазона и триамциналона 250 минут и 3648 часов.
Следует еще раз подчеркнуть, что само по себе исследование уровня АКТГ для диагностики НН непригодно, а лишь помогает локализовать уровень поражения ГГНС, наличие которого было доказано с помощью описанных выше методик. Как было показано, уровень АКТГ пациентов с гипоталамогипофизарной патологией почти не отличался от такового в контрольной группе 481 пг/мл и 875 пг/мл соответственно [28].
XII. Тест с длительной стимуляцией надпочечников АКТГ
До того, как были разработаны надежные методы определения плазменного уровня АКТГ, для дифференциальной диагностики 1и 2НН использовался тест с длительным введение препаратов АКТГ. При этом по 8 часов в день на протяжении 35 дней подряд пациенту внутривенно вводилось по 250 мг АКТГ, после чего исследовалось содержание 17ОКС в суточной моче. При 1НН кора надпочечника уже никак не может отреагировать на стимуляцию, тогда как при 2НН, наоборот столь длительное введение АКТГ восстанавливает функцию гипотрофированной коры надпочечников и уровень 17ОКС возрастает в 35 раз от базального [16]. Тест со 100% точностью позволяет дифференцировать 1и 2НН [31]. Существует несколько упрощенных модификаций этого теста. При одной из них, однократно внутримышечно вводится синактендепо (1 мг 124кортикотропина), при этом содержание в суточной моче свободного кортизола и 17ОКС исследуется на 1ый, 3ий и 5ый день. В норме их экскреция увеличивается до 300700% от исходной. При полной 1НН уровень свободного кортизола и 17ОКС в крови и в моче будет низким и одинаковым как до, так и после стимуляции. При относительной 1НН исходные показатели могут быть в норме или сниженными, в 1ый день стимуляции увеличиваться до нормы, однако на 3ий день снижаются, сохраняясь на подпороговом уровне. При 2НН в первые дни стимуляции АКТГ уровни свободного кортизола и 17ОКС могут остаться неизменными, но в последующие 35 дней достичь нормы [1,2]. В еще одной модификации теста, АКТГ вводится постоянно внутривенно на протяжении 48 часов со скоростью 3 Ед/час. Содержание 17ОКС в суточной моче на следующий день при 2НН составит как минимум 10 мг/сут, а при 1НН не превысит 4 мг/сут [31].
Следует отметить, что такие препараты как фенобарбитал, рифампицин и фенитоин (дифенин) стимулируют печеночную метаболизацию кортизола до соединений не относящихся к фракции 17ОКС, что требует их предварительной отмены [10]. При необходимости оценки надпочечниковой функции на фоне лечения ингибиторами стероидогенеза, следует помнить, что аминоглютетимед (элиптен) и митотан (хлодитан) оказывают аналогичное влияние на печеночный метаболизм кортизола.
С целью дифференциации 1и 2НН предлагалось на фоне стимуляции АКТГ определять уровень альдостерона [7], однако ни это исследование ни определение активности ренина плазмы не позволяют сделать это достаточно надежно [10,28]. Таким образом, тест с длительной стимуляцией коры надпочечников АКТГ точное, но требующее много времени исследование, позволяющее дифференцировать 1и 2НН.
XIII. Уровень КРГ
Определение уровня КРГ и тест с КРГ в будущем возможно приобретут диагностическое значение в плане определения уровня поражения ГГНС. Секреция КРГ значительно возрастает в ответ на гипокортизолемию, что происходит при 1и 2НН, однако не при повреждении собственно гипоталамуса, то есть при 3НН. В норме плазменный уровень КРГ увеличивается в ответ на введение инсулина (ИТТ) и метирапона и уменьшается при введении дексаметазона. Однако, такая закономерность не постоянна [29]. Причиной этого может быть колебание уровня КРГсвязывающего белка, методики исследования, наличие других стимуляторов секреции АКТГ [10]. Кроме того, весьма сомнительно, что по уровню КРГ, который определяется в пробе крови, взятой из кубитальной вены, можно судить о его колебаниях в портальной системе гипофиза. Таким образом, определение уровня КРГ для диагностики НН использоваться не может.
Сравнительно недавно был предложен КРГстимулирующий тест, диагностическая ценность которого продолжает исследоваться как в отношении выявления НН, так и для топической диагностики уровня повреждения ГГНС. Пациенту внутривенно вводится КРГ в дозе 1 г/кг массы, после чего через 2 часа исследуется уровень кортизола плазмы. Такая доза КРГ безопасна для пациента и только в 20% случаев вызывает такие побочные реакции как тахипноэ и приливы [32]. В одном из исследований у 61 пациента, получавших длительную терапию глюкокортикоидами, ценность этого теста сопоставлялась с ИТТ. Результаты тестов, с учетом того, что в качестве диагностического критерия был выбран уровень кортизола в 20 мкг% (0,55 мкмоль/л), оказались одинаковыми в 85% случаев [32].
Предполагается, что исследование изменений уровня АКТГ в ответ на стимуляцию КРГ позволит различить 1, 2и 3НН. При 1НН изначально высокий базальный уровень АКТГ в ответ на введение КРГ возрастает еще более, а затем медленно возвращается к исходно высокому уровню. При 2НН исходно низкий уровень АКТГ на стимуляцию КРГ ни как не реагирует. При 3НН исходно низкий уровень АКТГ в ответ на введение КРГ делает значительный скачок и затем еще долго продолжает оставаться высоким[33]. Широкого распространения и, таким образом, исчерпывающей оценки эти исследования пока не получили.
XIV. Лабораторные исследования в этиологической диагностике НН
Наиболее часто, причиной хронической 1НН (порядка 75%) является аутоиммунное поражение коры надпочечника, далее следует туберкулезный процесс [27]. До недавнего времени аутоиммунная природа НН (идиопатическая НН) устанавливалась путем исключения других ее возможных причин, в первую очередь, туберкулеза. На сегодняшний день многочисленными исследованиями выявлен специфический маркер “аутоиммунного адреналита” антитела к надпочечниковому ферменту 21гидроксилазе (Р450с21) [9, 14]. Более подробно вопросы этиологической диагностики и иммуногенетики 1ХНН будут освещены в наших дальнейших публикациях.
Резюме
Существующие методы лабораторной диагностики НН имеют разное диагностическое значение и, таким образом, разные показания. Наиболее оптимален ступенчатый принцип. В зависимости от тяжести состояния пациента, обследование начинается со спонтанного определения уровня кортизола плазмы или с короткого синактенового теста. При подозрении на острую гипоталамогипофизарную дисфункцию проводится метирапоновый тест. Исследование базального уровня АКТГ позволяет дифференцировать 1и 2НН. Как альтернатива, в этом плане может рассматриваться тест с длительной стимуляцией АКТГ. Обследование пациентов в связи с имеющимся риском развития НН более проблематично, поскольку нарушения могут иметь минимальную выраженность и носить функциональный характер. В этой ситуации (как по сути дела всегда) тактика будет варьировать от пациента к пациенту в зависимости от конкретных факторов риска и предполагаемого уровня дисфункции ГГНС. Для этого рекомендуются синактеновый, метирапоновый тесты и ИТТ. Ценность КРГстимулирующего теста в диагностике НН окончательно не выяснена. Специфическим маркером 1НН аутоиммунного генеза являются антитела к надпочечниковому ферменту 21гидроксилазе.
Сводная таблица по методам диагностики
Литература
1. Алгоритмы диагностики и лечения болезней эндокринной системы. / Под ред. И.И. Дедова.М., 1995.
2. Клиническая эндокринология: Руководство для врачей. / Под ред. Н.Т. Старковой. М.,1991.
3. Azziz R., Bradley E., Huth J., et al. // J. Clin.Endocrinol. Metab. 1990. Vol. 70. P. 12731279.
4. Borst G.C., Michenfelder H.J., O’Brian J.T. // N.Engl. J. Med. 1982. Vol. 302. P. 1462 1464.
5. Constine L.S., Woolf P.D., Cann D., et al. // N.Engl. J. Med. 1993. Vol. 328. P. 87 94.
6. Cunninham S.K., Moore A., McKenna T.J. // Arch. Intern. Med. 1983. Vol. 143. P. 22762279.
7. Dluhy R.G., Himathongkam T., Greenfield M. // Ann. Intern. Med. 1974. Vol. 80. P. 693696.
8. Donald R.A. // J. Clin. Endocrinol. Metab. 1971.Vol. 32. P. 225 231.
9. Falorni A., Nikoshkov A., Laureti S., et al. // J.Clin. Endocrinol. Metab. 1995. Vol. 80, N. 9. P. 2752 2755.
10. Grinspoon S.K., Biller B.M.K. // J. Clin. Endocrinol. Metab. 1994. Vol. 79, N. 4. P. 923931.
11. Hagg E., Asplud K., Lithner F. // Clin. Endocrinol(Oxf.). 1987. Vol. 26. P. 221 226.
12. Hartzband P., VanHerle J., Sorger L., Cope D. // J. Endocrinol. Invest. 1988. Vol. 11. P.769776.
13. Hjortrup A., Kehlet H., Lindholm J., Stentoft P. // J. Clin. Endocrinol. Metab. 1983. Vol. 57. P.668 670.
14. Husebye E.S., Rorsman F., Batterle C., et al. // Proc. of the 10th International Congress of Endocrinology. 1996. [ Abst. P3 1031 ].
15. Jasani M.K., Freeman P.A., Boyle J.A., et al. // QJM 1968. Vol. 147. P. 407 421.
16. Jenkins D., Forsham P.H., Laidlaw J.C., et al. // Am. J. Med. 1955. Vol. 18 P. 3 14.
17. Jurney T.H., Cockrell J.L., Lindberg J.S., et al. // Chest. 1987. Vol. 92. P. 292 295.
18. Kehlet H., Binder C. // BMJ. 1973. Vol. 2. P.147 149.
19. Landon J., Greenwood F.C., Stamp T.C.B., Wynn V. // J. Clin. Invest. 1966. Vol. 45. P.437 449.
20. Leisti S., Perheentupa J. // Pediatr. Res. 1978. Vol. 12. P. 272 278.
21. Liddle G.W., Estep H.L., Kendall J.W., et al. // J.Clin. Endocrinol. Metab. 1959. Vol. 19. P.875 894.
22. Lindholm J., Kehlet H. // Clin. Endocrinol. (Oxf.).1987. Vol. 26. P. 53 59.
23. May M.E., Carey R.M. // Am. J. Med. 1985. Vol. 79. P. 679 684.
24. Meikle A.W., Jubiz W., Matsukura S., et al. // J.Clin. Endocrinol. Metab. Vol. 29. P. 15531558.
25. MeKee J.I., Finlay W.E. // Lancet. 1983. Vol.1. P. 484.
26. Nelson J.C., Tindall D.J. // Am. J. Med. Sci.1978. Vol. 275. P. 165 172.
27. Nerup J. // Acta Endocrinol. 1974. Vol.76. P.127 141.
28. Oelkers W., Diderich S., Bahr V. // J. Clin.Endocrinol. Metab. 1992. Vol. 75. P. 259264.
29. Orth D.N. // Endocr. Rev. 1992. Vol. 13. P.164 191.
30. Reis A.F., Ferreira j.g., Shiota., et al. // Proc. of the 10th International Congress of Endocrinology. 1996. [ Abst. P3 634 ].
31. Rose L.I., Williams G.H., Jagger P.I., et al. //Ann. Inn. Med. 1970. Vol. 73. P. 49 59.
32. Schlageke R., Kornely E., Sauten R.T., Ridderskamp P. // N. Engl. J. Med. 1992. Vol.326.. P. 226 230.
33. Schulte H.M., Chrousus G.H., Avgerinos P., et al.// J. Clin. Endocrinol. Metab. 1984. Vol. 58. P. 1064 1067.
34. Scott R.S., Donald R.A., Espiner E.A. // Clin.Endocrinol (Oxf.). 1978. Vol. 9. P. 571 576.
35. Snow K., Jiang N.S., Kao P.S., Scheithauer B.W.// Mayo Clin. Proc. 1992. Vol. 63. P. 10551065.
36. Speckart P.F., Nicoloff J.T., Bethune J.E. // Arch.Intern. Med. 1971. Vol. 128. P. 761 763.
37. Spiger M., Jubiz W., Meikle W., et al. // Arch.Intern. Med. 1975. Vol. 135. P. 698 700.
38. Stewart P.M., Corrie J., Seckl J.R., et al. // Lancet. 1988. Vol. 1. P. 1208 1210.
39. Tsatsoulis A., Shalet S.M., Harrison J., et al. //Clinical Endocrinol (Oxf.). 1988. Vol. 28 P.225 232.
40. Watts N.B., Tindall G.T. // JAMA. 1988. Vol.259. P. 708 711.









Комментировать