Могилевкина Ирина Александровна, д.м.н., професор, кафедра Акушерства, гинекологии и перинатологии ФИПО Донецкий национальный ме-дицинский университет им. М.Горького.
Севастьянова Татьяна Вадимовна,
факультет фундаментальной медицины, Харьковский национальный университет им В.Н. Каразина
В диагностике акушерских инфекций важное место занимает лабораторное обнаружение возбудителя.
В диагностике акушерских инфекций важное место занимает лабораторное обнаружение возбудителя. Диагностика инфекционного процесса может проводиться как на основе выделения чистой культуры или прямого обнаружения антигена в пробе, так и на основе обнаружения специфических антител. Выбор метода зависит от того, насколько легко можно обнаружить предполагаемый микроорганизм. В частности, при бактериальных инфекциях новорожденного, вызываемых стрептококками В или Neisseria gonorrhoeae, в качестве материала для исследования отдается предпочтение гемокультуре или спинномозговой жидкости младенца одновременно с мазком выделений гениталий у матери. Для обнаружения других микроорганизмов типа Toxoplasma gondii и Treponema pallidum основным методом исследования является обнаружение антител.
Методы выявления возбудителя
Метод культивирования
Традиционно «золотым стандартом» в выявлении возбудителя считается культуральный метод диагностики. Заключается он в заражении культуры клеток L-929, Mc Coy или эпителиальных клеток оболочек желточных мешков 6-8-дневных куриных эмбрионов и выделении возбудителя с использованием моноклональных антител. Преимуществом метода является высокая специфичность и чувствительность. Метод не дает ложноположительных результатов. К недостаткам относят его трудоемкость и дороговизну, что ограничивает его применение в повседневной практике. Как правило, этот метод используется в научных целях.
Цитологический метод
Основан на микроскопическом исследовании мазка после окраски красителями. Чувствительность данного метода составляет 10-40%.
Это наиболее доступный и технически простой метод. Но его диагностическая ценность снижается изза субъективной оценки результата.
Посев на специфическую среду
С целью выявления возбудителей можно использовать различные посевы на специальные среды. Таким способом выделяют бактерии, грибы, микоплазму, уреаплазму. Метод позволяет определить концентрацию микроорганизма в полученной среде, что во многих случаях является очень важным. Диагностически значимое количество микроорганизмов, выявляемых этой методикой, соответствует 104 КОЕ /мл и более.
Молекулярно-биологические методы
Не так давно были разработаны молекулярнобиологические методы, основанные на анализе нуклеотидной последовательности, которые способны повысить титры чувствительности до 1:10 микроорганизмов. К ним относятся: метод ДНК-зондов, лигазная цепная реакция, полимеразная цепная реакция.
Метод ДНК-зондов. Метод точечной гибридизации нуклеиновых кислот на твердой фазе с использованием ДНК-зонда, меченного биотином. Тесты, основанные на этой методике, имеют множество преимуществ с точки зрения транспортировки, обработки и скорости исследования. Чувствительность метода — 78-90%, специфичность — 98%. Материалом для исследования является любая биологическая среда организма.
Лигазная цепная реакция. Основана на зависимой от мишени амплификации с использованием термостабильной ДНК-лигазы.
Полимеразная цепная реакция (ПЦР). ПЦР была открыта в 1986 году американским биохимиком Кэри Мюллисом. ПЦР позволяет выявить в исследуемом материале наличие специфического участка ДНК, характерного для исследуемого организма, и многократно размножить его. В основе метода лежит многократное увеличение числа копий специфического участка ДНК (так называемая направленная амплификация ДНК). Специфичность метода составляет 100%, преимуществом является также быстрота получения результатов.
Серологические реакции
Принцип этих реакций основан на выявлении антигенов с помощью специфических антител — либо поликлональных, полученных при иммунизации животных антигенами, либо моно-клональных, полученных с помощью гибридомной технологии. В основе этих методов лежит реакция специфического связывания антиген-антитело. Различия методов заключаются в способах регистрации и учета этой реакции. К основным серологическим реакциям относятся:
реакция связывания комплемента (РСК); реакция нейтрализации (РН); реакция непрямой геммаглютинации (РНГА);. реакция иммунофлюоресценции (РИФ); радиоиммунный анализ (РИА); иммуноферментный анализ (ELISA, ИФА).
В настоящее время классические серологические реакции типа РСК, РН, РПГА в силу их низкой чувствительности, высокой трудоемкости, малой пригодности к автоматизации отступили на второй план. Все большее распространение получили РИФ и ИФА.
Метод иммунофлюоресценции. Как в прямой, так и в непрямой модификации позволяет выявить возбудителя по содержанию в них антигена с помощью моноклональных антител. Метод быстрый, простой и недорогой, но оценка результата является субъективной и требует высокого уровня подготовки. Недостаточная чувствительность отмечена у больных с вялотекущей и асимптоматической инфекцией.
Иммуноферментный метод. Полученный материал обрабатывается специальной тест-системой. Метод основан на определении антигена с помощью моноклональных антител.
На положительный результат в этих случаях указывает изменение окраски пробы, которое измеряется спектрофотометрпческим способом. Данный метод позволяет одновременно проводить исследование большого количества проб и объективно оценивать результаты.
Однако в течение 1-1,5 месяца после излечения происходит слущивание разрушенных клеток, содержащих поверхностный антиген, с которым реагируют моноклональные антитела. Поэтому в течение этого времени контрольный анализ может быть положительным.
Выделение вирусов
Количество вируса в организме обычно бывает максимальным в первые несколько дней после заражения. К моменту появления первых симптомов у больного нередко бывает уже слишком поздно выделять вирус, вызвавший заражение. У некоторых людей, однако, может наблюдаться длительное выделение вируса. Поэтому целесообразно пытаться выделять его у больных с подозрением на вирусную этиологию заболевания. Однако если вирус не найден, то это не исключает вероятности вирусной инфекции.
Выделение вируса у новорожденных с подозрением на врожденную инфекцию следует проводить как можно быстрее после рождения, чтобы не спутать случаи с неонатальной инфекцией или инфекцией более позднего детского возраста.
Для правильной диагностики инфекционного процесса очень важно производить правильный забор материала. При подозрении на вирусную инфекцию пораженные органы не всегда являются теми участками организма, в которых легче всего выделить вирус. Мазки из носа и мокрота обычно непригодны для выделения вируса. Моча также в ограниченной степени пригодна для этих целей, однако она является предпочительной пробой при исследовании на цитомегаловирусную инфекцию (ЦМВ). При вирусных заболеваниях, вызывающих образование везикулярной сыпи, для выделения вируса необходимо брать мазок содержимого везикул.
Выделение бактерий
Для того, чтобы максимально увеличить вероятность выделения бактерий, необходимо отбирать материал для исследования до начала антибиотикотерапии. Материалом для бактериологического исследования являются глоточные мазки, мазки из половых органов, гемокультура. Необходимо отметить, что при заборе материала нужно учитывать, что некоторые возбудители являются внутриклеточными паразитами (Chlamydia). Поэтому важно, чтобы были отобраны клетки, наиболее вероятно содержащие данные микроорганизмы.
Обнаружение специфических антител
По свойствам антител различают два понятия: аффинность (или аффинитет) и авидность (или авидитет).
Аффинность — это степень специфического сродства активного центра к антигенной детерминанте
Авидность — это степень прочности связывания молекулы антитела с молекулой антигена. Чем выше аффинность (степень сродства), тем выраженнее и авидитет (прочность связывания). Кроме того, авидитет тем сильнее, чем больше связывающихся центров.
Антитела, реагирующие на инфекцию, впервые появляются примерно через неделю после заражения. Вначале вырабатываются антитела класса IgM, затем начинают вырабатываться антитела класса IgG. После появления антител класса IgG начинается снижение титров IgM-антител. Через некоторый промежуток времени, длительность которого зависит от особенностей возбудителя и организма больного, антитела IgM уже не определяются. Нарастание уровня IgG происходит в течение нескольких недель. IgG обладают наиболее высокими аффинностью и авидностью. В начале иммунного ответа образуются низкоаффинные антитела. Позже в процессе вырабатывания иммунного ответа в организме появляются высокоаффинные IgG-антитела. Высокоаффинные IgG-антитела остаются в организме в течение длительного времени.
В случаях, когда IgM обнаруживаются в крови, необходимо разделять первичную инфекцию и обострение. Для этого рекомендуется определять авидность антител IgG. Если в крови при наличии IgM обнаруживаются IgG с низкой авидностью, то это свидетельствует о первичной инфекции. Наличие же высоко авидных антител IgG (в присутствии IgM) говорит о вторичном иммунном ответе в случае попадания возбудителя в организм или обострения (реактивации) инфекции.
У новорожденных выявление IgM-антител имеет диагностическое значение, так как материнские IgM, в отличие от IgG, не проникают через плаценту. Появление IgM у новорожденных наблюдается только при их инфицировании, в то время как обнаружение IgG может быть следствием пассивного переноса от матери.
Материнские антитела могут персистировать у ребенка до одного года. Поэтому целесообразно одновременно исследовать сыворотку матери и младенца, что позволяет исключить пассивный перенос антител.
Антитела определяют с помощью серологических реакций, принцип которых заключается в выявлении антител с помощью специфического антигена. Реакция основана на специфическом связывании антиген—антитело.
Для выявления антител используют классические серологические способы (РСК, РПГА, РН, РИФ), а также ИФА, чувствительность которого на 2-4 порядка выше по сравнению с классическими серологическими методами.
Важными понятиями в серодиагностике являются: сероконверсия антител, титр антител, серая зона.
Сероконверсия — появление специфических антител в сыворотке крови или увеличение их титра в 24 раза.
Титр антител — способ полуколичественного выражения содержания специфических антител в сыворотке крови. Титр выражается в виде дроби, представляющей собой степень разведения исследуемой сыворотки, при котором анализ дает результат (1:100; 1:200 1:400 и т. д.). Более современные тестсистемы позволяют определять количественное значение антител, которое выражается в Международных единицах (ME) или нанограммах на литр.
Серая зона — это диапазон концентраций специфических антител, в который с равной вероятностью могут попадать как положительные, так и отрицательные пробы. В этом случае для уточнения результата необходимо повторить исследование с новой сывороткой, полученной через 1-2 недели.
Хламидийная инфекция
Chlamydia trachomatis — внутриклеточный микроорганизм, тропный к цилиндрическим эпителиальным клеткам, поэтому полученные пробы должны содержать как можно больше эпителиальных клеток. Некачественно отобранный материал приводит к появлению ложноотрицательных результатов.
Материалом для исследования на Chlamydia trachomatis являются мазки конъюктивы, шейки матки.
Традиционно «золотым стандартом» считают культуральный метод диагностики, предложенный в 1965 году J.B. Gordon и A.L. Quan. Это чувствительный и достоверный метод диагностики, который не дает ложноположительных результатов. Однако данный метод трудоемкий, дорогой и требует наличия необходимого оборудования и используется в настоящее время в исследовательских целях.
Исторически первым было открытие телец Гельберта-Провачека в цитоплазме пораженных клеток конъюнктивы, цервикального канала, уретры, парауретральных ходов. Данный метод используется и в настоящее время. Недостатками его является то, что он информативен при острых формах и при инфекции нижнего полого тракта. Чувствительность данного метода составляет от 10 до 40%.
Распространенным методом диагностики хламидийной инфекции является метод прямой и непрямой иммунофлюоресценции. Он относительно простой и недорогой, основан на определении антигена Chlamydia trachomatis. Меченные флюоресцином моно-клональные антитела прикрепляются к элементарным тельцам, присутствующим в исследуемом материале. Чувствительность данного метода составляет 90-100%, специфичность — 85-100%. Однако данный метод, как и цитологический, информативен при инфицировании нижних отделов урогенитального тракта, а субъективизм в оценке результатов анализа ограничивает его диагностическую ценность.
Метод иммуноферментного анализа основывается также на выявлении антигена хламидий в пораженных клетках. Преимуществами его в диагностике хламидийной инфекции являются простота транспортировки и хранения полученных материалов, объективности оценки результатов, возможности автоматизации и одновременного исследования большого количества проб. К недостаткам относят высокий показатель ложноотрицательных и ложноположительных результатов, особенно при обследовании «бессимптомных» групп низкого риска, отсутствие возможности оценки качества забранного материала. Использование данного метода информативно также при инфекции нижнего отдела урогенитального тракта. В настоящее время этот метод не рекомендуется для исследования материала из конъюнктивы, однако он все чаще применяется при изучении материала из шейки матки и уретры в лабораториях, исследующих большое количество проб.
К молекулярным методам диагностики относятся все виды ПЦР, при которой выделяют возбудителя по нескольким копиям ДНК. Этот высокочувствительный метод позволяет с достоверностью определять хламидийную инфекцию, однако есть опасность гипердиагностики хламидиоза при широком использовании этого метода для скринингового обследования пациентов вследствие невозможности дифференцирования мертвых и живых хламидий.
Наряду с выявлением антигенов или возбудителя в биоматериале достаточно широко используются серологические методы, основанные на выявлении противохламидийных антител и определения их титров в сыворотке больного. При неосложненных инфекциях половых органов специфические антитела не вырабатываются, однако повышенные уровни этих антител часто выявляются у женщин с воспалением тазовых органов или с пери-гепатитом.
Определение классов специфических иммуноглобулинов (IgM, IgA, IgG) в сыворотке крови пациентов позволяет выявить как ранние стадии инфекционного процесса верхнего отдела полового тракта женщины (IgM), так и обострение хронического (IgA, IgG), а также контролировать эффективность лечения по изменению уровня специфичных антител. В сомнительных случаях полезным может быть исследование увеличения титра антител, проведенное через 2 недели после первого исследования.
Определение специфических антител также информативно у новорожденных, поскольку обнаружение IgM у младенца с пневмонией указывает на хламидийную этиологию.
Говоря о методах диагностики хламидийной инфекции, необходимо отметить, что ни один из них не является универсальным. Поэтому рекомендуется проводить исследование на хламидийную инфекцию, используя одновременно как минимум два метода.
Цитомегаловирусная инфекция
Вирус может быть выделен из амниотической жидкости, глоточного мазка или мочи инфицированного младенца. Наиболее достоверно выделение в материале самого вируса или его ДНК. «Золотым стандартом» до сих пор остается вирусологический метод. Для выявления антигена используют реакцию иммунофлю-оресценции (РИФ), иммуноферментный анализ (ИФА), ДНК-гибридизацию, полимеразную цепную реакцию (ПЦР). Специфические антитела IgM и IgG класса определяют иммуноферментным методом. Обнаружение ЦМВ-специфических IgMантител в единичной пробе крови указывает на недавнюю первичную или текущую (рецидивирующую) инфекцию. Определение IgG CMV должно осуществляться одновременно с определением IgM, особенно для диагностики первичной инфекции. Однократно определенный повышенный титр специфических антител класса IgG CMV не является диагностическим критерием острой фазы инфекции. Определение IgG-антител необходимо проводить в парных сыворотках с интервалом не менее 10 дней. Сероконверсия в период между двумя пробами крови может свидетельствовать о текущей инфекции.
Первичную инфекцию при беременности можно выявить с помощью лабораторного исследования крови. После первичного инфицирования IgM-антитела персистируют до 16 недель, поэтому специфические IgM-антитела могут обнаруживаться в ранние сроки беременности, если инфицирование произошло еще до зачатия.
Врожденная инфекция может быть подтверждена либо путем выделения вируса из глоточного мазка или пробы мочи, взятых в течение первых трех недель жизни новорожденного, либо путем выявления ЦМВ-специфических IgM-антител в крови младенца или в пуповинной крови. В более поздние периоды жизни поставить диагноз врожденной ЦМВинфекции не представляется возможным. Определение IgM-антител после трех недель жизни может указывать на недавно развившуюся неонатальную или постнеонатальную инфекцию, а выделение вируса в среду происходит постоянно у детей как с приобретенной, так и с врожденной инфекцией.
Энтеровирусы
Энтеровирусные инфекции обычно диагностируют путем выделения в клеточной культуре вируса из испражнений, глоточных мазков, спинномозговой жидкости, крови, мазков кожных поражений или секционного материала. Выделение вируса возможно только в тех лабораториях, где имеются условия для обнаружения возбудителя в культуре ткани. Таким способом могут быть выявлены вирусы Коксаки группы В и ECHO, некоторые штаммы Коксаки группы А. Серологический анализ, выявляющий IgMантитела против энтеровирусов, может иметь определенное ретроспективное значение, особенно при вспышках, но он мало пригоден на острой стадии инфекций у новорожденных. Следует иметь в виду возможность перекрестных реакций между различными се-ротипами вирусов, поэтому зачастую трудно или невозможно серологическим путем установить, каким именно типом вируса вызвано заболевание.
Escherichia coli
Материалом для исследования у беременной женщины может быть среднесуточная порция мочи, кровь, амниотическая жидкость, полученная путем амниоцентеза, выделения из влагалища (заднего свода). У младенцев (при подозрении на инфицирование) материалом для исследования может быть кровь, желудочный аспират, мазок из уха, моча, пробы с других участков.
Е. coli легко выделяется в бактериальной культуре наряду с другими потенциально патогенными бактериями, включая разновидности энтеробактерий и анаэробы.
При культивировании микроорганизмов экспрессметоды идентификации энтеробактерий могут обеспечить результат в тот же день. Более важным преимуществом данного метода является то, что в тот же день, когда выделена гемокультура или другая культура E.coli, могут быть получены результаты определения антибио-тикочувствительности, поскольку чувствительность к антибиотикам иногда может быть определена после 8-часовой инкубации.
При септицемии или менингите, вызванных грамотрицательными бактериями, в крови или спинномозговой жидкости может быть обнаружен эндотоксин. Высокочувствительным методом обнаружения эндотоксина является тест с лизатом Limulus.
Многие различные типы E.coli можно идентифицировать путем анализа антигенов, которые находятся в клеточной стенке (О-серо-типы) и капсуле (Кантигены). Эти типы имеют большое значение, так как могут коррелировать со специфическими инфекциями. Методами обнаружения является латексная агглютинация.
Среди других лабораторных тестов используют количественное определение С-реактивного белка (СРБ) как ориентировочный показатель бактериальной инфекции у младенцев, которые находятся в тяжелом состоянии, но без признаков явного сепсиса. Высокие (> 80 мг/л) или возрастающие уровни СРБ могут служить основанием для срочного назначения антибиотикотерапии, а серийные пробы позволяют осуществлять мониторинг противомикробной терапии.
К числу других неспецифических показателей наличия сепсиса, вызванного E.coli, относятся следующие: нейтропения, нейтропения с наличием незрелых форм лейкоцитов и тромбоцитопения; увеличение продуктов деградации фибрина; удлинение протромбинового времени. О наличии тяжело протекающего сепсиса могут свидетельствовать также повышение билирубина и трансаминаз.
Вирусный гепатит В (HBV)
Диагностика вируса гепатита В основывается на серологическом исследовании крови. Маркерами вирусного гепатита В являются следующие:
- поверхностный антиген гепатита В (HBsAg) и антитела к нему (анти-HBs);
- антитела к ядерному антигену гепатита В (анти-НВс, анти-НВс IgM);
- е-антиген гепатита В (HBeAg) и специфические
- антитела к нему (анти-НВе).
Пациенты, у которых обнаруживается HBsAg (HBsAg — положительны), трактуются как инфицированные вирусом гепатита В; его обнаружение в крови на протяжении 6 месяцев и более свидетельствует о хроническом течении процесса. Этот маркер не несет информации об активности гепатита. Поэтому его выявление в крови служит только основанием для исследования других маркеров гепатита В. Те, у кого обнаруживаются HBeAg, расцениваются как высоко инфекционные и опасны для окружающих. HBeAg — маркер фазы размножения (репликации вируса), который может выявляться как при остром, так и при хроническом гепатите В. Наличие этого показателя учитывается при решении вопроса о проведении противовирусного лечения. Как только пациент начинает выздоравливать, происходит потеря еантигена, и начинают образовываться антитела НВе и антитела HBs.
Анти-HBs — это антитела, которые обнаруживаются у лиц, выздоровевших или вакцинированных от гепатита. Это показатель иммунной защиты организма от вируса гепатита В. О степени надежности этой защиты свидетельствует количественный уровень анти-HBsAg в крови пациента.
Анти-НВе — антитела появляются в крови после исчезновения HBeAg и, как правило, свидетельствуют о прекращении размножения вируса. Однако существует измененная (мутантная) разновидность вируса гепатита В, при инфицировании которой активное размножение вируса сохраняется при наличии антиНВе. Беременная женщина с положительным HBsAg должна параллельно обследоваться на анти-HBs, которые указывают на наличие перенесенной инфекции. Если HBsAg сохраняются в течение более 6 месяцев, это свидетельствует о хроническом течении болезни. Даже после выздоравливания пациенты могут быть носителем антигена в течение года и более. Исследование уровня трансаминаз печени необходимо для дифференцирования между симптоматическим хроническим течением, хроническим персистирующим гепатитом и хроническим активным гепатитом. Результаты скрининга на гепатит В у беременной могут указывать на то, что новорожденному необходимо как можно скорее после рождения ввести иммуноглобулин и вакцину против гепатита В.
Существуют разнообразные тесты, применяемые при HBV-инфекции. В настоящее время в основном применяют серологические исследования крови (РИА или ИФА).
Вирусный гепатит С (HCV)
Диагностика вируса гепатита С также основывается на серологическом исследовании крови. Маркерами вирусного гепатита С являются: антитела HCV и прямое обнаружение вируса гепатита С в сыворотке крови.
Для обнаружения антител HCV используют иммуноферментные технологии (ELISA). Недостатком данного метода является тот факт, что пациенты с HCV-инфекцией могут вырабатывать антитела до года. Кроме того, количество вырабатываемых организмом антител может быть незначительным и не обнаруживаться данным методом даже при наличии активной, инфекционной болезни. Результаты HCV, следовательно, должны интерпретироваться с учетом анамнеза и объективного статуса, а также результатов вспомогательных лабораторных исследований.
Для подтверждения тест-положительных результатов иммуно-ферментного анализа используется рекомбинантный иммуноблот-метод (Western blot).
Наиболее специфическим диагностическим методом на сегодняшний день является ПЦР, которая заключается в полимеразном цепном увеличении вирусного антигена в клинических экземплярах для его прямого обнаружения.
Вирусный гепатит Д (HDV)
Лабораторная диагностика HDV-инфекции обычно основывается на определении антител в сыворотке пациента (анти-HDV). В острой фазе болезни специфический анти-HDV IgM может определяться, хотя IgM может оставаться в низких титрах в случаях персистирующей HDV-инфекции. Анти-HDV IgG появляются позже. Для определения антител в сыворотке применяется Western blot, методика которого более чувствительна, чем иммуноферментные методы. В научно-исследовательских лабораториях используется метод молекулярной гибридизации, что позволяет обнаружить РНК HDV в клинических экземплярах. Следует отметить, что обследованию на HDV подлежат пациенты с гепатитом В, поскольку HDV — маленькая круглая полоска РНК, которая связана со специфическим антигеном (HDVAg), покрытым HbsAg.
Вирусный гепатит Е (HEV)
Диагноз HEV-инфекции ставится на основании исключения другого инфекционного гепатита.
Вирус простого герпеса
Вирус может быть обнаружен в жидкости везикул, спинномозговой жидкости (СМЖ) и тонких срезах инфицированных тканей на секции; у новорожденных — на коже, в полости рта, глотки, носовой полости, глаз и СМЖ. Достоверным методом лабораторной диагностики инфекции является культуральное выделение вируса. Однако для этого нужны специализированные микробиологические лаборатории.
Обнаружение антигенов ВПГ в биологических жидкостях или в клетках является прямым доказательством активной репликации вируса и, следовательно, однозначно подтверждает этиологию заболевания. Для выявления антигенов ВПГ широко применяется метод РИФ. Характеризуя метод РИФ, следует подчеркнуть как его преимущества (специфичность, экспресс-метод, доступность, невысокую стоимость), так и недостатки (относительно невысокую чувствительность, зависимость диагностической эффективности от стадии заболевания, высокий уровень субъективности при учете результата).
Цитоморфологические методы позволяют выявить индуцированные вирусом морфологические изменения в клетках и тканях пораженных органов. Эти методы делятся на две группы: в одних используется световая, в других — электронная микроскопия.
При использовании световой микроскопии в зонах поражения отмечается типичный для герпеса метаморфоз клеток и ядер. К недостаткам световой микроскопии следует отнести их неспецифичность, невозможность дифференцирования первичной инфекции от рецидивирующей, невозможность дифференцирования типа ВПГ.
Электронно-микроскопическое исследование позволяет обнаружить в биопробах характерные по морфологии частицы ВПГ. Ограничениями при использовании электронно-микроскопических методов является их неспецифичность, невозможность дифференцирования первичной и рецидивирующей инфекции и типа ВПГ, труднодоступность оборудования и отсутствие подготовленного персонала. Новейшим методом диагностики генитального герпеса является метод ПЦР.
Для выявления антител к антигену ВПГ используют классические серологические методы, а также ИФА, чувствительность которого на 2-4 порядка выше по сравнению с классическими серологическими методами.
Обнаружение ВПГ-специфических IgM-антител в единичной пробе крови указывает на недавнюю первичную или текущую (рецидивирующую) инфекцию. Определение IgG ВПГ должно осуществляться одновременно с определением IgM, особенно для диагностики первичной инфекции. Однократно определенный повышенный титр специфических антител класса IgG ВПГ не является диагностическим критерием острой фазы инфекции. Определение IgG-антител необходимо проводить в парных сыворотках с интервалом не менее 10 дней. Сероконверсия в период между двумя пробами крови также свидетельствует о текущей инфекции.
Исследование же сыворотки новорожденных на антитела к ВПГ не информативно, поскольку невозможно интерпретировать факт обнаружения IgGантител к ВПГ из-за присутствия материнских антител, прошедших через плаценту. В этом случае диагностическую ценность приобретает определение специфических IgM-антител в сыворотке новорожденного.
Листериоз
Подозрение на листериоз может возникнуть в тех случаях, когда беременные страдают атипичным лихорадочным состоянием, а также при преждевременных родах. Следует брать пробы влагалищных секретов, мочи и крови для бактериологического анализа и посева. Для этих целей обычно требуются специальные среды.
В последние годы разработана методика фаготипирования, однако 36% штаммов являются нетипируемыми.
При гистологическом исследовании плаценты выявляются такие характерные изменения, как микроабсцессы диаметром до 10 мм, воспаление ворсин и пуповины, а также хориоамнионит.
Анализ материнской крови на наличие антител обычно бывает малоэффективным, но его можно применять для определения Listeria как вероятной причины недавнего выкидыша.
У новорожденных Listeria могут быть высеяны из прямой кишки, с поверхности кожи, из крови и спинномозговой жидкости. Возбудитель может быть также высеян из первых порций выделенного мекония. При окраске по Граму мазков желудочного аспирата, взятых у младенца при болезни с ранним началом, обычно обнаруживаются полиморфно-ядерные лейкоциты и грамположительные микроорганизмы.
Neisseria gonorhoeae
Диагноз гонореи может быть легко поставлен с помощью методов культивирования возбудителя. В этих случаях следует брать материал из уретры, шейки матки и прямой кишки. Другие методы выявления возбудителя дают менее удовлетворительные результаты, а исследование крови совершенно не эффективно. Методы культивирования обладают высокой чувствительностью, но при этом требуется, чтобы забранный материал был направлен в лабораторию в соответствующих транспортных средах. Необходимо отметить, что ни в одной транспортной среде гонококки полностью не сохраняются на протяжении более 24 часов. Культуральная идентификация возбудителя включает оксидазную реакцию и реакцию расщепления декстрозы. Преимуществом культурального метода обнаружения гонококка является возможность одновременно проводить определение антибиотикоустойчивости, поскольку в настоящее время у больных циркулируют штаммы, устойчивые к пенициллину и другим антибиотикам. Обнаружение гонококка посредством выявления антигена с помощью ИФА или РИФ менее эффективно, чем культуральный метод. Окраска препаратов метиленовым синим и по Граму имеет только указательный характер и не может использоваться для постановки диагноза. В последнее время для обнаружения Neisseria gonorrhoeae используют молекулярно-биологические методы — ПЦР и ЛЦР.
Корь
Клинические симптомы кори делают в большинстве случаев ненужной лабораторную диагностику. Антитела, выявляемые при ИФА, увеличиваются по мере нарастания сыпи и достигают пика к десятому дню (около четырех недель после вакцинации).
IgM и IgG появляются одновременно, но IgM исчезает к 90-му дню от начала заболевания, a IgG снижаются к шестому месяцу и остаются на стабильном уровне.
Парвовирус В19
Не существует традиционных методов исследования клеточных культур для парвовируса В19. Однако разработаны специальные методики, основанные на использовании первичных культур клетокпредшественников кроветворного ряда из костного мозга человека или печени плода. Однако эти методы применяются только при научных исследованиях. На практике используется метод ДНКгибридизации, основанный на выделении нуклеиновых кислот. Для подтверждения тестов на вирус В19 могут применяться некоторые другие тесты. Надежным средством для обнаружения вируса является электронная микроскопия, поскольку при данной инфекции часто отмечается В19-виремия и достаточное количество частиц вируса может быть визуально определено при негативной окраске. Данный метод может быть использован для исследования тканей.
Для обнаружения антигена В19 используют ряд методов — в частности, реакцию встречного иммуноэлектрофореза и радиоимму-ноанализа. Реакция вируса В19 в тестах по определению антигена может быть снижена или блокирована за счет одновременного присутствия специфических антител в пробах сыворотки или тканей.
Наиболее широко используемыми тестами на IgM и IgG к В19 в настоящее время являются разные варианты радиоиммуноанали-за. Количественное определение IgM-антител к В19 необходимо для диагностики недавно развившейся инфекции. Количественные показатели IgG к В19 определяют в целях получения доказательства ранее перенесенной инфекции и наличия иммунитета.
Наиболее информативным диагностическим тестом является выявление IgM-антител к В19. Диагноз В19-инфекции при беременности должен основываться на обнаружении у матери IgM-антител к В19. Беременных женщин, которые имели контакт с больными, следует тестировать на IgM и IgGантител к В19. Для выявления инфицированных эмбрионов применяются такие методы, как определение уровней сывороточного альфа-протеина, ультразвуковая диагностика и исследование крови плода на IgM-антитела к В19. При выкидышах или гибели плода в результате материнской инфекции необходимо проводить исследование плаценты и тканей плода на наличие В19.
Можно исследовать с помощью прямых тестов на обнаружение вируса В19 пуповинную кровь, глоточные мазки и другие пробы, взятые у новорожденного. Но очень часто имеют место отрицательные результаты. В этих случаях проводят исследование ребенка в возрасте 1 год. К этому времени титры антител, пассивно переданных плоду от матери, падают до невыявляемого уровня и при наличии инфекции определяются собственные антитела.
Краснуха
Весьма важно, чтобы беременные женщины с заболеваниями, похожими на краснуху или контактировавшие с такими больными, были обследованы как можно быстрее. Материалом для исследования является сыворотка крови.
Существует ряд методик выявления антител против вируса краснухи, которые позволяют проводить количественную оценку уровней антител и тем самым использовать ее для диагностики инфекции при нарастании титров антител. К методикам, чаще всего применяющимся для скрининга антител при краснухе, относятся радиальный гемолиз (РГ), иммуноферментный анализ (ИФА) и латекс-агглютинация (ЛА). Для выявления нарастания титров антител часто применяют реакцию торможения гемагглютинации (РТГА) и ИФА.
Серологическая диагностика краснухи может быть проведена путем обнаружения значительного подъема титров антител IgG (более чем в 4 раза) или выявления специфических IgM-антител к вирусу краснухи.
Существенный подъем титров антител может быть выявлен в течение первых 4-7 дней после появления симптомов, хотя иногда серологический ответ может задержаться до 10 дней. При обследовании беременной женщины важно подтвердить полученные результаты с помощью альтернативного метода (например, определение специфических IgMантител или путем исследования второй пробы сыворотки).
Специфические IgM-антитела обычно обнаруживаются в течение 6-8 недель после контакта, в отдельных случаях они могут быть выявлены к четвертой неделе после начала болезни.
Пренатальная диагностика имеет значение для решения вопроса о том, произошло ли инфицирование плода. Теоретически имеются три возможных метода постановки пренатального диагноза врожденной инфекции:
- Обнаружение вируса, вирусных антигенов или нуклеиновой кислоты в биоптатах хориона.
- Обнаружение вируса, вирусных антигенов или нуклеиновой кислоты в амниотической жидкости.
- Обнаружение специфических IgM-антител в крови плода, полученной при кордоцентезе.
Диагноз врожденной краснухи обычно ставят путем исследования пуповинной крови, а также сыворотки новорожденного или младенца на наличие специфических IgM-антител. Отсутствие специфических IgM-антител в неонатальный период, по существу, исключает диагноз врожденной краснухи.
Диагноз можно поставить на основании выделения вируса краснухи из глоточных мазков или мочи. При этом вирус обнаруживается у большинства новорожденных с врожденной инфекцией. Обнаружение специфических IgG-антител в период от 1 года до 2х лет жизни ребенка указывает на вероятность врожденной инфекции, так как инфицирование детей краснухой в этом возрасте происходит довольно редко.
Стрептококк группы В
Материалом для исследования у беременной женщины может быть среднесуточная порция мочи, кровь, выделения из влагалища (заднего свода). У младенцев (при подозрении на инфицирование) материалом для исследования может быть кровь, желудочный аспират, мазок из уха, моча, пробы с других участков, спинномозговая жидкость.
Штаммы стрептококка группы В быстро и постоянно растут на средах, обогащенных глюкозой, кровью или сывороткой. К другим методам диагностики относится обнаружение антигена в крови, спинномозговой жидкости и моче. Имеется ряд наборов промышленного производства, основанных на разнообразных иммунологических методах выявления стрептококкового антигена группы В. Точные данные о проценте ложноположительных и ложноотрицательных результатов у разных авторов варьируют, однако в целом эти тесты являются достаточно надежными. Особенно пригодны они в тех случаях, где высока вероятность их обнаружения. Как правило, методы обнаружения антигена — это экспресстесты, которые занимают 30 минут. Многие современные полуавтоматические методы позволяют получить культуру грамположительных кокков во флаконе в течение суток. Обнаружение антигена группы В во флаконе дает возможность быстро поставить ориентировочный диагноз.
Сифилис
Для установления диагноза сифилиса используют как бактериоскопическое, так и серологическое исследование крови.
Наиболее убедительным доказательством трепонемной природы заболевания является прямая визуализация трепонемы. При первичном сифилисе на бледную трепонему исследуют отделяемое эрозивно-язвенных папулезных элементов в области половых органов, полости рта, в пунктате из регионарных лимфатических узлов. При вторичном сифилисе используется материал из различных поражений кожи и слизистых оболочек. Для диагностики врожденного сифилиса может быть использована амниотическая жидкость. При отрицательных результатах микроскопическое исследование повторяют либо до обнаружения бледной трепонемы, либо до подтверждения диагноза результатами серологического исследования. В последнее время для обнаружения ДНК бледной трепонемы применяют ПЦР.
Серологические исследования крови основаны на определении антител, которые вырабатываются при сифилисе и классифицированы как неспецифические и специфические антитела против трепонем.
Специфические антитела против трепонем вырабатываются в ответ на инфекцию, вызываемую трепонемами. Как и при других инфекциях, вначале появляются антитела класса IgM, а затем — IgGантитела. IgM-антитела можно выявить у пациентов с первичным, вторичным или врожденным сифилисом, а также при реинфекции. В целом титры IgMантител снижаются после лечения, однако скорость снижения зависит от стадии болезни, при которой проводилось лечение; антитела снижаются быстрее после ранее начатого лечения. При позднем или неполном лечении антитела могут персистировать в течение длительного периода.
Образование IgG-антител следует за выработкой IgM-антител и обычно достигает более высокого уровня. Хотя титры IgG-антител могут со временем снижаться, они персистируют в течение всей жизни пациента даже при адекватном лечении.
Неспецифические антитела против трепонем включают антитела против группового антигена и кардиолипина (антилипидные антитела). Антилипидные антитела выявляются на ранних стадиях течения инфекции и достигают высоких уровней к началу вторичного периода. После проведенного лечения титры антител снижаются до уровня, который зависит от стадии, при которой было начато лечение. Данные уровни могут снижаться по мере прогрессирования инфекции до поздней стадии (даже при отсутствии терапии). Реинфекция приводит к увеличению титров антител.
Существует множество тестов для количественной оценки антител против липидов. Тесты фиксации комплемента (например, реакция Вассермана) в настоящее время в мире применяются очень редко, так как они не имеют преимуществ по сравнению с современными тестами флоккуляции, тестом Venereae Disease Research Laboratory (VDRL) или экспресс-тестом, основанным на микропреципитации с кардиолипиновым антигеном с плазмой крови (RPR), которые более простые, быстрые, а также дешевле в исполнении.
Скрининговые и подтверждающие тесты на сифилис представлены в таблице 3.1. Серологический скрининг проводится с помощью анализа крови, взятого в первый визит пациентки, с применением стандартных тестов — нетрепонемных, таких как VDRL (Veneral Disease Research Laboratory) или RPR (Rapid Plasma Reagin). Эти тесты обнаруживают нетрепонемные антитела и являются неспецифическими, поэтому все положительные или сомнительные результаты должны быть подтверждены с помощью специфических трепонемных тестов, таких как тест иммобилизации Treponema pallidum (Treponemapallidum immobilization test — TPI) и реакция иммунофлюоресценции-абсорбции (FTA-ABS — fluorescent treponemal antibody absorption).
После того, как получен первичный положительный результат какого-либо теста по определению антилипидных антител, необходимо определить титры этих антител. Данные тесты обладают ограниченной специфичностью, но они пригодны для диагностики трепонемной инфекции, поскольку дают положительный результат в начальной стадии и являются достоверными маркерами активности инфекционного процесса.
Достоверным способом оценки активности болезни является тест на IgM-антитела.
Кардиолипины широко распространены в природе, поэтому антилипидные антитела не являются специфическими при трепонемной инфекции: позитивные результаты могут наблюдаться при других заболеваниях, а иногда и у здоровых людей.
В 1982 году Всемирная организация здравоохранения (ВОЗ) рекомендовала применение двух тестов для скрининга на сифилис. Один из них предназначался для обнаружения липидного (VDRL), а второй — трепонемного антигена (RPR). Данная комбинация представляет собой оптимальный способ выявления всех стадий трепонемной инфекции — как леченной, так и не леченной. В то же время тесты VDRL и RPR — взаимозаменяемые и оказываются недостаточными для выявления ранней первичной инфекции.
Таблица 3.1.
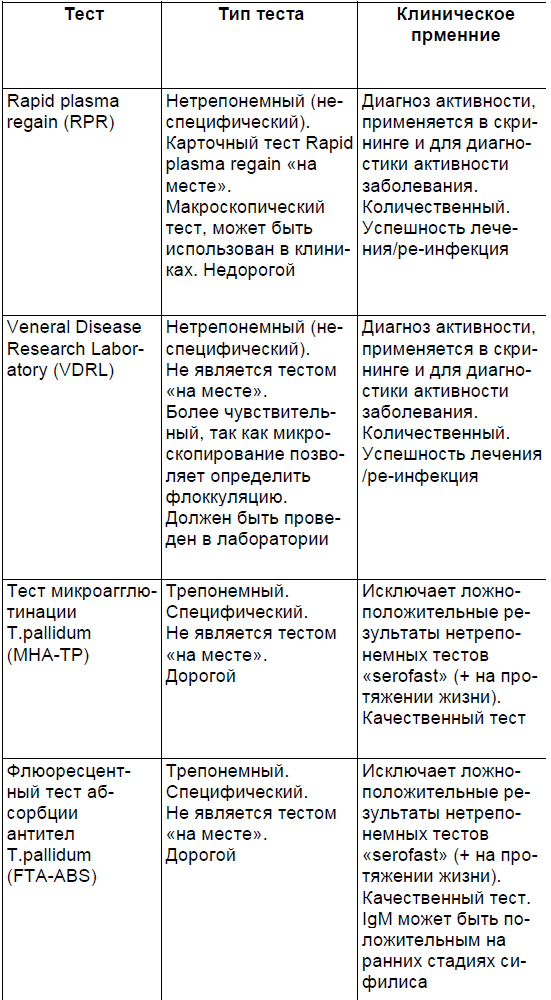
При подозрении на первичную инфекцию у беременной необходимо проводить определение FTA. Однако диагноз первичной инфекции в большинстве случаев можно поставить путем тщательного клинического обследования, сбора анамнеза и темнопольной микроскопии материала, взятого из любых участков поражения. Тест FTA применяется также в качестве контрольного теста для подтверждения результатов, полученных при исследовании материала каким-либо из скрининг-тестов.
Современные серологические методики непригодны для диагностики сифилиса у плода.
Имеющиеся у матери антилипидные и антитрепонемные антитела могут пассивно проходить через плаценту; следовательно, обнаружение антител в крови плода не обязательно подразумевает наличие инфекции. Поэтому, учитывая эффективность лечения инфекции у матери, следует ориентироваться именно на это лечение в сочетании с регулярными серологическими обследованиями новорожденного для подтверждения эффективности терапии.
Окончательный диагноз сифилиса у новорожденного может быть поставлен при выявлении возбудителя — обычно путем темнопольного микроскопического исследования материала, полученного из пораженных участков тела. Серологическая диагностика у младенцев проблематична, так как антилипидные и антитрепонемные антитела IgG-антитела, имеющиеся у матери, могут пассивно передаваться плоду через плаценту. Антитела, полученные от матери, могут персистировать у младенца в течение нескольких месяцев, но, как правило, исчезают к 6месячному возрасту. Новорожденный может быть обследован на наличие IgM-антител. Материнские IgM-антитела не проходят через плаценту, и позитивный результат в этом случае позволяет предположить врожденную инфекцию. Однако при этом могут наблюдаться как ложноположи-тельные, так и ложноотрицательные результаты, и младенцы с врожденной инфекцией могут не быть IgMпозитивными вплоть до 3-месячного возраста. Кроме того, инфицированные младенцы могут быть и серонегативными при рождении, если мать была инфицирована в третьем триместре беременности. Поэтому рекомендуется проводить повторный скрининг младенцев, подверженных риску инфекции, вплоть до 6-месячного возраста.
В постнеонатальном периоде и в раннем детском возрасте клинический диагноз врожденного сифилиса может быть подтвержден путем серологического обследования.
Токсоплазмоз
Материалом для исследования у беременной женщины является сыворотка крови. Диагноз основывается на определении специфических антител. Наиболее достоверным подходом в этом случае является выявление специфической IgGсероконверсии (т. е. переход отрицательных результатов исследования в положительные). Точно установленная IgG-сероконверсия может быть подтверждена выявлением специфических IgM-антител. В этом случае становится очевидным, что речь идет об острой инфекции, создающей риск внутриутробной передачи токсоплазмоза.
Если серологические тесты в первом триместре беременности указывают на наличие инфекции у матери, необходимо обследовать плод с помощью ультразвуковой эхографии и кордоцентеза. В крови плода, полученной путем кордоцентеза, можно измерить уровень IgM-антител
Принятым «эталонным» методом для количественной оценки антител против токсоплазм является тест окрашивания. Ввиду технической сложности и высокой его стоимости, выполняется только в специализированных центрах. Традиционные варианты метода ELISA при количественном определении IgM-антител часто дают ложноположительные результаты, связанные с избытком специфических IgGантител, и ложно позитивные реакции, связанные с присутствием ревматоидного и антинуклеарного фактора в сыворотке.
У новорожденных с выраженными поражениями предположительный диагноз может быть поставлен на основании клинических данных. При выделении паразита из ткани плаценты диагноз врожденной инфекции становится весьма вероятным, но и отрицательные результаты исследования не исключают такого диагноза. Выделение Т.gondii из крови новорожденного имеет диагностическое значение, но, как и при культивировании ткани плаценты, отрицательные результаты могут быть получены при наличии врожденной инфекции, особенно если проводилось пренатальное лечение. Для выделения паразитов из крови плода требуется ускоренная и высокочувствительная методика. Заражение животных является высокочувствительным методом, однако окончательные результаты могут быть получены только через 45 дней. Более быстрым методом является выращивание токсоплазм в культуре ткани, но при этом не обеспечивается достаточный уровень чувствительности. Эти проблемы можно преодолеть с помощью молекулярной биологии в целях обнаружения специфической ДНК.
Серологическое обследование младенца осложняется при наличии у ребенка (как инфицированного, так и неинфицированного) пассивно приобретенного материнского иммуноглобулина G. Титр материнских антител, выявленных у младенца после родов, прогрессивно снижается. Если не считать случаев обнаружения чрезвычайно высоких исходных титров, то материнские антитела обычно исчезают из крови младенца к 10-месячному возрасту. Наличие специфических IgM-антител свидетельствует о врожденной инфекции, но лишь у 1/3 новорожденных с врожденной инфекцией вырабатываются IgMантитела в определяемых уровнях. Накопленный до настоящего времени опыт свидетельствует о большом значении определения IgA-антител для постнатальной диагностики врожденного токсоплазмоза.
Ветряная оспа
Клинический диагноз ветряной оспы можно подтвердить серологическими методами путем обнаружения четырехкратного нарастания титров антител в парных сыворотках, взятых в определенные периоды, и выявления специфических IgM-антител к вирусу ветряной оспы. IgG и IgM-антитела появляются через 2-5 дней после возникновения сыпи, их уровни достигают пика через 3-5 дней, затем титры IgMантител снижаются, и через несколько месяцев эти антитела уже не выявляются; IgG-антитела персистируют в течение всей жизни. Уровни антител можно достоверно определить с помощью реакции связывания комплемента (РСК), иммунофлюоресценции (РИФ) и иммуноферментными методиками (ИФА). Нарастание титров IgG-антител может быть у пациентов с первичными поражениями, вызванными вирусом простого герпеса, а также у пациентов с опоясывающим лишаем.
Для подтверждения неонатальной инфекции используют определение специфических IgM-антител. У некоторых IgM-негативных больных ретроспективные доказательства врожденной инфекции были получены путем выявления персистенции специфических IgG-антител в течение первого года жизни. Сообщения об антенатальной диагностике врожденной инфекции ветряной оспы путем выявления специфических IgM-антител в крови плода отсутствуют.
Лабораторное подтверждение ветряной оспы у взрослого или новорожденного можно осуществлять путем идентификации вируса ветряной оспы в жидкости везикул. Частицы вируса эффективно выявляются путем электронной микроскопии. Обнаружение специфических антигенов в везикулярной жидкости методом меченных флюоресцином антител осуществляется гораздо быстрее. Попытки выделить вирус у младенцев с синдромом врожденной ветряной оспы обычно оказываются безуспешными.
ВИЧ
С 1984 года основой диагностики ВИЧ-инфекции являются иммунологические методы.
Специфический диагноз можно поставить путем тестирования крови на наличие антител против ВИЧ (анти-ВИЧ). У большинства пациентов сероконверсия отмечается в течение 6-8 недель после инфицирования, хотя в некоторых случаях антитела выявляются только через 6-9 месяцев. Поэтому отрицательный тест на наличие антител может считаться достоверным, если пациент не имел экспозиции к вирусу в течение приблизительно 6 месяцев. При наличии постоянного риска инфекции отрицательный тест не имеет существенного значения.
Иммуноферментный анализ является первым скрининговым этапом обследования. Он позволяет определить в сыворотке крови суммарные антитела к ВИЧ. Если в ELISA получен положительный результат, проводят два повторных исследования данного образца тем же методом; при двух отрицательных результатах повторных исследований кровь считается неинфицированной. Если одно или оба исследования повторяют ранее полученный результат, его перепроверяют на втором этапе — стадии подтверждающей диагностики. На этом этапе осуществляется исследование сыворотки крови с помощью метода иммуноблотинга, позволяющего установить наличие антител к отдельным протеинам ВИЧ.
Выявление в сыворотке антител к поверхностным протеинам ВИЧ (gpl60, gpl20, gp41), как правило, обнаруживающихся в сочетании с антителами к ядерному белку р24, свидетельствует о наличии ВИЧинфекции. Положительными считаются пробы, в которых обнаруживаются антитела к 2-3 гликопротеидам ВИЧ.
Среди антигенов ВИЧ наиболее часто определяют белок р24, Антиген р24 не связан с антителами только в начальный период заболевания и в стадии СПИДа, поэтому он может быть использован для диагностики ВИЧ только в эти периоды. Высокой специфичностью обладает метод ДНК-зондов, или молекулярной гибридизации, или полимеразная цепная реакция (ПЦР). Этот метод позволяет определять генетический материал вируса даже в начальный период болезни. Кроме того, ПЦР выявляет количество РНК-копий вируса в 1 мл крови («вирусная нагрузка»), что является одним из основных лабораторных маркеров прогрессирования ВИЧ-инфекции.
Теоретически решающим для уточнения вопроса об инфицированности организма ВИЧ является выделение культуры вируса. Однако на практике возможности применения этого метода ограничены из-за дороговизны исследования, низкого количества копий вируса в крови больных в некоторые периоды заболевания, что делает невозможным выделение вируса, и длительность получения результата. Таким образом, хотя выделение культуры ВИЧ является важным диагностическим тестом, но он практически не применяется из-за большой трудоемкости исследования, необходимости специально оборудованной лаборатории, высокой стоимости, длительности получения результата (2-4 недели).
Для определения глубины иммуносупрессии и прогнозирования развития тех или иных вторичных заболеваний применяют определение уровня CD4+Tлимфоцитов. У здоровых взрослых людей минимальное количество СD4+Т-лимфоцитов составляет 1400 в 1 мкл. При ВИЧ-инфекции количество этих клеток снижается до 500 в 1 мкл. В стадии СПИДа их менее 200 в 1 мкл.
В настоящее время нет никаких данных об эффективной диагностике инфекции у плода. Результаты проводимых тестов трудно интерпретировать, и даже самый чувствительный из них — ПЦР — не может считаться достоверным на самых ранних этапах жизни. Обнаружение антител против вируса как традиционный подход достаточно трудно применять для диагностики внутриматочной и/или неонатальной инфекции. Эти трудности связаны с наличием материнских антител, перенесенных через плаценту. Поэтому необходимо регулярно обследовать ребенка, чтобы выявить исчезновение или постоянное наличие антител. На практике это означает, что последующее наблюдение должно продолжаться не менее 15-18 месяцев.
Эпидемический вирус паротита
Основным методом лабораторной диагностики эпидемического паротита является определение IgM к вирусу паротита в сыворотке. IgM-антитела появляются в острый период инфекции (первые дни) и сохраняются до 2-х лет.
Урогенитальные микоплазмы
Учитывая то, что урогенитальные микоплазмы, к которым относятся Mycoplasma hominis и Ureaplasma urealyticum, могут являться коменсалами вагинального тракта здоровых женщин, оценка уровня контаминации ими должна всегда носить количественный характер. Поэтому для диагностики урогенитальных микоплазм приемлем культуральныи метод. Количество бактерий оценивают в КОЕ/мл исследуемого материала. Концентрация микоплазм, в которой они не вызывают патогенное действие, составляет 103 КОЕ/мл. Для сбора исследуемого материала и его транспортировки используют специальные питательные среды. Культивирование, идентификация и количественный учет микоплазм могут быть осуществлены при помощи стандартных систем Mycoplasma DUO, Mycoplasma 1ST. Эти же тестсистемы могут быть использованы и для определения чувствительности выделенных штаммов микоплазм к антибиотикам.
Материалом для исследования являются пробы со слизистой уретры, сводов влагалища, пробы мочи, абортированные или мертворожденные плоды, амниотическая жидкость, пробы с плаценты.
Папилломавирусная инфекция
Для диагностики ВПЧ-инфекции используют цитологический метод при окраске мазков по Папаниколау и метод ДНК-гибридизации с применением нуклеиновых кислот. Определение типа вируса осуществляется с помощью эндонуклеазного анализа ДНК.
Другие методы диагностики папилломавирусной инфекции, такие как серологические и ПЦР, как правило, не используются, поскольку они не исключают процент ложноположительных результатов и не дают возможности определить тип вируса. Материалом для исследования являются мазки-соскобы, взятые со слизистой шейки матки.
Кандидоз
Принимая во внимание возможность кандидоносительства, диагноз кандидоза устанавливается при наличии клинических проявлений заболевания и микроскопического выявления грибов рода Candida с преобладанием вегетирующих форм. Наиболее достоверным методом лабораторного исследования является культуральный метод с количественным определением колоний грибов.
Туберкулез
Основным методом диагностики туберкулеза является бактериологическое исследование, Традиционная микробиологическая диагностика туберкулеза с помощью посева на плотные яичные среды дает визуальный результат через 6-8 недель, а с учетом определения лекарственной резистентности микобактерий туберкулеза — через 10-12 недель при наличии в посеянном материале не менее 100 жизнеспособных клеток.
В настоящее время разработаны полностью автоматизированные системы для выявления микобактерий на жидких средах, что дает возможность получить результаты, начиная с четвертого дня после поступления диагностического материала. Приблизительно третья часть пациентов с бактериовыделением может быть выявлена при первичной микроскопии окрашенного мазка мокроты.
Определение антител к возбудителю туберкулеза в сыворотке — новый и перспективный метод серологической диагностики этого заболевания. В пуле специфических антител при туберкулезе у взрослых обычно превалируют IgG. Реже подавляющая часть пула бывает представлена IgA. Антитела IgM у взрослых больных встречаются довольно редко и более характерны для начальных стадий заболевания. У детей высокие титры специфических антител IgA и IgM отмечаются гораздо чаще. Причем высокий уровень IgM иногда может сохраняться длительное время и даже при относительно низких уровнях IgG- и IgA-антител.
Выводы
- По способности выявления возбудителя инфекции методы лабораторной диагностики могут быть разделены на две группы: прямые, позволяющие выявить в биологических жидкостях или тканях матери (плода) вирусы или микроорганизмы; непрямые, позволяющие зарегистрировать специфический иммунный ответ матери (плода) на возбудителей инфекции.
- К прямым методам относятся:
- микроскопия (электронная или прямая — например, в темном поле);
- выявление вирусных или бактериальных антигенов (в т. ч. одноэтапными иммуноферментными и иммунохроматографическими методами);
- полимеразная цепная реакция (ПЦР); культуральный метод.
- Лабораторная диагностика инфекции у беременной женщины, как правило, базируется на данных серологических исследований (сероконверсия специфических антител в сыворотке крови IgG и наличие IgM).
- У новорожденных выявление IgM-антител имеет диагностическое значение, так как материнские IgM, в отличие от IgG, не проникают через плаценту.
- Серологические обследования могут давать как ложноположительные, так и ложноотрицательные результаты.
ЛИТЕРАТУРА
- Адаскевич В.П. Заболевания, передаваемые половым путем. — Витебск: Изд-во Витебского медицинского института, 1997. — 310 с.
- Врожденные перинатальные и неонатальные инфекции / Пер. с англ.; Под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд. — М.: Медицина, 2000. — 288 с.
- Кузьмин В.Н. Акушерская тактика у беременных с герпетической инфекцией. — М.: Информполиграф, 2000. — 31 с.
- Кулаков В.И., Гуртовой Б.Л., Орджоникидзе Н.В., Тютюник В.Л. Цито-мегаловирусная инфекция в акушерстве. — М.: Гэотар-Мед, 2001. — 32 с.
- Энциклопедия клинических лабораторных тестов / Пер. с англ.; Под ред. проф. Норберта У. Тица — М.: Лабинформ, 1997. — 942 с.
- Obstetric and Gynecologic Infectious Disease / Joseph G. Pastorek. — New York: Raven Press, 1993. — 798 p.












Комментировать