Кобец Т.В., Бассалыго Г.А.
Министерство здравоохранения Украины
Крымский медицинский Университет им. С.И. Георгиевского
ЛЕЙКОЗЫ – являются первичным опухолевым заболеванием костного мозга, при котором опухолевые клетки, поражая костный мозг, распространяются не только по органам кроветворения, но и в ЦНС, и в другие органы и системы. Это наиболее частые злокачественные новообразования у детей (частота 1:20000), в возрасте до 4 лет.
Согласно современной схеме кровотворения, острые лейкозы объединяет общий признак: субстракт опухоли составляют бластные клетки. При хронических лейкозах субстрактом опухоли являются созревающие и зрелые клетки.
ЭТИОЛОГИЯ.
По имеющимся данным, лейкозы “полиэтиологичны”, т.к. не установлено какой-либо безусловно вызывающей лейкоз причины. Причинными факторами лейкоза человека могут быть химические (экзо- и эндогенные) и физические (ионизирующая радиация) факторы, а также вирусы.
Рауншенбах М. О. с соавт., 1974 г., обнаружил у больных лейкозом людей некоторые в-ва из метаболитов триптофана и тирозина, которые способны индуцировать лейкозы и опухоли у мышей.
У человека найден вирус лимфомы Беркитта и выявлена транскриптаза, которая способствует синтезу ДНК на вирусной РНК, что приводит к образованию эндосимбиоза онкогенного вируса и клетки. Это позволило считать обоснованной вирусную этиологию лейкозов.
По гипотезе Р. Хабнера, 1976 г., в геноме каждой клетки заложена информация в виде ДНКпровируса, равноценная информации в геноме онковируса. В норме ДНК-провирус (онкоген) находится в репрессированном состоянии, однако под воздействием концерогенных факторов (химических, радиации) он активизируется и вызывает клеточную трансформацию. Провирус передается по наследству. Некоторые ученые допускают возможность существования систем, подавляющих вирусную лейкозную трансформацию в клетках хозяина, в частности системы, ответственной за иммунитет. Таким образом, в этиологии заболевания главную роль играет не инфицированность вирусом, а состояние контролирующих систем, стимулирующих факторов.
Радиационный этиологический фактор в последние десятилетия привлек внимание как реально существующий фактор внешней среды и внутренней среды человека, способный вызывать лейкоз.
Радиациональные лейкозы человека реально существуют. Это лейкозы у жителей Японии, возникающие много лет спустя после взрывов атомных бомб в Хиросиме и Нагосаки.
Нами была выявлена связь между ростом заболеваемостью лейкозом и загрязнением воздуха некоторыми полютантами воздуха в таких районах Крыма как Сакский, Бахчисарайский, Раздольненский и др.
Итак, этиология лейкозов находится в стадии изучения.
ПАТОГЕНЕЗ.
О патологической сущности лейкозов известно, что лейкоз это опухоль. В основе его лежит первичная патология клеток кроветворения, сопровождающаяся нарушением процессов их пролиферации и дифференцирования, возникновение клонов опухолевых (лейкозных) клеток. Прогрессирующая прлиферация этих клеток приводит к поражению органов кроветворения и уменьшению плацдарма нормального гемопоэза.
Учение о развитии лейкозного процесса, понятие об опухолевой прогрессии при лейкозах ввел А. И. Воробъев в 1965 г. В настоящее время это учение разработано применительно ко всем формам лейкоза с соответствующими патогенетическими мероприятиями терапии.
Бластные клетки при остром лейкозе теряют ферментную специфичность. Клетки становятся морфологически и цитохимически недифференцируемыми. Они характеризуются:
- Изменением ядра и цитоплазмы (вместо крупных появляются клетки неправильной формы с увеличением площади ядра и цитоплазмы;
- Обладают способностью расти вне органов гемопоэза (пролифераты из лейкозных клеток находят в коже, почках, головном мозге и в мозговых оболочках), они неравноценны и представляют разные этапы прогрессии;
- Имеют скачкообразный уход опухоли из-под цитостатического воздействия, а также лучевого, гормонального;
- Нарастание процесса в виде выхода бластных элементов в периферическую кровь, перехода от лейкопении к лейкоцитозу.
Этапы опухолевой прогрессии – это этапы злокачественности лейкоза. В основе данной прогрессии лежит нестабильность генетического аппарата лейкозных клеток, которым свойственен переход из неактивного состояния в активное. Раскрытие этапов лейкозного процесса имеет большое практическое значение, ибо главный его смысл заключается в поисках цитостатических препаратов, адекватных каждому этапу злокачественности.
Начиная разбор клинической картины лейкозов, необходимо коснуться вопроса о современной классификации заболевания, стадиях и диагностике.
Начиная с 1976 г. во всем мире клиницисты пользуются ФАБ (Франция, Америка, Британия) классификацией острых лейкозов. По которой лейкозы делятся на острый лимфобластный лейкоз (ALL), 75-80% от всех лейкозов у детей, и острый нелимфобластный лейкоз ANLL, который включает в себя семь подтипов (М1 – М7) и составляет 2025% лейкозов у детей.
М1, 2 – острый миелобластный лейкоз, М 1 – недифференцируемая острая миелоидная лейкемия, М2 – дифференцируемая миелоидная лейкемия, 15-18%, чаще у детей старшего возраста.
М 3 – острый промиелоцитарный лейкоз, 2-5%.
М 4 – острый миелобластный лейкоз, встречается очень редко.
М 5 – острая монобластная и моноцитарная лейкемия.
М 6 – острый эритромиелоз (эритролейкоз) – 1,25%.
М 7 – острая мегакариоцитарная лейкемия.
М 0 – острый недифференцируемый лейкоз.
Выживаемость при острых нелимфобластных лейкозах значительно ниже, чем при ОЛЛ. Однако в настоящее время она значительно возросла в связи с трансплантацией костного мозга от братьев или сестер, совместимых по HLA.
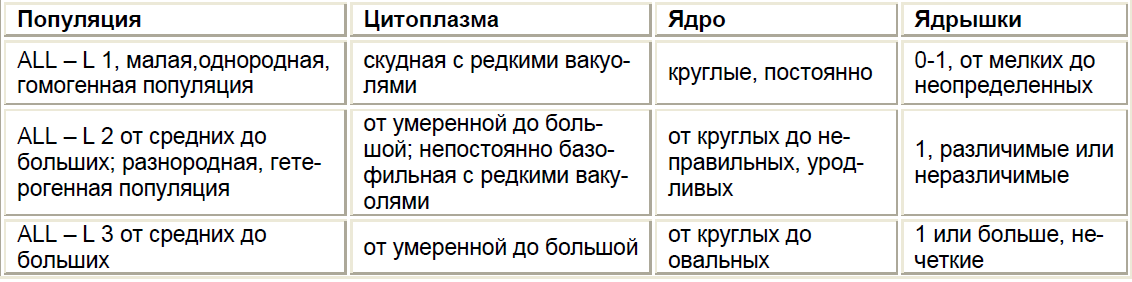
Для установления диагноза лейкоза необходимо цитологическое, цитохимическое и цитогенетическое исследование костного мозга и выявление поверхностных антигенных маркеров клеток (иммунофенотипирование L1, L2, L3).
С учетом морфологической характеристики ОЛЛ выделяют 3 подварианта (Табл. 4).
Таблица 4

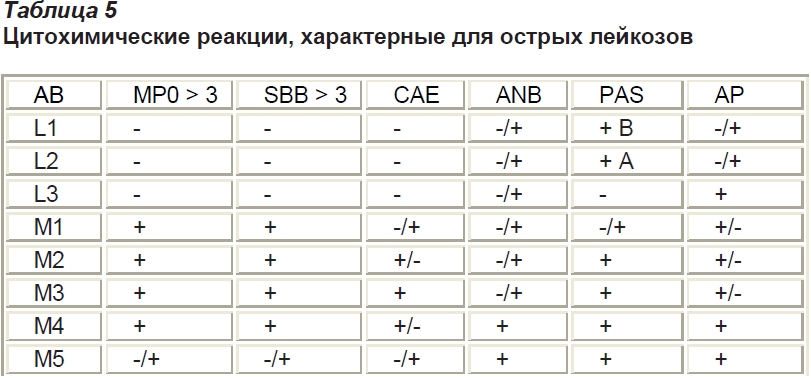
MPO – миелопероксидаза
SBB – судан черный
PAS – периодическая Шифф-кислота (реакция на гликоген)
САЕ- хлорацетат эстераза
ANB- альфа нафтил бутиратэстераза
AP- кислая фосфатаза
Как видно из Таблицы 5 L1 и L2 варианты ОЛЛ в большинстве PAS положительные, а L 3 вариант – отрицательный, в то время как нелимфобластные лейкозы дают положительную реакцию на миелопероксидазу и судан черный.
Для клинической практики выделение трех подвариантов ОЛЛ имеет очень большое значение, поскольку от подварианта зависит курс проводимой терапии и прогноз для жизни больного. Кроме того L1 и L2 подварианты могут быть Т-клеточной формой или ни-Т- ни В-клеточной формой, а L3 подвариант В-клеточной формой.
При постановке диагноза ОЛЛ необходимо указать и стадию заболевания. В 1979 г. А. И. Воробьев и М. Д. Бриллиант предложили свою классификацию
ОЛЛ. Согласно этой классификации выделяют начальный период, развернутую стадию болезни, полную ремиссию, выздоровление (состояние полной ремиссии на протяжении 5 лет), частичную ремиссию, рецидив с указанием, какой по счету, и уточнением очага локализации при локальном рецидиве, терминальная стадия.
Для прогноза заболевания имеет значение диагностирование на ранней стадии. Ни у кого нет сомнения сегодня, что ОЛЛ начинается постепенно и лишь его манифестация представляется острой. Многие исследователи пишут о “предлейкозе ”, но в предлейкозе поставить диагноз нельзя. Поставить диагноз лейкоза позволяет морфологическая картина костного мозга с наличием 30% бластов и более. В начальном периоде ОЛЛ протекает под видом болезней, “масок ”, связанных преимущественно с гиперпластическим поражением органов, либо с выраженным цитопеническим синдромом. Соответственно детям выставляется диагноз ревматизм, лимфаденит, инфекционный мононуклеоз, злокачественная лимфома и др., а с другой стороны апластическая анемия, геморрагический васкулит, тромбоцитопеническая пурпура, сепсис и др.
Следует подчеркнуть, что для раннего распознавания ОЛЛ у детей во всех неясных случаях о лейкозе надо думать чаще и прибегать к исследованию костного мозга. Особенно это имеет значение для постановки диагноза в алейкемическую стадию, когда в геммограмме еще отсутствуют бласты. К сожалению диагноз ОЛЛ чаще выставляется в лейкемическую стадию, при наличии бластов в геммограмме.
Пунктат костного мозга особенно необходимо исследовать в случаях, сопровождающихся цитопенией или увеличением лимфоузлов, либо тем и другим вместе, не применяя до этого никакого лечения (рентгеновское облучение, электрофорез, УВЧ, назначение преднизалона), так как такая терапия может ускорить течение лейкозного процесса и миелограмма будет нехарактерной, что затруднит постановку диагноза, оставит больного на долгое время без специфической терапии
Таблица 6

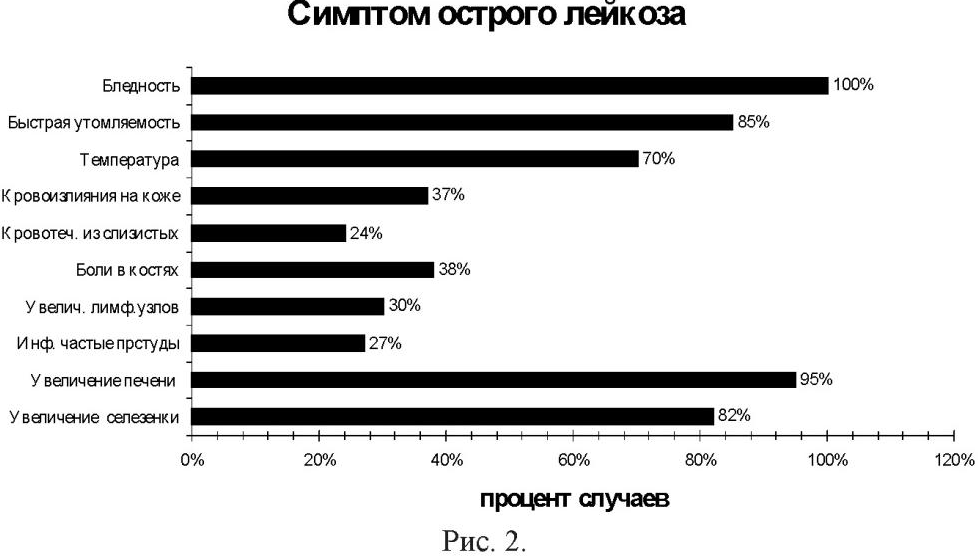
Для манифестных клинических проявлений ОЛЛ характерны увеличение лимфатических узлов, печени, селезенки, боли в костях и суставах, повышение температуры, бледность, быстрая утомляемость, недомогание, геморрагии. Реже появляется стоматит, головная боль, обмороки, изменения со стороны нервной системы.
В периферической крови находят либо алейкемическую картину, либо наличие бластных клеток, в костном мозге – 30% и более бластов. Если же диагноз острого лейкоза неубедителен (10-15% бластных клеток), то, возможно только симптоматическое лечение, необходимо повторно исследовать миелограмму через 3-4 недели

В стадии полной ремиссии в пунктате костного мозга находят не более 5% бластных клеток, а общее количество бластных и лимфоидных клеток в нем не превышает 40%; в периферической крови бластных клеток не должно быть, в составе крови возможны умеренная лейкемия и тромбоцитопения, соответственно 3,0·109/л и 100,0·109/л из-за цитотоксического воздействия; должен быть нормальный состав спиномозговой жидкости и отсутствовать клинические признаки лейкозной пролиферации.
Частичная ремиссия может характеризоваться гематологическим улучшением, уменьшением бластных клеток в костном мозге, в спиномозговой жидкости при ликвидации клинических признаков нейролейкоза и (или) при подавлении очагов лейкозной инфильтрации в других органах, вне костного мозга.
Рецидив острого лейкоза бывает костномозговым (появление в пунктате более 5% бластных клеток) или внекостномозговым с различной локализацией лейкозной инфильтрации (нейролейкоз, лейкозная инфильтрация селезенки, лимфоузлов, гайморовых пазух, яичек и др.).
В терминальную стадию, клинически в значительной мере условную, вкладывается морфологическое понятие об исчерпании терапевтических резервов, о некурабельном этапе опухолевой прогрессии лейкоза. Вместе с этим отмечается условность этой стадии, поскольку она отражает лишь современный уровень терапевтических возможностей. Все цитостатические средства не только оказываются неэффективными, но и на их фоне прогрессирует лейкоз, нарастает цитопенический синдром, прежде всего агранулоцитоз, появляются некрозы на слизистых оболочках, сепсис, кровоизлияние. Терминальная стадия свидетельствует о необходимости отмены цитостатической терапии с сохранением симптоматической.
Причины смерти детей при лейкозах, в том числе лимфобластном, – это сепсис, кровоизлияния в мозг, интоксикация.
При остром лимфобластном лейкозе (ОЛЛ) выделяют прогностически неблагоприятные формы, которые влияют на выживаемость больного.
Особо выделяется нейролейкоз, который может присоединиться к любым локальным формам рецидива и стать самостоятельной формой, без проявления какой-либо другой клиники заболевания. В последние годы нейролейкоз стал частым проявлением рецидива заболевания. Это связывают с увеличением продолжительности жизни больных и с тем обстоятельством, что противолейкозные препараты не проникают через гематоэнцефалический барьер и для лейкозных клеток в центральной нервной системе создается определенное укрытие, благоприятные условия для проявления лейкозных инфильтратов.
НЕЙРОЛЕЙКОЗ
(лейкозное поражение нервной системы) развивается вследствие метастазирования лейкознык клеток в оболочки головного и спинного мозга, в вещество мозга и нервные стволы. Диагноз нейролейкоза ставится на основании обнаружения бластных клеток в ликворе. При нейролейкозе в ликворе может наблюдаться вариобельный цитоз до нескольких тысяч клеток в 1 мкл., повышение уровня белка и снижение уровня глюкозы, цвет жидкости, как правило, сероватый, с положительной реакцией Панди.
Клинических проявлений при нейролейкозе, кроме обнаружения цитоза в ликворе, может и не наблюдаться; в то же время они могут быть самыми разнообразными. Это изменение поведения ребенка: раздражительность, вялость, необщительность. Появляется головная боль, тошнота, рвота (при менингиальной форме), очаговая симптоматика в виде поражения черепных нервов, пирамидной недостаточности, мозжечковых симптомов, судорог, нарушения речи и сознания (при менингоэнцефалической и энцефалической форме), нижних парапарезов, нарушение походки и функции тазовых органов, корешковых симптомов (при менингомиелитической форме). Экзофтальм наблюдается, как правило, при хлорлейкозе.
Почти у половины больных при рецидиве лейкоза отмечается нормальный состав периферической крови, и поэтому большое значение имеет внимательный осмотр больного, своевременная костномозговая и люмбальная пункции при диспансерном наблюдении.
Клинические маски острого лейкоза самые разнообразные: лимфаденит, эпид, паротит, туберкулез, лимфогранулематоз, ревматизм, ревматоидный артрит, гепатиты, инфекционный мононуклеоз, острый аппендицит, затяжные простудные заболеванияы, длительные язвено-некротические стоматиты, ангины, сепсис, апластическая анемия, гемолитическая анемия, тромбоцитопеническая пурпура, геморрагический васкулит, дизентерия, мелкоочаговая пневмония.
ЛЕЧЕНИЕ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗ.
С 1990 года в гематологическом отделении Республиканской клинической детской больницы применяют современные терапевтические протоколы лечения острого лимфобластного лейкоза у детей ОЛЛ-БФМ-90 разработанные немецкими коллегами (1988, 1990, 1992 гг.). По протоколам среди детей, больных ОЛЛ, выделяют три группы риска:
- Группа стандартного риска – дети от 1 года до 6 лет. Количество бластов на 8 день терапии в периферической крови не превышает 1000 в 1 мкл. (после 7-дневного приема преднизалона); отсутствует пре-Т иммунофенотип лейкоза (если у пациента не проводилось иммуноспецифическое исследование бластов, но имеется медиастенальная опухоль, то пациент в любом случае из стандартной группы риска); не имеется первичного поражения ЦНС; установлена полная ремиссия на 33 –й день лечения;
- Группа среднего риска – дети до 1 года и старше 6 лет, количество бластов в периферической крови на 8-й день, после 7-дневной преднизолоновой профазы, не превышает 1000 в 1 мкл; полная ремиссия на 33-й день лечения;
- Группа высокого риска – отсутствие полной ремиссии на 33-й день лечений.
Между 65 и 70 днем повторная контрольная костномозговая пункция для подтверждения ремиссии, если на 33 день в костном мозге 5% и более бластов (в гемограмме не более 20·109/л лейкоцитов).
КЛАССИФИКАЦИЯ ЦИТОСТАТИЧЕСКИХСРЕДСТВ
Противолейкозные препараты.
1. Антиметаболиты – нарушают синтез предшественников нуклеиновых кислот, путем конкуренции с последними в лейкозной клетке.
Метотрексат – антогонист фолиевой кислоты (эффект в стадии разгара и в качестве поддерживающей терапии, действует на S фазу).
Ланвис (Tioguaninum) (Glaxo Wellcome) – 1 табл. содержит 40 мг тиогуанина : 25 табл. в упаковке. Тиогуанин является сульфгидрильным аналогом гуанина и проявляет свойства пуринового антиметаболита. Являясь структурными аналогами пуриновых нуклеотидов, метаболиты тиогуонина включаются в пуриновый обмен и ингибируют синтез нуклеиновых кислот в опухолевых клетках.
6-Меркаптопурин (пуринетол) – антогонист пурина, вмешивается в обмен нуклеиновых кислот, действует на S фазу.
Цитозар (цитозинарабинозид) – систематический аналог пиримидина, препятствует превращению цитидина в диоксицитидин (на S фазу лейк. клетки).
2. Алкилирующие соединения – подавляют синтез ДНК и в меньшей степени РНК в лейкозной клетке.
Циклофосфан, обладающий цитостатическим и цитолитическим действием на лейкозные клетки.
3. Алколоиды растений.
Винкристин – практически воздействует на все фазы покоящейся клетки.
Этопозид (вепезид, VP –16) – из растений мондрагоры, предотвращает вхождение клетки в митоз.
4. Ферментные препараты.
L-аспарагиназа (краснитин) – разлагает аспарагин, необходимый для синтеза протеина, на аспарагиновую кислоту и амоний в лейкозной клетке, которая не способна к самостоятельному синтезу аспарагина и поэтому погибает от его эндогенного действия.
5. Противоопухолевые антибиотики. Адриамицин, рубомицин – обладает цитостатическим действием, подавляет синтез нуклеиновых кислот путем взаимодействия с ДНК и РНК – полимеразами.
6. Гормональные препараты.
Преднизолон – обладает цитолитическим действием на лейкозные клетки (лимфобласты и недифференцируемые бласты) и не вызывает разрушения нормальных лимфоцитов.








Комментировать