Опыт применения концентрата протромбинового комплекса при массивной кровопотере у онкологических пациентов, отражены преимущества применения концентрата протромбинового комплекса перед свежезамороженной плазмой и криопреципитатом. Сравнение эффективности комплексной интенсивной инфузионно-трансфузионной терапии в соответствии с принятыми стандартами диагностики и лечения кровотечений с использованием свежезамороженной плазмой и криопреципитата и метода коррекции гемостаза с применением концентрата протромбинового комплекса.
Васильченко А.Н., Смирнов В.М., РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова, Минск
Резюме. Изложен опыт применения концентрата протромбинового комплекса (КПК) при массивной кровопотере у онкологических пациентов, отражены преимущества применения КПК перед свежезамороженной плазмой (СЗП) и криопреципитатом. Проведено сравнение эффективности комплексной интенсивной инфузионно-трансфузионной терапии в соответствии с принятыми стандартами диагностики и лечения кровотечений с использованием СЗП и криопреципитата и метода коррекции гемостаза с применением КПК.
Ключевые слова: концентрат протромбинового комплекса, массивная кровопотеря в онкохирургии, коагулопатия.
При массивной кровопотере При большинстве злокачественных опухолей хирургический метод остается единственным или предпочтительным либо важнейшим компонентом комбинированного лечения. Существующая в настоящее время тенденция к расширению объемов и травматичности хирургических вмешательств, увеличению при этом интраоперационной кровопотери делает актуальной проблему развития кровесберегающих технологий и применения препаратов, альтернативных компонентам донорской крови. Во многих зарубежных странах разработка и применение препаратов, альтернативных переливанию компонентов донорской крови во время хирургических вмешательств, возведены в ранг национального стандарта [9]. Активное применение в онкохирургии интраоперационной реинфузии аутоэритроцитов (ИРА) избавило от необходимости использования значительных объемов эритроцитной массы, позволило осуществлять быстрое восстановление кислородной емкости крови, избегать значимых иммунных реакций, повысить выживаемость пациентов.
Одним из недостатков данного метода являются тромбоцитопения и коагуляционные расстройства, что усугубляет коагулопатию, обусловленную кровопотерей [3, 8]. Массивная и экстремальная кровопотеря при травматичных онкохирургических вмешательствах часто явлется причиной развития дилюционной коагулопатии, ДВС-синдрома и неконтролируемого коагулопатического кровотечения. Указанные осложнения в интра-послеоперационном периоде приводят к значительному повышению длительности госпитализации в отделении интенсивной терапии и реанимации, являются основной причиной летальности при массивной и экстремальной кровопотере [5, 6, 8].
В физиологических условиях между светывающей и противосвертывающей системами существует динамическое равновесие, которое блокирует кровотечение и тромбообразование. Гемостаз обеспечивается взаимодействием трех компонентов – сосудистой стенки, клеток крови и плазмы. Различают два механизма гемостаза: сосудисто-тромбоцитарный (первичный – обеспечивает достаточный гемостаз, главным образом в капиллярах) и коагуляционный (вторичный – обеспечивает образование крепкого тромба). Сосудисто-тромбоцитарный гемостаз, который включает два главных участника – сосудистую стенку и тромбоциты, осуществляется путем местной вазоконстрикции (спазм сосудов), адгезии тромбоцитов и агрегации тромбоцитов. Коагуляционный гемостаз – это каскад реакций, которые осуществляются спе-цифическими факторами, причем каждый фактор активируется предыдущим и в свою очередь активирует следующий. Завершается процесс образованием фибрина. Один из них обозначается как «внешний механизм», поскольку запускается поступлением из тканей или из лейкоцитов в плазму тканевого тромбопластического фактора (фактора III). Этот фактор вступает во взаимодействие с фактором VII и при участии ионов кальция быстро образует активатор фактора X, который и является главной составной частью протромбиназы, поскольку трансформирует протромбин (фактор II) в тромбин (IIа). Второй путь активации свертывания назван внутренним, поскольку осуществляется без добавления извне тканевого тромбопластина, за счет внутренних ресурсов плазмы. Запуск этого внутреннего механизма начинается с активации фактора XII (фактора Хагемана). Эта активация возникает в разных условиях: вследствие контакта крови с поврежденной сосудистой стенкой (коллагеном и другими структурами), с измененными клеточными мембранами, под влиянием некоторых протеаз и адреналина, а вне организма – вследствие контакта крови или плазмы с чужеродной поверхностью. Вслед за фактором XII последовательно активируются факторы XI, IX и VIII. Последние два фактора образуют продукт, который активирует фактор X, что приводит к формированию протромбиназной активности. В результате протромбин (фактор II) в присутствии ионов кальция и под влиянием «тромбокиназы» превращается в тромбин, который, в свою очередь, обеспечивает отщепление фибринопептидов и превращение фибриногена в фибрин [4].
Неизбежными проявлениями острой кровопотери являются нарушения в системе гемостаза. Патогенез этих изменений определяется преимущественно потреблением компонентов системы гемостаза, их потерей с излившейcя кровью. Вследствие массивной кровопотери в организме развиваются патологические явления, важнейшие из которых – уменьшение объема циркулирующей крови (ОЦК) с последующим развитием гипотонии, гипоксемии и гипоксии, органной гипоперфузии и метаболического ацидоза, а также активация всех звеньев системы свертывания с возможным развитием диссеминированного внутрисосудистого микротромбирования (ДВС-синдрома). Острый ДВСсиндром вследствие массивной кровопотери протекает двухфазно из-за патогенетически обусловленного самоограничения тромбообразования. Выпавший в микротромбах фибрин подвергается фибринолизу, а продукты деградации фибрина (ПДФ), в свою очередь, обладают фибринолитическими свойствами. Поэтому при массивном микротромбообразовании (фаза гиперкоагуляции ДВСсиндрома, которая во временном интервале может быть как короткой, так и длинной) вскоре в крови оказывается большое количество ПДФ, активно растворяющих ранее образовавшиеся тромбы – возникает повсеместная кровоточивость, характерная для гипокоагуляционной фазы ДВС-синдрома [2]. Следствием массивной кровопотери является также дилюционная коагулопатия, т.е. коагулопатия вследствие разведения и потери факторов свертывания. Дальнейшее прогрессирование нарушений системы гемостаза ведет к быстрому развитию полиорганной недостаточности и неконтролируемому коагулопатическому кровотечению. Проблема усугубляется тем, что у онкологических пациентов нарушен баланс между свертывающей и противосвертывающей системами: злокачественные новообразования способствуют активации прокоагулянтных факторов, что, в свою очередь, ведет к развитию венозных тромбозов и тромбоэмболий. Используемые при их лечении оральные антикоагулянты в ряде случаев являются причиной коагулопатических кровотечений [13, 16]. Опухолевое поражение печени, а также осложнения после обширных резекций печени – причина развития печеночной недостаточности и нарушений когуляции, приводящих к развитию коагулопатических кровотечений. Серьезное влияние на синтез факторов свертывания оказывают специфическая химиотерапия, приводящая к сочетанию дефектов плазменного гемостаза (вследствие выраженного снижения активности факторов II, VII, IX, X) и тромбоцитопении.
Прогрессирование полиорганной недостаточности и развитие неконтролируемого коагулопатического кровотечения можно предотвратить только с помощью интенсивного восполнения факторов свертывания. Наиболее важные мишени целенаправленной гемостатической терапии:
– фактор 1 (фибриноген);
– фактор II (протромбин);
– фактор VII (проконвертин);
– фактор VIII (антигемофильный глобулин А);
– фактор IX (плазменный тромбопластиновый компонент);
– фактор X (фактор Стюарта–Прауэра);
– фактор XIII (фибринстабилизирующий фактор).
Факторы свертывания крови II, VII, IX и X вместе формируют протромбиновый комплекс. Синтез этих факторов зависит от витамина К и осуществляется в печени.
В настоящее время основными группами препаратов, используемых для коррекции коагулопатий различной этиологии, являются:
1. Компоненты донорской крови – свежезамороженная плазма (СЗП), крио-преципитат.
2. Апротинин и его препараты – гордокс, контрикал.
3. Плазменные и рекомбинантные факторы свертывания:
– Октаплекс® (концентрат протромбинового комплекса);
– НовоСэвен® (рекомбинантный фактор VIIа);
– Октанат® (коагуляционный фактор VIII);
– Фейба® (антиингибиторный коагулянтный комплекс).
Длительное время препаратами выбора для коррекции коагулопатии различного генеза были компоненты крови – СЗП и криопреципитат. В последние годы альтернативой компонентам крови являются плазменные и рекомбинантные факторы свертывания, применяемые как наряду с СЗП и криопреципитатом, так и вместо них. Одним из таких препаратов является концентрат протромбинового комплекса (КПК), содержащий в своем составе факторы свертывания II, VII, IX, X и протеины C и S. КПК имеет 100%-ную биодоступность, его введение обуславливает повышение уровня витамин-К-зависимых факторов свертывания в плазме крови и может быстро корригировать нарушение коагуляции у пациентов с дефицитом одного или нескольких этих факторов. Препарат был первоначально разработан для лечения гемофилий и коагулопатий, вызванных передозировкой оральных антикоагулянтов (антагонистов витамина К), он также показан при кровотечениях, обусловленных приобретенным дефицитом факторов протромбинового комплекса. В настоящее время многие клиницисты рассматривают КПК как серьезную альтернативу применению СЗП при коагулопатиях, обусловленных печеночной недостаточностью, и кровотечениях различной этиологии [1, 7, 10, 12,13]. Это связано с теми преимуществами, которые дает КПК по сравнению с применением донорских компонентов крови[1, 7, 10, 11]:
1. Уровень факторов коагуляции в СЗП достаточно низок по сравнению с КПК, для коррекции коагулопатии необходимы очень большие объемы СЗП. При использовании КПК применяются малые объемы: 20–60 мл в зависимости от клинической ситуации.
2. Риск передачи вирусных инфекций при применении КПК практически отсутствует, так как в процессе производства применяются специальные методы вирусной инактивации.
3. Безопасен при применении – отсутствует риск трансфузионных осложнений, в частности, связанного с трансфузией СЗП синдрома острого повреждения легких.
4. Достигается гораздо более точная и быстрая коррекция факторов свертывания. Эффект прогнозируемый – в отличие от СЗП, КПК содержит стандартизированное количество факторов II, VII, IX, X.
5. Благодаря малому объему КПК и высокому содержанию факторов свертывания эффект достигается очень быстро.
Следует также отметить тот факт, что содержание в препарате КПК (Октаплекс®) терапевтических концентраций протеина С и протеина S, являющихся антикоагулянтами, снижает риск нежелательных тромбогенных реакций.
Цель исследования – оценка эффекта применения КПК в виде монотерапии либо в сочетании с препаратами донорской крови для купирования коагулопатических кровотечений или их периоперационной профилактики.
Материалы и методы
Были обследованы 37 пациентов с массивной кровопотерей свыше 80% ОЦК, оперированных на базе РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова с января 2009 по февраль 2013 г. Средний возраст обследованных составил 55,4 ± 9,3 года, средний объем кровопотери –6212 ± 820 мл. Распределение пациентов по нозологическим формам онкологических заболеваний было следующим: распространенный рак легкого, в том числе с врастанием в грудную клетку, магистральные сосуды – 8 человек, опухоли средостения – 7, забрюшинные опухоли – 10, генерализованные формы колоректального рака с метастазами в печени – 6, гепатоцеллюлярный рак – 1, рак желудка – 5 пациентов. Количество больных, принимающих варфарин, было одинаковым в обеих группах. Всем пациентам была выполнена ИРА на аппарате C.A.T.S. (Fresenius). Реинфузия проводилась в режимах High Quality Wash и QualityWash с 5–7 циклами отмывания, которые позволяли осуществить высокую степень очистки крови.
Пациенты были разделены на две группы, однородные по возрасту, полу, типу патологии, виду оперативного вмешательства и исходным показателям коагулограммы. Для определения значимости различий между группами по указанным признакам использовался метод x2 Пирсона.
1—я группа (n = 20) – пациенты, которым проводилась комплексная интенсивная инфузионно-трансфузионная терапия с использованием:
1. Поддержки соотношения коллоидов и кристаллоидов 1:2–1:3, при восполнении интраоперационной кровопотери, умеренной гиперволемической гемодилюции производными 6%-ного гидроксиэтилкрахмала непосредственно перед началом операции.
2. СЗП в дозе 20 мл/кг, при при изменении активированного частичного тромбопластинового времени (АЧТВ) и протромбинового индекса (ПТИ) более чем на 1,5 от нормы.
3. Криопреципитата при уровне фибриногена ниже 1 г/л.
4. Донорской эритроцитной массы при снижении гемоглобина ниже 70 г/л на фоне проводимой ИРА.
5. Апротинина в качестве ингибитора фибринолиза в дозе 1 000 000 КИЕ и более.
При назначении СЗП, криопреципитата и эритроцитной массы придерживались инструкций Британского комитета по стандартам в гематологии 2004 г. и принятых в Евросоюзе директив по использованию эритроцитной массы [14, 15].
2—я группа (n = 17) – пациенты, которым применялся КПК (Октаплекс®) в дозе 20–25 МЕ/кг для коррекции факторов свертывания II, VII, IX, X и протеинов C и S, при снижении уровня фибриногена менее 1 г/л дополнительно назначался криопреципитат. Апротинин не применялся, СЗП использовалась при развитии неконтролируемого коагулопатического кровотечения. Эритроцитная масса, коллоиды и кристаллоиды назначались так же, как и в 1-й группе. Применение Октаплекса® и при необходимости крио-преципитата при значительном ограничении использовании СЗП связано с теми преимуществами, которые дает КПК по сравнению с СЗП, а также с данными о применении его при массивных кровотечениях различной этиологии.
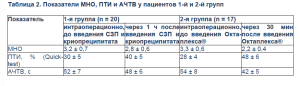
Для оценки результативности проводимого лечения непосредственно перед введением КПК и через 15–20 мин после него проводился забор крови для определения международного нормализованного отношения (МНО), ПТИ (по Quick), АЧТВ, а также фибриногена для определения необходимости введения криопреципитата. Дополнительно изучали выживаемость в течение 24 ч и 30 сут, причины смерти.
Для статистической обработки данных использовались непараметрические методы анализа, в том числе для оценки количественных признаков в малых связанных группах использовался критерий Уилкоксона (Wilcoxon, z, p-level). Определение нормальности распределения осуществлялось с помощью теста Шапиро–Уилка. Статистическая обработка данных выполнялась при помощи пакета прикладных программ Statistica 6.0.
Результаты и обсуждение.
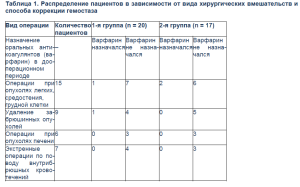
Наиболее многочисленной группой были пациенты онкоторакального профиля, которым проводилось удаление опухолей средостения, легких, резекции грудной клетки, резекции и протезирование аорты, магистральных сосудов. Четыре человека из этой группы были прооперированы экстренно по поводу массивного внутриплеврального кровотечения. Шести пациентам были выполнены расширенные гемигепатэктомии, девяти больным были выполнены расширенные и комбинированные операции по поводу забрюшинных опухолей. Семеро пациентов были прооперированы экстренно по поводу массивных внутрибрюшных кровотечений. Распределение больных в зависимости от вида хирургических вмешательств и способа коррекции гемостаза представлено в табл. 1.
В 14 из 17 всех случаев применения КПК в течение 15 мин после начала введения препарата клинически отмечалось уменьшение темпа и объема кровотечения. У 10 пациентов из 2-й группы в связи со снижением уровня фибриногена ниже 1,0 г/л проводилась трансфузия криопреципитата. СЗП применялась только при развитии неконтролируемого коагулопатического кровотечения. В 1-й группе клинически отмечалось уменьшение темпа и объема кровотечения через 45–60 мин у 10 из 20 больных. По данным исследования выявлено, что во 2-й группе (применялся КПК и криопреципитат) отмечено уменьшение показателей МНО на 33,4% (1-я группа – на 12,5%), увеличение ПТИ на 41,7% (1-я группа – на 25%), уменьшение АЧТВ на 22,3% (1-я группа – на 7,7%) – p < 0,05 (табл.2).
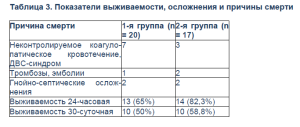
У 10 пациентов с экстремальной кровопотерей 120–550% ОЦК развилось неконтролируемое коагулопатическое кровотечение и ДВС-синдром, резистентный к введению СЗП, криопреципитата, Октаплекса®, однако частота развития вышеуказанных осложнений в группе, где периоперационно применялся Октаплекс®, была ниже (табл. 3).
Выводы:
1. Острая массивная кровопотеря остается одной из основных причин летальности в периоперационном периоде высокотравматичных онкохирургических вмешательств.
2. Развитие геморрагического синдрома в периоперационном периоде приводит к значительному повышению 30-дневной летальности и длительности госпитализации в отделении интенсивной терапии и реанимации.
3. Профилактика и лечение коагулопатии вследствие острой массивной кровопотери с помощью КПК позволяет увеличить выживаемость пациентов, минимизировать риск трансфузионных осложнений.
4. Применение КПК у онкологических пациентов для периоперационной профилактики и лечения коагулопатий при массивной кровопотере позволяет быстро восстановить дефицит прокоагулянтных факторов, поддержать баланс между свертывающей и противосвертывающей системами.
Л И Т Е Р А Т У Р А
1. Волков В.И. // Мед. новости. – 2012. – № 9. – С. 44–46.
2. Воробьев А.И., Городецкий В.М., Шулутко Е.М., Васильев С.А. Острая массивная кровопотеря. – М., 2001. – 176 c.
3. Горобец Е.С., Громова В.В., Буйденок Ю.В. и др. // Рос. журн. анестезиологии и интенсив. терапии. – 1999. – № 2. – С. 71–81.
4. Дроздов А.А., Дроздова М.В. Заболевания крови. Полный справочник. – М., 2008. – 151 с.
5. Ломидзе С.В. Интенсивная терапия в раннем послеоперационном периоде у онкологических больных, перенесших массивную интраоперационную кровопотерю: автореф. дис. … канд. мед. наук:14.00.14, 14.00.37. – М., 2007. – 24 с.
6. Мазурок В.А. Особенности раннего послеоперационного периода у онкологических больных с массивной интраоперационной кровопотерей: автореф. дис. … канд. мед. наук: 14.00.14. – М., 1999. –25 с.
7. Минов А.Ф., Дзядько А.М. // Мед. новости. – 2012. – № 3. – С. 55–58.
8. Русинович В.М., Васильченко А.Н., Петровская И.В. // Онкол. журн. – 2012. – № 4. – С. 49–53.
9. Шандер А. Бескровные методы лечения. Альтернативы переливанию крови // Проблемы бескровной хирургии: сб. науч. докл. – М., 2001. – С. 30–44.
10. Arnйkian V., Camous J., Fattal S. et al. // Interact. Cardiovasc. and Thorac. Surgery. – 2012. – Vol.15. – P. 382–389.
11. Bruce D., Nokes T.J.C. // Crit. Care. – 2008. – Vol. 12, N 4. – R105.
12. Levi M., Fries D., Gombotz H. et al. // Vox Sanguinis. – 2011. – Vol. 101. – P. 154–174.
13. Mendarte L., Munne M., Rodriguez S. et al. // Journal of Coagulation Disorders. – 2010. – Vol. 2, N 2. – P. 1–7.
14. Morris K. Guidelines for red cell transfusion // ESTM Proceedings. – 2007. – P. 93–96.
15. O’Shaughnessy D.F., Atterbury C., Bolton Maggs P. // Brit. J. Haematol. – 2004. – Vol. 126, Is. 1. – P.11–28.
16. Schick K.S., Fertmann J.M., Jauch K.W., Hoffmann J.N. // Crit. Care. – 2009. – Vol. 13, N 6. – R191.
Медицинские новости. – 2013. – №9. – С. 51-54.











Комментировать