С.В. Думова, О.Л. Чугунова, ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, Москва, РФ
В работе приведены данные наблюдения за 72 недоношенными новорожденными с задержкой внутриутробного развития, у которых проводили исследование активности митохондриальных ферментов, определяли уровень свободного L-карнитина, соотношения свободного карнитина и ацилкарнитина. Еженедельно проводили антропометрические измерения с определением z-индексов. В результате проведенного исследования было выявлено, что у данной категории детей наблюдаются постнатальное формирование белково-энергетической недостаточности, нарастание дефицита карнитина и снижение активности митохондриальных ферментов. При применении энерготропных препаратов (L-карнитина, витаминов группы В, липоевой кислоты и кокарбоксилазы) в течение месяца происходила нормализация темпов прибавки массы на фоне нарастания активности митохондриальных ферментов, что свидетельствует о нормализации внутриклеточного обмена.
Ключевые слова: новорожденные, недоношенные, задержка внутриутробного развития, гипоксия, митохондриальная активность, карнитин.
Задержку внутриутробного развития (ЗВУР) можно определить как отставание плода в массе тела (МТ) или росте более чем на 2 стандартных отклонения (5) и ниже среднего значения для данного гестационного возраста (ГВ), либо как МТ при рождении <10-го перцентиля ниже среднего значения для данного ГВ. Термин ЗВУР используют для обозначения хронического расстройства питания плода, сопровождающегося задержкой его внутриутробного развития, отставанием физических параметров, клинической и функциональной незрелостью ряда органов и систем, снижением иммунологической реактивности и метаболическими расстройствами. Частота рождения детей с ЗВУР широко варьирует и встречается в 5-17,6% случаев от всех беременностей. Среди мертворожденных плодов данная патология регистрируется почти у 41,9% [1-4].
Замедление внутриутробного развития плода представляет собою следствие воздействия многих неблагоприятных факторов в период беременности, которые снижают состояние трофики плода, чаще всего в связи с повреждением плаценты или самого плода. Выделяют материнские факторы развития ЗВУР: малая МТ и рост (менее 50 кг, ниже 150 см), недостаточность питания, гипоксия, сосудистые нарушения, соматические заболевания матери, эндокринологические заболевания матери; плацентарные факторы: структурные и функциональные аномалии, инфаркт плаценты, аномалии прикрепления плаценты, одна пупочная артерия; фетальные факторы: хромосомные болезни, наследственные заболевания обмена веществ, хронические инфекции (TORCH-синдром), многоплодная беременность, врожденные пороки развития сердца, почек; социальные факторы: недостаточное питание, возраст матери, вредные привычки. У некоторых детей выявить причину ЗВУР не представляется возможным (идиопатическая ЗВУР), при этом у 1/3 из них в родословной нет других членов семьи с низкой МТ при рождении [4, 5].
Последствия недостаточного питания крайне разнообразны. Так, у взрослых определяется зависимость физического развития, композиции
МТ (доли жира и нежировой массы), развития сахарного диабета 2-го типа, смертности от кардиоваскулярной патологии, характера питания в период внутриутробного развития, а низкий индекс МТ (ИМТ) при рождении ведет к большему накоплению жировой массы в последующем. Европейские дети с низким ростом при рождении имеют в 6-7 раз больший риск снижения роста во взрослом состоянии [6, 7]. D. Barker [8, 9] одним из первых установил связь между размерами тела при рождении и последующим развитием метаболического синдрома в зрелом возрасте. У новорожденных со ЗВУР наблюдается большая толщина стенки аорты, что может привести к развитию кардиоваскулярной патологии [10]. Вклад низкого веса при рождении в риск развития сердечно-сосудистых заболеваний приблизительно равен вкладу курения [11]. ЗВУР связывают с резистентностью к соматотропному гормону (СТГ), которая лабораторно проявляется снижением уровня инсулиноподобного фактора роста 1 (ИФР-1) на фоне нормальных концентраций СТГ. В свою очередь уровень ИФР-1 тесно коррелирует с минеральной плотностью костной ткани [12]. У родившихся с ЗВУР повышены базальные уровни кортизола, что при сочетании с резистентностью к СТГ, возможно, ведет к сниженной минерализации костей в период роста и к повышенной потере костной ткани в пожилом возрасте [13]. Нарушения чувствительности обнаружены в разных эндокринных системах, включая ренин-ангиотензиновую [14], гипоталамо-гипофизарно-адреналовую [15] и инсулиновую [16]. Предполагается, что супрессия фетальной ренин-ангиотензиновой активности является следствием развивающейся в неблагоприятных условиях внутриутробного развития недостаточности нефрогенеза, так как количество нефронов зависит от МТ при рождении [17]. Повышение активности данной системы в постнатальном периоде обусловливает механизм развития артериальной гипертензии в зрелые годы [14, 17].
Несмотря на разнообразие патогенетических механизмов, одним из ведущих в формировании ЗВУР является гипоксия. В большинстве случаев в условиях гипоксии анаэробные механизмы генерации макроэргических фосфатов (анаэробный гликолиз) не в полной мере компенсируют нарастающий дефицит их продукции в системе окислительного фосфорилирования. В условиях гипоксии снижается приток к клетке как кислорода, так и энергетических субстратов. В результате кислородная недостаточность приводит к нарушению всех видов обмена и функционального состояния жизненно важных органов и систем. Установлено, что при биоэнергетической гипоксии нарушения функционирования дыхательной цепи начинаются не на цитохромном, а на ее субстратном участке, т.е. на уровне митохондриального ферментативного комплекса, приводящие к изменениям энергосинтезирующей функции митохондрий [18]. По мере снижения содержания АТФ в клетке наблюдается уменьшение АТФ-зависимых реакций, в т.ч., например, синтеза ацилкарнитина, что нарушает доставку жирных кислот через внутреннюю мембрану митохондрий. Кроме того, кислородная недостаточность вызывает снижение окисления различных метаболитов до ацетил-КоА, в т.ч. и жирных кислот. Нарушение функционирования метаболической цепи β-окисления вызывает накопление промежуточных продуктов окисления жирных кислот, основным из которых является ацил-КоА, способный вместе со свободными жирными кислотами тормозить дыхание и фосфорилирование в митохондриях. Несмотря на включение компенсаторных механизмов увеличение расхода энергетических субстратов над их синтезом приводит к быстрому снижению содержания макроэргических фосфатов, что является тяжелым мембраноповреждающим фактором. Результатом истощения макроэргов является угнетение активности Na+, К+-АТФазы, приводящее к деполяризации клеточных мембран, в т.ч. и митохондриальных, и нарушению их функций [19]. Происходит ослабление пластических процессов по замене поврежденных мембранных структур и дефосфорилирование мембранных белков [20]. Накопление недоокисленных продуктов свободнорадикального окисления усиливает метаболический ацидоз [21]. Нарушение липидного обмена при гипоксии усиливает развитие процессов перекисного окисления липидов (ПОЛ) за счет действия на липидные структуры мембран свободных жирных кислот и продуктов их неполного окисления [22, 23]. Процессам ПОЛ наиболее подвержены ненасыщенные жирные кислоты, большая часть которых входит в состав фосфолипидов, являющихся структурными компонентами клеточных мембран и принимающих участие в ряде метаболических процессов [24]. Ведущая роль в пусковом механизме ПОЛ при гипоксии и ишемии отводится наружным митохондриальным мембранам, богатым липидами [25]. Таким образом, при развитии гипоксии нарушается работа как цикла Кребса, так и процессов окислительного фосфорилирования жирных кислот. Уровень синтеза АТФ зависит от поступления жирных кислот внутрь митохондрий. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии, в которых происходит их β-окисление до ацетил-КоА [26-30].
Карнитин — производное аминомасляной кислоты, присутствующее в тканях в виде L-стереоизомера. Основным источником его поступления в организм являются продукты питания животного происхождения. Эндогенное образование карнитина осуществляется клетками печени, почек и головного мозга путем трансформации аминокислот лизина и метионина. Кофакторами синтеза служат витамины С, В6, В3 и ионы железа. Карнитин принимает непосредственное участие в катаболизме липидов, обеспечивая его начальные этапы — активацию и перенос длинноцепочечных жирных кислот в виде сложных эфиров (ацилкарнитинов) из цитоплазмы в матрикс митохондрий с образованием ацетил-КоА, который служит субстратом для цикла Кребса и последующего синтеза АТФ [30, 31]. При дефиците карнитина свободные жирные кислоты не могут быть использованы в качестве источника энергии. Карнитин оказывает также защитное действие, купируя негативный эффект ряда токсических агентов, что предотвращает дегенеративное поражение нервной ткани [32].
По данным ряда авторов, экзогенное введение карнитина, кофакторов цикла Кребса, препаратов из групп антиоксидантов и мембраностабилизаторов приводит к восстановлению процессов окислительного фосфорилирования, цикла трикарбоновых кислот и нормализации внутриклеточных энергопроцессов [33-35], что в свою очередь приведет к снижению интенсивности ПОЛ, нормализации работы цикла Кребса и окислительного фосфорилирования, нормализации интенсивности пластических процессов.
Это крайне актуально при выхаживании детей со ЗВУР, так как для предотвращения развития белково-энергетической недостаточности используют принцип «догоняющего роста». Это компенсаторное усиление роста организма после периода замедленного роста. Значения роста считаются удовлетворительными, если они расположены на уровне 10-го перцентиля и выше. Однако как низкий вес при рождении, так и «догоняющий рост» ассоциируются с возникновением метаболического синдрома в последующем [36]. Дело в том, что у детей со ЗВУР коэффициент обновления белка примерно на 20% ниже, чем у таковых, родившихся на более ранних сроках с той же МТ, следовательно, нарастание количества белка в организме может происходить при более низком его синтезе, что говорит об ослаблении распада белка. Поэтому при расчете потребности в белке у детей со ЗВУР лучше учитывать постконцептуальный возраст, а не МТ при рождении, что приводит к замедлению темпов физического развития и формированию постнатальной белково-энергетической недостаточности [37].
Таким образом, во время пребывания недоношенного ребенка со ЗВУР в стационаре наблюдается замедление темпов физического развития, несмотря на адекватную коррекцию потребляемых питательных веществ в соответствии с рекомендациями ВОЗ для недоношенных детей и детей со ЗВУР. Соответственно, существуют другие причины задержки темпов прироста массо-ростовых показателей у недоношенных детей, одним из которых, вероятно, является нарушение внутриклеточных энергообменных процессов.
Материалы и методы исследования
Обследованы 72 недоношенных ребенка со ЗВУР и 51 недоношенный ребенок без ЗВУР, с ГВ 25-34 недель, находящихся на лечении в отделениях реанимации и интенсивной терапии, второго этапа выхаживания новорожденных филиала № 2 ГКБ № 24 г. Москвы. В группу исследования вошли дети с асимметричной формой ЗВУР (гипотрофической). Диагноз ЗВУР I степени ставили при дефиците МТ в 1,5-2 сигмальных отклонения, II степени — при дефиците МТ в 2-3 сигмальных отклонения, III степени — при дефиците МТ более 3 сигмальных отклонений. Антропометрические измерения с обработкой результатов с помощью таблицы центиль-ных номограмм с вычислением Z-индексов проводили при рождении, поступлении в отделение и еженедельно. При анализе темпов физического развития недоношенных со ЗВУР было выявлено, что у всех детей с низкой (НМТ), очень низкой (ОНМТ) и экстремально низкой МТ (ЭНМТ) наблюдается задержка темпов физического развития в постнатальный период (рис. 1).

У 28% детей МТ при рождении составляла 2-2,5 кг, у 37% детей — 1,5-2 кг, у 16%- 1-1,5 кг, с ЭНМТ наблюдалось 19% детей. I степень ЗВУР отмечалась у 29% детей, II степень — у 44% и III степень — у 33% новорожденных.
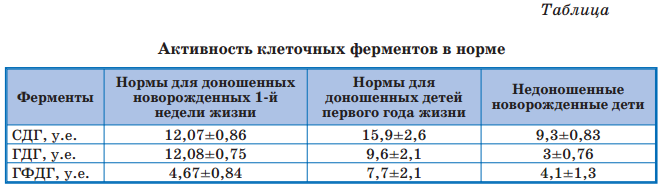
Кроме рутинных лабораторно-инструментальных методов обследования наблюдаемым детям проводили цитохимический анализ лимфоцитов на 7-й, 14-й, 21-й, 28-й и 51-й день жизни. Интенсивность внутриклеточного энергообмена оценивали по цито-химической активности лимфоцитов и уровню свободного и связанного L-карнитина. Цитохимическую активность лимфоцитов определяли методом, модифицированным Р.П. Нарциссовым в России и являющимся скринингом для выявления митохондриальных дисфункций по активности митохондриальных ферментов в лимфоцитах крови. После обработки мазка специфическими реактивами и фиксации ацетон-триалоном с помощью световой водно-эмиссионной микроскопии при увеличении 40 оценивали размеры и количество гранул, оптическую плотность, уровень кластообразования таких ферментов, как α-глицерофосфатдегидрогеназат (ГФДГ), сукцинатдегидрогеназа (СДГ), глутаматдегидрогеназа (ГДГ). Учитывая эти показатели, можно судить о функциональном состоянии митохондрий. Единицы измерения — условные единицы (у.е.) [33]. Изменения карнитинового обмена определяли по уровню общего, свободного карнитина (СК) и связанного карнитина — ацилкарнитины (АК) и их соотношения АК/СК, определяемых методом хромато-масс-спектрометрии, которое в норме равно 0,6 [34].
Нами были уточнены нормы активности митохондриальных ферментов у недоношенных новорожденных (табл. 1).
Проводили наблюдение за изменением активности митохондриальных ферментов с рождения до 28-го дня жизни (уровень активности определяли еженедельно), а также за динамикой массо-ростовых показателей в те же периоды развития.
Результаты и их обсуждение
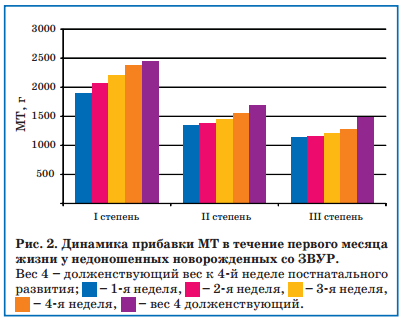
При анализе корреляционной зависимости активности СДГ и массо-ростовых показателей достоверные изменения отмечались только с динамикой МТ (р<0,001). Достоверной корреляции активности СДГ и ростовых показателей не наблюдалось (р>0,05). Так, у детей без ЗВУР, независимо от ГВ при рождении наблюдалась положительная динамика как весовой кривой, так и нарастания активности СДГ. На 5-7-й день внеутробного развития наблюдалось снижение активности СДГ в 1,5-2,3 раза по сравнению с доношенными новорожденными, на 14-й день жизни отмечалось дальнейшее снижение активности СДГ на 45-63% от первоначального уровня, а на 21-й день показатели активности клеточных ферментов достигали первоначальных значений. Однако у недоношенных детей со ЗВУР II-III степени на 21-е и 28-е сутки жизни не происходило нормализации активности митохондриальной СДГ. Также у новорожденных со ЗВУР к 28-му дню не достигалась долженствующая МТ (рис. 2).
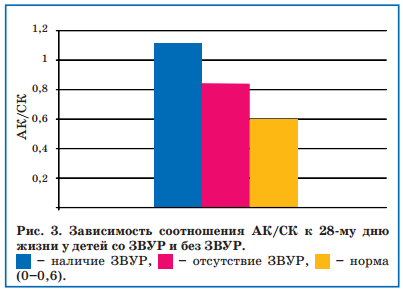
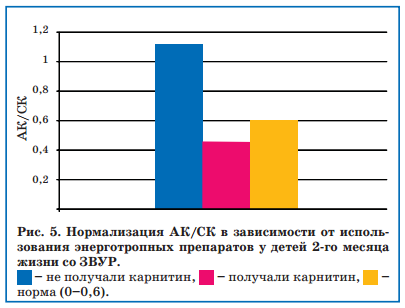
У 29 недоношенных детей со ЗВУР также определяли уровень свободного L-карнитина и коэффициент соотношения АК/СК. Уровень свободного карнитина у всех наблюдаемых детей на первой неделе жизни не отличался от такового у здоровых доношенных новорожденных и соответствовал возрастным нормам (7-30 мкмоль/л), а соотношение АК/СК не превышало 0,6, что также соответствовало нормальным возрастным показателям. Однако к 28-му дню жизни коэффициент АК/СК у недоношенных детей со ЗВУР повышался до 0,9-1,2, чего не наблюдалось у новорожденных того же ГВ без ЗВУР (рис. 3), хотя уровень общего карнитина оставался в пределах возрастных норм.
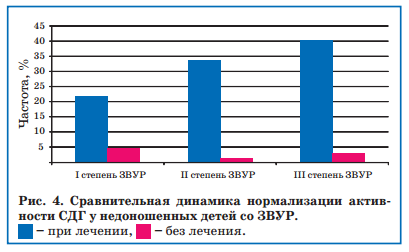
В связи с полученными данными, отражающими развитие митохондриальной и карнитиновой недостаточности у недоношенных детей со ЗВУР, 48 из 72 детей в течение 3 недель, начиная с возраста 1 мес, проводили коррекцию митохондриальной активности с назначением энерготропных препаратов: L-карнитин (Элькар 30%) 100 мг/кг в сутки, корилип нео 1 свеча 1 раз/сут № 10, пиридоксин хлорид 2 мг/кг, α-токоферол-ацетат 2 мг/кг, что приводило к повышению активности СДГ к 51-му дню жизни, т.е. через 3 недели после начала лечения (рис. 4).
Также к 51-му дню жизни у детей, получавших терапию энерготропными препаратами, наблюдалась нормализация соотношения АК/ СК, чего не было в группе детей, которым коррекция внутриклеточного энергообмена не проводилась (рис. 5).
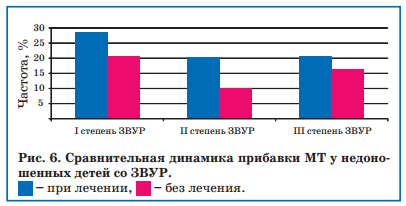
Процент отклонения набранной МТ в возрасте 51 дня жизни у детей со ЗВУР, не получавших лечения, составил — 4%, а у детей, получавших энерготропные препараты, процент отклонений был положительным (+5%), а темпы прибавки МТ у детей, получивших курс энерготропных препаратов, значительно опережали таковые в контрольной группе (рис. 6).
Таким образом, у недоношенных детей различного ГВ со ЗВУР наблюдаются выраженные нарушения митохондриальной активности и карнитинового обмена. Использование энерготропных препаратов, в т.ч. L-карнитина (Элькар 30% мг в 1 мл) приводит к восстановлению внутриклеточного энергообмена и препятствует развитию постнатальной белково-энергетической недостаточности.
Выводы
- У недоношенных новорожденных со ЗВУР наблюдается дальнейшее формирование белково-энергетической недостаточности, несмотря на проведение коррекции питания согласно принципу «догоняющего» роста.
- У недоношенных детей со ЗВУР к концу первого месяца не происходит восстановление первоначальной активности СДГ.
- У новорожденных различного ГВ со ЗВУР наблюдается недостаточная прибавка МТ к концу первого месяца жизни.
- У недоношенных детей со ЗВУР к концу первого месяца жизни определяется повышение коэффициента АК/СК до 0,9-1,2, что свидетельствует о нарастающем дефиците карнитина.
- К концу второго месяца жизни у недоношенных детей со ЗВУР, получавших курс лечения энерготропными препаратами, отмечалась нормализация темпов прибавки МТ на фоне нарастания активности СДГ.
- Применение препаратов L-карнитина (Элькар 30%), витаминов группы В, липоевой кислоты и кокарбоксилазы приводит к нормализации внутриклеточного энергообмена.

На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Fewtrell MS, Cole TJ, Bishop NJ, Lucas A. Neonatal factors predicting childhood height in preterm infants: evidence for a persisting effect of early metabolic bone disease? J. Pediatr. 2000; 137: 668-673.
- Nobili V, Alisi A, Panera N, Agostoni C. Low birth weight and catch-up-growth associated with metabolic syndrome: a ten year systematic review. Pediatr. Endocrinol. Rev. 2008; 6 (2): 241-247.
- Dulloo AG. Regulation of fat storage via suppressed thermogenesis: a thrifty phenotype that predisposes individuals with catch-up growth to insulin resistance and obesity. Horm. Res. 2006; 65 (Suppl. 3): 90-97.
- Шабалов Н.П. Неонатология. М.: МЕДпресс-информ, 2004.
- Аржанова О.П. Плацентарная недостаточность: диагностика и лечение. Санкт-Петербург: Н-Л, 2001: 32 с.
- Yajnik CN, Fall CH, Coyaji KJ. Neonatal anthropometry: the thin-fat Indian baby. The pune marternal nutrition Study. Int. J. Obes. Rel. Metab. Disord. 2003; 27: 173-180.
- Plagemann A. Perinatal programming and functional teratogenesis: impact on body weigh regulation and obesity. Physiol. Behav. 2005; 86 (5): 661-668.
- Barker DJ, Hales CN, Fall CH, et al. Type 2 (non-insulindependent) diabetes mellitus, hypertension and hyperlipidaemia (Syndrome X): relation to reduced fetal growth. Diabetologia. 1993; 36 (1): 62-67.
- Barker D. The midwife, the coincidence, and the hypothesis. BMJ. 2003; 327 (7429): 1428-1430.
- Koklu E, Ozturk M, Kurtoglu S, Akcakus M, Yikilmaz A, Gunes T. Aortic intima-media thickness, serum IGF-1. lgf-3 and leptin levels in intrauterine growth-restricted newborns of healthy mothers. Pediatr. Res. 2007; 62 (6): 704-709.
- Leeson CPM, Kattenhorn M, Morely R, Lucas A, Deanfield JE. Impact of low birth weight and cardiovascular risk factors on endothelial function in early adult life. Circulation. 2001; 103: 1264-1268.
- Ljunghall S, Johansson AG, Burman P, et al. Low plasma levelsof insulin-like growth factor 1 (IGF-1) in male patients with idiopathic osteoporosis. J. Int. Med. 1992;232 (1):59—64.
- Fall C, Hindmarsh P, Dennison E, et al. Programming of growth hormone secretion and bone mineral density in elderly men: a hypothesis. J.Clin. Endocrinol. Metab. 1998; 83 (1): 135-139.
- Langley-Evans SC, Sherman RC, Welham SJ, et al. Intrauterineprogramming of hypertention: the role of the renin-angiotensinsystem. Biochem. Soc. Trans. 1999; 27 (2): 88-93.
- Lesage J, Blondeau B, Grino M, et al. Maternal undernutritionduring late gestation induces fetal overexposure to glucocorticoidsand intrauterine growth retardation, and disturbs the hypothalamo-pituitary adrenal axis in the newborn rat. Endocrinology. 2001; 142 (5): 1692-1702.
- Simmons RA, Templeton LJ, Gertz SJ. Intrauterine growth retardation leads to the development of type 2 diabetes in the rat. Diabetes. 2001; 50 (10): 2279-2286.
- Woods LL, Ingelfinger JR, Nyengaard JR, Rasch R. Maternal protein restriction suppresses the newborn renin-angiotensin system and programs adult hypertension in rats. Pediat. Res. 2001; 49 (4): 460-467.
- Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции. Бюллетень экспериментальной биологии и медицины. 1997; 124 (9): 244-254.
- Ашмарин И.П., Стукалов П.В. Нейрохимия. М.: Изд-во Института биомедицинской химии РАМН, 1996.
- Кравцов А.В., Алексеенко И.Р. Механизмы регуляции векторных ферментов биомембран. Киев: Наукова Думка, 1990: 176 с.
- Пожаров В.П., Миняйленко Т.Д. Перекисное окисление липидов в условиях тяжелой гипоксии: возможные механизмы активации. Hypoxia Medical. 1993; 3: 13-17.
- Yoshida S, Abe K, Busto R, et al. Free radical reaction in transient cerebral ischemia: Lipid — soluble antioxidants and free fatty acids. Stroke. 1982; 13 (1): 116.
- Владимиров ЮА Свободнорадикальное окисление липидов и физические свойства липидного ^оя биологических мембран. Биофизика. 1987; 32 (4): 830-844.
- Freeman BA, Crapo JD. Free radicals and tissue injury. Lab. Invest. 1982; 47: 412-426.
- Джафаров А.И., Магомедов Н.М. Перекисное окисление липидов в синаптосомальной и митохондриальной фракциях отдельных структур мозга при гипоксии. Бюллетень экспериментальной биологии и медицины. 1989; 107 (3): 305-307.
- Мошкова А.Н., Хватова Е.М., Русакова ИА Оценка и прогнозирование скорости фосфорилирования в мозге животных в условиях гипоксии. Нейрохимия. 2006; 23 (4): 342-345.
- Лукьянова Л.Д., Германова Э.Л., Копаладзе РА. Закономерности формирования резистентности организма при разных режимах гипоксического прекондиционирования: роль гипоксического периода и реоксигенации. Бюллетень экспериментальной биологии и медицины. 2009; 147 (4): 380-384.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и принципы коррекции. В кн.: Перфторорганические соединения в биологии и медицине: Сб. науч. тр. Пущино: ОНТИ ПНЦ РАН, 2001: 56-69.
- Лукьянова Л.Д., Дудченко A.M., Цыбина ТА и др. Действие интервальной нормобарической гипоксии на кинетические свойства митохондриальных ферментов. Бюллетень экспериментальной биологии и медицины. 2007; 144 (12): 644-652.
- Sharma S, Black SM. Carnitine homeostasis, mitochondrial function, and cardiovascular disease. Drug Discov Today Dis. Mech. 2009; 6 (1-4): e31-e39.
- Das AM, Steuerwald U, Illsinger S. Inborn Errors of Energy Metabolism Associated with Myopathies. J. Biomed. Biotechnol. 2010; 2010: 340849.
- Wang C, Sadovova N, Ali HK, et al. L-carnitine protects neurons from 1-methyl-4-phenylpyridinium-induced neuronal apoptosis in rat forebrain culture. Neuroscience. 2007; 144 (1): 46-55.
- Сухоруков В.С. Гетерогенность и клинико-морфологическая неоднородность митохондриальной патологии у детей: Автореф. дисс. … докт. мед. наук. М., 1998.
- Николаева ЕА, ХарабадзеМ.Н., ЗолкинаИ.В., Сухоруков В.С., Новиков П.В. Недостаточность карнитина у детей с наследственными болезнями обмена веществ и митохондриальными заболеваниями: особенности патогенеза и эффективность лечения. Педиатрия. 2013; 92 (3): 42-49.
- Николаева Е.А., Семячкина С.В., Васильев С.Ц. Основные способы медикаментозного лечения детей с митохондриальными заболеваниями. Руководство по фармакотерапии в педиатрии и детской хирургии. Т. 2. «Клиническая генетика». А.Д. Царегородцев, В.А. Таболин, ред. М.: Медпрактика-М, 2002: 32-44.
- Nobili V, Alisi A, Panera N, Agostoni C. Low birth weight and catch-up-growth associated with metabolic syndrome: a ten year systematic review. Pediatr. Endocrinol. Rev. 2008: 6: 241-247.
- Cauderay M, Schutz Y, Micheli JL, et al. Energy-nitrogen balances and protein turnover in small and appropriate for gestational age low birthweight infants. Eur. J. Clin. Nutr. 1988; 42 (2): 125-136.









Комментировать