Во всем мире термин «гастрит» нередко до сих пор используется в качестве объяснения диспептических симптомов, а не как процесс, в основе причин которого лежит воспаление желудка со структурными изменениями его слизистой. Хотя воспаление слизистой оболочки желудка (гастрит) и связывали с пептической язвой, раком желудка и пернициозной анемией, но причины гастрита оставались плохо понятыми. Открытие Helicobacter pylori (H. pylori) как причины гастрита сфокусировало внимание на этиологии, патогенезе и прогнозе процесса. Теперь во всем мире основной причиной хронического гастрита считается инфекция H. pylori. Она вызывает прогрессирующее повреждение слизистой желудка и играет важную роль в развитии серьезных заболеваний, включая язвенную болезнь 12-перстной кишки и желудка, аденокарциному желудка и MALT-лимфому [3–5]. Более того, индуцированный H. pylori гастрит рассматривается как наиболее важный фактор риска развития пептической язвы и ее осложнений, а также рака желудка [5].
Глобальный консенсус по поводу H. pylori-ассоциированного гастрита установил новый ориентир для гастрита, сфокусировав внимание на нем во всех клинических проявлениях, а также высказал определенную позицию в отношении 4 главных вопросов: классификация гастрита в связи с продолжающимся пересмотром ICD (МКБ); функциональная диспепсия и H. pylori-инфекция; диагностика гастрита и его лечение. Методология встречи включила в себя все современные способы достижения консенсуса и используемые средства Интернета – метод Дельфи с полным доступом к опубликованным данным.
Положения консенсуса
Секция 1. Классификация гастритов согласно ICD-11
Является ли текущая классификация гастрита по ICD-10 приемлемой?
Положение 1
Текущая классификация гастрита ICD-10 устарела в свете открытия H. pylori.
Уровень рекомендации: сильный.
Доказательный уровень: высокий.
Уровень согласованности: 100%.
Комментарий
Классификация гастрита по ICD-10 была сформирована в 1989 г. и до сих пор используется в большинстве стран. Во время своего формирования классификация гастрита и дуоденита ICD-10 была рудиментарной, поскольку основывалась на макроскопических и гистоморфологических критериях; единственный указанный этиологический фактор – алкоголь [6] (табл. 1).
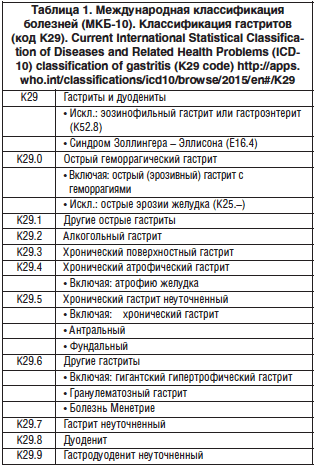
Гистологическая классификация гастрита содержала лишь аспекты, касающиеся атрофии и аутоиммунного поражения [1].
Признание H. pylori главной причиной хронического гастрита оказалось прорывом, который открыл новую главу в изучении гастрита [2, 24, 25]. В настоящее время ни одна классификация гастрита не будет полной без включения H. pylori в качестве этиологического фактора.
Является ли представленная классификация гастрита по ICD-10 приемлемой?
Положение 2
Только что представленная классификация гастрита в версии ICD-11 β является улучшенной, поскольку она основана на выделении ведущего этиологического фактора.Уровень рекомендации: сильный.
Доказательный уровень: средний.
Уровень согласованности: 100%.
Комментарий
Классификация ICD-10 (Международной статистической классификации и проблем, имеющих отношение к здоровью (International Statistical Classification of Diseases and Related Health Problems) регулярно анализируется, т. к. ВОЗ определила необходимость всеобщих систематических изменений в ней. Новый вариант ICD–11 – β-версия остается на уровне проекта и может быть изменен на этапе подготовки ICD-1 (http://www.who.int/classifications/icd/revision/betaexpectations/en/)
В ICD-11-β представлена классификация гастрита, основанная на ведущих этиологических факторах. Соответственно, H. pylori-ассоциированный гастрит классифицирован как особая нозологическая единица.
Оценка гастрита, основанная на гистопатологических критериях, была полностью изменена после определения H. pylori как самой частой причины хронического гастрита. Как следствие, была разработана и интегрирована в клиническую практику Сиднейская система. Сиднейская классификация гастрита совмещала гистологические параметры активности, хронизации, атрофии, кишечной метаплазии, топографического распределения и этиопатогенетической информации для описания патологических изменений, полученных в ходе эндоскопической биопсии [19, 20].
Классификация гастрита в основной части ICD-11 β-версии основана на причинных факторах, среди которых 3 самых важных: (a) H. pylori-ассоциированный, (b) лекарственно-индуцированный и (c) аутоиммунный гастрит. H. pylori-ассоциированный гастрит может вызывать симптомы диспепсии [26, 27] и привести к гастродуоденальной патологии, включая язвенную болезнь и рак желудка. Распознавание роли H. pylori как канцерогена делает эрадикацию H. pylori инфекции предпочтительной стратегией для предотвращения рака желудка [5, 11, 28]. Многие вопросы этиологии гастрита помимо H. pylori предстоит изучить, и это связано с «H. pylori-отрицательным или идиопатическим гастритом» [29].
Представленная классификация, основанная на этиологии, в базовом компоненте ICD-11 β-версии была в дальнейшем улучшена на встрече, посвященной консенсусу (табл. 2). Необходима детальная клиническая оценка предложенной новой классификации.

Необходимо ли классифицировать гастриты согласно месторасположению в желудке?
Положение 3
Принято классифицировать H. pylori-индуцированный гастрит согласно локализации в отделах желудка, потому что риски развития рака желудка и пептической язвы связывают с типами гастрита.
Уровень рекомендации: сильный.
Уровень доказательности: высокий.
Уровень согласованности: 97,4%.
Комментарий
Классификация H. pylori-ассоциированного гастрита согласно локализации процесса по отношению к отделам желудка и совместно с оценкой тяжести гастрита позволяет прогнозировать индивидуальный риск развития тяжелых гастродуоденальных осложнений, в т. ч. рака желудка [30–32]. В зависимости от пораженного отдела желудка, может быть нарушена секреция соляной кислоты в сторону как гиперсекреции, так и гипосекреции или даже ахлоргидрии [33–35].
Пациенты с тяжелым атрофическим гастритом (с или без кишечной метаплазии) в теле желудка или с тяжелым фундальным гастритом имеют высокий риск прогрессирования в рак желудка как интестинального [31, 37], так и диффузного типа.
Необходимо ли классифицировать гастриты согласно гистологическому заключению (тяжести) и/или эндоскопии?
Положение 4
Желательно классифицировать гастриты согласно гистологии, потому что риск развития рака желудка при H. pylori-ассоциированном гастрите варьирует в зависимости от степени и тяжести воспаления и атрофии.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
Принятая Сиднейская система глобально внедрена в клиническую практику и требует надлежащей оценки всех характеристик H. pylori-индуцированного гастрита, включая атрофию и кишечную метаплазию в различных отделах желудка [19, 20]. Тяжесть и степень атрофического гастрита и кишечной метаплазии считаются индикаторами повышенного риска развития рака желудка [31, 39, 40]. Так, тяжелый H. pylori-индуцированный гастрит тела желудка ассоциирован с повышенным риском развития рака желудка [31, 41].
Новые системы для характеристики гастритов представлены еще и для стратификации риска развития рака желудка. Они используются в клинической практике и основаны на показателях тяжести атрофии разных отделов желудка (OLGA) или кишечной метаплазии (OLGIM) [16, 17].
Как мы должны классифицировать эрозии желудка в контексте хронического гастрита?
Положение 5
Эрозии желудка должны быть выделены отдельно от гастрита. Клиническая значимость гастродуоденальных эрозий зависит от этиологии и нуждается в дальнейшей классификации.
Уровень рекомендации: сильный.
Уровень доказанности: низкий.
Уровень согласованности: 100%.
Омментарий
Эрозии желудка – это поверхностные повреждения слизистой с диаметром от 3 до 5 мм [42]. Такой маленький размер принят для того, чтобы не путать эрозии с пептическими язвами, которые по своему определению могут пенетрировать в мышечный слой [3]. Эрозии желудка могут выявляться и при H. pylori инфекции, но более частой причиной их возникновения является повреждение слизистой лекарствами, в частности ацетилсалициловой кислотой и нестероидными противовоспалительными препаратами (НПВП) [43, 44].
С позиции прогноза, наиболее значимым аспектом эрозий у пациентов, принимающих НПВП и имеющих множественные эрозии в желудке, может быть повышенный риск развития язв [48]. Хотя необходимы дальнейшие исследования для лучшего понимания их происхождения, потенциальных возможностей прогрессирования, язвообразования и кровотечения [49
Является ли H. pylori-ассоциированный гастрит инфекционным заболеванием, вне зависимости от симптомов и осложнений?
Положение 6
Н. pylori-ассоциированный гастрит должен быть определен как инфекционное заболевание, даже если у пациента нет симптомов, вне зависимости от осложнений, таких как язвенная болезнь и рак желудка.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.ї
Комментарий
Н. pylori-ассоциированный гастрит – это инфекционное заболевание, которое приводит к хронизации активного гастрита различной тяжести фактически у всех зараженных субъектов [50]. Существует значительная вариабельность индивидуальной выраженности структурных нарушений в слизистой желудка, сопутствующих клинических проявлениях и скорости прогрессии процесса [30, 35]. H. pylori-ассоциированный гастрит – это заболевание, которое может быть излечено с последующим предотвращением тяжелых осложнений. Лечение H. pylori инфекции может привести к полному восстановлению слизистой желудка. Эрадикация H. pylori может уменьшить или устранить диспептические симптомы и обычно излечивает язвенную болезнь (ЯБ). Если H. pylori-ассоциированный гастрит развился в более тяжелые формы гастрита, такие как атрофический гастрит, с или без кишечной метаплазии, или тяжелый гастрит тела желудка, риск развития рака желудка увеличивается, и эрадикация инфекции на этом этапе должна быть объединена со стратегией наблюдения такого пациента [5, 11, 28, 31, 36, 40].
Секция 2. Диспепсия, связанная с инфекцией H. Pylori
Вызывает ли H. pylori-ассоциированный гастрит диспепсию?
Положение 7
Н. pylori-ассоциированный гастрит является причиной диспепсии у части пациентов.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
В большом количестве наблюдений был сделан следующий вывод: инфекция H. pylori может быть причиной симптомов диспепсии у части пациентов [26, 27]. Во-первых, острое заражение инфекцией H. pylori может вызвать острые симптомы диспепсии [24, 25], в то время как персистирующая колонизация бактерий фактически всегда приводит к развитию хронического гастрита [48]. Во-вторых, большинство, но не все эпидемиологические исследования показывают связь между инфицированием H. pylori и хроническими симптомами диспепсии [52–55]. В большом количестве исследований эрадикация оказывается эффективным методом купирования симптомов диспепсии. NNT* составляет 14 [12, 56–61], а в более недавних исследованиях это число составляет 8 [61]. Требуется по меньшей мере 6 мес. (время, которое необходимо для излечения гастрита), чтобы отметить, купировалась ли симптоматика после эрадикации [12, 59–61].
Должны ли мы классифицировать H. pylori-ассоциированную диспепсию как особую форму заболевания?
Положение 8A
У пациентов с диспепсией, инфицированных H. pylori, симптомы могут быть связаны с H. pylori-ассоциированным гастритом, если после успешной эрадикационной терапии следует устойчивая ремиссия.
Уровень рекомендаций: высокий.
Уровень доказанности: высокий.
Уровень согласованности: 97,4%.
Положение 8B
Н. pylori-ассоциированная диспепсия (как в положении 8A) является отдельной нозологической формой.
Уровень рекомендации: сильный.Уровень доказанности: средний.
Уровень согласованности: 92,1%
Комментарий
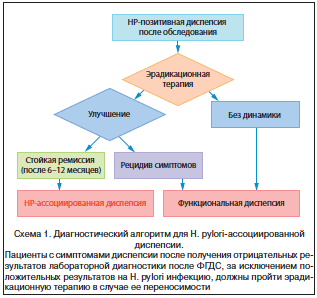
На основании Римского консенсуса III [9, 62] функциональная диспепсия определена как «присутствие симптомов хронической диспепсии (постпрандиальное переполнение, раннее насыщение, эпигастральная боль или жжение) при отсутствии (включая ФГДС) структурных нарушений, которые могли бы объяснить эти симптомы (схема 1). При органической диспепсии симптомы имеют определенную органическую или метаболическую причину, при ее устранении или лечении происходит исчезновение или регрессия симптомов [9].
Римский консенсус III выделяет часть пациентов с H. pylori-ассоциированным гастритом как страдающих от органической диспепсии, если симптомы исчезали после успешной эрадикации. В случае сохранения симптомов у больных с H. pylori-ассоциированным гастритом после успешной эрадикации H. pylori диагностировалась функциональная диспепсия [9]. Исследования, посвященные эрадикационной терапии, показали, что часть H. pylori-инфицированных пациентов с функциональной диспепсией отмечают улучшение состояния, уменьшение симптомов от эрадикации с задержкой минимум на 6 мес. от момента проведения лечения [12, 59–61].
В связи с этим устойчивое купирование симптомов после успешной эрадикации определяет H. pylori инфекцию как органическую причину возникновения симптомов у этих пациентов и позволяет считать H. pylori-ассоциированную диспепсию отдельной клинической группой. У H. pylori-инфицированных пациентов с симптомами хронической диспепсии и отрицательными данными эндоскопии диагноз выставляется в зависимости от ответа на лечение, как указано в схеме 1.
Является ли эрадикация H. pylori терапией первой линии для лечения симптомов диспепсии?
Положение 9
Эрадикация H. pylori является терапией первой линии для H. pylori-инфицированных пациентов с диспепсией.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 94,7%.
Комментарий
Как следует из положения 8, у части пациентов с функциональной диспепсией H. pylori считается причиной симптомов. Эрадикация инфекции приводит к устойчивому купированию симптоматики [9, 59–61], хоть и с небольшой задержкой после успешной эрадикационной терапии [12, 59–61]. Эрадикационная терапия является коротким по продолжительности лечением, с приемлемым соотношением цены и пользы в отношении контроля симптомов диспепсии, а также с потенциальной пользой в отношении предотвращения язвенной болезни и рака желудка [5]. На основании этих соображений эрадикационная терапия может быть представлена как терапия первой линии для пациентов с диспепсией, инфицированных H. pylori, которая соответствует основам Римских критериев [64
Насколько эффективна эрадикация H. pylori в отношении симптомов диспепсии на коротком и длинном отрезках времени, и как она выглядит в сравнении с другими методами лечения (такими как ингибиторы протонной помпы (ИПП))?
Положение 10
У пациентов с диспепсией, инфицированных H. pylori, эрадикационная терапия для лечения симптомов диспепсии лучше, чем плацебо, и является предпочтительной.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 97,4%.
Комментарий
Исследования, посвященные эрадикационной терапии, подтвердили, что часть пациентов, инфицированных H. pylori и имеющих функциональную диспепсию, избавилась от ее симптомов с помощью эрадикационной терапии [12, 56–61]. Будущие исследования должны быть посвящены сравнению эрадикации с другими схемами лечения.
Должны ли пациенты, у которых сохранилась диспепсия после успешной эрадикации H.pylori, считаться пациентами, имеющими функциональную диспепсию?
Положение 11
Пациенты с симптомами, сохранившимися после успешной эрадикации H. pylori, должны считаться имеющими функциональную диспепсию.
Уровень рекомендации: слабый.
Уровень доказанности: средний.
Уровень согласия: 97,4%.
Комментарий
Как указано в положениях 8A и 8B и согласно критериям Римского консенсуса III [9, 62], H. pylori-инфицированные пациенты с диспепсией и отрицательными результатами эндоскопии с устойчивым контролем симптомов классифицированы как пациенты с H. pylori-ассоциированной диспепсией. И наоборот: когда симптомы не уменьшаются в течение долгого времени после успешной эрадикации, это указывает на то, что H. pylori-ассоциированный гастрит не был причиной симптомов у этих пациентов. Следовательно, для них сохраняется диагноз «функциональная диспепсия» (схема 1).
Секция 3.
Диагностика гастрита
Возможно ли поставить диагноз атрофии и/или кишечной метаплазии при помощи эндоскопических методов обследования?
Положение 12
Атрофированная слизистая и кишечная метаплазия могут быть точно определены с помощью эндоскопии с улучшением изображения специалистами, имеющими соответствующий уровень подготовки.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласия: 84,2%.
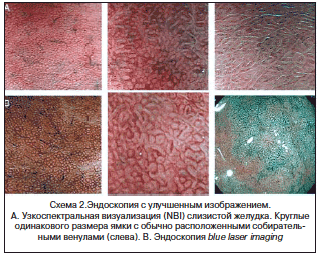
Обычная эндоскопия в большинстве случаев не подходит для диагностики атрофии и кишечной метаплазии, и, следовательно, биопсия остается обязательной процедурой, позволяющей судить о гистоморфологической структуре слизистой желудка согласно Сиднейской классификации [19, 20]. Тем не менее эндоскопия с улучшением изображения повысила точность и воспроизводимость эндоскопической диагностики предраковых поражений желудка. К ней относится: хромоэндоскопия [65], эндоскопия в высоком разрешении c увеличением [66, 67] и эндоскопия с улучшенным изображением, комбинированная с увеличением [15, 68–72] (схема 2). Сейчас эти методы являются рутинными в Японии и будут все шире использоваться во всем мире. Адекватная оценка состояния слизистой желудка каждым из этих методов требует соответствующего обучения [66] и открывает лучшие возможности для проведения прицельной биопсии.
Является ли обновленная Сиднейская система подходящей для гистологической диагностики гастрита?
Положение 13
Точная гистологическая оценка гастрита требует проведения биопсии как в антральном отделе, так и в теле.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 92,1%.
Комментарий
Предраковые поражения желудка могут быть распределены неравномерно, и точная гистологическая оценка гастрита требует проведения биопсии из всех отделов [20, 73–76]. Сиднейская система рекомендует рутинное взятие биопсии из 5 точек: антрального отдела по большой и малой кривизне, из области угла желудка, из тела по большой и малой кривизне [36]. Ключевую важность имеет то, что дополнительно образцы берутся из участков эндоскопически видимых изменений. Точность эндоскопии с улучшением изображения, проведенной специалистом соответствующей квалификации, повышает эффективность прицельной биопсии [66, 77, 78
Полезны ли оценочные системы, такие как OLGA и OLGIM, для стратификации риска?
Положение 14A
Риск рака желудка коррелирует с тяжестью и степенью атрофического гастрита
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 94,7%.
Положение 14B
Гистологические системы, такие как OLGA и OLGIM, являются полезными для стратификации риска.
Уровень рекомендации: сильный.
Уровень доказанности: низкий.
Уровень согласованности: 97,3%.
Комментарий
Большая часть злокачественных опухолей желудка вызвана гастритом, протекающим длительное время и чаще всего на фоне H. pylori инфекции и претерпевшим определенную последовательность изменений: атрофический гастрит, кишечная метаплазия и дисплазия/ интраэпителиальная неоплазия. Различные исследования подтверждают увеличение риска развития рака желудка у пациентов с предраковым фоном. К примеру, национальное исследование, проведенное в Голландии, включавшее примерно 98 000 пациентов с предраковыми поражениями желудка, показало в среднем 2–3% риск развития рака желудка за 10 лет [79]. Этот риск варьировал при различных предраковых состояниях, составляя 0,8, 1,8, 3,9 и 32,7% соответственно для пациентов с атрофическим гастритом, кишечной метаплазией, дисплазией от легкой до средней и тяжелой степени соответственно [79].
С одной стороны, эти данные подтвердили связь между наличием предраковых поражений желудка и развитием рака желудка. С другой стороны, было показано, что риск развития рака желудка у отдельных людей с предраковыми поражениями все-таки невысок (2–6 на 1000 человек в год). Это показывает необходимость методов стратификации риска.
Биопсия желудка может быть использована для обеспечения самой важной информацией для классификации риска. Это приводит нас к системе OLGA [16, 17], которая распределяет пациентов с гастритом по степени риска развития рака желудка [80–82]. Дальнейшее развитие получила система оценки в виде OLGIM, основанная на диагностике наличия и распространенности кишечной метаплазии [18].
ования с системами OLGA и OLGIM показали более высокий риск развития рака желудка у пациентов со стадиями III или IV по OLGA или OLGIM [82–84]. В итоге пациенты в этих подгруппах нуждаются в особом эндоскопическом контроле
Являются ли серологические тесты (пепсиноген I, II, I/II, антитела к H. pylori) полезными для стратификации риска?
Положение 15
Серологические тесты (пепсиногены I, II и антитела к H. pylori) полезны для индивидуального определения повышенного риска развития рака желудка.ї
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 91,9%.
Комментарий
Серологические тесты для диагностики хронического гастрита и атрофии желудка используются уже более 25 лет. Они включают в себя серологическое выявление H. pylori инфекции, а также сывороточные пепсиногены I, II и гастрин для диагностики атрофии, проявляющейся гипоацидным состоянием [85]. Эти тесты показали свою эффективность в качестве инструментов неинвазивной диагностики как у отдельных пациентов, так и в популяционных скринингах [86, 87]. В японской когорте, состоящей из 9293 человек при профилактическом осмотре, была проведена серологическая диагностика уровней пепсиногенов I, II и антител к H. pylori [86]. Годовая прогрессия рака желудка была очень низкой у субъектов с нормальным уровнем пепсиногенов, вне зависимости от статуса H. pylori. Годовая прогрессия рака желудка была существенно выше (3,5–6 на 1000 в год) у пациентов с низкими уровнями сывороточного пепсиногена, которые совпадали с наличием атрофического гастрита [86]. В последней группе частота развития рака желудка была выше среди пациентов с серологически негативной инфекцией H. pylori по сравнению с серологически позитивными пациентами. Это служит дополнительным ориентиром для выделения групп риска в отношении скорости прогрессии и распространения атрофии и метаплазии. Похожие данные были получены и в других исследованиях [88, 89].
Когда предпочтительно проводить поиск и скрининг H. pylori-ассоциированного гастрита?
Положение 16
В зависимости от эпидемиологической ситуации проводить поиск и скрининг H. pylori-ассоциированного гастрита приемлемо до момента развития атрофического гастрита и кишечной метаплазии.
Уровень рекомендации: сильный.
Уровень доказанности: средний.
Уровень согласованности: 97,3%.
Комментарий
Заражение H. pylori инфекцией чаще всего происходит в детстве – в возрасте до 12 лет, в развитых странах – большей частью в семье [90–92]. Бактерия и связанный с ней гастрит персистируют пожизненно, пока не будет проведена эрадикационная терапия или не появится распространенный атрофический гастрит и кишечная метаплазия. Риск развития рака желудка зависит от степени атрофии слизистой желудка и наличия кишечной метаплазии [31, 82–84, 86]. Эрадикация H. pylori может уменьшить риск развития рака, но этот эффект сильно ограничен у пациентов с атрофией и метаплазией [93–95]. У пациентов с этими изменениями эрадикация H. pylori может уменьшить выраженность гастрита, но может не предотвратить прогрессию в рак. В итоге рак может проявиться более чем через 10 лет после проведения эрадикационной терапии H. pylori [96]. Поэтому предпочтительно проводить поиск и скрининг H. pylori-ассоциированного гастрита в возрасте, когда новое инфицирование менее вероятно (>12 лет) и до развития атрофического гастрита и кишечной метаплазии. Все это зависит от географического расположения и эпидемиологических особенностей, а также распространенности инфекции и частоты развития рака [97].
Должны ли пациенты с положительными результатами диагностики H. pylori инфекции получать эрадикационную терапию?
Положение 17
Н. pylori-инфицированным пациентам должна быть предложена эрадикационная терапия, если нет иных обоснованных мнений.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
H. pylori является важным человеческим патогеном, который вызывает хроническое, прогрессирующее поражение слизистой желудка и этиологически связан с возникновением язвенной болезни, рака желудка и атрофии слизистой. Также эта инфекция тесно связана с MALT-лимфомой желудка, диспепсией, гиперпластическими полипами желудка и идиопатической тромбоцитопенической пурпурой [5, 12, 46, 47, 61, 98–104]. H. pylori-положительные пациенты также являются крупным резервуаром переноса инфекции.
H. pylori инфекция отличается от множества других хронических инфекций тем, что она всегда заразна, таким образом, подвергает риску других людей. Вызванный ею процесс в желудке имеет прогрессирующий характер, и выраженность субъективных симптомов не имеет никакой предсказательной ценности для оценки жизненного риска у отдельных пациентов, их семей или сообщества. Потенциальные преимущества эрадикации включают в себя остановку прогрессирования поражения слизистой, стабилизацию или уменьшение риска развития рака желудка, разрешение воспаления слизистой, стабилизацию или улучшение функций слизистой желудка, восстановление нормальных механизмов регуляции секреции соляной кислоты, излечение H. рylori-ассоциированной ЯБ, уменьшение риска желудочно-кишечных осложнений при терапии НПВС, а также предотвращение будущего развития H. рylori-ассоциированной язвы желудка [2, 5, 11, 28, 46, 47, 106–115].
На популяционном уровне преимущества включают в себя уменьшение количества резервуаров инфекции, а также пациентов, которые могут передавать инфекцию другим, и избегание затрат, связанных с диагностикой, ведением и исходами H. рylori-ассоциированных заболеваний, которые будут предотвращены. Таким образом, пациентам, инфицированным H. pylori, должна быть предложена эрадикационная терапия, за исключением случаев, когда присутствуют противоположные мнения на этот счет, в случае коморбидности, высокой вероятности реинфекции в популяции, а также других приоритетов в здравоохранении и финансовых затрат. Тем не менее следует помнить, что существует обеспокоенность по поводу негативного влияния эрадикационной терапии на здоровье человека, такого как учащение аллергии или ожирения, нарушений микрофлоры [116, 117
Каково оптимальное время для проведения эрадикационной терапии H. pylori у бессимптомных пациентов?
Положение 18
Максимум пользы от эрадикации H. pylori можно получить, когда в слизистой желудка не возникло атрофических изменений.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
Эрадикация H. pylori всегда приносит пользу, сдерживая прогрессию поражения слизистой и уменьшая резервуары инфекции. Максимальная польза и при проведении эрадикации до появления атрофических изменений в слизистой на фоне H. рylori инфекции. Такая стратегия особенно уместна в странах, где заболеваемость раком желудка высока, и болезнь возникает в молодом возрасте. Эрадикация H. pylori у подростков и лиц молодого возраста имеет дополнительное преимущество в том, что уменьшает или предотвращает риск переноса инфекции их детям.
Рак – это кульминация многоэтапного процесса генетической нестабильности, с мутациями в раковых клетках в кодирующей части ДНК, а также перестройками соматических генов и таких эпигенетических изменений, как метилирование. Эрадикация H. pylori сдерживает прогрессирование повреждения и уменьшает или устраняет H. рylori-ассоциированную нестабильность слизистой желудка. Это включает в себя ассоциированные с инфекцией двухцепочечные разрывы ДНК [118], парные ошибки при репарации ДНК [119], аномальную экспрессию активированного деаминирования цитидина (AICDA), которая вызывает замены нуклеотидов, включенных в мутации ДНК [120], аномальное метилирование в большом количестве генов промотеров в слизистой желудка, включая связанные с ростом клетки гены, гены по репарации ДНК, гены-супрессоры опухолей, ген адгезии клеток Е-кадгерин и CpG островки микроРНК генов [121–123] и аномальную экспрессию микроРНК [124]. Риск рака желудка увеличен в зависимости от возможности инфекционного штамма вызывать воспаление (например, несущие островок патогенности Cag). Тем не менее все штаммы вызывают воспаление, и рак желудка ассоциирован также с инфекциями с отсутствующими предрасполагающими факторами вирулентности. Таким образом, все инфекции H. pylori должны считаться патогенными и подвергаться эрадикации
Эрадикация H. pylori может остановить прогрессирование риска и стабилизировать или уменьшить последующий риск.
Нужно ли адаптировать схемы эрадикации в разных регионах?
Положение 19
Схемы эрадикации должны быть основаны на самой эффективной местной схеме, желательно и с учетом индивидуальной чувствительности или чувствительности к антибиотикам в данной популяции.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
Распространенность H. pylori резистентности к обычно назначаемым антибиотикам очень сильно отличается географически и связана с особенностями приема антибактериальных препаратов в отдельных регионах [125], поэтому схемы эрадикационной терапии отличаются между регионами. В идеале режимы терапии должны быть основаны на результатах тестирования на чувствительность к антибиотикам. В любом регионе только схемы лечения, достоверно достигающие уровня эрадикации более 90% в этой популяции, могут быть использованы в качестве эмпирического лечения [5, 126–129].
Предотвращает ли эрадикация H. pylori рак желудка?
Положение 20
Эрадикация H. pylori уменьшает риск развития рака желудка. Степень уменьшения риска рака желудка зависит от наличия, тяжести и выраженности атрофического поражения в момент проведения эрадикации
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
Инфекция, вызванная H. рylori, является самой важной причиной развития рака желудка, по оценкам, 89% от некардиального рака желудка, составляющего 78% от всех случаев рака желудка [130]. Предотвращение H. pylori инфекции устраняет главную причину рака желудка и, таким образом, уменьшает частоту встречаемости рака желудка в данной популяции. Эффективность эрадикации H. pylori в отношении предотвращения рака желудка зависит от тяжести и выраженности атрофических изменений в момент проведения эрадикации и варьирует от практически полного предотвращения у пациентов с неатрофическим гастритом до стабилизации или уменьшения риска у пациентов с доказанной атрофией [94, 95]. Как отмечено в секции 3, риск может быть стратифицирован с использованием целого ряда подходов, например, одной из утвержденных валидизированных систем гистологической стратификации (OLGA или OLGIM) [16–18]. Более того, проведение эрадикации H. pylori может стабилизировать и сдержать прогрессирование риска [28, 94]. Предотвращение заражения H. pylori инфекцией и эрадикация инфекции до развития атрофических изменений являются формами первичной профилактики. Вторичная профилактика включает в себя обнаружение и наблюдение за пациентами с факторами риска и направлена на то, чтобы убрать интраэпителиальные поражения и ранний рак желудка до их инвазивной стадии [5, 71, 72, 77, 131]. Иммунотерапия может также играть свою роль в лечении предраковых изменений, а также в сдерживании их прогрессирования [132].
Должен ли проводиться контроль за эффективностью эрадикационной терапии (т. е. проверка лечения)?
Положение 21
За эрадикационной терапией должен проводиться контроль, предпочтительно с использованием неинвазивных способов диагностики.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 100%.
Комментарий
Успех эрадикации должен быть всегда подтвержден и, предпочтительно, неинвазивными методами, такими как дыхательный уреазный тест или сертифицированный метод определения антигенов в стуле при помощи моноклональных антител [5]. Для пациентов, требующих эндоскопического контроля, как, например, после эндоскопического удаления аденомы желудка, может быть использована и гистологическая оценка. Контроль лечения также служит ранней системой оповещения об увеличении резистентности к антибиотикам в популяции, которая будет проявляться учащением случаев неудачной терапии [125, 128, 129].
Какие пациенты требуют длительного наблюдения после эрадикационной терапии?
Положение 22
Эрадикация H. pylori может не полностью устранить риск развития рака желудка. Пациентам с сохранившимся риском, в зависимости от выраженности и тяжести атрофии, следует предложить наблюдение с помощью эндоскопического и гистологического исследований.
Уровень рекомендации: сильный.
Уровень доказанности: высокий.
Уровень согласованности: 97,3%.
Комментарий
Необходимость длительного динамического эндоскопического обследования должна быть основана на расчетах риска развития рака желудка после эрадикации H. pylori (т. е. стратификации риска) [95, 133]. Риск рака коррелирует с выраженностью и тяжестью атрофического гастрита с применением утвержденных схем оценки и расчета риска.









Комментировать