И.А.ЩукинИ1, А.В.Лебедева1, Г.С.Бурд1, М.С.Фидлер1, Р.К.Шихкеримов2, А.М.Исмаилов3, М.Э.Бельгушева4, С.В.Петров5
1ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И.Пирогова Минздрава России,
2ГБУЗ Городская поликлиника №166 Департамента здравоохранения г Москвы.
3ГБУЗ Городская поликлиника №218 Департамента здравоохранения г Москвы.
4ГБУЗ Городская больница г Московский Департамента здравоохранения г Москвы.
5ГБУЗ Городская поликлиника №69 Департамента здравоохранения г Москвы.
Проблема цереброваскулярных заболеваний в последние десятилетия приобретает все большую актуальность. Это связано с целым рядом факторов, ведущими из которых являются увеличение продолжительности жизни и появление новых и эффективных методик диагностики и лечения и целого ряда хронических сосудистых заболеваний. В результате увеличивается число пациентов с заболеваниями, традиционно характерными для пожилого и старческого возраста.
По оценкам Организации Объединенных Наций, население мира в возрасте 60 лет и старше насчитывало в 2000 г. 600 млн человек, что почти втрое превышало численность этой возрастной группы в 1950 г. (205 млн человек). В 2009 г она превысила 737 млн, а к 2050 г. составит более 2 млрд человек, еще раз утроившись за 50 лет. В 2009 г. удельный вес населения 60 лет и старше в среднем по миру составлял 10,8%. Он был наименьшим в Катаре и ОАЭ (1,9%), а наибольшим — в Японии (29,7%) [1].
Хроническая ишемия головного мозга (ХИГМ) — это термин, пришедший на смену традиционно применявшемуся в России и странах бывшего Советского Союза термину «дисциркуляторная энцефалопатия». По данным З.А.Суслиной, число пациентов с явлениями дисциркуляторной энцефалопатии в нашей стране неуклонно растет, составляя не менее 700 на 100 тыс. населения [2]. По данным отдела статистики Департамента здравоохранения г. Москвы в 2012 г. на диспансерном учете находились около 1 млн пациентов с диагнозом ХИГМ.
Термин «дисциркуляторная энцефалопатия» предложен Г.А.Максудовым и В.М.Коганом в 1958 г. В Международной классификации болезней 10-го пересмотра (МКБ-10) этот термин отсутствует. Среди состояний, наиболее близких по клинической картине, в МКБ-10 упоминаются «церебральный атеросклероз», «прогрессирующая сосудистая лейкоэнцефалопатия», «гипертензивная энцефалопатия», «другие уточненные поражения сосудов мозга», в том числе «ишемия мозга (хроническая)», «цереброваскулярная болезнь неуточненная». Дисциркуляторная энцефалопатия — состояние, проявляющееся прогрессирующим многоочаговым расстройством функций головного мозга, обусловленным недостаточностью церебрального кровообращения. Клинически ХИГМ, или дисциркуляторная энцефалопатия, представляет собой заболевание, включающее ряд синдромов: синдром когнитивных нарушений, астенический синдром, синдром эмоциональных нарушений, головокружение, нарушения сна и т.д.
В то же время имеется некоторое несоответствие между, казалось бы, по сути одинаковыми терминами, что вносит определенные трудности в работу врача. Так, дисциркуляторная энцефалопатия традиционно подразделялась на стадии, что облегчало подход к диагностике и лечению этой группы пациентов, ХИГМ никак не стратифицируется.
В развитии дисциркуляторной энцефалопатии выделяют три стадии: на I стадии доминируют субъективные расстройства в виде головных болей и ощущения тяжести в голове, общей слабости, повышенной утомляемости, эмоциональной лабильности, снижения памяти и внимания, головокружения, чаще несистемного характера, неустойчивости при ходьбе, нарушения сна; на II стадии симптомы сходны с таковыми при I стадии, в то же время нарастает частота нарушений памяти, снижения трудоспособности, усугубляются головокружение, неустойчивость при ходьбе, астенический синдром, появляется невыраженная очаговая неврологическая симптоматика; на III стадии на первый план выступают когнитивные расстройства, зачастую достигая уровня деменции, и очаговая неврологическая симптоматика.
Умеренные когнитивные и астенические расстройства у пациентов с ХИГМ
Еще в 1962 г. канадским исследователем V.Kral был введен термин «доброкачественная старческая забывчивость» [3], в последующие годы многими авторами были предложены другие определения, несущественно отличающиеся друг от друга, — когнитивное снижение, связанное с возрастом; возрастное ухудшение памяти; поздняя забывчивость и когнитивное снижение [4]. Все описанные дефиниции подразумевали прежде всего резидуальные изменения со стороны когнитивной сферы, но не достигающие уровня деменции.
Термин «умеренное когнитивное расстройство» (УКР) был впервые введен исследовательской группой из Нью-Йоркского университета в 1980-х годах [5]. В отдельную нозологическую единицу УКР было выделено в 1999 г. после публикации работы американских исследователей R.Petersen и соавт. «Mild cognitive impairment: clinical characterization and outcome» [6].
С клинической позиции УКР представляет собой ухудшение со стороны когнитивной сферы, занимающее промежуточную позицию между естественными возрастными изменениями и деменцией. По мере старения у любого здорового человека отмечаются незначительные изменения со стороны когнитивной сферы, чаще всего затрагивающие область памяти, но эти изменения, как правило, никак не сказываются на социальном и бытовом функционировании человека. По данным R.Petersen (2009 г.), лишь у 1 из 100 человек на протяжении всей жизни не отмечается когнитивного снижения.
УКР традиционно можно разделить на два основных подтипа — амнестическое и неамнестическое [7].
Амнестическое УКР представляет клинически значимое ухудшение памяти, но не соответствующее критериям деменции. Обычно и пациенты, и их родственники самостоятельно отмечают нарастание забывчивости. В то же время остальные когнитивные сферы, такие как исполнительные функции, речь, ориентация, длительное время остаются интактными или затрагиваются очень незначительно.
Неамнестический тип УКР, как правило, характеризуется незатронутостью сферы памяти, но наличием нарушений со стороны других когнитивных сфер: внимание, речь, зрительно-пространственные навыки. Неамнестическое УКР, как правило, не приводит к развитию болезни Альцгеймера, но может трансформироваться в другие типы деменций: лобно-височная дегенерация (болезнь Пика) или деменция с тельцами Леви [8]. По данным целого ряда исследований, у 90% пациентов с амнестическим типом УКР в последующем происходит прогрессирование в болезнь Альцгеймера.
В генезе УКР у пациентов с хроническими цереброваскулярными заболеваниями лежит, как правило, разобщение между корой и подкорковыми структурами, что в первую очередь может быть обусловлено поражением белого вещества. С клинической позиции такой симптомокомплекс носит название лобной дисфункции.
Клинически лобная дисфункция проявляется снижением внимания и концентрации, замедлением психических процессов, трудностями с переключением, нарушениями со стороны праксиса и гнозиса, ухудшениями памяти. Кроме того, для этих пациентов характерен целый ряд коморбидных состояний, ухудшающих течение основного заболевания — апатия, астения, нарушения памяти, депрессия и тревога [9]. Коморбидные, в особенности эмоциональные расстройства, оказывают неблагоприятное воздействие на динамику УКР: в исследовании J.Modrego и соавт. (2004 г.) было выявлено, что максимальный риск развития деменции имеют пациенты с УКР, страдающие депрессией [10].
С точки зрения структурных изменений у пациентов с УКР, обусловленным цереброваскулярными заболеваниями, конкурируют два основных процесса — «накапливающиеся» лакунарные инфаркты и прогрессирующая лейкоэнцефалопатия (поражение белого вещества) [11]. В одном из крупных европейских исследований (LADIS) оценивалась роль поражения белого вещества, а именно потери белого вещества, в генезе когнитивных расстройств [12]. Авторы выявили, что поражение белого вещества удваивает риск развития деменции, кроме того, низкие показатели по краткой шкале психического статуса были связаны с лакунарными кистами в области таламусов.
У пациентов с УКР сосудистой этиологии также отмечены уменьшение объема гиппокампов и атрофия коры и подкорковых структур [13]. В то же время в одном из последних исследований (2013 г.) авторы не нашли связи между степенью поражения белого вещества и конверсией УКР в деменцию [14]. Таким образом, роль цереброваскулярных заболеваний в генезе когнитивных нарушений очевидна, однако остается ряд открытых вопросов, как, например, сочетание нейродегенеративного и сосудистого поражения вещества головного мозга и роль амилоидной ангиопатии в генезе когнитивных нарушений у пациентов старческого возраста, подходы к медикаментозной и немедикаментозной коррекции и т.д.
Астенический синдром хорошо изучен у пациентов, перенесших острые нарушения мозгового кровообращения. Было показано, что до 75% пациентов после инсульта страдают от астении, а врачи зачастую не придают значения данному состоянию [15]. В настоящее время в целом ряде крупных исследований показано, что постинсультная астения, как правило, осложняет восстановительный период, значительно ухудшает состояние пациентов, трудно поддается коррекции, снижает качество жизни и связана с увеличением смертности [16, 17].
В то же время несмотря на то, что одним из основных составляющих дисциркуляторной энцефалопатии является астенический синдром, как в отечественной, так и зарубежной литературе работ, освещающих данный вопрос, крайне недостаточно. В пожилом возрасте астенический синдром наблюдается у более чем 70% пациентов, а порядка 43% больных указывают, что испытывают астению постоянно [18].
В крупном многоцентровом европейском исследовании, включившем 10 стран, было показано, что 27% лиц в возрасте от 50 до 65 лет испытывали признаки астении в последний месяц, а в группе старше 65 лет симптомы, характерные для астении, были отмечены у 37% пациентов [19]. В то же время большинство авторов признают, что истинные цифры распространенности астении в популяции остаются неизвестны. Так, в одном из исследований было показано, что распространенность астенического синдрома в подгруппе лиц от 64 до 75 лет была ниже, чем у более молодых пациентов — от 36 до 63 лет [20].
Очевидно, что основную группу пациентов с дисциркуляторной энцефалопатией составляют лица пожилого и старческого возраста, а зачастую и те, кто ранее перенес инсульт или инфаркт миокарда. Кроме того, те же факторы риска (гипертоническая болезнь, дислипидемия, диабет, нарушения ритма сердца), которые, с одной стороны, приводят к острым сосудистым катастрофам, а с другой стороны, способствуют прогрессированию сосудистой мозговой недостаточности, играют важнейшую роль в развитии астенического синдрома.
В основе формирования астенического синдрома у пациентов, страдающих дисциркуляторной энцефалопатией, прежде всего лежит энергетический дефицит. С возрастом, и в особенности у пациентов с сосудистыми заболеваниями, изменяются продукция и утилизация аденозинтрифосфата (АТФ). Начальный этап синтеза АТФ происходит на клеточной мембране, где специфические молекулы-переносчики транспортируют энергетические субстраты из пищи внутрь клетки. С возрастом и в условиях ишемии снижается способность клеток утилизировать «тяжелые» энергосодержащие субстанции. Так, в молодом возрасте основным субстратом для кардиомиоцитов являются жирные кислоты, а в пожилом — глюкоза [21].
Есть данные, что астения в пожилом возрасте может быть обусловлена митохондриальной дисфункцией. Показано, что у пожилых снижается интенсивность синтеза АТФ на мембране митохондрий, уменьшается активность транспортных цепей электронов и ферментов, участвующих в цикле Кребса [22]. Как правило, с возрастом происходит прогрессирование хронических заболеваний, что усугубляет ишемическое повреждение органов и в первую очередь мозга.
Лечение астенического синдрома и когнитивных расстройств у пациентов с дисциркуляторной энцефалопатией представляет определенные трудности, к настоящему времени не существует четких терапевтических алгоритмов. Для коррекции астении используется несколько классов фармакологических препаратов. Основными являются психостимуляторы, антидепрессанты и препараты, подавляющие сонливость. Психостимуляторы как противоастенические средства, пожалуй, наиболее изучены при многих неврологических заболеваниях, включая рассеянный склероз (РС), болезнь Паркинсона (БП) и инсульт. Метилфенидат, оборот которого в России запрещен, показал свою эффективность у пациентов с БП и астенией. Другим препаратом, используемым для лечения астении, является модафинил, основными показаниями которого являются нарколепсия и дневная сонливость. Ацетил-L-карнитин (АЛК) показал свою эффективность при астении у пациентов с РС. Амантадин, трициклический амин, используемый как противовирусное средство, показал высокую эффективность в плацебо-контролируемых исследованиях в плане купирования астении у больных с РС. В одном из исследований были показаны хорошая переносимость и эффективность комбинации амантадина и АЛК. Определенный интерес представляет использование антидепрессантов, и в первую очередь ингибиторов обратного захвата серотонина. Показана эффективность пароксетина как препарата, который, наряду с уменьшением выраженности депрессии у пациентов с неврологическими заболеваниями, также снижает выраженность астении.
К настоящему времени нет четких международных рекомендаций по лечению когнитивных расстройств, в особенности легких и умеренных. В ряде плацебо-контролируемых исследований препаратов, используемых для лечения болезни Альцгеймера (донепезил, галантамин, ривастигмин), у пациентов с УКР не было отмечено снижения риска прогрессирования до уровня деменции [23-26]. В исследовании R.Petersen и соавт. (2005 г.) [27] у пациентов с УКР оценивалось влияние высоких доз витамина Е (2000 Ед/сут) и донепезила. Авторы показали, что риск развития болезни Альцгеймера достоверно уменьшался в первые 12 мес лечения донепезилом, однако через 36 мес такого эффекта отмечено не было. Витамин Е не оказывал какого-либо влияния на прогрессирование болезни Альцгеймера.
Большое внимание со стороны как исследователей, так и практикующих специалистов уделяется методикам, направленным на тренировку когнитивной сферы, в частности когнитивную реабилитацию, тренировку памяти и внимания. Авторами показано достоверное улучшение со стороны когнитивной сферы у пациентов с УКР к моменту окончания тренировки. Также немаловажным является влияние на факторы риска цереброваскулярных заболеваний. Так, в одном из исследований было выявлено, что адекватная физическая нагрузка (быстрая ходьба по 150 мин в неделю) у пациентов с УКР через 6 мес достоверно улучшает по сравнению с контрольной группой когнитивную функцию [28].
В настоящее время в медицинской практике широко используются лекарственные препараты, влияющие на метаболизм, среди которых важное место занимает L-карнитин. Это вызвано тем, что L-карнитин и его производные, из которых наиболее широко изучен ацетил-L-карнитин, выполняют важнейшую функцию в организме человека. L-карнитин переносит остатки жирных кислот в виде ацетил-L-карнитина из цитоплазмы в матрикс митохондрий, где ацильные группы подвергаются β-окислению; АЛК доставляет ацетильную группу в цикл Кребса. Результатом β-окисления и превращений в цикле Кребса является образование АТФ — энергии, которая необходима для функционирования всех клеток, тканей и систем организма.
В последнее время стало очевидным, что, кроме своей основной функции, митохондрии выполняют и целый ряд других, таких, например, как запуск программируемой клеточной смерти (апоптоз). Нарушение функции митохондрий, связанное с менее эффективным производством энергии, является основным этапом повреждения клеток. Эти повреждения ведут к снижению выработки энергии из продуктов питания, что приводит к нарушению важных процессов метаболизма и дальнейшему развитию клеточных повреждений, вплоть до гибели клетки. Процесс разрушения митохондрий осуществляют активные формы кислорода — АФК (свободные радикалы), генераторами которых являются сами митохондрии. Часть образующихся АФК не успевают поглощаться клеточной антиокислительной системой и реагируют с окружающими митохондриальными мембранами и митохондриальной ДНК (мДНК). Особенно чувствительны к токсическим эффектам окислительного стресса мДНК, частично из-за отсутствия компенсационных механизмов защиты. С течением времени повреждения митохондрий накапливаются и, в конечном счете, это приводит к их уничтожению. Специфические мутации мДНК, которые не обнаруживаются у молодых лиц, появляются при старении. Существует целая теория старения, основанная на увеличении митохондриальных повреждений кислородными радикалами, приводящих к накоплению мутаций мДНК.
Митохондриальный окислительный стресс также вносит свой вклад и в появление нейродегенеративных заболеваний. В этой связи выяснить, каким путем можно подавить или уменьшить разрушения митохондрий, — важная задача проводимых во многих странах исследований. Специально разработанные для этой цели препараты, по-видимому, могут значительно улучшить здоровье и продлить жизнь человека. Поскольку L-карнитин и АЛК вносят существенный вклад в митохондриальный синтез АТФ, являясь кофакторами ключевых митохондриальных белков, можно предположить, что они способны защищать митохондрии от окислительного стресса. Недавние эксперименты in vitro со всей очевидностью указывают, что нейропротекторное действие АЛК, установленное ранее в большом числе работ, реализуется прежде всего через его влияние на митохондриальные процессы.
В одной из работ американских ученых было сообщено, что связанное с возрастом нарушение митохондрий у старых животных было значительно уменьшено введением АЛК и α-липоевой кислоты. В экспериментальном 4-месячном исследовании молодым и старым крысам (в возрасте 4 и 21 мес соответственно) давали с пищей АЛК и липоевую кислоту. Анализ частиц гиппокампа с использованием электронных методов микроскопии показал увеличение количества неповрежденных митохондрий для обеих групп. Наряду с этим у старых крыс также было отмечено существенное сокращение количества поврежденных митохондрий. Авторам работы представляется весьма перспективным подход, при котором для стабилизации структуры и функции клеток митохондрий в гиппокампе мозга и связанных с ним клеток эндотелия используют оптимальное потребление этих клеточных метаболитов. Эти и другие исследования, упомянутые в работе, также подразумевают, что по мере старения необходимо более высокое потребление АЛК.
Таким образом, становится все более очевидным, что коррекцию митохондриальных дисфункций разной этиологии, включая и старение, можно осуществлять с помощью препаратов, которые в последнее время стали называть энерготропными. В последние годы АЛК, наряду с L-карнитином, коэнзимом Q10 и некоторыми другими, выходит в первый ряд энерготропных препаратов. Если последние два вещества достаточно хорошо известны российским врачам и накоплен значительный клинический опыт их применения, то АЛК до последнего времени был недоступен для отечественного здравоохранения, хотя это соединение выполняет важные функции в клеточном метаболизме и применяется в мировой клинической практике.
Из зарубежных публикаций многие специалисты уже знают, что это производное L-карнитина, которое используется для лечения целого ряда болезней и потенциально может продлить человеческую жизнь. Потребительские исследования как в Европе, так и в США указывают, что АЛК является сейчас одним из наиболее употребляемых в этих странах веществ. К настоящему времени имеется большое число сообщений по экспериментальному и клиническому изучению АЛК, тем не менее исследования по его применению в разных областях медицины продолжают развиваться, о чем можно судить по значительному увеличению количества ссылок в поисковых системах, таких как, например, Google и PubMed. Эти исследования оказывают существенное воздействие на разработку новых методов профилактики и лечения разных заболеваний с использованием препаратов на основе АЛК.
Таким образом, учитывая высокую социальную значимость хронических форм нарушения мозгового кровообращения, негативное влияние когнитивных расстройств и астенического синдрома на течение ХИГМ и отсутствие четких терапевтических стратегий, представляются крайне важными изучение данного вопроса и поиск новых препаратов, способных облегчить состояние пациентов.
Целью настоящего исследования было оценить в динамике выраженность астенического синдрома, когнитивных нарушений, эмоциональных расстройств и показателей качества жизни у пациентов с ХИГМ и исследовать возможность использования АЛК, препарата, обладающего метаболическими и нейропротективными свойствами, с целью коррекции указанных нарушений.
Материалы и методы
Основными критериями включения пациентов в исследование были: достоверный диагноз ХИГМ, наличие астенического синдрома, на включении пациент должен был быть стабилен по клиническому, неврологическому и гемодинамическому статусу в течение 28 дней.
Критериями исключения были: грубые когнитивные расстройства, соответствующие критериям деменции, влияющие на возможность участия в программе, нежелание сотрудничать в рамках программы, тяжелая степень инвалидизации, неспособность выполнять любую из процедур программы, тяжелая депрессия (более 30 баллов по Госпитальной шкале депрессии и тревоги — HADS ), требующая консультации психиатра, выраженные нарушения функции почек или печени, тяжелая сердечная недостаточность, повышенная чувствительность к компонентам препарата АЛК.
На протяжении всего наблюдения пациенты получали терапию по показаниям (антигипертензивную, сахароснижающую, антиагрегантную, гиполипидемическую и т.д.). Пациенты были разделены «слепым» методом на две группы — основную и контрольную. В основной группе на протяжении всего периода наблюдения пациенты получали комбинацию АЛК (лекарственный препарат Карницетин® в капсулах по 295 мг №60, содержание АЛК в 1 капсуле — 250 мг) по 2 капсулы 3 раза в день и винпоцетин по 5 мг 3 раза в день. В контрольной группе пациенты получали только винпоцетин по 5 мг 3 раза в день. Период наблюдения за пациентами составил 60±2 дня.
Всего было 2 визита: визит скрининга/начала лечения (1-й визит), и визит окончания лечения (2-й визит). На всех визитах проводилась оценка по субъективной шкале оценки астении (MFI-20), визуальной аналоговой шкале (VAS) оценки астении, госпитальной шкале тревоги и депрессии HADS. Оценка качества жизни проводилась по Европейскому опроснику качества жизни (EuroQol). Проводился физикальный осмотр с оценкой жизненно важных функций (дыхание, артериальное давление, пульс). Астенический синдром диагностировался на основании описанных диагностических критериев. Также анализировались сосудистые факторы риска — наличие артериальной гипертензии, сахарного диабета, дислипидемии, нарушений сердечного ритма, курения, инсульт или инфаркт в анамнезе.
В исследуемую популяцию вошли 82 пациента с диагнозом ХИГМ. В основной группе были 55 (67,1%) пациентов, которые получали комбинацию АЛК и винпоцетина, 27 (32,9%) пациентов составили контрольную группу, участники которой получали только винпоцетин.
Средний возраст пациентов в основной группе составил 63,16±6,93 года, в контрольной — 64±8,42 года. Мужчин в основной группе было 24 (43,6%), в контрольной -12 (44,4%).
Статистически значимой разницы между группами по всем показателям на момент включения в программу не было (табл. 1).
Средний балл по MoCA соответствовал умеренному когнитивному снижению. При этом также какой-либо существенной разницы между мужчинами и женщинами внутри основной и контрольной групп отмечено не было.
На момент включения средний балл по HADS составлял 15,36 в основной группе и 16,15 — в контрольной, что соответствовало умеренно выраженной тревоге/депрессии. На момент включения в исследование уровень астении по шкале MFI-20 соответствовал выраженной астении: 66,07 балла — в основной группе (6,45 по VAS) и 62,89 балла (5,4 по VAS) в контрольной группе.
При анализе факторов риска в исследуемой популяции было выявлено, что все пациенты имели широкий набор сосудистых факторов риска: 78 пациентов страдали артериальной гипертензией, у 34 пациентов имела место достоверная дислипидемия, большинство пациентов получали статины, 14 больных страдали сахарным диабетом типа 2, нарушения ритма сердца как постоянного, так и пароксизмального характера были отмечены у 12 пациентов, курил 21 больной, инсульт в анамнезе имел место у 4 пациентов.
Статистическая обработка материала проводилась с помощью статистического пакета SPSS 14.0. С учетом неравномерности распределения показателей на основании проверки с помощью критерия Колмогорова-Смирнова сравнение показателей между несвязанными группами проводилось с помощью непараметрических методик — критерия Манна-Уитни и χ-квадрата. Внутригрупповой анализ проводился с использованием критерия Вилкоксона. Для анализа корреляционных связей использовался коэффициент Спирмана. Дальнейшее представление данных приводится в виде медиан (25 и 75-й перцентиль).
Результаты и обсуждения
- Умеренное когнитивное расстройство
На момент включения в наблюдательную программу медиана балла по MoCA в основной группе составила 27 баллов, что соответствовало УКР.
При детальном анализе количества баллов по разным когнитивным сферам было выявлено следующее: по зрительно-конструктивным/исполнительным навыкам медиана составила 4 балла (52,8% пациентов имели балл меньше 5); в сфере называния медиана балла была 3, лишь 18,2% не смогли назвать представленных на картинках животных; в сфере внимания 54 (98%) пациента имели нарушения разной степени выраженности, медиана составила 5 баллов (максимально возможный результат — 7 баллов); нарушения со стороны сферы речи выявлены у 18 (36,7%) пациентов — медиана 3 балла; 9 (16,4%) пациентов имели сложности с абстракцией — медиана 2 балла; отсроченное воспроизведение было нарушено у 50 (70,9%) пациентов — медиана 4 балла, и 8 (14,5%) пациентов не могли в полной мере ориентироваться, однако сложности возникали только с датой и днем недели.
В контрольной группе медиана балла по MoCA была несколько ниже — 26 баллов, но данное различие было статистически незначимо (р=0,138).
При анализе выраженности изменений в тех или иных когнитивных сферах были получены следующие данные: зрительно-конструктивные навыки — медиана 5 баллов (48,1% пациентов имели менее 5 баллов); называние — медиана 3 балла (7,4% пациентов не смогли полностью выполнить задание); внимание — медиана 5 баллов (63% пациентов имели балл ниже 7,0); речь — медиана 2 балла (51,8% пациентов имели балл ниже 3); абстрактное мышление — медиана 2 балла (14% пациентов не смогли выявить связи между предложенными объектами); отсроченное воспроизведение — медиана 4 балла (74,1% пациентов не смогли воспроизвести ранее предложенные слова); ориентация — медиана 6 баллов (лишь 11,1% не смогли правильно назвать дату или день недели).
Через 2 мес терапии в основной группе медиана балла по MoCA составила 28 баллов (25% — 27; 75% — 29), при этом по сравнению с визитом включения отмечено статистически значимое нарастание балла (р=0,000). В контрольной группе на визите окончания лечения медиана составила 27 баллов (25% — 24,75; 25% — 28). При сравнении показателей в основной и контрольной группах выявлена статистически достоверная разница (р=0,005); рис. 1.
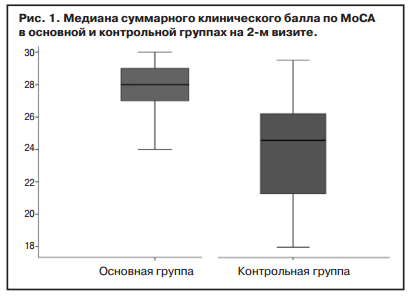
При этом прирост суммарного количественного балла по MoCA в основной группе был более выражен — медиана прироста в основной группе составила 2 балла (25% — 1,0; 75% — 3,0), в контрольной — 1 балл (25% — 0,75; 75% — 1,25), также отмечена статистически значимая разница между показателями (р=0,01).
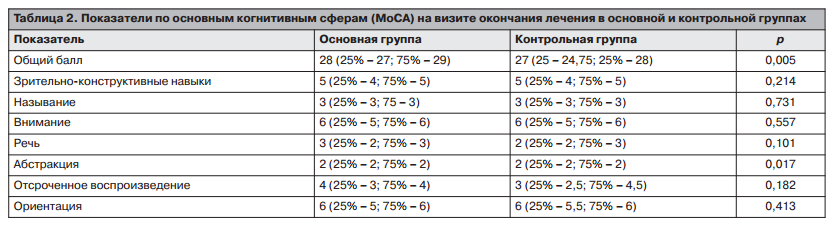
При сравнении групп по когнитивным сферам на 2-м визите статистическая разница была достигнута только по показателю абстракции (р=0,017); табл. 2.
- Эмоциональные нарушения
При анализе эмоциональных нарушений в основной и контрольной группах на визите включения медиана общего балла в основной группе составила 16 баллов (25% — 10; 75% — 20), в контрольной — 17 баллов (25% — 12; 75% — 21). При этом в основной группе медиана балла по разделу тревоги составила 8 баллов (25% — 5; 75% — 12), а по разделу депрессии — 7 баллов (25% — 4; 75% — 10), что соответствовало субклинически выраженным эмоциональным расстройствам.
В контрольной группе несколько значимее, но статистически недостоверно преобладала тревога — 10 баллов (25% — 6; 75% — 11), по разделу депрессии медиана, так же как и в контрольной группе, составила 7 баллов (25% — 5; 75% — 10).
При анализе эмоциональных расстройств на визите включения в программу статистически значимой разницы между группами по HADS выявлено не было (см. табл. 1). Тревога и/или депрессия у большинства пациентов либо не выявлялись, либо имели минимальную выраженность. На фоне проведенного лечения отмечена положительная динамика как по тревоге, так и по депрессии в обеих группах (табл. 3). Статистически значимой разницы между группами достигнуто не было, что как раз и обусловлено исходным относительно благоприятным эмоциональным статусом пациентов обеих групп.

- Астения
Медиана балла по шкале MFI-20 в основной группе на визите включения в программу составила 67 баллов (25% -59; 75% — 74), в контрольной — 66 баллов (25% — 57; 75% -72), что соответствовало выраженной астении (отсутствие астении — от 20 до 30 баллов).
При детальном анализе разных аспектов астенического синдрома в основной группе выявлены следующие показатели: общая астения — 15 баллов (25% — 13; 75% — 16), активность — 14 баллов (25% — 11; 75% — 16), мотивация — 12 баллов (25% — 9; 75% — 13), физическая астения — 13 баллов (25% — 12; 75% — 16), психическая астения — 13 баллов (25% — 12; 75% — 15). В контрольной группе медиана балла общей астении составила 14 баллов (25% — 10; 75% — 16), активность — 14 баллов (25% — 11; 75% — 15), мотивация — 13 баллов (25% — 8; 75% — 15), физическая астения — 13 баллов (25% — 11; 75% — 14), психическая астения — 13 баллов (25% — 10; 75% — 15).
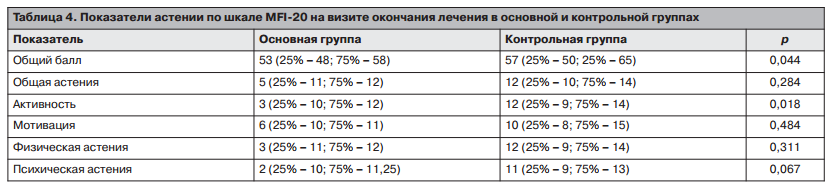
На фоне проведенного лечения в основной группе медиана суммарного клинического балла по шкале MFI-20 составила 53 балла (25% — 48; 75% — 58), а в контрольной — 57 баллов (25% — 50; 75% — 65), отмечена статистическая разница между группами (р=0,044); рис. 2.
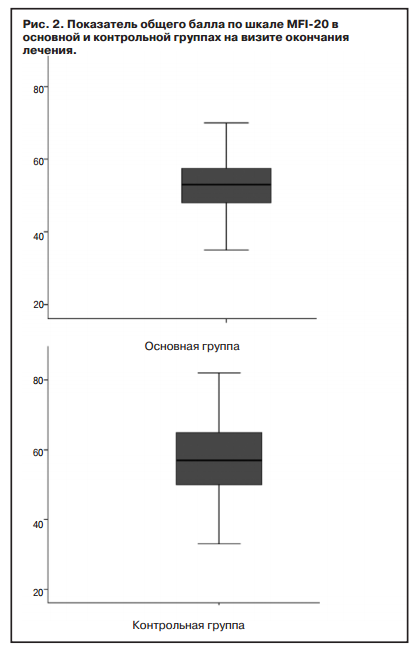
В то же время при сравнении показателей разных аспектов астенического синдрома статистически значимо (р=0,018) различался только показатель общей активности (табл. 4). Кроме того, в основной группе нарастание суммарного клинического балла было значительно лучше, чем в контрольной: 14 баллов (25% — 8; 75% — 21) в основной группе и 3 балла — в контрольной (25% — 0,0; 75% — 8); р=0,000.
По визуальной аналоговой шкале астении на включении пациентов в программу медиана в основной группе составила 6,4 балла (25% — 5,7; 75% — 7,2), в контрольной -5,5 балла (25% — 4; 75% — 7,5). На 2-м визите медиана балла по визуальной аналоговой шкале астении в основной группе составила 3,5 балла (25% — 2,4; 75% — 4,8), в контрольной — 4,5 (25% — 2,8; 75% — 7,0). Несмотря на то, что суммарный балл в основной группе был ниже, статистической значимости достигнуто не было (р=0,187).
- Качество жизни
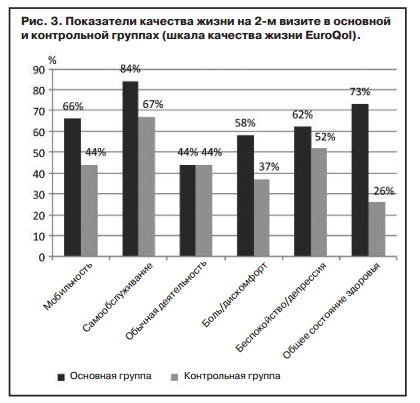
На момент включения в программу в основной группе 49,1% пациентов имели проблемы с мобильностью, 40% испытывали трудности с самообслуживанием, 89,1% не могли в полной мере справляться с повседневной деятельностью, 80% испытывали боль или дискомфорт, 80% ощущали беспокойство или депрессию и 87,3% больных отметили, что в настоящее время общий уровень здоровья примерно такой же (30,9%) или хуже (56,4%), чем в последние 12 мес.
В контрольной группе показатели качества жизни были следующие: 63% пациентов имели проблемы с мобильностью, у 33,3% были трудности с самообслуживанием, 77,8% имели трудности в повседневной деятельности, 67,7% жаловались на боль или дискомфорт, 63% ощущали беспокойство или депрессию, 88,9% чувствовали себя либо хуже, либо так же, как и в предыдущие 12 мес.
На фоне проведенного лечения в основной группе отмечено статистически значимое улучшение по большинству показателей качества жизни, за исключением параметра мобильности (р=0,175). В контрольной группе отличия были менее выражены.
При сравнении показателей качества жизни на 2-м визите между группами статистически значимая разница была достигнута только по показателю общего уровня здоровья за последние 12 мес (рис. 3), в основной группе 72,7% пациентов отметили, что их здоровье лучше, чем ранее, в контрольной группе — лишь 25,9% (р=0,000).
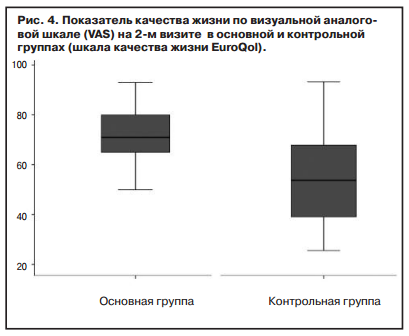
По VAS общий уровень качества жизни на 2-м визите в основной группе составил 71 (25% — 65; 75% — 80), в контрольной — 60 (25% — 47; 75% — 75) (р=0,002); рис. 4.
- Корреляционные связи
При анализе корреляционных связей на 1-м визите в обеих группах выявлено, что чем выше был балл по HADS, тем выше был уровень астении (r=0,373, p=0,005), при этом тревога не имела связи с астенией, в отличие от депрессии (r=0,376, p=0,005). Также чем выше был уровень астении, тем ниже было качество жизни по VAS (r=-0,581,p=0,000).
На 2-м визите появляются новые корреляционные связи, в частности в основной группе, чем выше был балл по MoCA, тем более значимые нарушения по HADS имел пациент (r=0,486, p=0,001), причем преимущественно за счет подшкалы тревоги (r=0,506, p=0,000). Также показатель качества жизни был выше у пациентов без когнитивных нарушений (r=0,233, p=0,037). Как и на 1-м визите, чем выше был уровень астении, тем ниже было качество жизни по шкале EuroQol (r=-0,5751, p=0,000). В контрольной группе отмечались такие же связи разной силы.
Заключение
Таким образом, на фоне комбинированной терапии Карницетином и винпоцетином, в отличие от изолированной терапии винпоцетином, быстрее и существеннее уменьшается выраженность когнитивных расстройств у пациентов с ХИГМ — прирост суммарного клинического балла по MoCA составил 2 балла в основной группе и 1 балл — в контрольной (p=0,001). Также сочетанное использование АЛК и винпоцетина, в отличие от изолированной терапии винпоцетином, способствует значимому снижению проявлений астении у пациентов с ХИГМ — прирост суммарного клинического балла по MFI-20 составил 14 баллов в основной группе и 3 балла — в контрольной. Показатель качества жизни был выше у пациентов, которые получали комбинированную терапию Карницетином и винпоцетином.
Выявлено, что астения и тревога/депрессия являются коморбидными состояниями, оказывающими друг на друга взаимно негативное влияние, кроме того, показано, что астения оказывает существенное отрицательное влияние на показатель качества жизни у пациентов с ХИГМ.
Наши результаты подтверждают данные, полученные в других исследованиях. Так, в работе С.Н.Думы и соавт. (2012 г.) было показано, что использование АЛК ослабляет проявления астении, уменьшает неврологическую и вегетативную симптоматику, способствует значимому улучшению по всем когнитивным шкалам у пациентов с синдромом дисплазии соединительной ткани [29]. Это свидетельствует в пользу общих механизмов развития астении, когнитивных расстройств и эмоциональных нарушений при разных нозологиях, при которых, возможно, на первый план выступают процессы, связанные с нарушением синтеза энергетических субстратов на мембране митохондрии, что может быть эффективно компенсировано назначением АЛК.
Литература/References
- World Population Ageing, 2007.
- Суслина З.А., Румянцева С.А. Нейрометаболическая терапия хронической ишемии мозга. Методическое пособие. М., 2009. / Suslina Z.A., Rumiantseva S.A. Neirometabolicheskaia terapiia khronicheskoi ishemii mozga. Metodicheskoe posobie. M., 2009. [in Russian]
- Kral VA. Senescent forgetfulness: benign and malignant. Can Med Assoc J 1962; 86: 257-60.
- Ritchie K, Touchon J. Mildcognitive impairment: conceptual basis and current nosological status. Lancet 2000; 355 (9199): 225-8.
- Petersen RC, Morris JC. Mild cognitive impairment as a clinical entity and treatment target. Arch Neurol 2005; 62 (7): 1160-3.
- Petersen RC, Smith GE, Waring SC et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999; 56 (3): 303-8.
- Petersen RC, Roberts RO, Knopman DS et al. Mild cognitive impairment: ten years later. Jr Arch Neurol 2009; 66 (12): 1447-55.
- Molano J, Boeve B. Mild cognitive impairment associated with limbic and neocortical Lewy body disease: a clinicopathological study. Brain 2010; 133 (Pt 2): 540-56.
- Гусев Е.И., Боголепова А.Н. Когнитивные нарушения при цереброваскулярных заболеваниях. М.: МЕДпресс-информ, 2013. / Gusev E.I., Bogolepova A.N. Kognitiv-nye narusheniia pri tserebrovaskuliarnykh zabolevaniiakh. M.: MEDpress-inform, 2013. [in Russian]
- Modrego PJ, Ferrandez J. Depression in patients with mild cognitive impairment increases the risk of developing dementia of Alzheimer type: a prospective cohort study. Arch Neurol 2004; 61 (8): 1290-3.
- Jokinen H, Lipsanen J, Schmidt R et al. Brain atrophy accelerates cognitive decline in cerebral small vessel disease: the LADIS study. Neurology 2012; 78 (22): 1785-92.
- LADIS Study Group. 2001-2011: a decade of the LADIS (Leukoaraiosis And DISability) Study: what have we learned about white matter changes and small-vessel disease? Cerebrovasc Dis 2011; 32 (6): 577-88.
- Eckerstrom C, Olsson E, Klasson N et al. High white matter lesion load is associated with hippocampal atrophy in mild cognitive impairment. Dement Geriatr Cogn Di-sord 2011; 31 (2): 132-8.
- Devine ME, Fonseca JA,Walker Z. Do cerebral white matter lesions influence the rate of progression from mild cognitive impairment to dementia? Int Psychogeriatr 2013; 25 (1): 120-7.
- Leegaard OF. Diffuse cerebral symptoms in convalescents from cerebral infarction and myocardial infarction. Acta Neurol Scand 1983; 67: 348-55.
- Christensen D, Johnsen SP, Watt T et al. Dimensions of post-stroke fatigue: a two-year follow-up study. Cerebrovasc Dis 2008; 26: 134-41.
- Glader EL, Stegmayr B, Asplund K. Poststroke fatigue: a two-year follow-up study of stroke patients in Sweden. Stroke 2002; 33: 1327-33.
- Hardy SE. Qualities of fatigue and associated chronic conditions among older adults. J Pain Symptom Manage 2010; 39: 1033-42.
- Schultz-Larsen K. Tiredness in daily activities: a subjective measure for the identification of frailty among non-disabled community-living older adults. Arch Gerontol Geriatr 2007; 44: 83-93.
- Aggarwal VR, McBeth J, Zakrzewska JM et al. The epidemiology of chronic syndromes that are frequently unexplained: Do they have common associated factors? Int J Epidemiol 2006; 35: 468-76.
- Kates AM, Herrero P, Dence C et al. Impact of aging on substrate metabolism by the human heart. J Am Coll Cardiol 2003; 41: 293-99.
- Lanza IR, Nair KS. Muscle mitochondrial changes with aging and exercise. Am J Clin Nutr 2009; 89: 467-71.
- Winblad B, Gauthier S, Scinto L et al. Safety and efficacy of galantamine in subjects with mild cognitive impairment. Neurology 2008; 70: 2024-35. [Erratum, Neurology 2010; 75: 1485.]
- Feldman HH, Ferris S, Winblad B et al. Effect of rivastigmine on delay to diagnosis of Alzheimer’s disease from mild cognitive impairment: the InDDEx study. Lancet Neurol 2007; 6: 501-12. [Erratum, Lancet Neurol 2007; 6: 849.]
- Thal LJ, Ferris SH, Kirby L et al. A randomized, double-blind, study of rofecoxib in patients with mild cognitive impairment. Neuropsychopharmacology 2005; 30: 1204-15.
- Doody RS, Ferris SH, Salloway S et al. Donepezil treatment of patients with MCI: a 48-week randomized, placebo-controlled trial. Neurology 2009; 72: 1555-61.
- Petersen RC, Thomas RG, Grundman M et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med 2005; 352: 2379-88.
- Lautenschlager NT, Cox KL, Flicker L et al. Effect of physical activity on cognitive function in older adults at risk for Alzheimer disease: a randomized trial. JAMA 2008; 300: 1027-37.
- Дума С.Н., Лисиченко О.В., Лукьянова Г.В. Психовегетативные, астенические и когнитивные нарушения при дисплазии соединительной ткани: выбор оптимальной терапии. Фарматека. 2012; 7. / Duma S.N., Lisichenko O.V., Luk’ianova G.V. Psikhovegetativnye, astenicheskie i kognitivnye narusheniia pri displazii soedini-tel’noi tkani: vybor optimal’noi terapii. Farmateka. 2012; 7. [in Russian].




Комментировать