Инфаркт миокарда, острый период. Клинико-биохимические особенности течения острого периода инфаркта миокарда у больных с метаболическим синдромом. Тенденции. Результаты проведенных исследований.
Т.В. Статкевич, Н.П. Митьковская, Е.Г. Оганова, Э.И. Шкребнева, И.В. Головач
Белорусский государственный медицинский университет, УЗ «9ГКБ»
В настоящее время установлено, что метаболический синдром и его отдельные компоненты – артериальная гипертензия, абдоминальное ожирение, сахарный диабет, атерогенная дислипидемия и/или низкое содержание в сыворотке крови липопротеинов высокой плотности – значительно повышают кардиоваскулярный риск. В статье рассматривается распространенность метаболического синдрома у больных инфарктом миокарда и его влияние на некоторые клинико-лабораторые параметры течения заболевания.
В большинстве экономически развитых стран заболевания сердечно-сосудистой системы занимают первое место среди причин заболеваемости, инвалидизации и смертности, хотя их распространенность в различных регионах значительно колеблется. По данным ВОЗ, ежегодно умирают от кардиоваскулярных причин приблизительно 3.8 млн. мужчин и 3.4 млн. женщин, причем 1/4 умерших составляют люди в возрасте до 65 лет [1 ].
Инфаркт миокарда (ИМ) занимает особое положение в общей структуре заболеваний сердечно-сосудистой системы, что связано с высокой летальностью, неизменно сопровождающей данное заболевание. За последние годы тактика и стратегия лечения ИМ претерпела значительные изменения. Внедрение в клиническую практику методов медикаментозной и хирургической реперфузии миокарда позволило существенно улучшить эффективность лечения. Но, несмотря на значительные достижения, ИМ остается таким же серьезным заболеванием, как и несколько десятилетий назад. [1,5 ,6 ,7 ,21 ].
Метаболический синдром (МС) комплекс метаболических, гормональных и клинических нарушений, в основе которых лежит инсулинорезистентность и компенсаторная гиперинсулинемия [7 ,8,11,14]. В настоящее время выделено 6 основных компонентов МС: инсулинорезистентность, висцеральное ожирение, артериальная гипертензия, дислипидемия, провосполительное и протромботическое состояние [7 ,8 ].
Распространенноbсть МС при ИМ варьирует от 37% (Япония) до 50% (США, Франция) [11,14 ,16 ,17 ]. Следует отметить, что частота встречаемости МС у больных ИМ моложе 45 лет возрастает и составляет около 66% [8,13]. Некоторые авторы отмечают большую распространенность МС при ИМ у женщин [16 ,17 ,18 ]. Приведенные данные свидетельствуют, что нарушение метаболизма глюкозы и сопутствующая инсулинорезистентность являются характерными состояниями для больных ИМ и встречаются у каждого второго пациента.
Показатель летальности в остром периоде ИМ в группе больных с МС в 2 раза выше, чем в группе больных, не имеющих достаточного для диагностики МС сочетания факторов риска [14 ]. Характерна большая частота развития сердечной недостаточности (Killip class > II) и кардиогенного шока. При анализе индивидуального влияния каждого из пяти компонентов МС на риск развития осложнений ИМ установлено, что гипергликемия является независимым предиктором развития кардиогенного шока, а гипергликемия и низкие значения ХС ЛПВП – острой сердечной недостаточности [14 ]. В отношении влияния МС на риск развития рецидивирующего ИМ имеются несколько противоречивые данные. Согласно мнению некоторых авторов, МС не вызывает увеличения частоты развития рецидивирующего ИМ и фатальных желудочковых аритмий [14 ]. С другой стороны, установлено, что присутствие МС у больных с ОКС приводит к увеличению относительного и абсолютного риска развития внезапной сердечной смерти, рецидивирующего ИМ, возвратной ишемии миокарда на 34 и 5% соответственно [18 ].
При изучении влияния МС на прогноз инфаркта миокарда установлено, что присутствие МС достоверно увеличивает риск развития смертельного исхода в течение ближайших 3-х лет на 29%, а кардиоваскулярных событий на 23%. В случае наличия сахарного диабета данные показатели увеличиваются до 68% и 47% соответственно [15 ]. Наличие МС увеличивает риск развития сахарного диабета в 2 раза, причем, с увеличением числа компонентов МС риск значительно возрастает – в сравнении с больными, имеющими 3 компонента МС, на 60% при наличии 4-х компонентов и на 273% в случае присутствия 5-ти признаков МС [15 ]. Именно со значительно возрастающим риском развития сахарного диабета при наличии МС некоторые авторы связывают увеличение риска сердечной смерти и кардиоваскулярных событий в отдаленном периоде ИМ [15 ].
В настоящее время окончательно утвердилась теория, доказывающая, что фундаментальное значение в патогенезе развития и прогрессирования атеросклероза имеет хроническое сосудистое воспаление, характеризующееся каскадом иммунологических и биохимических процессов [19 ]. Показатель неспецифического воспаления С-реактивный белок (СРБ) и его уровень ≥0.3 мг/дл рассматривается как нетрадиционный фактор риска ИБС [16,17,21,23]. В ряде крупных проспективных эпидемиологических исследований выявлена неблагоприятная прогностическая значимость СРБ в отношении риска развития кардиоваскулярных катастроф [22 ,23 ,24]. Вместе с тем, повышенный уровень СРБ является характерным состоянием для МС и СД 2-го типа, отражающим провосполительное состояние [16 ,19 ,21 ].
Установлено, что сочетание МС и СД 2-го типа и повышенного уровня СРБ (≥ 0.3 мг/дл) у больных ИМ приводит к значительному увеличению риска развития основных кардиоваскулярных событий (фатального и нефатального ИМ, ХСН, коронарной реваскуляризации, смертельных исходов, обусловленных сердечно-сосудистыми причинами) [16 ]. Приведенные данные подтверждают роль системного воспаления в патофизиологии МС и СД 2-го типа. Понимание взаимодействий между указанными компонентами может послужить основой улучшения вторичной профилактики после перенесенного ИМ [16 ,20 ,22 ].
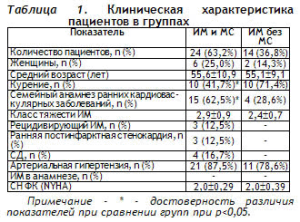
Материалы и методы. В исследование включено 38 больных ИМ с зубцом Q. Для диагностики МС использовались критерии, предложенные Международной Диабетической Ассоциацией (2005 г.). Исследуемую группу составили 24 больных ИМ с МС, пациенты с острым ИМ, не имеющие необходимого для диагностики МС сочетания факторов риска (n = 14), составили группу сравнения. Клиническая характеристика групп представлена в таблице 1.
С целью изучения клинических особенностей коронарного атеросклероза в исследуемых группах проводился анализ частоты встречаемости безболевого варианта течения заболевания, оценивались средние значения функционального класса сердечной недостаточности (ФК СН) по NYHA, распространенность и степень артериальной гипертензии (АГ), характер и частота встречаемости осложнений ИМ.
Антропометрическое исследование включало в себя измерение массы тела, расчет ИМТ Кетле (отношение массы тела в килограммах к росту, выраженному в метрах и возведенному в квадрат), измерение окружности талии. Для диагностики ожирения использовались критерии индекса массы тела (ИМТ), предложенные ВОЗ (1997 г.).
Всем пациентам проводились биохимические исследования крови (кардиоспецифичные ферменты, тропонин I, высокочувствительный СРБ, липидограмма и коагулограмма). Исследование липидного спектра крови проводили энзиматическим колориметрическим методом на полуавтоматическом биохимическом анализаторе ФП–901 («Labsystems», Финляндия) при помощи диагностических ферментных наборов «Liquick CHOL-60», «Liquick-TG-60», «HDL-cholesterol» фирмы «Cormay P. Z.». Материал для исследования – сыворотка крови, взятая из кубитальной вены натощак после 12-часового голодания. Определялось содержание общего холестерола (ОХ), триглицерола (ТГ), холестерола липопротеидов низкой плотности (ЛПНП), холестерола липопротеидов очень низкой плотности (ЛПОНП), холестерола липопротеидов высокой плотности (ЛПВП).
Структурные и гемодинамические параметры сердца исследовали методом эхокардиографии в трех режимах: М–, В–модальном и цветном допплеровском на аппарате «Hewelett Packard-2000» (США). Исследование проводилось по стандартной методике с использованием ультразвукового датчика с частотой сканирования 3,5 МГц. Допустимая погрешность измерений в Мрежиме – 2%, в В-режиме – 5%, в допплеровском режиме – 4-10%.
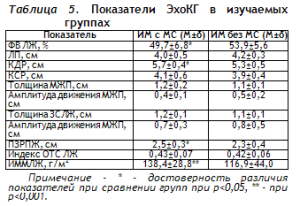
Определяли следующие структурнофункциональные показатели: размер левого предсердия (ЛП), диаметр корня аорты, амплитуда раскрытия аортального клапана, передне-задний размер правого желудочка (ПЗРПЖ), толщину передней стенки правого желудочка (ПСПЖ), конечно-систолический и конечно-диастолический (КДД и КСД) размеры полости левого желудочка(ЛЖ), толщину задней стенки ЛЖ (ЗСЛЖ) и толщину межжелудочковой перегородки (МЖП) в диастолу, фракцию выброса (ФВ) ЛЖ в М–(Teichgolz) и В– модальном (Simpson) режимах.
Для оценки процесса ремоделирования ЛЖ определяли индекс массы миокарда левого желудочка (ИММЛЖ, г/м²) и индекс относительной толщины стенок (ОТС) ЛЖ в диастолу.
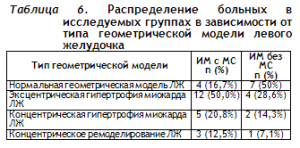
По сочетанию показателей ИММЛЖ и индекса ОТС установлен тип ремоделирования левого желудочка. При ИММЛЖ≤110 г/м2 у женщин и ИММЛЖ≤125 г/м2 у мужчин и ОТС≤0,45 геометрическую модель ЛЖ считали нормальной; при ИММЛЖ>110 г/м2 у женщин и ИММЛЖ>125 г/м2 у мужчин и ОТС≤0,45 геометрическая модель ЛЖ расценивалась как эксцентрическая гипертрофия; концентрическую гипертрофию миокарда левого желудочка определяли при ИММЛЖ>110 г/м2 у женщин и ИММЛЖ>125 г/м2 у мужчин и ОТС>0,45; при ИММЛЖ≤110 г/м2 у женщин и ИММЛЖ≤125 г/м2 у мужчин, ОТС>0,45 геометрическая модель оценивалась как концентрическое ремоделирование ЛЖ.
Результаты исследования и обсуждение.
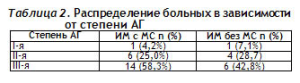
Безболевой вариант течения ИМ в группе больных ИМ с МС отмечен у 12,5% (n=3), в группе сравнения указанная форма течения заболевания не была зарегистрирована. АГ установлена у 87,5% (n=21) больных основной группы и у 78,6% (n=11) в группе сравнения. Распределение больных в зависимости от степени АГ приведено в таблице 2.
Частота развития ИМ, протекающего без осложнений, в группе больных с МС составила 29,2% (n=7), в группе больных ИМ, не имеющих необходимого для диагностики МС сочетания факторов риска – 50% (n=7). Наиболее частыми осложнениями течения ИМ в обеих группах являлись нарушения ритма и проводимости и развитие ранней постинфарктной стенокардии.
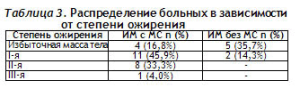
Проведение антропометрических исследований выявило большую частоту встречаемости ожирения в группе больных ИМ с МС по сравнению с контрольной группой (83,3% (n=20) и 14,3% (n=2) соответственно). ИМТ в исследуемой группе составил 33,6±5,1 кг/м2, группа сравнения –27,6±3,0 кг/м2, кружность талии – 117,0±9,5 см и 83,4±12,1 см соответственно. Распределение больных в зависимости от степени ожирения, диагностированной в зависимости от значения ИМТ, приведено в таблице 3.
Анализ уровней гликемии (плазма венозной крови) при поступлении в стационар выявил высокую распостраненность нарушений углеводного обмена в остром периоде ИМ у больных с МС. Значения гликемии при поступлении в стационар в исследуемой группе составили 9,7±4,0 ммоль/л, в группе сравнения – 6,8±2,0 (р<0,05). Статистическая значимость различий сохранялась даже при исключении из анализа больных, имеющих СД 2-го типа в анамнезе.
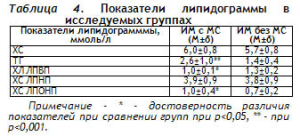
Липидный спектр крови в группе больных ИМ с МС характеризовался частой гипертриглицеролемией, повышением фракции ХС ЛПОНП и снижением фракции ХС ЛПВП. Полученные в ходе исследования значения показателей липидограммы в исследуемых группах представлены в таблице 4.
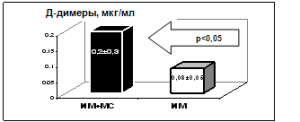
Среди больных ИМ при наличии МС отмечено увеличение доли лиц с коагуляционными нарушениями, выявлено статистически значилое повышение концентрации Д-димеров (рис. 1). В исследуемой группе средние значения Д-димеров составили 0,2±0,3 мкг/мл, в группе сравнения –0,08±0,05 мкг/мл.
Рисунок 1. Значения Д-димеров в исследуемых группах.
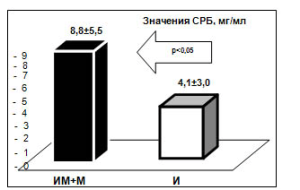
Выявленное прогностически значимое повышение уровня высокочувствительного СРБ в исследуемой группе (8,8±5,5 мг/мл, 4,1±3,0 мг/мл, р<0,05) свидетельствует о склонности данной категории больных к высокому риску развития сердечно-сосудистых осложнений и неблагоприятному прогнозу (рис. 2).
Рисунок 2. Значения высокочувствительного СРБ в исследуемых группах.
Показатели ЭхоКГ в изучаемых группах преведены в таблице 5.
При сравнительном анализе результатов эхокардиографического исследования выявлено преобладание в структуре ремоделирования ЛЖ в группе больных ИМ с МС эксцентрической гипертрофии миокарда. Распределение больных в исследуемых группах в зависимости от типа геометрической модели левого желудочка приведено в таблице 6.
Таким образом, полученные результаты позволяют сделать следующие выводы: клинические особенности течения ИМ в присутствии МС характеризуется тенденцией к более частому безболевому дебюту заболевания и развитию осложнений в остром периоде; ИМ у больных с МС протекает на фоне прогностически неблагоприятных показателей липидного спектра крови, сопровождается более выраженными коагуляционными и воспалительными изменениями; в структуре ремоделирования ЛЖ у больных ИМ при наличии необходимого для диагностики МС сочетания факторов риска преобладает эксцентрическая гипертрофия миокарда, для указанной группы характерно более выраженное нарушение сократительной способности миокарда.
Литература
1. Митьковская, Н. П. Сердце и метаболический риск: монография / Н. П. Митьковская, Е. А. Григоренко, Л. И. Данилова. Минск: Белорус. наука, 2008. 277 с.
2. Митьковская, Н. П. Инфаркт миокарда у больных с метаболическим синдромом / Н. П. Митьковская, Т. В. Статкевич // Медицинский журнал. 2009. № 2. С. 8–12.
3. Чазова, И. Е. Метаболический синдром /И. Е. Чазова, В. Б. Мычка. М.: Медиа Медика,2004. 144 с.
4. The Metabolic Syndrome: A Global Public Health Problem and A New Definition / P. Zimmet [et al.] // Journal of Atherosclerosis and Thrombosis.2005. Vol. 12. P. 295–300.
5. Prognostic Impact of Metabolic Syndrome by Different Definitions in a Population With High Prevalence of Obesity and Diabetes / G. D. Simone[et al.] // Diabetes Care. 2007. Vol. 30. P. 1851–1856.
6. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey / E. S. Ford, W. H. Giles, W. H. Dietz. // JAMA. 2002. Vol. 287. P.356–359.
7. Combined Effect of the Metabolic Syndrome and Hostility on the Incidence of Myocardial Infarction (The Normative Aging Study) / J. F. Todaro[et al.] // The American Journal of Cardiology. 2005. Vol. 49. P. 221–226.
8. Prevalence of metabolic syndrome in young patients with acute MI: does the Framingham Risk Score underestimate cardiovascular risk in this population / S. Zarich [et al.] // Diabetes and Vascular Disease Research. 2006. Vol. 3. P. 103–106.
9. NCEP-defined metabolic syndrome, diabetes, and prevalence of coronary heart disease among NHANES III participants age 50 years and older / C. M. Alexander [et al.] // Diabetes. 2003. Vol. 52. P.1210–1214.
10. The metabolic syndrome and cardiovascular risk in the British Regional Heart Study / S. G.Wannamethee // Int. J. Obes. (Lond.). 2008. Vol. 32. P. 25–29.
11. Prevalence and Impact of Metabolic Syndrome on Hospital Outcomes in Acute Myocardial Infarction / M. Zeller [et al.] // Arch. In tern. Med. 2005. Vol. 165. P. 1192–1198.
12. Metabolic Syndrome and Risk of Cardiovascular Events After Myocardial Infarction / G. Levantesi [et al.] // Journal of the American College of Cardiology. 2005. Vol. 46. P. 277–283.
13. Impact of Metabolic Syndrome on the Long-Term Survival of Patients With Acute Myocardial Infarction / M. Takeno [et al.] // Circulation Journal.2008. Vol. 72. Р. 415–419.
14. Poor in-hospital outcome in young women with acute myocardial infarction. Does metabolic syndrome play a role / H. Turhan, E. Yetkin // International Journal of Cardiology. 2006. Vol. 112. Р. 257–258.
15. Relation of Characteristics of Metabolic Syndrome to Short-Term Prognosis and Effects of Intensive Statin Therapy After Acute Coronary Syndrome / G.G. Schwartz [et al.] // Diabetes Care. 2005. Vol. 28. P. 2508–2513.
16. Metabolic Syndrome With and Without CReactive Protein as a Predictor of Coronary Heart Disease and Diabetes in the West of Scotland Coronary Prevention Study / N. Sattar [et al.] // Circulation.2003. Vol. 10. P. 408–414.
17. Markers of Inflammation and Infection Influence the Outcome of Patients With Baseline Asymptomatic Carotid Lesions. A 5-Year Follow-Up Study / E. Corrado [et al.] // Stroke. 2006. Vol. 37. P.482–486.
18. Metabolic syndrome: prevalence, associated factors, and C-reactive protein The MADRIC (MADrid RIesgo Cardiovascular) Study / M. A. Martíneza [et al.] // Metabolism Clinical and Experimental.2008. Vol. 57. P. 1232–1240.
19. Serial Measurements of C-Reactive Protein After Acute Myocardial Infarction in Predicting One-Year Outcome / O. Dimitrijevich, B. D. Stojcevski// Int. Heart J. 2006. Vol. 47. P. 833–842.
20. Differential Impact of Admission CReactive Protein Levels on 28-Day Mortality Risk in Patients With ST-Elevation Versus Non–ST-Elevation Myocardial Infarction (from the Monitoring Trends and Determinants on Cardiovascular Diseases [MONICA]/Cooperative Health Research in the Region of Augsburg [KORA] Augsburg Myocardial Infarction Registry) / B. Kuch [et al.] // Am. J. Cardiol. 2008. Vol.102. P. 1125–1130.
21. Prevalence of Metabolic Syndrome in Patients <45 Years of Age With Acute Myocardial Infarction HavingPercutaneous Coronary Intervention / E.H. Chung [et al.] // The American Journal of Cardiology. 2007. Vol. 5. P. 1052–1055.
22. Metabolic Syndrome and Risk of Restenosis in Patients Undergoing Percutaneous Coronary Intervention / J. S. Rana [et al.] // Diabetes Care.2005. Vol. 28. P. 873–877.
23. Metabolic syndrome in patients with acute myocardial infarction is associated with increased infarct size and in-hospital complications / L. C. Clavijo[et al.] // Cardiovascular Revascularization Medicine.2006. Vol. 7. P. 7–11.
24. What glucose target should we aim for in myocardial infarction / N. W. Cheung, V. W. Wong, M. McLean // Diabetes research and clinical practice.2008. Vol. 80. P. 411–415.









Комментировать